Si dans la majorité des situations, l’anémie peut être prise en charge en médecine générale, un recours au spécialiste s’impose en l’absence de cause évidente et lorsqu’elle est mal tolérée. Pour orienter le diagnostic, plusieurs dosages s’avèrent utiles.
Très fréquente en pratique médicale, elle se définit chez l’adulte par un taux d’hémoglobine < 12 g/dL chez la femme et < 13 g/dL chez l’homme. Du fait de l’hémodilution, le seuil retenu pendant la grossesse est de 11 g/dL (voire 10,5 g/dL au 2e trimestre).
La carence martiale, de loin la cause la plus fréquente dans le monde, concernerait environ 1 milliard d’individus.
Syndrome anémique
Il regroupe les signes cliniques et fonctionnels pouvant révéler une anémie. Inconstants et aspécifiques, ces derniers incluent asthénie inhabituelle, céphalées, pâleur cutanéo-muqueuse, en particulier conjonctivale, et palpitations (tachycardie) et/ou dyspnée d’effort d’intensité variable. Si l’anémie est profonde, les signes de souffrance d’organes (cœur, poumons, reins…) peuvent passer au premier plan. Lorsqu’elle est secondaire à une hémolyse, un ictère d’intensité variable, des urines foncées et/ou des lombalgies (voire un syndrome « pseudogrippal » si hémolyse aiguë) sont possiblement associés. Une splénomégalie modérée est fréquente en cas d’hémolyse intratissulaire persistante.
Quand transfuser ?
L’anémie conduit à un défaut d’oxygénation des tissus, une situation de stress plus ou moins bien tolérée selon le taux d’hémoglobine, le terrain sous-jacent et la rapidité d’installation. La tolérance est d’autant meilleure que l’anémie s’installe progressivement.
Elle peut induire des syndromes coronaires aigus, des ischémies mésentériques ou des troubles de la vigilance conduisant au décès.
Les seuils transfusionnels ont été établis par la HAS afin de limiter tout risque de complication :
– 7 g/dL pour les sujets sans antécédents particuliers ;
–10 g/dL en cas d’insuffisance coronaire aiguë ou cardiaque décompensée avérée ou traitée par bêtabloquants (
En phase aiguë, la politique transfusionnelle restrictive a montré son efficacité sur l’augmentation de la survie. Chez le sujet âgé, un avis d’experts émis en 2014 établit un seuil général de :
– 7 g/dL en l’absence d’insuffisance cardiaque et ou/coronaire ;
– 8 g/dL en cas d’insuffisance coronaire ou cardiaque stable ;
– 10 g/dL si l’anémie est mal tolérée.
La transfusion est fractionnée (1 concentré érythrocytaire, puis réévaluation), sans association systématique d’un diurétique.
Au-delà des seuils, elle est décidée en fonction du mécanisme et de la tolérance de l’anémie, selon les signes cliniques et le terrain du patient.
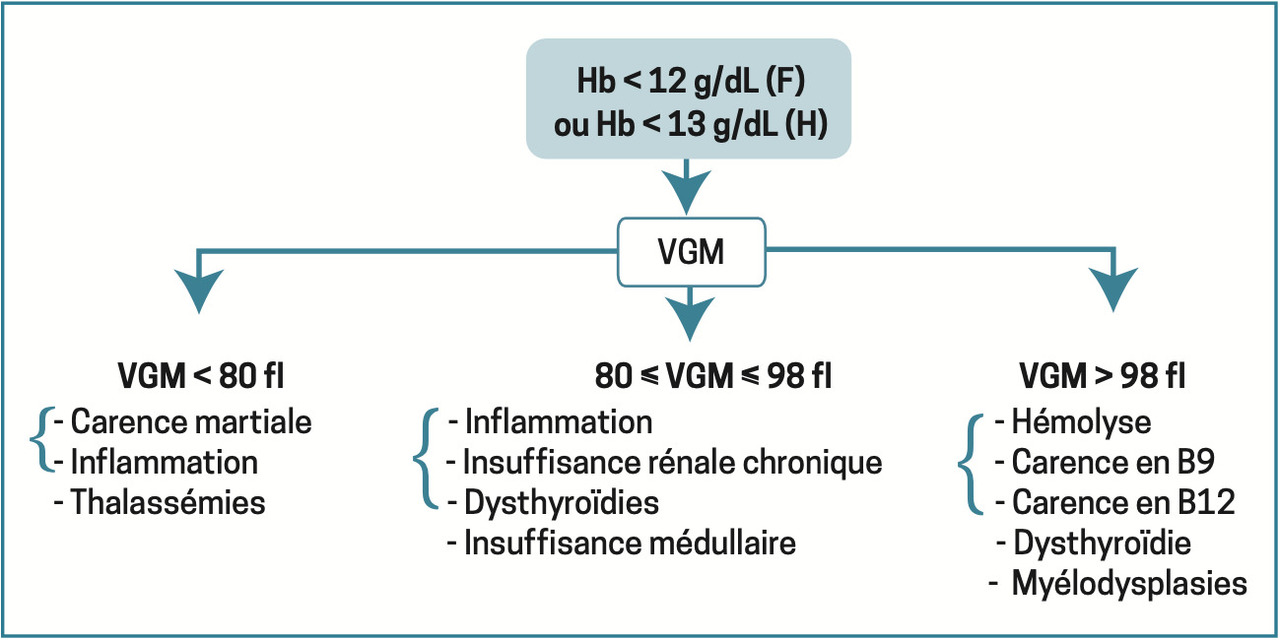
Orientation : fonction du VGM
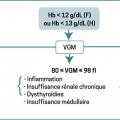
Une fois l’anémie authentifiée sur l’hémogramme, et en l’absence de contexte évident (hémorragie aiguë extériorisée), la première étape repose sur l’analyse du volume globulaire moyen (VGM) [
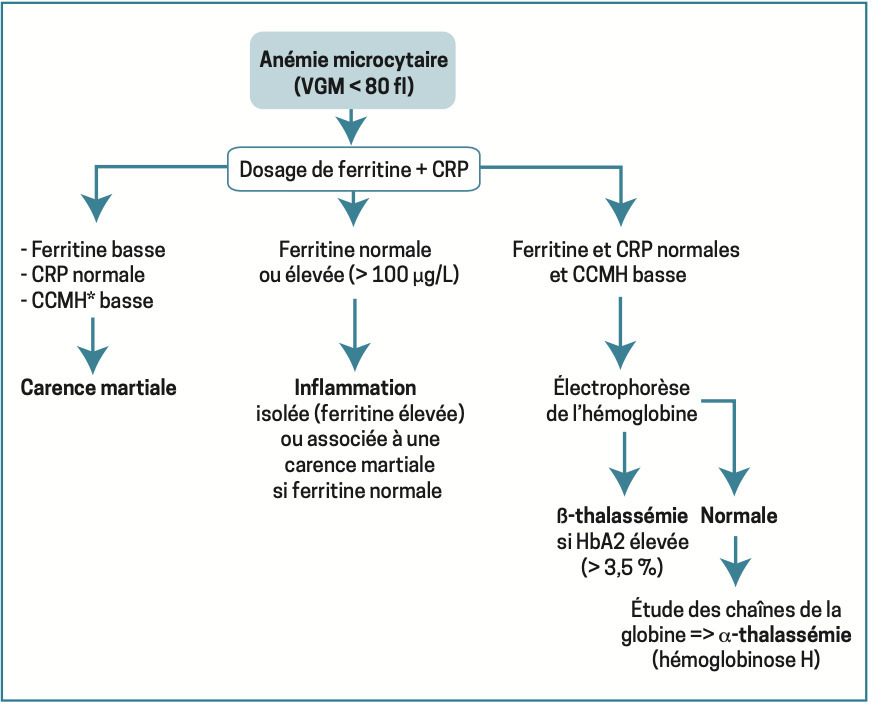
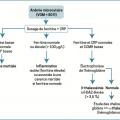
Anémie microcytaire
VGM < 80 fl. Situation la plus courante dont la cause principale est la carence martiale [
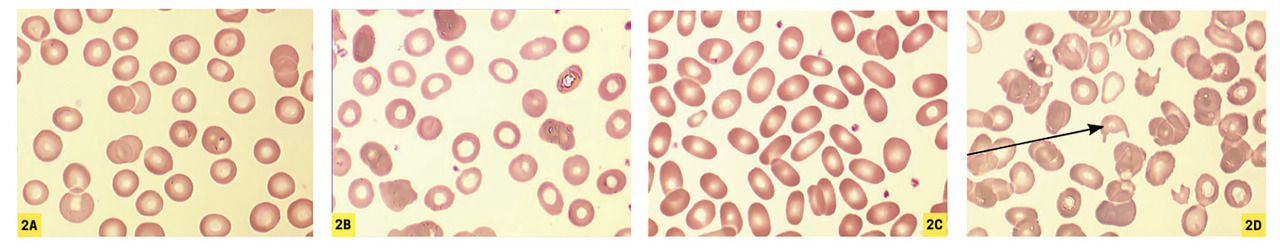
Une microcytose marquée évoluant depuis l’enfance oriente d’emblée vers ce diagnostic, surtout si l’origine ethnique est évocatrice. De façon beaucoup plus exceptionnelle, une anémie microcytaire révèle parfois une dysérythropoïèse congénitale (de type I, CDA I) ou un saturnisme (
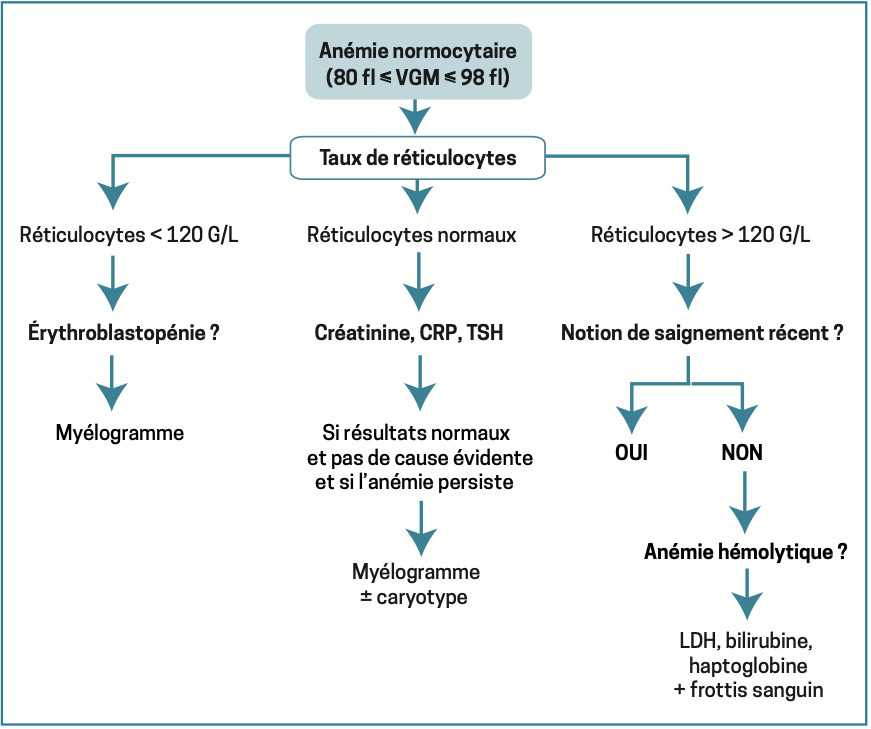
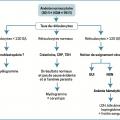
Anémie normocytaire
VGM compris entre 80 et 100 fl. Priorité : éliminer un saignement abondant aigu extériorisé (hémorragie digestive…) ou non (hématome profond, contexte postopératoire…).
En dehors de cette situation, elle est en général secondaire à une insuffisance de production médullaire : insuffisance rénale chronique (carence relative en érythropoïétine), inflammation persistante (parfois microcytaire), hypothyroïdie (notamment car les hormones thyroïdiennes stimulent la formation d’érythropoïétine), érythroblastopénie (diminution, voire absence, des précurseurs érythroïdes dans la moelle osseuse) aiguë ou chronique, envahissement médullaire (tumoral ou infectieux) ou anomalies qualitatives des érythroblastes (myélodysplasie).
L’anémie est alors arégénérative (réticulocytes < 120 g/L), voire réticulocytopénique (réticulocytes < 20 G/L) en cas d’érythroblastopénie sous-jacente.
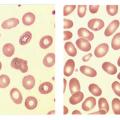
Plus rarement, l’anémie normocytaire est régénérative (réticulocytes ≥ 120 G/L), après un saignement récent ou lors d’une hémolyse. Si celle-ci est importante et durable, sachant que le VGM des réticulocytes est supérieur à celui des hématies matures, l’anémie devient volontiers macrocytaire. On note parfois la présence de sphérocytes (
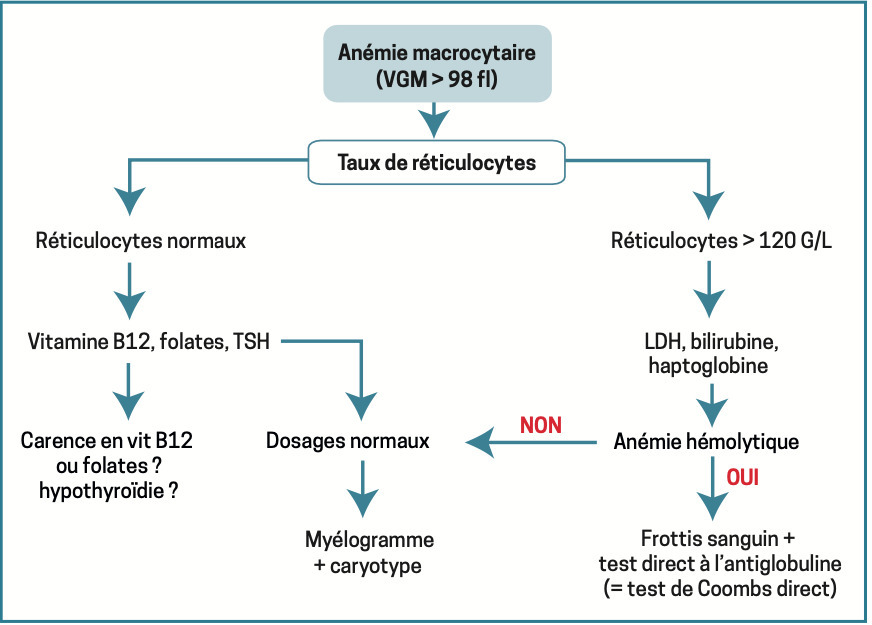
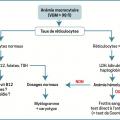
Anémie macrocytaire
VGM > 100 fl. On raisonne selon le taux de réticulocytes. On distingue en effet les anémies régénératives (secondaires à une hémolyse) des anémies arégénératives. Ces dernières sont liées à des carences vitaminiques (vitamine B12, vitamine B9 [folates]) entraînant un défaut de synthèse de l’ADN à une hypothyroïdie (les hormones thyroïdiennes stimulent la sécrétion d’EPO) ou à des anomalies qualitatives de la lignée érythroïde (hémopathies, syndrome myélodysplasique).
De nombreux médicaments sont également responsables d’une macrocytose (méthotrexate, azathioprine, certains anticonvulsivants…). L’analyse soigneuse des traitements reçus par le patient est nécessaire. Devant une anémie macrocytaire régénérative, la confirmation d’une hémolyse repose sur la baisse de l’haptoglobine (paramètre le plus sensible) et/ou l’augmentation du taux de LDH et/ou du taux de bilirubine non conjuguée.
Devant une anémie hémolytique avérée, 2 examens orientent vers la cause de l’hémolyse :
– frottis sanguin : anomalies morphologiques des hématies (schizocytes orientant vers une microangiopathie thrombotique) [
– test direct à l’antiglobuline (ou test de Coombs ;
Ces 2 urgences hématologiques mettent en jeu le pronostic vital à très court terme et nécessitent une hospitalisation rapide. En l’absence d’hémolyse après élimination d’une carence vitaminique et d’une hypothyroïdie, un avis spécialisé et un myélogramme par aspiration sternale s’imposent afin d’éliminer une hémopathie et notamment un syndrome myélodysplasique.
Carence martiale : 4 mécanismes
Chronique, elle est à l’origine de symptômes non spécifiques : irritabilité, troubles mnésiques, perlèche (fissuration de la commissure des lèvres), glossite avec atrophie des papilles linguales, ongles cassants et/ou mous, voire striés, et/ou en cupule (koïlonychies), alopécie, tendance à la dysgueusie et, de façon relativement exceptionnelle, dysphagie ou syndrome des jambes sans repos.
Elle se traduit en premier lieu par une diminution de la ferritine sérique, qui reflète la réduction des réserves en fer. Puis on observe successivement une baisse marquée du coefficient de saturation de la transferrine (principale protéine de transport du fer), nettement inférieur à 10 %, et une augmentation de la capacité de fixation de la transferrine (optimisation de la captation ferrique). L’apparition de l’anémie correspond au stade « ultime » de la carence en fer. Ces examens doivent être réalisés avant tout traitement martial.
Toujours arégénératif (avant substitution), le dosage des réticulocytes est inutile. La ferritinémie sérique sert de référence, un taux abaissé (< 15-20 mg/L) permettant à lui seul d’affirmer la carence martiale. Au contraire, un taux supérieur à 2 fois la normale rend improbable ce diagnostic. La CRP est demandée pour ne méconnaître une inflammation chronique.2, 3 Une thrombocytose peut accompagner l’anémie.
En cas de difficulté diagnostique, le dosage du récepteur soluble de la transferrine, non influencé par l’inflammation, permet de faire la part des choses. Il est le plus souvent augmenté lorsqu’une carence martiale coexiste.
Il en va de même pour l’effondrement du coefficient de saturation de la transferrine. Ces examens sont réservés aux diagnostics difficiles.
Une fois confirmée, il faut rechercher une des 4 grandes causes :
– saignement chronique ;
– augmentation des besoins ;
– malabsorption ;
– carence d’apport.
L’interrogatoire et l’examen clinique investiguent donc : régime alimentaire végétarien, méno-/métrorragie chez la femme, prise d’aspirine ou d’AINS (même intermittente), douleurs épigastriques et antécédent d’ulcère, histoire personnelle ou familiale de polypose ou de cancer rectocolique, modification de la consistance, de la couleur et de l’odeur des selles, rectorragies, éléments en faveur d’une maladie hémorragique…
La recherche de sang dans les selles par Hémoccult n’est pas recommandée dans ce cas, car ce test de dépistage de masse n’est pas un outil diagnostique à l’échelon individuel.
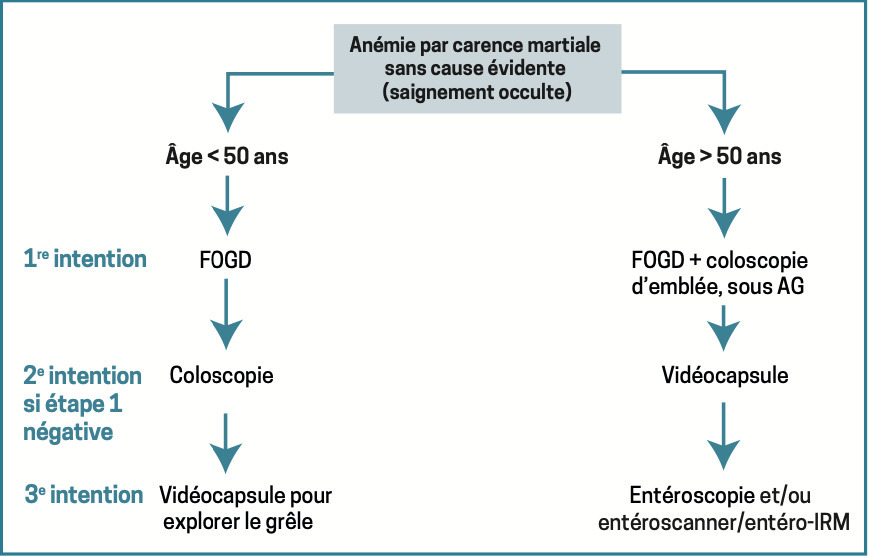
Les examens étiologiques dépendent du sexe et de l’âge du patient : pas d’échographie génito-urinaire systématique, explorations endoscopiques digestives différentes si le sujet est âgé de plus ou de moins de 50 ans (
Substituer en fer
Le traitement est d’abord étiologique. La complémentation repose sur le fer ferreux per os : 150 à 300 mg/j à prendre de préférence le matin à jeun ou en 2 prises, en dehors des repas afin de ne pas gêner l’absorption.
Les effets secondaires digestifs (nausées, douleurs abdominales, troubles du transit) sont relativement fréquents et peuvent nuire à l’observance. La durée du traitement doit être au minimum de 3 à 4 mois jusqu’à normalisation de la ferritine (temps nécessaire pour reconstituer les réserves en fer).
En cas d’intolérance digestive à diverses formulations de fer ou de malabsorption avérée, une substitution par voie veineuse est possible en hospitalisation de jour (risque de réaction allergique grave et imprévisible) :
– carboxymaltose ferrique (Ferinject), dose adaptée au poids, sans dépasser 1 000 mg par injection ;
– hydroxyde ferrique-saccharose (Venofer) à intervalle régulier.
L’hémogramme est contrôlé en général après 3 mois de substitution. En situation d’inflammation aiguë ou chronique, l’absorption en fer est fortement diminuée, et la supplémentation orale inefficace. Il faut donc traiter la carence martiale après cet épisode. Par ailleurs, le fer étant un facteur de croissance bactérien, on doit éviter les perfusions en période infectieuse.
Autres anémies carencielles : B9 et B12
Carence en folates (vitamine B9)
Elle est le plus souvent liée à une insuffisance d’apport (dénutrition, régime alimentaire déséquilibré, alcoolisme chronique…). Elle peut être secondaire à des besoins accrus (grossesses répétées, hémolyse chronique) ou, plus rarement, à une malabsorption intestinale (maladie intestinale, résection du grêle proximal) ou à la prise de certains médicaments (méthotrexate, triméthoprime, pyriméthamine, certains antiépileptiques, salazopyrine…).
Le diagnostic est biologique : dosage des folates sériques < 5 ng/L. Le folate intra-érythrocytaire reflète les réserves durant toute la durée de vie d’une hématie, mais il n’est pas considéré comme plus spécifique que le dosage sérique (5 % des patients ayant une carence en folates non détectée par cet examen seraient rattrapés par le dosage intra-érythrocytaire). Si une origine nutritionnelle (carence ou besoins accrus) est mise en évidence, le traitement substitutif par acide folique per os à la dose de 5 à 10 mg/j pendant 2 à 4 mois est en règle générale suffisant.4
carence en vitamine B12
Elle est volontiers secondaire à une maladie de Biermer (50 % des cas). Cette gastrite atrophique chronique auto-immune est localisée au fundus et responsable d’une malabsorption. Elle atteint de manière privilégiée la femme de plus de 60 ans. En dehors de l’anémie, glossite, dyspepsie, diarrhée et signes neuropsychiques sont parfois identifiés. Elle est fréquemment associée à d’autres affections auto-immunes, qu’il faut rechercher : myxœdème ou thyroïdite de Hashimoto, maladie d’Addison, vitiligo, diabète insulinodépendant, hypo-gammaglobulinémie acquise. Les anticorps anti-facteur intrinsèque sont spécifiques.
Le principal diagnostic différentiel est la mal- digestion des cobalamines alimentaires, favorisée par certains médicaments (metformine, inhibiteurs de la pompe à protons). Les fourchettes physiologiques de vitamine B12 étant mal connues chez les sujets âgés et non européens, le diagnostic de carence ne doit pas être abusif en l’absence d’anémie macrocytaire.
La supplémentation se fait par voie orale, 1 000 µg/j (sauf maladie de Biermer), ou par voie IM, 1 000 µG/j, pendant 1 semaine, puis une fois par semaine pendant 1 mois, puis tous les 1-3 mois dès lors que le stock est reconstitué.4 En général, il s’agit d’un traitement au long cours, sauf cause réversible.
Anémie inexpliquée du sujet âgé
Si la démarche diagnostique et les seuils retenus ne diffèrent pas de ceux des sujets jeunes, la prévalence de l'anémie croît avec l’âge : 8 % entre 65 et 74 ans, 13 % entre 75 et 84 ans et 23 % après 85 ans. Les signes classiques sont souvent pris en défaut. En revanche, la fréquence de la symptomatologie d’emprunt est spécifiquement gériatrique, une anémie pouvant décompenser une pathologie cardiovasculaire, mais aussi neurovasculaire, voire neurodégénérative (malaises, chutes, confusion). Elle est un facteur indépendant de mortalité.
L’anémie inexpliquée est une entité particulière.
Normocytaire et arégénérative, elle n’est due ni à une carence d’apport ni à une insuffisance rénale chronique ni à une inflammation persistante, et la réponse à l’EPO est diminuée. Elle représenterait jusqu’à 37 % des anémies du sujet âgé. La CRP est basse.
Les origines en sont probablement multiples (défaut de réponse à l’EPO, déficit androgénique, myélodysplasie a minima). Elle est en général modérée, avec un taux d’hémoglobine moyen à 11,6 g/dL.
Anémie des maladies chroniques
Elle serait la deuxième cause la plus fréquente, après la carence martiale. Sa prévalence augmente avec l’âge, touchant jusqu’à 77 % des sujets âgés anémiques sans cause clairement identifiée mais atteints de maladies chroniques infectieuses, néoplasiques, auto-immunes (polyarthrite rhumatoïde, lupus érythémateux disséminé et autres connectivites, vascularites systémiques, sarcoïdose, maladies inflammatoires chroniques de l’intestin), de rejet chronique post-transplantation, d’insuffisance rénale chronique (en sus de la carence en érythropoïétine), d’obésité, de bronchopathie chronique obstructive ou d’insuffisance cardiaque chronique.
Sa physiopathologie demeure peu claire et associe plusieurs facteurs : défaut du métabolisme du fer, inhibition de l’érythropoïèse, moindre réponse à l’érythropoïétine et durée de vie des hématies réduite. En général modérée, normocytaire arégénérative, elle est parfois associée à une carence en fer.
Ce diagnostic d’élimination ne se conçoit qu’après exploration complète de l’anémie normocytaire. Le traitement est celui de la maladie sous-jacente, combiné à une prise en charge de la carence martiale le cas échéant.6
Quand passer la main au spécialiste ?
L’indication d’un avis spécialisé dépend du type d’anémie et de la tolérance.
Profonde, mal tolérée, sans cause évidente ou secondaire à une hémolyse aiguë (même modérée), elle impose un transfert urgent en milieu hospitalier.
Pour les formes microcytaires, le recours au spécialiste se décide en l’absence d'étiologies évidentes, après élimination d’une carence martiale et d’une inflammation chronique.
Les anémies normo- ou macrocytaires arégénératives restant idiopathiques après le bilan indiqué ci-dessus doivent également être référées au spécialiste pour discuter un myélogramme (syndrome myélodysplasique).
1. HAS. Transfusion de globules rouges ; homologues : produits, indications, alternatives. Recommandation de bonne pratique. Novembre 2014.
2. Short MW, Domagalski JE. Iron Deficiency Anemia: evaluation and management. Am Fam Physician 2013;87:98-104.
3. Celi J, Samii K, Perrier A, Reny JL. Anémie ferriprive, inflammatoire ou mixte : comment orienter le diagnostic ? Rev Med Suisse 2011; 7:2018-23.
4. Devalia V, Hamilton MS, Molloy AM. Guidelines for the diagnosis and treatment of cobalamin and folate disorders. Br JHaematol 2014;166: 496-513.
5. Goodnough LT, Schrier SL. Evaluation and management of anemia in the elderly. Am J Hematol 2014;89:88-96.
6. Poggiali E, Migone De Amicis M, Motta I. Anemia of chronic disease: a unique defect of iron recycling for many different chronic diseases. Eur J Intern Med 2014; 25:12-7.