Autrefois diagnostiquée tardivement dans son évolution et cantonnée à l’est de la France, cette maladie est de plus en plus souvent découverte fortuitement et précocement chez des patients traités par des immunosuppresseurs mais aussi dans d’autres régions.
L’échinococcose alvéolaire est une zoonose parasitaire due au développement pseudo-tumoral, le plus souvent hépatique, de la larve du cestode Echinococcus (E.) multilocularis.1
Au cours des 30 dernières années, de maladie découverte tardivement, presque toujours mortelle sans traitement, elle est devenue une maladie de découverte le plus souvent fortuite, en particulier chez les patients traités par des médicaments immunosuppresseurs pour cancer ou pour maladie inflammatoire chronique,2 et de bon pronostic, au prix, si possible, d’une résection chirurgicale et, dans tous les cas, d’un traitement antiparasitaire prolongé par albendazole.3
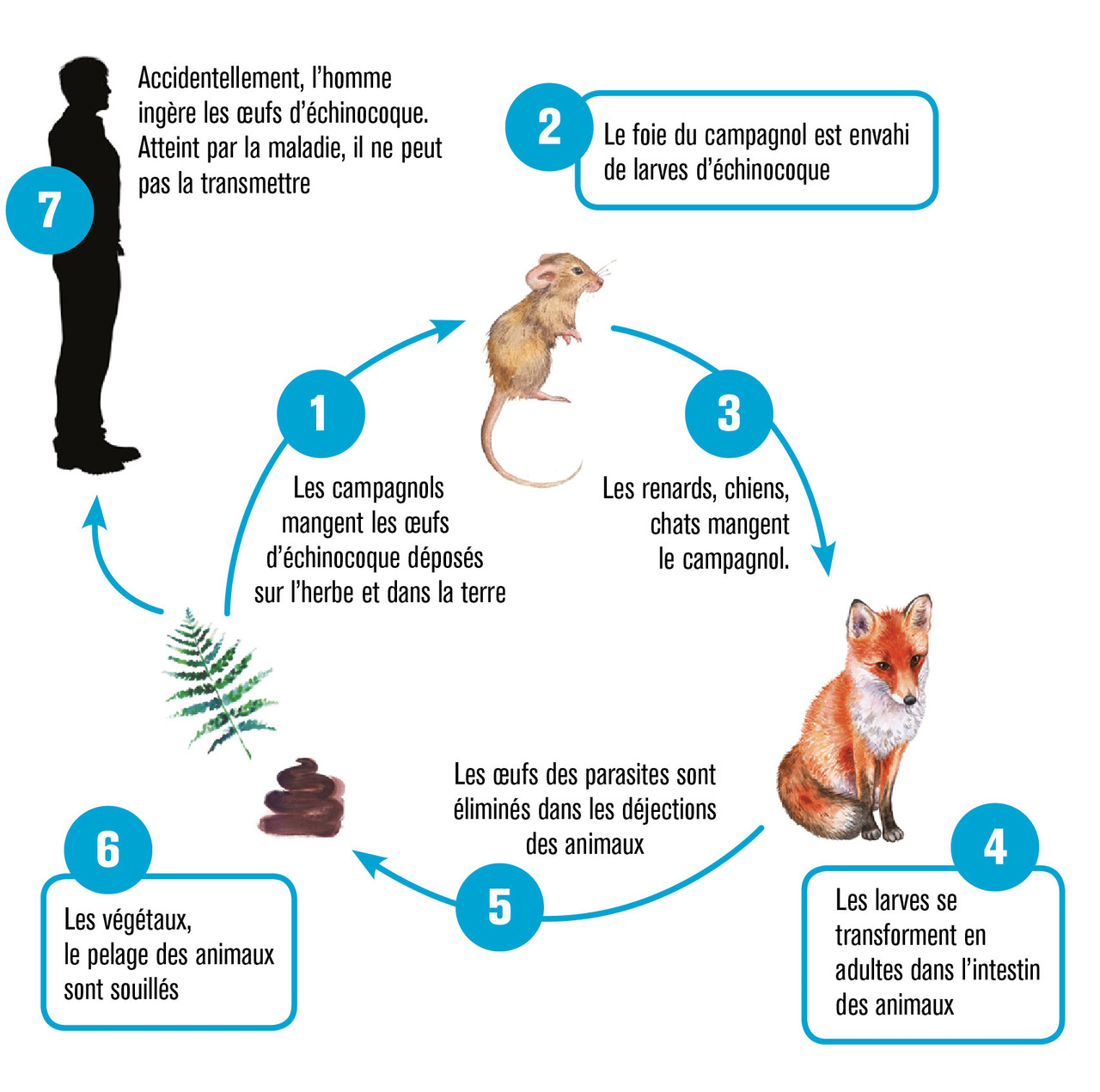
Cycle parasitaire
Des carnivores sont les hôtes définitifs des vers adultes (de 3 à 4 mm de long) du cestode E. multilocularis (
La couche germinale (germinal layer) de cellules parasitaires est à l’origine de :
– la croissance parasitaire, par bourgeonnement et vésiculation ;
– la production de liquide intracavitaire et des éléments qui assurent la fertilité du métacestode, les proto-scolex, préfiguration du ver adulte, constamment observés chez les petits mammifères, mais dans 20 % seulement des lésions d’échinococcose alvéolaire chez l’homme ;
– la formation de la cuticule (ou couche stratifiée, si on adopte la terminologie internationale en langue anglaise laminated layer).1
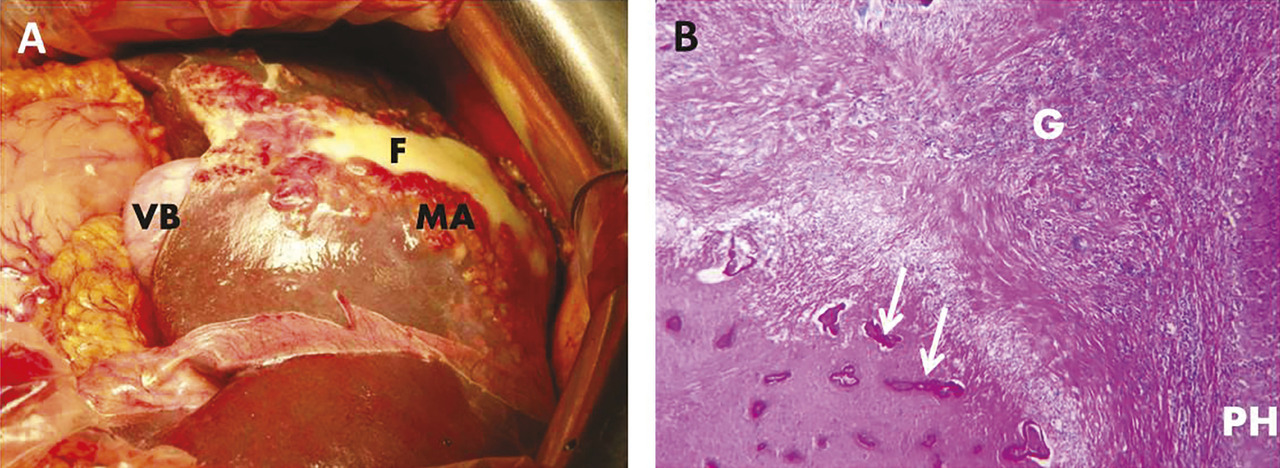
À la périphérie des microkystes est observée une réaction périparasitaire granulomateuse intense du système immunitaire de l’hôte, responsable à terme de nécrose et de fibrose qui contribuent aux complications de la maladie.3
Nouveautés épidémiologiques
La présence de facteurs environnementaux (géographiques, et en relation avec l’utilisation des sols par l’agriculture) qui favorisent la pullulation des rongeurs qui servent de réservoir à la parasitose explique la localisation particulière des cas humains dans des zones géographiques particulières. Cela est vrai au plan mondial comme au plan régional, en dépit de la présence quasi universelle des rongeurs et des carnivores concernés par le cycle parasitaire animal.5
La Chine de l’Ouest (centre et nord-ouest) rassemble le plus grand nombre de cas d’échinococcose alvéolaire au plan mondial. Des foyers d’échinococcose alvéolaire ont été identifiés en Alaska, au Japon (Hokkaïdo), dans la plus grande part de la Russie, de l’Asie centrale, dont l’ouest de la Turquie.5 Alors qu’en dépit d’une infection connue des renards en Amérique du Nord, seuls quelques cas humains isolés avaient été décrits au cours du siècle dernier, depuis 2013 des cas humains d’échinococcose alvéolaire ont été découverts au Canada, principalement dans l’Alberta.6 En Europe, les principales régions d’endémie sont au nord, est et centre de l’Europe : Allemagne, Suisse, Autriche, est et centre de la France. Cependant, depuis la fin du xxe siècle, la présence du parasite est avérée dans presque tous les pays d’Europe, et l’apparition de cas humains a confirmé le risque effectif de contamination dans ces pays ; les pays baltes sont les plus touchés.7
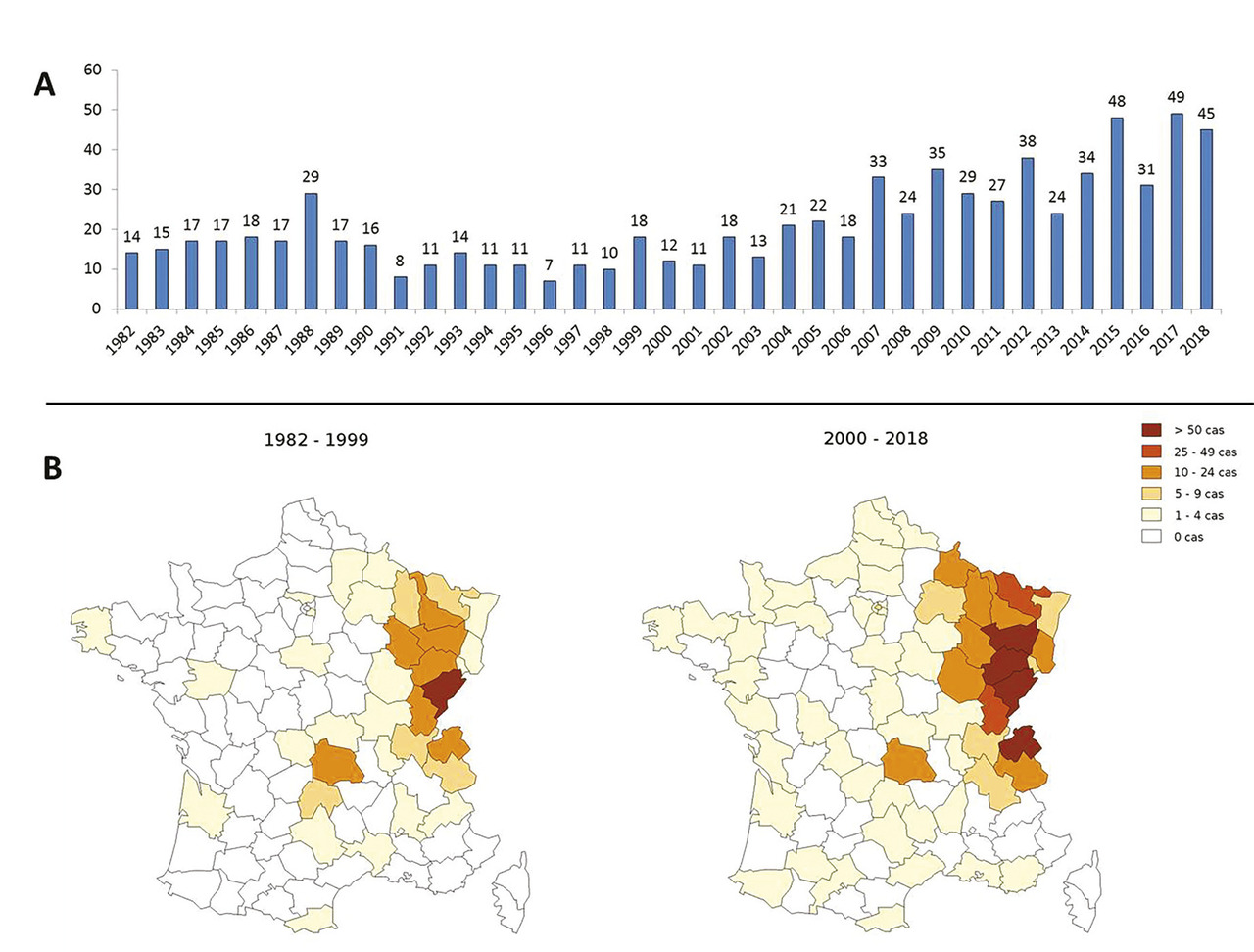
L’élargissement de la zone d’endémie européenne de l’échinococcose alvéolaire au cours des deux dernières décennies pourrait être dû à une augmentation importante de la population vulpine en Europe, donc de renards parasités dans les zones d’endémie, et la présence de renards infectés par E. multilocularis dans les villes, exposant les populations urbaines jusqu’à maintenant peu concernées. Les chiens sont le plus souvent responsables de la contamination humaine en Chine et en Asie centrale, mais ils semblent prendre de l’importance en Europe. En France, une étude à grande échelle a montré une contamination des renards dans des régions de l’Ouest jusqu’à présent considérées indemnes, et des cas humains y sont régulièrement signalés.8 La répartition temporelle et géographique des cas observés en France entre 1983 et 2018 est donnée dans la
Données cliniques
Chez les patients non immunodéprimés, l’évolution se fait à bas bruit pendant de nombreuses années, jusqu’à 10-15 ans après la contamination, dans les formes « classiques ». La pseudo-tumeur parasitaire envahit de proche en proche le parenchyme hépatique, les voies biliaires et les vaisseaux. La révélation de l’affection par des symptômes cliniques traduit habituellement soit une lésion volumineuse, soit une complication liée à l’invasion ou à la compression des structures vasculaires ou biliaires. De plus en plus souvent en Europe, une fois sur deux en France (données FrancEchino), l’échinococcose alvéolaire n’est découverte qu’à la faveur d’un examen d’imagerie.3 Une comparaison récente du recrutement de 4 centres de référence pour les échinococcoses alvéolaires, dont 2 en Europe et 2 en Chine de l’Ouest, montre bien la différence de recrutement – et de mode de révélation de la maladie – dans les deux zones d’endémie : les patients vus en Chine actuellement ont des formes très avancées et correspondent globalement, dans leur symptomatologie, aux patients qui étaient diagnostiqués en Europe dans les années 1980 (données du réseau XUUB*).9 Voir la
Symptômes révélateurs « classiques »
L’hépatomégalie, d’allure pseudo-tumorale, dure, irrégulière, due à la masse parasitaire, ne traduit parfois seulement que l’hypertrophie compensatrice du foie lorsque les lésions, même de taille limitée, ont envahi les vaisseaux portes. Sa découverte, avec un état général conservé, doit en zone d’endémie faire évoquer le diagnostic.10 Cette circonstance de découverte est devenue extrêmement rare en Europe.
L’ictère, accompagné éventuellement de prurit, présent dans la moitié des cas dans les années 1980, n’est présent que chez 7 % des patients en France dans les années 2010 (données FrancEchino). Il reste une circonstance habituelle de diagnostic dans les zones hyperendémiques de Chine ou d’Asie centrale, où le recours aux soins est tardif. L’ictère est lié à l’envahissement de la convergence biliaire par le processus parasitaire, comme dans un cholangiocarcinome.3
Des douleurs abdominales non systématisées, des troubles dyspeptiques, une pesanteur de l’hypocondre droit sans aucune caractéristique spécifique sont trouvés dans 80 % des cas dans les années précédant le diagnostic.11
Symptômes révélant des complications hépatiques
Dans les formes les plus évoluées de la maladie, les principales complications hépatiques sont dues : à l’infection des voies biliaires dilatées, avec des tableaux clinico-biologiques d’angiocholite (par mise en communication de la lésion avec les voies biliaires et/ou la migration de débris parasitaires ou de calculs pigmentaires développés en amont de la sténose parasitaire) ; à l’obstruction des veines portes, avec le lent développement d’une hypertension portale, et/ou d’un cavernome portal ; à l’obstruction des veines sus-hépatiques, avec la constitution d’un syndrome de Budd-Chiari développé progressivement ; au développement d’une cavité nécrotique au centre des lésions, pseudokyste (et non pas kyste parasitaire comme dans l’échinococcose kystique),1 dont le contenu peut être le siège d’une surinfection bactérienne et/ou fongique, d’autant plus qu’elle est en communication avec les voies biliaires ; dans ce cas, le tableau clinique est celui d’un abcès du foie.3 La cirrhose biliaire secondaire est l’aboutissement ultime de ces différentes complications.
Symptômes révélant des complications extrahépatiques
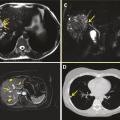
La progression des lésions hors du foie, avec envahissement pseudo-tumoral de voisinage, est à l’origine d’une symptomatologie très diverse en fonction des organes envahis : diaphragme et poumon le plus fréquemment, péricarde et cœur, glande surrénale droite, tête du pancréas, estomac et duodénum, espaces sous-cutanés et peau abdominale antérieure (par progression des lésions le long du ligament rond), cavité péritonéale et de façon ultime pelvis et os du rachis et du bassin.3
Enfin, des métastases à distance des lésions initiales, à la faveur généralement d’effraction vasculaire dans le système sus-hépatique, vers la veine cave, les cavités cardiaques droites, le poumon, le cerveau sont à l’origine d’une symptomatologie aussi variée que les éléments anatomiques atteints. Les localisations pulmonaires (par invasion locale ou métastases) sont identifiées dans 20 % des cas lors de l’évaluation initiale d’extension ; elles révèlent l’infection dans 5 % des cas ; les métastases cérébrales sont exceptionnelles (1 % des cas en Europe, mais plus fréquentes en Chine) et concernent surtout des patients ayant aussi des métastases pulmonaires.12 Bien que très rares, des formes à développement uniquement extrahépatique sont possibles ; à point de départ cutané, ou rachidien, elles ont parfois pu être mises en relation avec une morsure contaminée par les œufs d’E. multilocularis après léchage de sa fourrure par un renard.11
Données de l’imagerie
Le diagnostic d’échinococcose alvéolaire repose essentiellement sur l’imagerie. La découverte d’images évocatrices est de plus en plus souvent fortuite, lors d’un examen à visée diagnostique pour des douleurs abdominales vagues, ou dans le cadre du suivi d’une grossesse, d’un cancer ou d’une hémopathie maligne, ou de toute autre affection chronique.2, 3 La découverte de calcifications sur la zone de projection hépatique sur une radiographie sans préparation, celle d’une lésion hépatique de structure hétérogène avec calcifications en échographie ou à la tomodensitométrie sont les circonstances les plus typiques.
Échographie abdominale
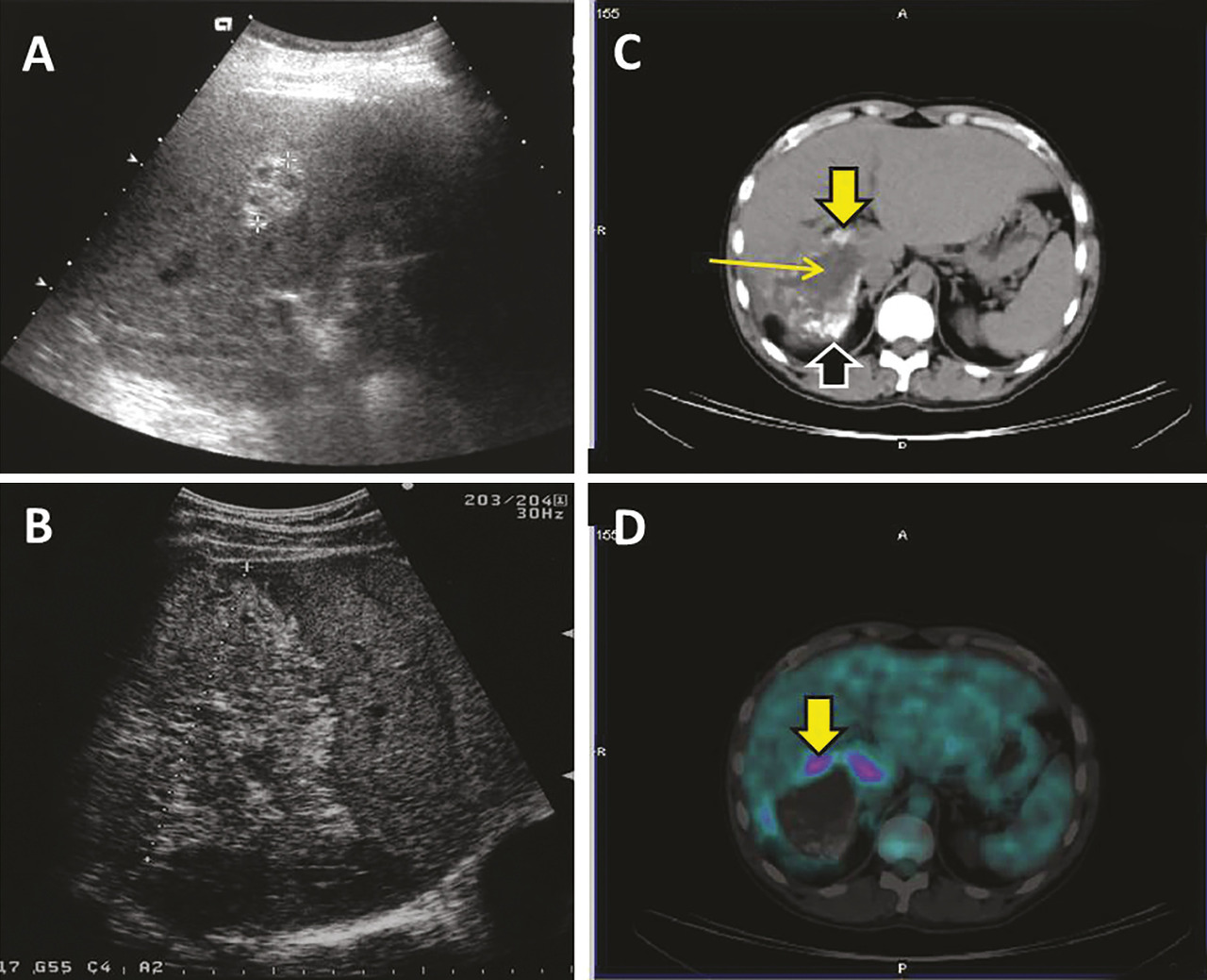
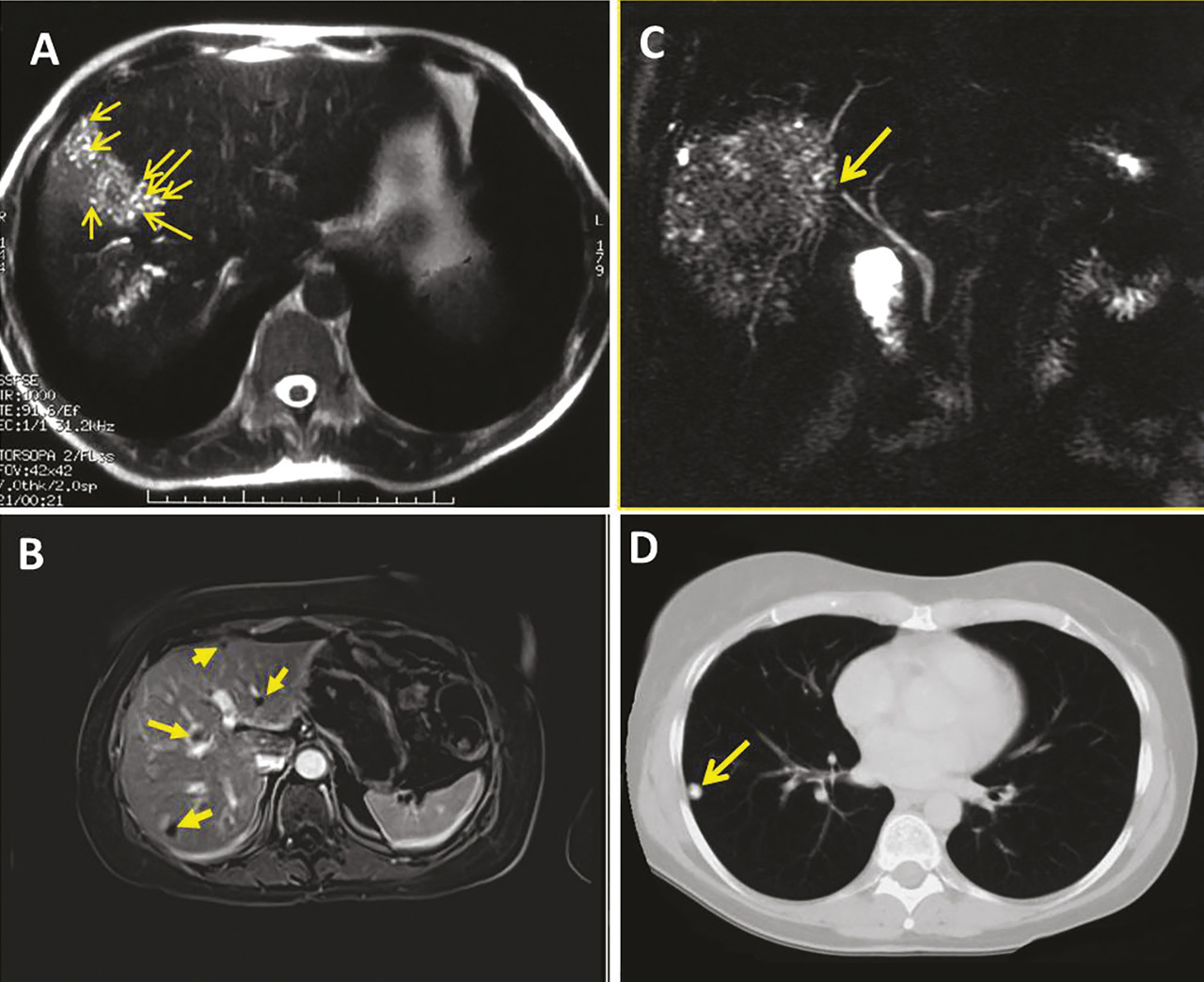
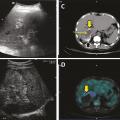
L’aspect échographique habituel est celui d’un processus expansif intrahépatique pseudonéoplasique, d’échostructure hétérogène, à prédominance hyperéchogène, de contours irréguliers mal définis ;13 les zones de nécrose sont généralement de siège central et d’aspect trans-sonore pseudoliquidien (
Tomodensitométrie
La tomodensitométrie (TDM) permet de mieux apprécier le nombre, la taille et la topographie exacte de la ou des lésions.14, 15 Une classification morphologique qui décrit les différents types de lésions observés a récemment été proposée par un des centres de référence européen.16 C’est l’examen qui permet le mieux de mettre en évidence les calcifications dont la signification semble différente selon leur type : témoins de la dégénérescence du métacestode quand elles sont macronodulaires, mais associées à des paramètres évolutifs et de viabilité du métacestode quand elles sont micronodulaires, donnant un aspect poudré.17 Dans les formes évoluées, les lésions, le plus souvent uniques et touchant le foie droit, peuvent atteindre 10-15 cm de diamètre. Les lésions de diagnostic accidentel, en Europe, sont plus souvent que par le passé de petite taille (1-5 cm), et souvent multicentriques, suggérant que les lésions évoluées seraient dues à la confluence de plus petites lésions initiales (données du réseau XUUB). Contrairement aux tumeurs cancéreuses où le rehaussement périlésionnel est très net après injection de produit de contraste, les lésions d’échinococcose alvéolaire ne se rehaussent peu ou pas. La
Imagerie par résonance magnétique
L’imagerie par résonance magnétique (IRM), qui méconnaît les calcifications, est cependant la meilleure technique pour analyser les contenus des foyers parasitaires.3, 14, 15 Les multiples vésicules parasitaires, infracentimétriques, peuvent être visualisées en hypersignal en pondération T2 : l’image « en rayons de miel » ou en « grappes de raisin » est pathognomonique de l’affection ; l’identification des microkystes est associée à l’activité métabolique des lésions.19 L’IRM est complémentaire de la TDM pour apprécier les envahissements vasculaires en particulier cave et sus-hépatiques et l’extension de contiguïté ; enfin, la cholangio-IRM est indispensable en cas de cholestase et de doute sur l’invasion ou l’obstruction des voies biliaires (
TEP-TDM
Une hyperconsommation du fluoro- désoxyglucose (FDG) à la périphérie des lésions en tomographie par émission de positons couplée à la tomodensitométrie (TEP-TDM), bien qu’en réalité associée à la réponse immunitaire de l’hôte, est considérée comme le meilleur signe d’activité métabolique du métacestode (
Autres investigations
L’artériographie cœliomésentérique ou la cavographie ne sont plus nécessaires, et l’opacification des voies biliaires par ponction percutanée l’est rarement en raison du diagnostic plus fréquent de formes asymptomatiques limitées, et des performances actuelles de la TDM et de l’IRM (y compris cholangio-IRM).15 L’opacification biliaire par cholangio-pancréatographie rétrograde endoscopique (CPRE) est la première étape d’un geste interventionnel sur des voies biliaires obstruées.22
Données biologiques, histopathologiques et moléculaires
Anomalies biologiques témoignant de complications de l’échinococcose alvéolaire
Une cholestase anictérique manifestée par une élévation de la gamma-glutamyl transférase et des phosphatases alcalines peut être une circonstance diagnostique, de même qu’une hyperimmunoglobulinémie polyclonale. Les autres paramètres biologiques de la fonction hépatique ne sont anormaux que dans les cas compliqués de cirrhose biliaire secondaire. Une élévation modérée des éosinophiles sanguins et des immunoglobulines (Ig) de type E totales est possible mais rare, parfois contemporaine d’une dissémination sanguine de fragments parasitaires. Une élévation de la protéine C-réactive est un signe de surinfection bactérienne (angiocholite, surinfection bactérienne du pseudokyste nécrotique).
Examens diagnostiques de l’infection par E. multilocularis
Les tests sérologiques identifient la présence d’anticorps contre les espèces d’Echinococcus ; la plupart ne sont pas spécifiques d’espèce et ne peuvent donc pas différencier l’échinococcose alvéolaire de l’échinococcose kystique.23 Des formes abortives peuvent s’accompagner d’une sérologie positive ; à l’inverse, la sérologie est négative dans 5 à 20 % des cas d’échinococcose alvéolaire, selon l’état immunitaire de l’hôte. Le diagnostic différentiel s’appuie en général plus sur la morphologie des lésions que sur la sérologie. Les tests qui utilisent un antigène de « genus » (en hémagglutination indirecte ou en ELISA) sont utilisés en recherche initiale, mais doivent être complétés en cas de positivité, ou de forte suspicion diagnostique fondée sur l’imagerie, par des tests de confirmation : ceux qui sont disponibles commercialement et ont le meilleur pouvoir diagnostique positif et différentiel sont Em2plus-ELISA (Bordier Affinity Product, Crissier, Suisse) et le Western Blot utilisant un antigène d’E. multilocularis (LDBio Diagnostics, Lyon, France).23 L’interprétation des tests par le Centre national de référence (CNR) pour les échinococcoses, à la disposition des médecins qui en font la demande, est recommandée en cas de doute et pour des recherches particulières (cnr-echino@chu-besancon.fr et https://cnr-echinococcoses-ccoms.univ-fcomte.fr/spip.php?article178).
L’examen anatomopathologique montre les lésions caractéristiques et la présence du métacestode, parfois réduit à des fragments de couche stratifiée, fortement PAS positive ; il est souvent réalisé sur la pièce de résection chirurgicale ; effectué sur une biopsie des lésions, il n’est souvent pas concluant s’il ne montre qu’un granulome non spécifique (
Une analyse moléculaire par amplification génique apportant l’identification formelle d’E. multilocularis est désormais possible, et particulièrement utile dans les formes débutantes et chez les immunodéprimés ; les ponctions percutanées pour accéder au tissu pathologique doivent être obligatoirement suivies d’un traitement par albendazole en cas de positivité.23 Ce test est mis à la disposition des médecins qui en font la demande par le CNR-échinococcoses.
Particularités de l’échinococcose alvéolaire chez les patients immunodéprimés
La sensibilité du métacestode d’E. multilocularis à l’immunosuppression est bien démontrée expérimentalement ; a contrario, l’homme est un hôte naturellement résistant au développement larvaire. Depuis le début du xxie siècle, une augmentation significative des cas d’échinococcose alvéolaire observés chez des patients immunodéprimés a pu être constatée.2, 24 Il s’agit surtout de patients recevant un traitement immunosuppresseur après une transplantation ou pour un cancer, une hémopathie maligne, ou une maladie inflammatoire chronique ; parmi ces traitements figurent aussi des biothérapies, en particulier les anti-tumor necrosis factor alpha (anti-TNF-α). L’échinococcose alvéolaire se comporte donc comme une infection opportuniste, particulièrement insidieuse car elle est découverte généralement lors des examens morphologiques de suivi de l’affection traitée par immunosuppresseur, et les lésions, récemment évolutives, peuvent mimer les lésions tumorales dont on effectue le suivi (formes pseudo-métastatiques, « tumeurs » positives en TEP-TDM…), et entraîner retard diagnostique et erreurs thérapeutiques.25 L’immunosuppression est aussi à l’origine d’une évolution rapide des lésions, avec parfois des douleurs hépatiques aiguës. L’absence d’anticorps détectables et donc l’observation de sérologies négatives dans près de 15 % des cas complique le diagnostic, qui repose alors sur les aspects pathognomoniques à l’IRM et l’identification du parasite par biologie moléculaire.2, 25
Moyens et stratégie thérapeutiques
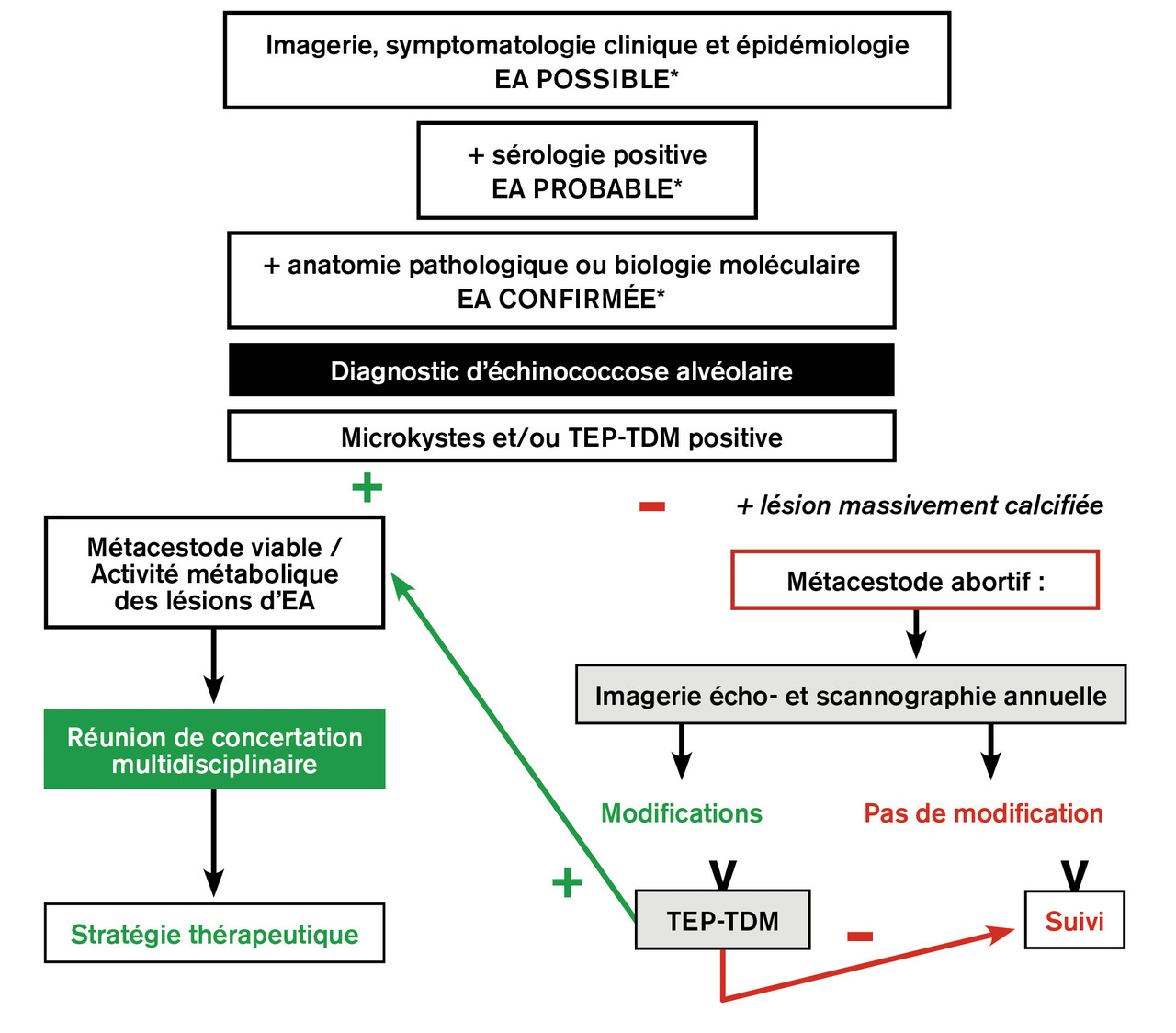
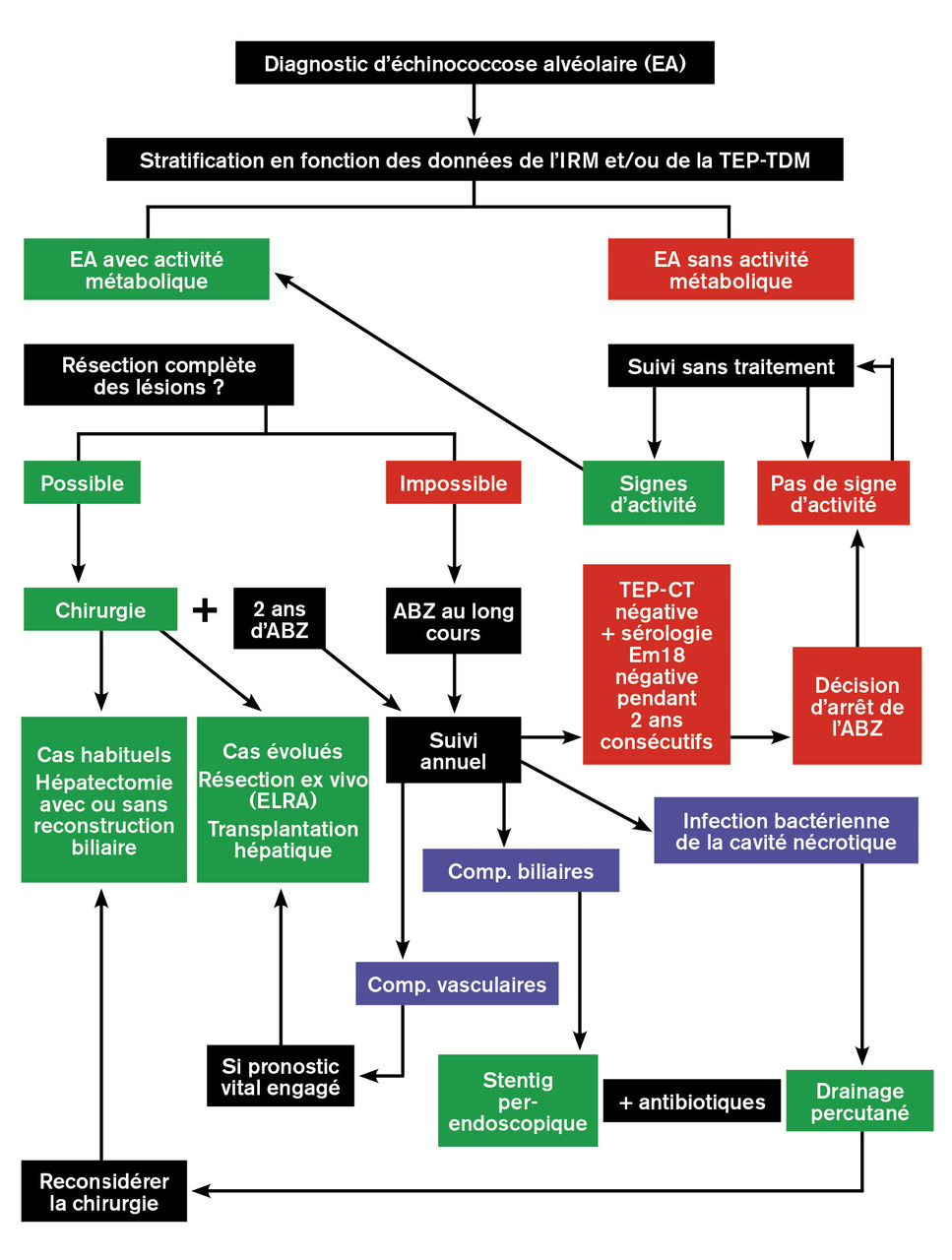
La viabilité du métacestode (appréciée par l’activité métabolique des lésions en TEP-TDM et/ou la présence de microkystes en IRM), l’extension des lésions à l ’imagerie, l’état général du patient et sa capacité à subir une hépatectomie parfois majeure vont déterminer la stratégie thérapeutique (
Conformément aux recommandations internationales publiées par le Groupe informel de travail sur les échinococcoses de l’Organisation mondiale de la santé (WHO-IWGE),18 le traitement de l’échinococcose alvéolaire confirmée et métaboliquement active repose sur le traitement antiparasitaire par albendazole au long cours, associé à une résection complète des lésions quand elle est possible, sur des données anatomiques évaluées par l’imagerie, et en fonction de l’âge et de l’état clinique du patient. Les interventions palliatives qui ne résèquent pas la totalité des lésions, génératrices de complications postopératoires à répétition, sont désormais proscrites.26
Traitement antiparasitaire
L’albendazole doit être administré de façon continue, par voie orale, à la dose de 10 à 15 mg/kg/j, accompagné d’un repas riche en graisses pour améliorer sa biodisponibilité, pendant 2 ans au minimum en cas de résection chirurgicale considérée par le chirurgien comme « complète » avec une marge de sécurité de 0,5 cm.27 Il est administré en principe à vie chez tous les autres patients.3, 18, 26, 28 En France, l’albendazole dans sa formulation adaptée au traitement des échinococcoses (Eskazole) est dispensé par les pharmacies hospitalières**. Ses possibles effets indésirables, alopécie mais surtout hépatite cytolytique et leucopénie, plus fréquents en cas de cholestase et/ou d’hypertension portale, et peut-être aussi chez les immunodéprimés,2 nécessitent un suivi de l’hémogramme et des transaminases au cours des premières semaines de traitement, puis tous les 3 mois.28 Les variabilités interindividuelles de pharmacocinétique de l’albendazole et les possibles interférences (avec des médicaments mais aussi avec le tabac, le cannabis, et d’autres xénobiotiques des plantes…) justifient un suivi pharmacologique par dosage de l’albendazole sulfoxide, réalisé en France par le CNR-échinococcoses, et à la disposition des médecins qui en font la demande.23, 28 Ces dosages permettent un ajustement des doses, pour une efficacité optimale. Un arrêt du traitement peut être tenté après plusieurs années d’administration à dose utile ; dans l’état actuel de nos connaissances et faute d’une étude prospective contrôlée sur un nombre adéquat de patients, il ne peut se faire que sur la base d’une double négativité pendant 2 ans : celle de la TEP-TDM et celle de la sérologie spécifique d’E. multilocularis, l’antigène de détection le plus adapté au suivi en ELISA étant la protéine recombinante Em18, qui semble témoin de la viabilité parasitaire.23, 29, 30 Le suivi des patients atteints d’échinococcose alvéolaire, traités ou non, demeure cependant une obligation à vie, car des reprises évolutives ont été décrites plusieurs années après une intervention chirurgicale ou un arrêt de l’albendazole ; l’immunosuppression peut être une circonstance de récidive.3, 24, 31
Traitements interventionnels invasifs
La résection chirurgicale à visée curative, possible dans 30 à 40 % des cas, est réalisée par différents types d’hépatectomie conventionnelle de la chirurgie hépatobiliaire, avec ou sans reconstruction de la voie biliaire et des vaisseaux porte, sus-hépatiques et/ou cave inférieur en fonction des données anatomiques.26 La transplantation hépatique est devenue une indication d’exception pour l’échinococcose alvéolaire, en raison du type de cas d’échinococcose alvéolaire diagnostiqués en Europe actuellement, et en raison du risque lié à l’immunosuppression thérapeutique (qui évite le rejet du foie mais favorise la récidive dans le greffon ou les métastases à distance).32, 33 Dans certaines formes très évoluées, ellepermet une survie très acceptable (plus de 30 ans chez des patients transplantés dans les années 1980), au prix d’un traitement continu par albendazole, indispensable.33 Pour pallier la nécessité de recourir à la transplantation hépatique, la technique ELRA (ex vivo liver resection and auto-transplantation), qui consiste à effectuer les différents gestes de résection hépatique et de reconstruction biliaire et vasculaire en dehors du corps du patient, puis à réimplanter le foie, a été développée par les chirurgiens chinois, avec des résultats très satisfaisants (sur plus de 100 patients) dans les mêmes situations de « sauvetage » que la transplantation allogénique.34 L’applicabilité de cette technique à la situation européenne est sujet à débat.35
Méthodes interventionnelles non chirurgicales
Elles permettent habituellement le traitement des complications infectieuses bactériennes et biliaires sans recourir à la chirurgie : drainage transhépatique transcutané pour les infections du pseudokyste formé par la nécrose au centre des lésions évoluées ; drainage biliaire perendoscopique par l’insertion de plusieurs stents plastiques après lavage extensif de la voie biliaire en cas d’obstruction.22 Un traitement antibiotique adapté s’impose dans tous ces cas. L’intérêt d’une administration au long cours d’acide ursodésoxycholique dans les cas de cholestase chronique et/ou après un geste interventionnel reste encore débattu.23, 28
Pronostic
Maladie mortelle dans 95 % des cas dans les 5 ans après le diagnostic dans les années 1980, l’échinococcose alvéolaire est devenue une maladie chronique, avec un traitement efficace et un suivi contraignant, mortelle dans moins de 5 % des cas. La courbe de survie des patients rejoint celle de la population générale en Europe.8, 36, 37 La parasitose reste cependant très préoccupante dans les zones d’endémie où l’accès aux soins est moins favorable.38
Prévention
La prévention de l’échinococcose alvéolaire est difficile car le cycle du parasite se déroule majoritairement dans la nature. Le chauffage et a fortiori la cuisson des aliments potentiellement contaminés détruisent les œufs, mais la congélation est sans effet. La prévention au plan individuel impose des précautions dans les contacts avec les carnivores, hôtes définitifs (ne jamais toucher un renard à mains nues), la protection des jardins potagers dont on sait maintenant qu’ils peuvent être infectés par des fèces de carnivores contaminants, y compris de chats et de chiens,39-42 et les mesures générales d’hygiène comme le lavage des mains et le rinçage des aliments consommés crus. En cas de doute sur une contamination éventuelle, en particulier en contexte professionnel, une échographie hépatique et une sérologie sont recommandées dans un délai de 2 ans.
Rester vigilant
Des progrès thérapeutiques importants ont amélioré le pronostic et la qualité de vie des patients atteints d’échinococcose alvéolaire. Cependant, l’émergence de cas dans des zones ou des populations qui n’étaient pas antérieurement considérées à risque et chez les patients immunodéprimés appelle à la vigilance des professionnels de santé, y compris hors des zones géographiques traditionnelles d’endémie.25, 39 Les pistes thérapeutiques incluent l’utilisation de l’immunothérapie associée à l’albendazole ; une observation clinique et des études expérimentales avaient montré l’intérêt possible de l’interféron alpha-2a ; des études plus récentes se sont intéressées à l’intervention sur les « check-points » dans les réponses immunitaires, déjà développée en cancérologie, comme celle ciblant les systèmes PD-1/PD-L1 (programmed cell death protein-1/PD-ligand 1) ou TIGIT (T-cell immunoreceptor with immunoglobulin and immunoreceptor tyrosine-based inhibitory motif domain) ; des études cliniques de phase I-II devraient être initiées dans un proche avenir.43-45 Des études prospectives sont requises pour mieux définir l’intérêt de la chirurgie dans les circonstances actuelles de diagnostic en Europe, et les modalités d’un éventuel arrêt du traitement au long cours par albendazole.
* Le réseau XUUB est constitué de deux centres de référence chinois, à Urumqi, région autonome du Xinjiang, et Xining, province du Qinghai, Chine, et de deux centres de référence européens, Besançon, Bourgogne-Franche-Comté, France, et Ulm, Baden Württemberg, Allemagne.
** http://base-donneespublique.medicaments.gouv.fr/
Les auteurs remercient vivement Florent Demonmerot pour son investissement dans la constitution et le maintien de la base de données FrancEchino, et de son aide dans la préparation des illustrations épidémiologiques. Ils remercient tous les membres du Centre national de référence échinococcoses pour leur expertise et leur mobilisation transdisciplinaire, les membres du réseau français FrancEchino, et les patients de l’Association pour l’information et la recherche sur l’échinococcose alvéolaire (AIREA).
1. Vuitton DA, McManus DP, Rogan MT, et al. International consensus on terminology in the field of echinococcosis. Parasite (Paris, France) 2020;27:41.doi:10.1051/parasite/2020024
2. Chauchet A, Grenouillet F, Knapp J, et al. Increased incidence and characteristics of alveolar echinococcosis in patients with immunosuppression-associated conditions. Clin Infect Dis 2014;59:1095-104.
3. Kern P, Menezes da Silva A, Akhan O, et al. The Echinococcoses: diagnosis, clinical management and burden of disease. Adv Parasitol 2017;96:259-369.
4. Wen H, Vuitton L, Tuxun T, et al. Echinococcosis: Advances in the 21st Century. Clin Microbiol Rev 2019;32.
5. Deplazes P, Rinaldi L, Alvarez Rojas CA, et al. Global distribution of alveolar and cystic echinococcosis. Advanc Parasitol 2017;95:315-493..
6. Massolo A, Klein C, Kowalewska-Grochowska K, et al. European Echinococcus multilocularis Identified in Patients in Canada. N Engl J Med 2019;381:384-5.
7. Vuitton DA, Demonmerot F, Knapp J, et al. Clinical epidemiology of human AE in Europe. Vet Parasitol 2015;213:110-20.
8. Combes B, Comte S, Raton V, et al. Westward spread of Echinococcus multilocularis in foxes, France, 2005-2010. Emerging Infect Dis 2012;18:2059-62.
9. Graeter T, Bao H, Delabrousse E, et al.; XUUB consortium. Hepatic alveolar echinococcosis: Comparative computed tomography study between two Chinese and two European centres. Food Waterborne Parasitol 2020;19:e00082.
10. Vuitton D, S Bresson-Hadni, Giraudoux P, et al. L’échinococcose alvéolaire : d’une maladie rurale incurable à une infection urbaine sous contrôle. Presse Med 2010;39:209-30.
11. Piarroux M, Piarroux R, Giorgi R, et al. Clinical features and evolution of alveolar echinococcosis in France from 1982 to 2007: results of a survey in 387 patients. J Hepatol 2011;55:1025-33.
12. Yang G, Zhang Q, Tang G, et al. Role of magnetic resonance spectroscopy and susceptibility weighted imaging in cerebral alveolar echinococcosis. Iran J Parasitol 2015;10:122-7.
13. Kratzer W, Gruener B, Kaltenbach TEM, et al. Proposal of an ultrasonographic classification for hepatic alveolar echinococcosis: Echinococcosis multilocularis Ulm classification-ultrasound. World J Gastroenterol 2015;21:12392-402.
14. Bresson-Hadni S, Delabrousse E, Blagosklonov O, et al. Imaging aspects and non-surgical interventional treatment in human alveolar echinococcosis. Parasitol Int 2006;55(Suppl):S267-272.
15. Liu W, Delabrousse É, Blagosklonov O, et al. Innovation in hepatic alveolar echinococcosis imaging: best use of old tools, and necessary evaluation of new ones. Parasite 2014;21:74.
16. Graeter T, Kratzer W, Oeztuerk S, et al. Proposal of a computed tomography classification for hepatic alveolar echinococcosis. World J Gastroenterol 2016;22:3621-31.
17. Brumpt E, Blagosklonov O, Calame P, et al. AE hepatic lesions: correlation between calcifications at CT and FDG-PET/CT metabolic activity. Infection 2019;47:955-60.
18. Brunetti E, Kern P, Vuitton DA, et al. Expert consensus for the diagnosis and treatment of cystic and alveolar echinococcosis in humans. Acta Trop 2010;114:1-16.
19. Azizi A, Blagosklonov O, Lounis A, et al. Alveolar echinococcosis: correlation between hepatic MRI findings and FDG-PET/CT metabolic activity. Abdom Imaging 2015;40:56-63.
20. Reuter S, Grüner B, Buck AK, et al. Long-term follow-up of metabolic activity in human alveolar echinococcosis using FDG-PET. Nuklearmedizin 2008;47:147-52.
21. Caoduro C, Porot C, Vuitton DA, et al. The role of delayed 18F-FDG PET imaging in the follow-up of patients with alveolar echinococcosis. J Nucl Med 2013;54:358-63.
22. Ambregna S, Koch S, Sulz MC, et al. A European survey of perendoscopic treatment of biliary complications in patients with alveolar echinococcosis. Expert Rev Anti Infect Ther 2017;15:79-88.
23. Grenouillet F, Chauchet A, Richou C, et al. Échinococcose alvéolaire : épidémiologie, surveillance et prise en charge. J Anti-Infectieux 2013;10:204-14.
24. Lachenmayer A, Gebbers D, Gottstein B, et al. Elevated incidence of alveolar echinococcosis in immunocompromised patients. Food Waterborne Parasitol 2019;16:e00060.
25. Vuitton DA, Bresson-Hadni S, Chauchet A, et al. L’échinococcose alvéolaire au XXIe siècle : une maladie infectieuse opportuniste ? Bull Acad Nat Med 2019;203:94-101.
26. Vuitton DA, Azizi A, Richou C, et al. Current interventional strategy for the treatment of hepatic alveolar echinococcosis. Expert Rev Anti Infect Ther 2016;14:1179-94.
27. Hillenbrand A, Gruener B, Kratzer W, et al. Impact of safe distance on long-term outcome after surgical therapy of alveolar echinococcosis. World J Surg 2017;41:1012-8.
28. Vuitton D, Bresson-Hadni S. Alveolar echinococcosis: evaluation of therapeutic strategies. Expert Opinion Orphan Drugs 2014;2:67686.
29. Gottstein B, Wang J, Blagosklonov O, et al. Echinococcus metacestode: in search of viability markers. Parasite 2014;21:63.
30. Gottstein B, Lachenmayer A, Beldi G, et al. Diagnostic and follow-up performance of serological tests for different forms/courses of alveolar echinococcosis. Food Waterborne Parasitol 2019;16:e00055.
31. Ammann RW, Stumpe KDM, Grimm F, et al. Outcome after discontinuing long-term benzimidazole treatment in 11 patients with non-resectable alveolar echinococcosis with negative FDG-PET/CT and anti-EmII/3-10 serology. PLoS Negl Trop Dis 2015;9:e0003964.
32. Koch S, Bresson-Hadni S, Miguet JP, et al. Experience of liver transplantation for incurable alveolar echinococcosis: a 45-case European collaborative report. Transplantation 2003;75:856-63.
33. Bresson-Hadni S, Blagosklonov O, Knapp J, et al. Should possible recurrence of disease contraindicate liver transplantation in patients with end-stage alveolar echinococcosis? A 20-year follow-up study. Liver Transpl 2011;17:855-65.
34. Aji T, Dong JH, Shao YM, et al. Ex vivo liver resection and autotransplantation as alternative to allotransplantation for end-stage hepatic alveolar echinococcosis. J Hepatol 2018;69:1037-46.
35. Beldi G, Vuitton D, Lachenmayer A, et al. Is ex vivo liver resection and autotransplantation a valid alternative treatment for end-stage hepatic alveolar echinococcosis in Europe? J Hepatol 2019;70:1030-1.
36. Torgerson PR, Schweiger A, Deplazes P, et al. Alveolar echinococcosis: from a deadly disease to a well-controlled infection. Relative survival and economic analysis in Switzerland over the last 35 years. J Hepatol 2008;49:72-7.
37. Piarroux M, Piarroux R, Giorgi R, et al. Clinical features and evolution of alveolar echinococcosis in France from 1982 to 2007: results of a survey in 387 patients. J Hepatol 2011;55:1025-33.
38. Bebezov B, Mamashev N, Umetaliev T, et al. Intense focus of alveolar echinococcosis, South Kyrgyzstan. Emerging Infect Dis 2018;24:1119-22.
39. Gottstein B, Stojkovic M, Vuitton DA, et al. Threat of alveolar echinococcosis to public health--a challenge for Europe. Trends Parasitol 2015;31:407-12.
40. Knapp J, Giraudoux P, Combes B, et al. Rural and urban distribution of wild and domestic carnivore stools in the context of Echinococcus multilocularis environmental exposure. Int J Parasitol 2018;48:937-46.
41. Bastien M, Vaniscotte A, Combes B, et al. High density of fox and cat faeces in kitchen gardens and resulting rodent exposure to Echinococcus multilocularis and Toxoplasma gondii. Folia Parasitol 2018;65.
42. Vaniscotte A, Raoul F, Poulle ML, et al. Role of dog behaviour and environmental fecal contamination in transmission of Echinococcus multilocularis in Tibetan communities. Parasitology 2011;138:1316-29.
43. Zhang C, Lin R, Li Z, et al. Immune exhaustion of T cells in alveolar echinococcosis patients and its reversal by blocking checkpoint receptor TIGIT in a murine model. Hepatology 2020;71:1297-15.
44. Wang J, Jebbawi F, Bellanger A-P, et al. Immunotherapy of alveolar echinococcosis via PD-1/PD-L1 immune checkpoint blockade in mice. Parasite Immunol 2018:e12596.
45. Godot V, Harraga S, Podoprigora G, et al. IFN alpha-2a protects mice against a helminth infection of the liver and modulates immune responses. Gastroenterology 2003;124:1441-50.