L’endométriose se définit par la présence de glandes ou de stroma endométrial en dehors de l’utérus. C’est une affection gynécologique fréquente (6-10 %) des femmes âgées de 30 à 45 ans1, mais la prévalence chez l’adolescente n’est pas connue en raison du délai tardif du diagnostic et de la nécessité d’une laparoscopie pour le confirmer. Les données d’interrogatoire rapportent néanmoins la survenue des premiers symptômes à l’adolescence.1, 2 Chez les jeunes filles ayant bénéficié d’une cœlioscopie exploratrice pour dysménorrhée sévère, des lésions d’endométriose seraient retrouvées dans 62 % des cas et jusqu’à 75 % lorsqu’elle est résistante aux traitements.2 L’histoire naturelle de la maladie n’est pas connue, et la classification internationale en quatre stades induit l’idée d’une progression, bien qu’aucune donnée ne crédite cette hypothèse. Compte tenu de l’impact potentiel des symptômes sur la qualité de vie, toute dysménorrhée sévère chez l’adolescente doit être explorée. La démarche diagnostique vise également à éliminer les nombreux diagnostics différentiels de syndrome abdomino-pelvien dans cette classe d’âge.
Rechercher une dysménorrhée sévère
Au début de la maladie, les critères diagnostiques et d’imagerie sont encore mal déterminés, et il n’est pas habituel de réaliser une laparoscopie à titre diagnostique. Par conséquent, chez l’adolescente, l’endométriose est évoquée sur la symptomatologie clinique et les facteurs de risque.
L’interrogatoire, fondamental, recherche une dysménorrhée primaire particulièrement sévère, insuffisamment soulagée par les traitements antalgiques adaptés et entraînant limitation des activités physiques et absentéisme scolaire régulier. Des troubles digestifs et/ou urinaires de type vomissements, diarrhée et pollakiurie l’accompagnent volontiers.
Dysurie, dyschésie ou plus rarement douleurs à la défécation ou dyspareunie – pour celles ayant déjà eu des rapports sexuels – sont fortement évocatrices. L’association de la dysménorrhée à des douleurs pelviennes chroniques non cycliques est aussi très caractéristique.2
Chez l’adolescente, il est essentiel d’évaluer le contexte sociofamilial, le rapport à la scolarité et l’impact sur la qualité de vie du syndrome douloureux. Un antécédent d’abus sexuel doit être systématiquement recherché.
L’examen physique est peu contributif du fait de la rareté des attentes profondes et des limites de l’examen gynécologique chez les patientes vierges. La palpation abdomino-pelvienne élimine un diagnostic différentiel et une tumeur pelvienne.
L’interrogatoire, fondamental, recherche une dysménorrhée primaire particulièrement sévère, insuffisamment soulagée par les traitements antalgiques adaptés et entraînant limitation des activités physiques et absentéisme scolaire régulier. Des troubles digestifs et/ou urinaires de type vomissements, diarrhée et pollakiurie l’accompagnent volontiers.
Dysurie, dyschésie ou plus rarement douleurs à la défécation ou dyspareunie – pour celles ayant déjà eu des rapports sexuels – sont fortement évocatrices. L’association de la dysménorrhée à des douleurs pelviennes chroniques non cycliques est aussi très caractéristique.2
Chez l’adolescente, il est essentiel d’évaluer le contexte sociofamilial, le rapport à la scolarité et l’impact sur la qualité de vie du syndrome douloureux. Un antécédent d’abus sexuel doit être systématiquement recherché.
L’examen physique est peu contributif du fait de la rareté des attentes profondes et des limites de l’examen gynécologique chez les patientes vierges. La palpation abdomino-pelvienne élimine un diagnostic différentiel et une tumeur pelvienne.
Quels facteurs de risque ?
L’analyse rétrospective de cohortes de patientes atteintes d’endométriose montre l’association forte de certains facteurs, à rechercher : hérédité (près de 50 % d’antécédents d’endométriose chez la mère), sévérité de la dysménorrhée primaire, absentéisme scolaire durant les règles, dysménorrhée réfractaire aux anti-inflammatoires non stéroïdiens (AINS), prise d’un estroprogestatif de type pilule à visée non contraceptive pour soulager les douleurs.3
Une malformation utérovaginale est un facteur de risque établi. Il n’existe pas à ce jour de marqueurs biologiques utilisables comme critères diagnostiques.1
Une malformation utérovaginale est un facteur de risque établi. Il n’existe pas à ce jour de marqueurs biologiques utilisables comme critères diagnostiques.1
Diagnostic positif : trois types d’arguments
Le diagnostic consiste à éliminer d’autres causes possibles à l’origine des symptômes, par l’interrogatoire, l’examen clinique et certains examens complémentaires en fonction des signes d’orientation.
Les principaux diagnostics différentiels sont les pathologies digestives (constipation chronique ou syndrome du côlon irritable, porphyrie hépatique) et urologiques. La recherche d’autres symptômes douloureux – musculosquelettiques, céphalées, voire migraine –, parfois associés, contribue au diagnostic différentiel et à une prise en charge appropriée.
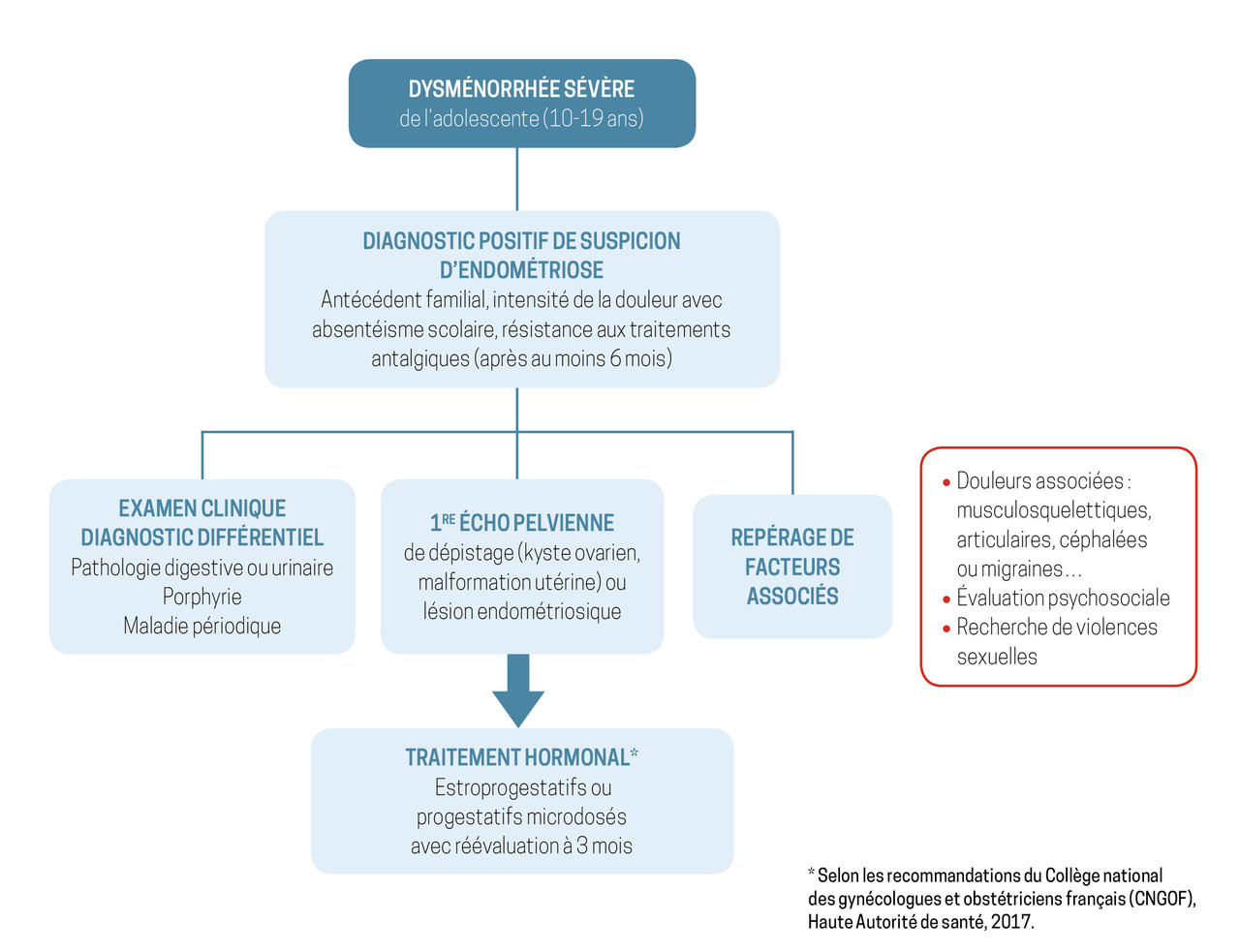
Le diagnostic positif est posé par l’association de signes (figure ) :
– cliniques, caractéristiques (v. supra) ;
– d’imagerie (lorsqu’ils existent) ;
– de réponse au traitement hormonal.
Contrairement à la femme adulte, il n’existe pas de critères d’imagerie consensuels chez l’adolescente. Par ailleurs, l’impossibilité fréquente de réaliser une échographie par voie endovaginale ne permet pas d’appliquer les critères retenus chez l’adulte.
Éliminer une pathologie ovarienne ou une malformation utérine est essentiel chez l’adolescente. L’échographie peut faire le diagnostic d’endométriome ovarien, mais cette lésion est rare à cet âge. En outre, elle n’élimine pas la possibilité d’une endométriose même lorsqu’elle est strictement normale. L’imagerie par résonance magnétique (IRM) pourrait être réalisée en l’absence d’anomalie à l’échographie pelvienne chez les jeunes filles vierges, notamment en cas de signes digestifs et/ou urinaires.
Toutefois, à ce jour, ni l’échographie par voie sus-pubienne ni l’IRM ne permettent de faire le diagnostic d’endométriose péritonéale ou d’évaluer l’étendue des lésions. Les données de la littérature ne recommandent donc pas de réaliser systématiquement une IRM en première intention. Le recours aux centres experts intervient lorsque le diagnostic est suspecté et après échec d’un traitement de première intention bien conduit pendant une période d’au moins six mois.
L’IRM pelvienne au sein d’un centre expert visualise des lésions d’endométriose non accessibles en échographie. En effet, elle est plus sensible (Se = 95 %) que l’échographie pour dépister les atteintes profondes. Ainsi, une IRM pelvienne négative exclut des lésions d’endométriose pelvienne profonde avec une performance proche de la chirurgie (sensibilité supérieure à 90 %).4 En l’absence de lésion significative à l’imagerie, et même en cas de forte suspicion, une laparoscopie à titre diagnostique n’est pas indiquée.
Le traitement hormonal et la prise en charge des douleurs (traitement pharmacologique et alternatives non médicamenteuses) sont donc initiés sans rechercher de confirmation diagnostique.
Les principaux diagnostics différentiels sont les pathologies digestives (constipation chronique ou syndrome du côlon irritable, porphyrie hépatique) et urologiques. La recherche d’autres symptômes douloureux – musculosquelettiques, céphalées, voire migraine –, parfois associés, contribue au diagnostic différentiel et à une prise en charge appropriée.
Le diagnostic positif est posé par l’association de signes (
– cliniques, caractéristiques (v. supra) ;
– d’imagerie (lorsqu’ils existent) ;
– de réponse au traitement hormonal.
Contrairement à la femme adulte, il n’existe pas de critères d’imagerie consensuels chez l’adolescente. Par ailleurs, l’impossibilité fréquente de réaliser une échographie par voie endovaginale ne permet pas d’appliquer les critères retenus chez l’adulte.
Éliminer une pathologie ovarienne ou une malformation utérine est essentiel chez l’adolescente. L’échographie peut faire le diagnostic d’endométriome ovarien, mais cette lésion est rare à cet âge. En outre, elle n’élimine pas la possibilité d’une endométriose même lorsqu’elle est strictement normale. L’imagerie par résonance magnétique (IRM) pourrait être réalisée en l’absence d’anomalie à l’échographie pelvienne chez les jeunes filles vierges, notamment en cas de signes digestifs et/ou urinaires.
Toutefois, à ce jour, ni l’échographie par voie sus-pubienne ni l’IRM ne permettent de faire le diagnostic d’endométriose péritonéale ou d’évaluer l’étendue des lésions. Les données de la littérature ne recommandent donc pas de réaliser systématiquement une IRM en première intention. Le recours aux centres experts intervient lorsque le diagnostic est suspecté et après échec d’un traitement de première intention bien conduit pendant une période d’au moins six mois.
L’IRM pelvienne au sein d’un centre expert visualise des lésions d’endométriose non accessibles en échographie. En effet, elle est plus sensible (Se = 95 %) que l’échographie pour dépister les atteintes profondes. Ainsi, une IRM pelvienne négative exclut des lésions d’endométriose pelvienne profonde avec une performance proche de la chirurgie (sensibilité supérieure à 90 %).4 En l’absence de lésion significative à l’imagerie, et même en cas de forte suspicion, une laparoscopie à titre diagnostique n’est pas indiquée.
Le traitement hormonal et la prise en charge des douleurs (traitement pharmacologique et alternatives non médicamenteuses) sont donc initiés sans rechercher de confirmation diagnostique.
AINS et traitement hormonal pour soulager
L’objectif du traitement est d’apaiser le syndrome douloureux. Pour cela, on combine antalgiques et traitement hormonal. En l’absence de données de niveau de preuve élevé relatives à l’efficacité des thérapeutiques de l’endométriose de l’adolescente, la conduite à tenir repose sur des recommandations institutionnelles.5
L’antalgie s’appuie sur les AINS. Bien que souvent déconseillés au long cours, ils sont privilégiés en raison de leur efficacité liée à l’effet antagoniste des prostaglandines à l’origine de la dysménorrhée. Chez l’adolescente, une gestion autonome est favorisée en éduquant à la prise adaptée des AINS et à l’association éventuelle au paracétamol.
Leur prise précoce assure leur efficacité et limite leur consommation aux doses recommandées. En l’absence d’efficacité suffisante, le traitement hormonal est indiqué.
À cet effet, on recourt aux contraceptifs hormonaux de type estroprogestatif ou microprogestatif, notamment en cas de contre-indication aux estrogènes. Comme pour la contraception, les estroprogestatifs de 2e génération, dosés à 20 ou 30 µg d’éthinylestradiol, sont privilégiés. Il n’y a pas d’argument pour prescrire un estroprogestatif de 3e génération ou combinant un autre progestatif, d’autant que ceux-ci sont associés à un sur-risque vasculaire par rapport aux estroprogestatifs de 2e génération. La prise continue (28 jours/28 plutôt que 21 jours/28) dans le but d’obtenir une aménorrhée n’a pas montré d’efficacité supérieure sur le syndrome douloureux. Ce schéma peut être envisagé en 2e intention en cas d’efficacité insuffisante avec la prise séquentielle.
Un microprogestatif par voie orale (levonorgestrel, désogestrel, drospirénone) peut être proposé en première intention, notamment en cas de contre-indication aux estroprogestatifs. Il est toutefois souvent moins bien toléré (saignements gynécologiques fréquents).
Le dispositif intra-utérin au progestatif (lévonorgestrel) et l’implant sous-cutané à l’étonogestrel, disponibles pour la contraception, n’ont pas été évalués sur le soulagement de la dysménorrhée secondaire à l’endométriose de l’adolescente. Leur utilisation peut s’envisager chez les patientes ayant besoin de contraception en cas d’échec du traitement per os.
Le diénogest, progestatif récent à la dose de 2 mg/j, a obtenu l’autorisation de mise sur le marché pour le traitement de l’endométriose, mais les données chez l’adolescente sont très limitées. À noter qu’il n’est pas contraceptif à cette posologie. Il pourrait être proposé en 2e intention, après échec des autres traitements hormonaux et avis d’expert.
Des thérapeutiques alternatives non médicamenteuses comme l’acupuncture, l’ostéopathie, le yoga, l’hypnose ou d’autres thérapies comportementales sont potentiellement efficaces chez ces patientes pour améliorer la qualité de vie en complément du traitement médicamenteux.5 Il n’existe pas de données spécifiques chez l’adolescente, mais, de façon générale, toute thérapeutique complémentaire pouvant apporter un bénéfice individuel est envisageable.
En cas d’échec des traitements de 1re intention, la stratégie de recours relève d’un avis spécialisé sous forme de concertation pluridisciplinaire (gynécologues médicaux, chirurgiens, spécialistes de l’imagerie, spécialistes de la prise en charge de la douleur, psychologues) en centre expert.
L’antalgie s’appuie sur les AINS. Bien que souvent déconseillés au long cours, ils sont privilégiés en raison de leur efficacité liée à l’effet antagoniste des prostaglandines à l’origine de la dysménorrhée. Chez l’adolescente, une gestion autonome est favorisée en éduquant à la prise adaptée des AINS et à l’association éventuelle au paracétamol.
Leur prise précoce assure leur efficacité et limite leur consommation aux doses recommandées. En l’absence d’efficacité suffisante, le traitement hormonal est indiqué.
À cet effet, on recourt aux contraceptifs hormonaux de type estroprogestatif ou microprogestatif, notamment en cas de contre-indication aux estrogènes. Comme pour la contraception, les estroprogestatifs de 2e génération, dosés à 20 ou 30 µg d’éthinylestradiol, sont privilégiés. Il n’y a pas d’argument pour prescrire un estroprogestatif de 3e génération ou combinant un autre progestatif, d’autant que ceux-ci sont associés à un sur-risque vasculaire par rapport aux estroprogestatifs de 2e génération. La prise continue (28 jours/28 plutôt que 21 jours/28) dans le but d’obtenir une aménorrhée n’a pas montré d’efficacité supérieure sur le syndrome douloureux. Ce schéma peut être envisagé en 2e intention en cas d’efficacité insuffisante avec la prise séquentielle.
Un microprogestatif par voie orale (levonorgestrel, désogestrel, drospirénone) peut être proposé en première intention, notamment en cas de contre-indication aux estroprogestatifs. Il est toutefois souvent moins bien toléré (saignements gynécologiques fréquents).
Le dispositif intra-utérin au progestatif (lévonorgestrel) et l’implant sous-cutané à l’étonogestrel, disponibles pour la contraception, n’ont pas été évalués sur le soulagement de la dysménorrhée secondaire à l’endométriose de l’adolescente. Leur utilisation peut s’envisager chez les patientes ayant besoin de contraception en cas d’échec du traitement per os.
Le diénogest, progestatif récent à la dose de 2 mg/j, a obtenu l’autorisation de mise sur le marché pour le traitement de l’endométriose, mais les données chez l’adolescente sont très limitées. À noter qu’il n’est pas contraceptif à cette posologie. Il pourrait être proposé en 2e intention, après échec des autres traitements hormonaux et avis d’expert.
Des thérapeutiques alternatives non médicamenteuses comme l’acupuncture, l’ostéopathie, le yoga, l’hypnose ou d’autres thérapies comportementales sont potentiellement efficaces chez ces patientes pour améliorer la qualité de vie en complément du traitement médicamenteux.5 Il n’existe pas de données spécifiques chez l’adolescente, mais, de façon générale, toute thérapeutique complémentaire pouvant apporter un bénéfice individuel est envisageable.
En cas d’échec des traitements de 1re intention, la stratégie de recours relève d’un avis spécialisé sous forme de concertation pluridisciplinaire (gynécologues médicaux, chirurgiens, spécialistes de l’imagerie, spécialistes de la prise en charge de la douleur, psychologues) en centre expert.
Encadre
Que dire aux jeunes patientes ?
Toute dysménorrhée ne signifie pas l’existence d’une endométriose.
Lorsque des lésions d’endométriose sont vues à l’imagerie, il n’y pas d’indication chirurgicale en l’absence de complication.
La prise en charge est médicale et associe traitement antalgique et hormonal. Des alternatives non médicamenteuses peuvent être bénéfiques au niveau individuel.
L’évolution vers une aggravation ou une infertilité n’est pas systématique.
Références
1. Chapron C, Marcellin L, Borghese B, et al. Rethinking mechanisms, diagnosis and management of endometriosis. Nat Rev Endocrinol 2019;15:666-82.
2. Janssen EB, Rijkers ACM, Hoppenbrouwers K, et al. Prevalence of endometriosis diagnosed by laparoscopy in adolescents with dysmenorrhea or chronic pelvic pain: a systematic review. Hum. Reprod. Update 2013;19:570-82.
3. Chapron C, Borghese B, Streuli I, et al. Markers of adult endometriosis detectable in adolescence. J Pediatr Adolesc Gynecol 2011;24:S7-S12.
4. Bazot M, Daraï E. Diagnosis of deep endometriosis: clinical examination, ultrasonography, magnetic resonance imaging, and other techniques. Fertil Steril 2017;108(6):886-94.
5. Sauvan M, Chabbert-Buffet N, Geoffron S, et al. Traitement médical de l’endométriose douloureuse de l’adolescente sans infertilité. RPC Endométriose CNGOF-HAS. Gynécologie obstétrique fertilité & sénologie 2018;46(3):267-72.
2. Janssen EB, Rijkers ACM, Hoppenbrouwers K, et al. Prevalence of endometriosis diagnosed by laparoscopy in adolescents with dysmenorrhea or chronic pelvic pain: a systematic review. Hum. Reprod. Update 2013;19:570-82.
3. Chapron C, Borghese B, Streuli I, et al. Markers of adult endometriosis detectable in adolescence. J Pediatr Adolesc Gynecol 2011;24:S7-S12.
4. Bazot M, Daraï E. Diagnosis of deep endometriosis: clinical examination, ultrasonography, magnetic resonance imaging, and other techniques. Fertil Steril 2017;108(6):886-94.
5. Sauvan M, Chabbert-Buffet N, Geoffron S, et al. Traitement médical de l’endométriose douloureuse de l’adolescente sans infertilité. RPC Endométriose CNGOF-HAS. Gynécologie obstétrique fertilité & sénologie 2018;46(3):267-72.

 Encadrés
Encadrés