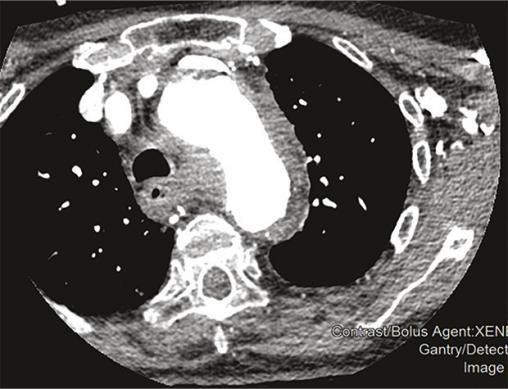
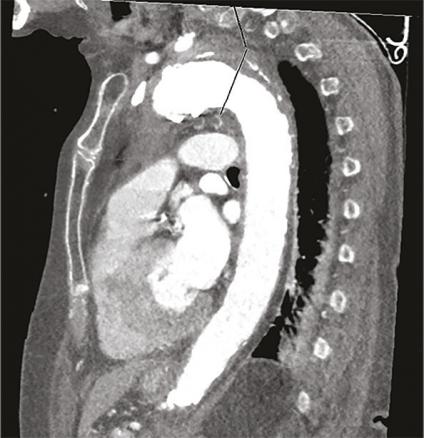
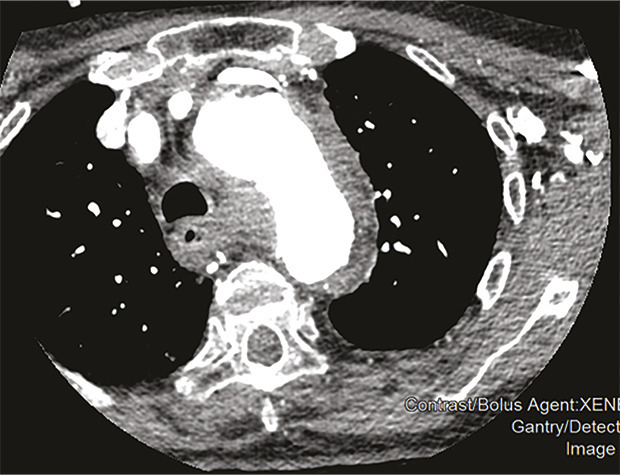
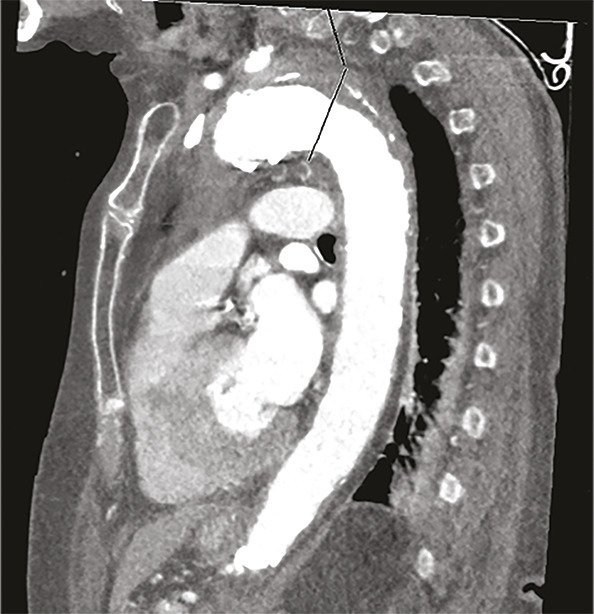
Cette femme de 95 ans arrivait aux urgences pour une douleur médiothoracique survenue brutalement quelques heures auparavant, transfixiante, sans irradiation ni facteur déclenchant évident. La patiente avait pour antécédents une hypertension artérielle (traitée par irbésartan et hydrochlorothiazide), une appendicectomie et une cholécystectomie. Devant une anisotension (différence de 30 mmHg de pression systolique [PAS] et 20 mmHg de diastolique entre les deux côtés), la patiente était placée en box de déchocage et monitoring continu. Un traitement par nicardipine au pousse-seringue électrique était instauré afin de contrôler cette hypertension majeure (221/114 mmHg), avec un objectif de PAS entre 150 et 170 mmHg. Le reste de l’examen clinique ne notait pas d’autres anomalies. Le bilan biologique montrait une élévation des D-dimères majeure (> 6 000 µg/L) et une insuffisance rénale. Malgré un débit de filtration glomérulaire (DFG) à 24 mL/min/m², la probabilité élevée d’une dissection aortique poussait à réaliser une tomodensitométrie thoraco-abdominopelvienne (fig. 1 et 2 ) avec injection de produit de contraste iodé, montrant un hématome intramural de la crosse de l’aorte. Après discussion pluridisciplinaire, l’indication chirurgicale était récusée du fait de l’âge avancé de la patiente et du risque opératoire.
Les syndromes aortiques aigus comprennent la dissection, l’ulcère et l’hématome intramural. Ce dernier, décrit pour la première fois en 1920,1 résulte d’une rupture des vasa vasorum sans déchirure intimale et est responsable de 10 à 40 % des syndromes aortiques aigus.2, 3 Le diagnostic se fait uniquement sur l’imagerie, généralement une tomodensitométrie thoracique injectée avec une augmentation d’épaisseur de la paroi aortique de plus de 5 mm.4 Néanmoins, il existe des facteurs clinico-biologiques d’orientation diagnostique comme l’asymétrie tensionnelle ou, selon certain auteurs, l’élévation des D-dimères.5 Selon sa localisation sur le trajet de l’aorte l’hématome est classé Stanford A ou B avec des taux de survie comparables aux dissections aortiques. Pouvant se résoudre de manière spontanée ou se rompre dans un tableau de dissection aortique, sa prise en charge fait débat. Ainsi, le traitement peut être médical avec contrôle tensionnel strict et surveillance monitorée des paramètres hémodynamique, ou chirurgical (mêmes indications que la dissection aortique). On peut également citer le traitement endo-aortique (pose d’une prothèse aortique synthétique par voie endoluminale) qui reste controversé en raison du risque d’endofuites secondaires, de pseudo-anévrismes ou de rupture intimale.6
Références
1. Nienaber CA, von Kodolitsch Y, Petersen B, et al. Intramural hemorrhage of the thoracic aorta. Diagnostic and therapeutic implications. Circulation 1995;92:1465‑72.
2. Lachat M, Rancic Z, Mayer D, Pfammatter T. Perspectives de prise en charge moderne des syndromes aortiques aigus. In: Rousseau H, Verhoye JP, Heautot JF (éd). Les syndromes aortiques aigus [Internet]. Paris : Springer, 2009:273‑86.
3. Maraj R, Rerkpattanapipat P, Jacobs LE, Makornwattana P, Kotler MN. Meta-analysis of 143 reported cases of aortic intramural hematoma. Am J Cardiol 2000;86:664‑8.
4. Evangelista A, Maldonado G, Moral S, et al. Intramural hematoma and penetrating ulcer in the descending aorta: differences and similarities. Ann Cardiothorac Surg 2019;8:456‑70.
5. Fournier Y, Moix PA, Hugli O. Dissection aortique aiguë : utilité diagnostique des D-dimères. Rev Med Suisse 2008;4:1759-63.
6. Iyer VS, Mackenzie KS, Tse LW, et al. Early outcomes after elective and emergent endovascular repair of the thoracic aorta. J Vasc Surg 2006;43:677‑83.
2. Lachat M, Rancic Z, Mayer D, Pfammatter T. Perspectives de prise en charge moderne des syndromes aortiques aigus. In: Rousseau H, Verhoye JP, Heautot JF (éd). Les syndromes aortiques aigus [Internet]. Paris : Springer, 2009:273‑86.
3. Maraj R, Rerkpattanapipat P, Jacobs LE, Makornwattana P, Kotler MN. Meta-analysis of 143 reported cases of aortic intramural hematoma. Am J Cardiol 2000;86:664‑8.
4. Evangelista A, Maldonado G, Moral S, et al. Intramural hematoma and penetrating ulcer in the descending aorta: differences and similarities. Ann Cardiothorac Surg 2019;8:456‑70.
5. Fournier Y, Moix PA, Hugli O. Dissection aortique aiguë : utilité diagnostique des D-dimères. Rev Med Suisse 2008;4:1759-63.
6. Iyer VS, Mackenzie KS, Tse LW, et al. Early outcomes after elective and emergent endovascular repair of the thoracic aorta. J Vasc Surg 2006;43:677‑83.
Une question, un commentaire ?