La prolifération des cellules tumorales prostatiques est sous la dépendance des androgènes.
La castration chirurgicale, définitive et psychologiquement mal acceptée, a été progressivement remplacée par la castration chimique. Celle-ci agit via les agonistes ou antagonistes de la LH-RH (tableau ). Injectables (SC ou IM), il existe des formes retard avec des durées d’action de 3 ou 6 mois.
Cette suppression androgénique (SA) vise à obtenir un taux de testostérone ≤ 0,5 ng/mL. Malheureusement, en phase métastatique, après un délai variable, on note une progression tumorale malgré un taux de testostérone bas, qui signale la phase de résistance à la castration. Elle ne signifie pas pour autant que les cellules tumorales deviennent hormono-indépendantes : en effet, dans plus de 80 % des cas, la prolifération cancéreuse est toujours sous la dépendance de la voie des androgènes, soit par amplification/mutation du récepteur, soit par sécrétion locale d’androgènes (paracrine/intracrine, c’est à dire à proximité et à l’intérieur même de la cellule les ayant synthétisés).
Les hormonothérapies de nouvelle génération (HTNG), qui contournent ces mécanismes de résistance, sont venues renforcer l’arsenal thérapeutique. Actuellement, elles ont fait la preuve de leur intérêt essentiellement dans les phases métastatiques de la maladie. Il s’agit de l’acétate d’abiratérone, qui inhibe l’enzyme CYP-17 ayant un rôle clé dans la synthèse des androgènes. Cette molécule entraîne ainsi une diminution de la production au niveau surrénalien, mais aussi de la sécrétion paracrine.
De nouveaux anti-androgènes (tableau ), plus puissants que le bicalutamide, sont maintenant également disponibles.
La castration chirurgicale, définitive et psychologiquement mal acceptée, a été progressivement remplacée par la castration chimique. Celle-ci agit via les agonistes ou antagonistes de la LH-RH (
Cette suppression androgénique (SA) vise à obtenir un taux de testostérone ≤ 0,5 ng/mL. Malheureusement, en phase métastatique, après un délai variable, on note une progression tumorale malgré un taux de testostérone bas, qui signale la phase de résistance à la castration. Elle ne signifie pas pour autant que les cellules tumorales deviennent hormono-indépendantes : en effet, dans plus de 80 % des cas, la prolifération cancéreuse est toujours sous la dépendance de la voie des androgènes, soit par amplification/mutation du récepteur, soit par sécrétion locale d’androgènes (paracrine/intracrine, c’est à dire à proximité et à l’intérieur même de la cellule les ayant synthétisés).
Les hormonothérapies de nouvelle génération (HTNG), qui contournent ces mécanismes de résistance, sont venues renforcer l’arsenal thérapeutique. Actuellement, elles ont fait la preuve de leur intérêt essentiellement dans les phases métastatiques de la maladie. Il s’agit de l’acétate d’abiratérone, qui inhibe l’enzyme CYP-17 ayant un rôle clé dans la synthèse des androgènes. Cette molécule entraîne ainsi une diminution de la production au niveau surrénalien, mais aussi de la sécrétion paracrine.
De nouveaux anti-androgènes (
Quelles Indications ?
En association à la radiothérapie
Dans les formes localisées du cancer de prostate mais à haut risque (PSA ≥ 20 ng/mL, stades T3-T4, ou score de Gleason ≥ 8), quand le traitement local décidé est une radiothérapie, il est nécessaire d’y adjoindre une suppression androgénique longue (> 18 mois). Il a en effet été démontré qu’elle augmentait la survie globale de 10 à 18 %, selon les études, en améliorant le contrôle local et en diminuant la survenue de métastases.1
Une hormonothérapie courte (6 mois) est également indiquée en association avec la radiothérapie dans les formes à risque intermédiaire ou en cas de radiothérapie de rattrapage, avec, là aussi, un bénéfice en survie. Il n’y a pas d’indication à l’hormonothérapie après chirurgie, sauf si une atteinte ganglionnaire est concomitante.
Une hormonothérapie courte (6 mois) est également indiquée en association avec la radiothérapie dans les formes à risque intermédiaire ou en cas de radiothérapie de rattrapage, avec, là aussi, un bénéfice en survie. Il n’y a pas d’indication à l’hormonothérapie après chirurgie, sauf si une atteinte ganglionnaire est concomitante.
Pour les cancers métastatiques
La SA reste le traitement de base à cette phase de la maladie. Elle doit être donnée de manière continue et définitive. Il importe de s’assurer tout au long du traitement que la testostéronémie est bien inférieure à 0,5 ng/mL, certaines injections pouvant être mal réalisées.
Aujourd’hui, une HTNG doit être ajoutée à la SA dès le diagnostic de métastases.Dans une étude comparant la SA avec ou sans acétate d’abiratérone, la survie à 3 ans était de 66 % dans le bras traité contre 49 % dans le bras contrôle (p < 0,001).2 Si les HTNG n’ont pas été prescrites au stade initial de la maladie métastatique, elles sont indiquées à la phase de résistance à la castration. Dans cette situation, l’enzalutamide accroît nettement la survie sans progression radiologique : elle passe de 5,4 mois avec un placebo à 20,0 mois avec le nouvel anti-androgène.3
Aujourd’hui, une HTNG doit être ajoutée à la SA dès le diagnostic de métastases.Dans une étude comparant la SA avec ou sans acétate d’abiratérone, la survie à 3 ans était de 66 % dans le bras traité contre 49 % dans le bras contrôle (p < 0,001).2 Si les HTNG n’ont pas été prescrites au stade initial de la maladie métastatique, elles sont indiquées à la phase de résistance à la castration. Dans cette situation, l’enzalutamide accroît nettement la survie sans progression radiologique : elle passe de 5,4 mois avec un placebo à 20,0 mois avec le nouvel anti-androgène.3
Pour les récidives biologiques après traitement local
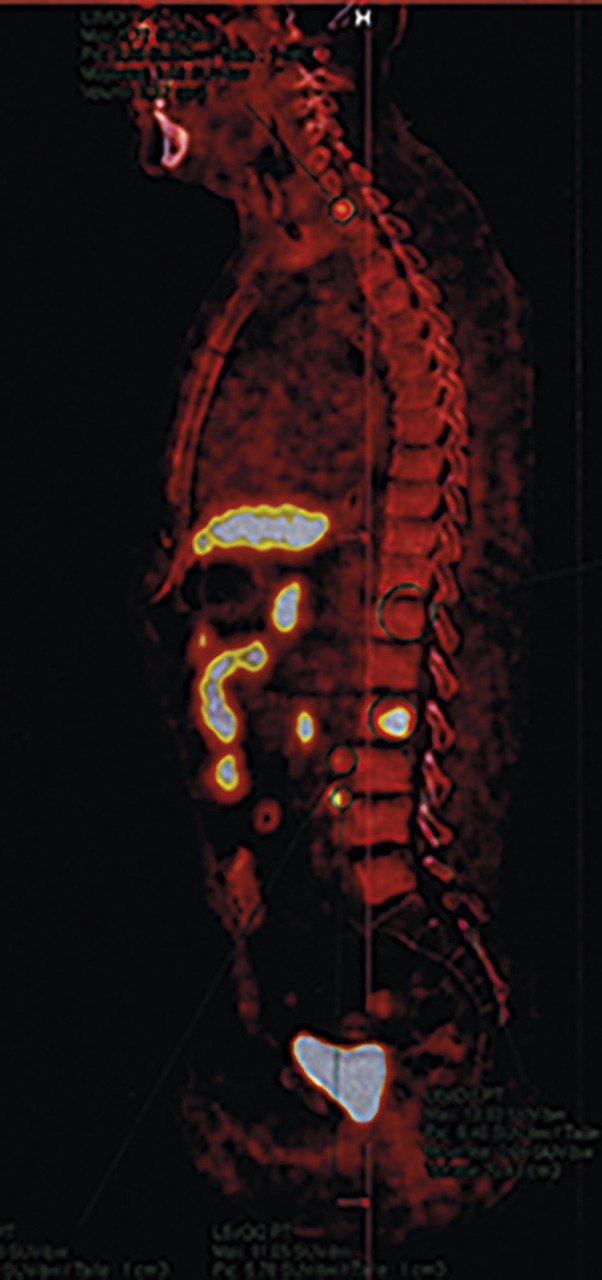
Dans certaines circonstances particulières (progression rapide du PSA), une SA androgénique peut être indiquée. Elle conduit parfois à une résistance à la castration, justifiant la prescription d’HTNG. Dans ce contexte, on réalise régulièrement une tomographie par émission de positons (TEP ; figure ) marquée à la fluorocholine, qui localise dans plus de 80 % des cas le site de la récidive et permet un traitement adapté à celle-ci.
Effets secondaires
De la suppression androgénique
Les plus fréquents sont les bouffées de chaleur, la diminution de la libido et l’impuissance, une gynécomastie ainsi que la prise de poids, une augmentation du périmètre abdominal et une asthénie. On peut également noter des troubles de l’humeur.
Les bouffées de chaleur peuvent être traitées par l’acétate de cyprotérone (100 mg/j), qui paraît plus efficace, mais aussi par la médroxyprogestérone et par certains antidépresseurs (venlafaxine, paroxétine). Il n’y a aucun médicament efficace pour la dysfonction érectile secondaire à la déprivation androgénique ; en particulier, les inhibiteurs de l’IPDE5 sont rarement utiles. À conseiller, un régime hypocalorique et une activité physique suffisante.
Un pseudo-syndrome métabolique avec une résistance à l’insuline, plus rare mais plus grave, survient assez rapidement, dès le 3e mois de traitement. L’apparition ou la décompensation d’un diabète est ainsi fréquente. Des perturbations du bilan lipidique sont également observées. Il faut donc surveiller très régulièrement la glycémie à jeun, voire l’hémoglobine glyquée, ainsi que le bilan lipidique (triglycérides, cholestérol-LDL). La survenue d’une hypertension artérielle n’est pas rare non plus. Ces troubles métaboliques sont à l’origine d’une augmentation des accidents cardiovasculaires.4
Enfin, une ostéoporose apparaît plus tardivement, après une année de prise en charge. Il importe cependant de réaliser une ostéodensitométrie au moment de l’instauration de la thérapeutique, en particulier chez les patients à risque, maigres ou fumeurs. Il est parfois nécessaire d’adjoindre à la SA des bisphosphonates, voire des inhibiteurs de RANK-L.
Les bouffées de chaleur peuvent être traitées par l’acétate de cyprotérone (100 mg/j), qui paraît plus efficace, mais aussi par la médroxyprogestérone et par certains antidépresseurs (venlafaxine, paroxétine). Il n’y a aucun médicament efficace pour la dysfonction érectile secondaire à la déprivation androgénique ; en particulier, les inhibiteurs de l’IPDE5 sont rarement utiles. À conseiller, un régime hypocalorique et une activité physique suffisante.
Un pseudo-syndrome métabolique avec une résistance à l’insuline, plus rare mais plus grave, survient assez rapidement, dès le 3e mois de traitement. L’apparition ou la décompensation d’un diabète est ainsi fréquente. Des perturbations du bilan lipidique sont également observées. Il faut donc surveiller très régulièrement la glycémie à jeun, voire l’hémoglobine glyquée, ainsi que le bilan lipidique (triglycérides, cholestérol-LDL). La survenue d’une hypertension artérielle n’est pas rare non plus. Ces troubles métaboliques sont à l’origine d’une augmentation des accidents cardiovasculaires.4
Enfin, une ostéoporose apparaît plus tardivement, après une année de prise en charge. Il importe cependant de réaliser une ostéodensitométrie au moment de l’instauration de la thérapeutique, en particulier chez les patients à risque, maigres ou fumeurs. Il est parfois nécessaire d’adjoindre à la SA des bisphosphonates, voire des inhibiteurs de RANK-L.
De l’hormonothérapie de seconde génération
L’acétate d’abiratérone inhibe la voie des androgènes, mais également celle des corticoïdes. Ceci entraîne une augmentation de l’hormone adrénocorticotrope et des minéralocorticoïdes. Il doit donc être pris en association avec des faibles doses de prednisone (10 mg/j) ou de prednisolone, pour freiner la voie des minéralocorticoïdes. Une HTA peut cependant se déclarer, de même que des œdèmes des membres inférieurs et surtout une hypokaliémie : celle-ci peut être rapide et profonde et justifie la réalisation d’un ionogramme sanguin dès le 15e jour de traitement, à répéter régulièrement.
Une hépatite cytolytique survient parfois dans le premier mois de traitement et impose un dosage des transaminases tous les 15 jours pendant les 3 premiers mois, mensuellement ensuite.
Les nouveaux anti-androgènes n’ont que peu d’effets secondaires. D’exceptionnelles convulsions ont été rapportées. En revanche, une fatigue, parfois intense, est très souvent observée et l’apalutamide est responsable de rashs cutanés. Ils ont de nombreuses interactions médicamenteuses car ce sont de puissants inducteurs enzymatiques de divers cytochromes. Sont concernés, en particulier, certains antiépileptiques (carbamazépine, clonazépam), des bêtabloquants, des hypnotiques (diazépam, midazolam, zolpidem) et des statines (atorvastatine, simvastatine). La surveillance de l’effet de ces médicaments doit être accrue.
Une hépatite cytolytique survient parfois dans le premier mois de traitement et impose un dosage des transaminases tous les 15 jours pendant les 3 premiers mois, mensuellement ensuite.
Les nouveaux anti-androgènes n’ont que peu d’effets secondaires. D’exceptionnelles convulsions ont été rapportées. En revanche, une fatigue, parfois intense, est très souvent observée et l’apalutamide est responsable de rashs cutanés. Ils ont de nombreuses interactions médicamenteuses car ce sont de puissants inducteurs enzymatiques de divers cytochromes. Sont concernés, en particulier, certains antiépileptiques (carbamazépine, clonazépam), des bêtabloquants, des hypnotiques (diazépam, midazolam, zolpidem) et des statines (atorvastatine, simvastatine). La surveillance de l’effet de ces médicaments doit être accrue.
Références
1. Bolla M, Van Tienhoven G, Warde P, et al. External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study. Lancet Oncol 2010;11:1066-73.
2. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2017;377:352-60.
3. Beer TM, Armstrong AJ, Rathkopf D, et al. Enzalutamide in Men with Chemotherapy-naive Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol 2017; 71:151-4.
4. O’Farrell S, Garmo H, Holmberg L, Adolfsson J, Stattin P, Van Hemelrijck M. Risk and timing of cardiovascular disease after androgen-deprivation therapy in men with prostate cancer. J Clin Oncol 2015;33:1243-51.
2. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2017;377:352-60.
3. Beer TM, Armstrong AJ, Rathkopf D, et al. Enzalutamide in Men with Chemotherapy-naive Metastatic Castration-resistant Prostate Cancer: Extended Analysis of the Phase 3 PREVAIL Study. Eur Urol 2017; 71:151-4.
4. O’Farrell S, Garmo H, Holmberg L, Adolfsson J, Stattin P, Van Hemelrijck M. Risk and timing of cardiovascular disease after androgen-deprivation therapy in men with prostate cancer. J Clin Oncol 2015;33:1243-51.