L’enjeu, pour tout patient asthmatique, est le contrôle de la maladie. De nouvelles stratégies et association de molécules ainsi que la biothérapie permettent d’améliorer l’observance et de limiter le nombre d’exacerbations.
L’asthme est une maladie des voies aériennes chronique, hétérogène, qui atteint les adultes comme les enfants. En 2019, on estimait que près de 262 millions de personnes dans le monde étaient concernées, et que plus de 461 000 décès lui étaient attribuables.1 En France, on dénombre plus de 4 millions de patients asthmatiques. Malgré la diversité des traitements proposés aux patients, les hospitalisations pour asthme sont encore fréquentes (plus de 60 000 séjours hospitaliers par an) et contribuent au coût de la maladie, constituant un problème de santé publique. Entre 3 et 10 % des patients seraient atteints d’une forme sévère.
La recherche est active dans le domaine de l’asthme : les traitements inhalés, pierre angulaire du traitement de fond, tendent à se simplifier ; de nouveaux médicaments anti-inflammatoires (biothérapies) ont vu le jour ces dernières années, révolutionnant la prise en charge des patients les plus sévères.
Mesure de la FeNO, un nouvel outil diagnostique ?
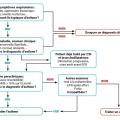
Le diagnostic d’asthme reste difficile en 2022, en l’absence de critère formel. Il repose sur l’association de plusieurs symptômes évocateurs (toux, sifflements, oppression thoracique, réveils nocturnes) et de la démonstration d’une obstruction bronchique variable et/ou réversible. Celle-ci doit toujours être recherchée, si possible avant la mise en place de tout traitement de fond par corticoïdes inhalés, par la spirométrie ou, en cas d’impossibilité, par la mesure de la variabilité du débit expiratoire de pointe (DEP) [
Récemment, la mise en évidence d’une inflammation des voies aériennes par la mesure de la fraction exhalée de monoxyde d’azote (FeNO) a été intégrée à l’algorithme diagnostique de l’asthme proposé par la Société européenne (European Respiratory Society [ERS]).2 En effet, le taux de NO exhalé, produit majoritairement par l’épithélium bronchique, est corrélé au nombre d’éosinophiles dans les expectorations.3
La mesure de la FeNO50, effectuée à un débit expiratoire de 50 mL/sec, peut être utilisée en routine clinique. Cependant, les seuils significatifs de la FeNO varient selon les études, et des valeurs élevées sont également observées dans la bronchite à éosinophiles, la rhinite allergique isolée, ou l’eczéma, sans asthme. Il est ainsi proposé de mesurer de manière systématique la FeNO chez les patients de plus de 18 ans pour lesquels le diagnostic d’asthme est incertain sur la spirométrie (pas d’obstruction ou de réversibilité sous bronchodilatateur).
Pour aider au diagnostic d’asthme, c’est la valeur seuil de 40 ppb (parties par milliard en volume) qui offrirait le meilleur compromis entre sensibilité et spécificité. Cependant, une valeur de FeNO inférieure à 40 ppb n’exclut pas le diagnostic d’asthme ; de la même manière, des niveaux de FeNO élevés ne sont pas suffisants pour confirmer ce diagnostic. La FeNO est aussi utile pour guider le choix des biothérapies.
Ce test n’est pas encore référencé comme un acte remboursé en France, ce qui limite son utilisation à certains centres et explique qu’il ne soit pas encore intégré aux recommandations françaises.4
Le défi du phénotypage : mieux décrire l’asthme pour mieux le prendre en charge
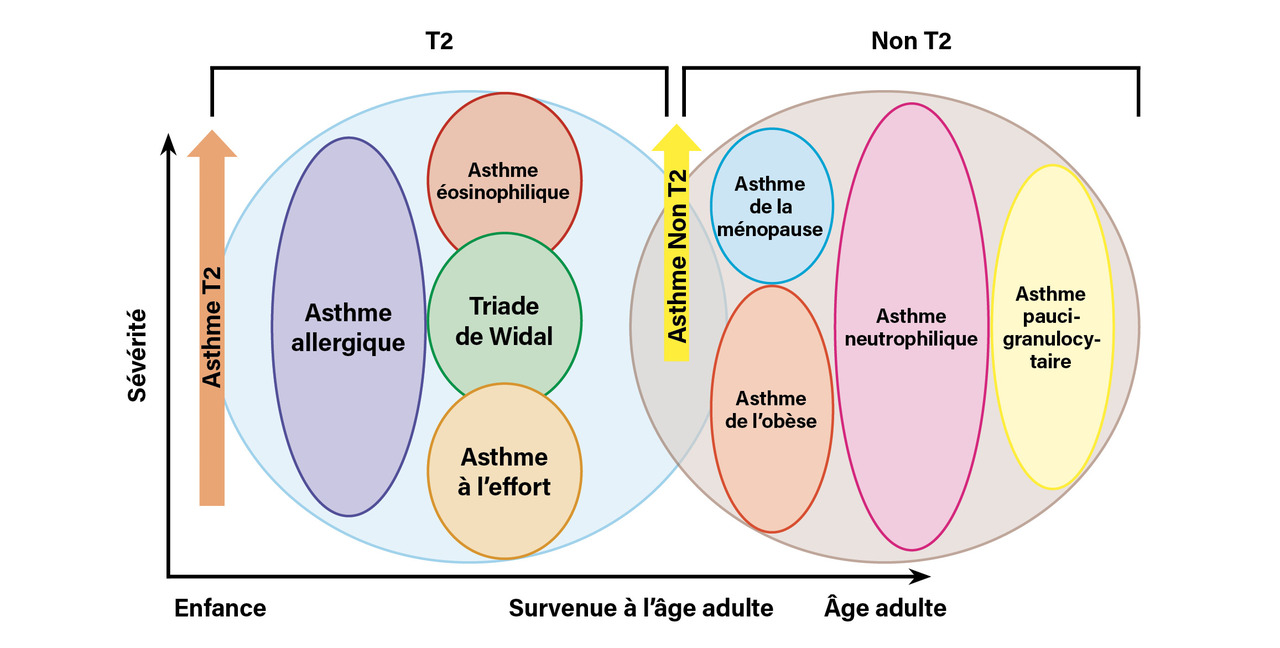
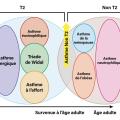
L’asthme est une pathologie multifactorielle, produit d’interactions complexes entre facteurs extrinsèques tels que l’environnement (tabac, polluants, irritants...) et intrinsèques, notamment liés à l’allergie. Chaque patient asthmatique est singulier par son histoire mais aussi par le type d’inflammation bronchique, plus ou moins riche en éosinophiles (
Définir le phénotype du patient, une fois que le diagnostic d’asthme a été confirmé, peut orienter la prise en charge. En pratique clinique courante, cela revient à identifier certains points clés.
Âge de début de l’asthme
L’asthme débutant dans l’enfance est très largement associé à la présence d’une allergie respiratoire, voire à d’autres maladies allergiques (alimentaires, cutanées...), tandis que l’asthme débutant à l’âge adulte est moins souvent lié à l’allergie mais plus fréquemment à la présence d’une polypose nasosinusienne, avec éventuellement intolérance à l’aspirine (triade de Widal), souvent riche en éosinophiles. La polypose, qui peut être invalidante, nécessite une prise en charge par un ORL pour discuter un traitement chirurgical quand les soins locaux sont insuffisants. Une autre forme d’asthme tardif concerne les femmes en période de périménopause, volontiers en surpoids, rarement allergiques, sans éosinophilie.
Rechercher une allergie respiratoire
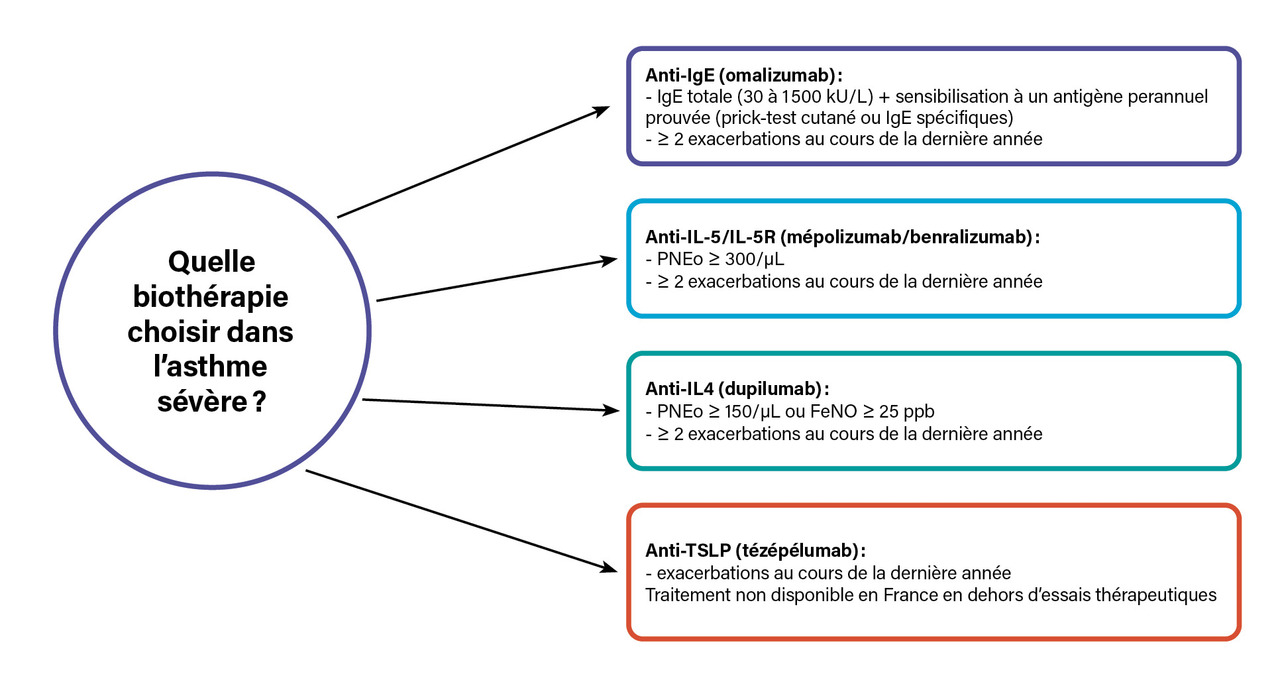
Il est nécessaire de rechercher une histoire personnelle et/ou familiale d’atopie, d’eczéma, de rhinoconjonctivite allergique ou d’allergies alimentaires. Les tests cutanés (prick-tests) aux pneumallergènes doivent donc être réalisés dans le bilan diagnostique de l’asthme, éventuellement complétés par un dosage des IgE spécifiques.6 Le dosage des IgE totales n’a pas de place dans le bilan systématique de tout patient asthmatique car sa spécificité pour le diagnostic d’atopie est faible ; il peut néanmoins être réalisé en cas de suspicion d’aspergillose bronchopulmonaire allergique (ABPA) ou pour évaluer la possibilité d’un traitement anti-IgE, par exemple. Identifier une allergie est important pour dispenser les conseils d’éviction, voire pour discuter une désensibilisation dans les formes d’asthme peu sévères ou une biothérapie dans les formes sévères.
Présence d’une éosinophilie sanguine
Elle est fréquente chez l’asthmatique, qu’il soit allergique ou non, et permet d’identifier une inflammation de type « T2 », caractérisée notamment par la production de cytokines IL-4, IL-5, IL-13 (interleukines) par les lymphocytes Th2 et les ILC2 (cellules lymphoïdes innées de type 2). Un taux d’éosinophiles supérieur à 300/mm3 prédit la réponse à certaines biothérapies chez les patients asthmatiques sévères, population dans laquelle la réalisation d’un hémogramme, en dehors de toute corticothérapie systémique, est donc importante afin de guider le choix du traitement. En revanche, cet examen est inutile pour le diagnostic de l’asthme ou de l’allergie, car l’éosinophilie est peu spécifique.4 Un taux supérieur à 1 500/mm3 n’est pas anodin chez un asthmatique et doit faire envisager un diagnostic associé comme une ABPA ou une vascularite (granulomatose éosinophilique avec micropolyangéite [EGPA]).
Quatre comorbidités non sans impact
Les patients asthmatiques obèses ont un asthme plus difficile à traiter, moins bien contrôlé, avec une consommation de traitements de secours et de corticoïdes plus importante. La perte de poids peut améliorer l’asthme et doit donc être intégrée à la stratégie thérapeutique, tout comme l’activité physique.7
Le syndrome d’apnées obstructives du sommeil (SAOS) est fréquent en cas d’asthme non contrôlé. L’obésité, le reflux gastrique et la rhinite contribuent à cette association. Le traitement du SAOS pourrait améliorer le contrôle de l’asthme. Il doit donc être recherché de façon systématique et traité selon les recommandations habituelles.8
Le reflux gastro-œsophagien (RGO) est très fréquent chez l’asthmatique, mais son traitement ne semble pas avoir un impact majeur sur le contrôle de la maladie. Actuellement, il est admis de ne traiter que les formes de RGO symptomatiques par inhibiteur de la pompe à protons et de ne pas faire de traitement d’épreuve ou de pH-métrie systématique en l’absence de symptômes en cas d’asthme non contrôlé.9
Comme dans nombre de maladies chroniques, les symptômes d’anxiété et les troubles dépressifs sont fréquents chez les asthmatiques, associés à un moins bon contrôle des symptômes de l’asthme, à une moins bonne observance du traitement et à une moindre qualité de vie liée à l’asthme.10 Ils doivent être dépistés et traités activement.
Traitement de fond inhalé : vers une simplification pour les patients… mais pas pour les prescripteurs ?
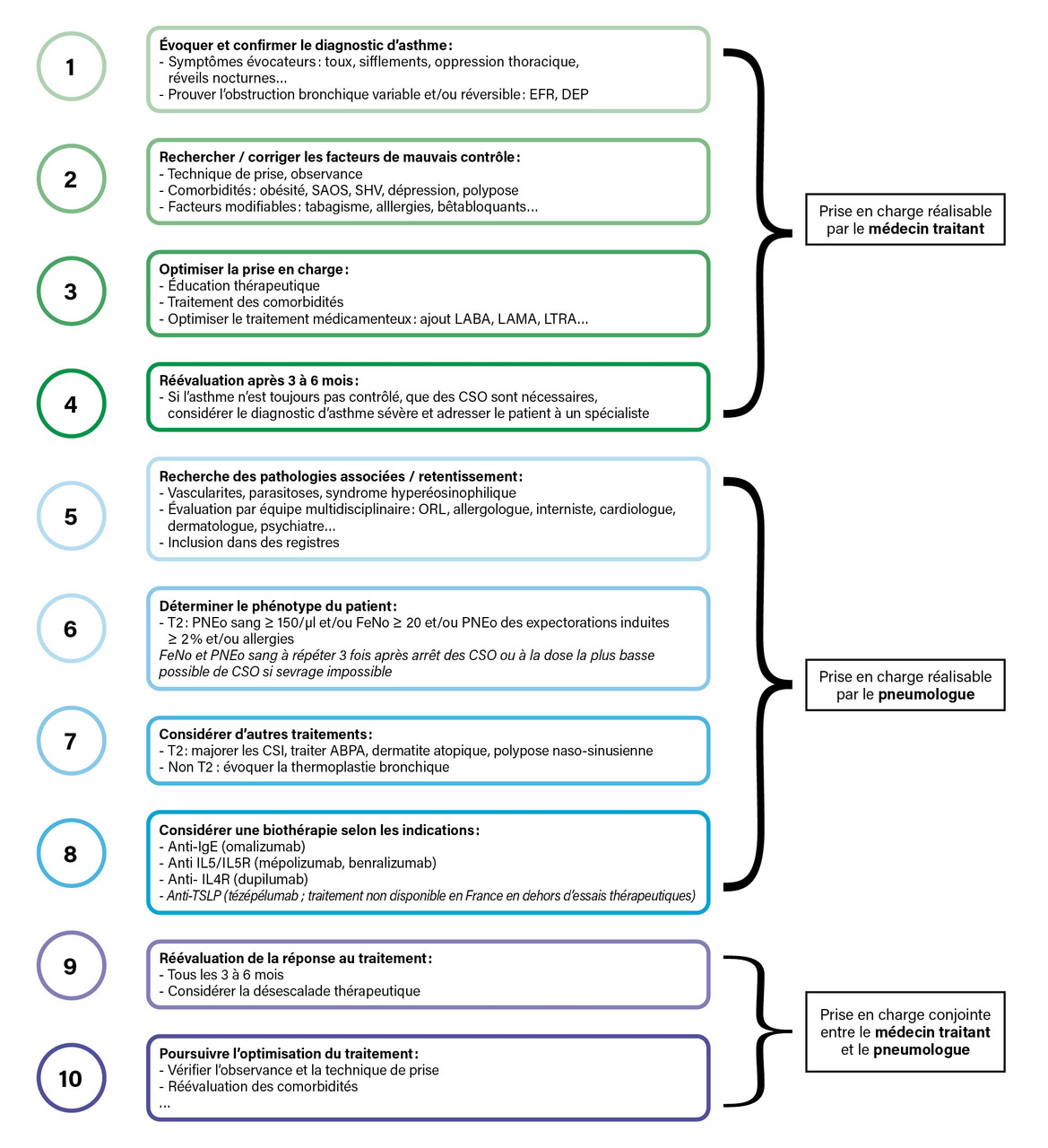
La prise en charge du patient asthmatique s’articule autour de plusieurs axes : instauration d’un traitement de fond, éducation thérapeutique, prise en charge des facteurs aggravants, évaluation du contrôle sous traitement (
Contrôler l’asthme
Un traitement de fond de l’asthme bien conduit doit permettre un bon contrôle de l’asthme, c’est-à-dire l’absence de symptômes au quotidien (réveils nocturnes, dyspnée d’effort, toux…), l’absence d’exacerbations et une fonction respiratoire normale. L’utilisation de questionnaires objectifs (Asthma control test ou Asthma control questionnaire) est recommandée pour éviter la sous-estimation des symptômes par les patients. L’interrogatoire doit également évaluer de façon systématique les exacerbations, leur gravité (passage aux urgences, hospitalisation, séjour en réanimation) et la consommation annuelle de corticoïdes oraux, souvent sous-estimée elle aussi.
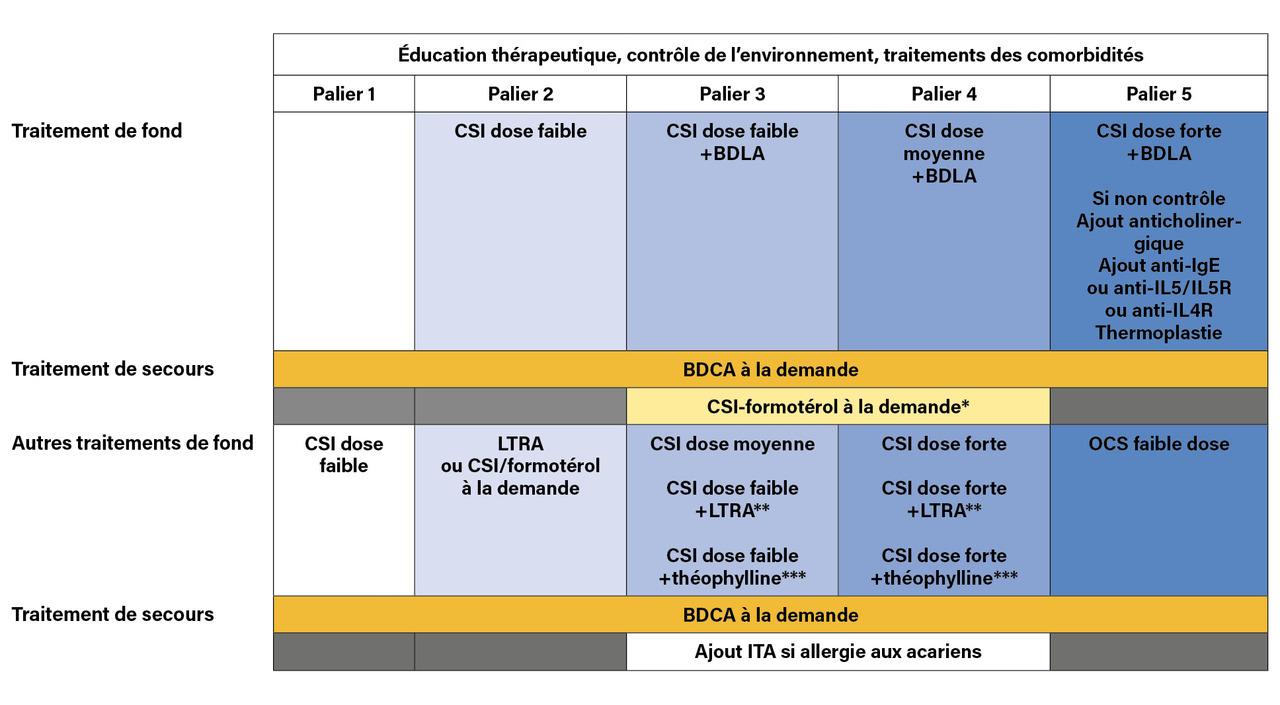
Le traitement de fond consiste en l’initiation précoce des corticostéroïdes inhalés (CSI), associés ou non à un bronchodilatateur de longue durée d’action (BDLA) dans le même dispositif. Sous traitement, le contrôle doit être réévalué régulièrement, de façon à adapter la prise en charge thérapeutique en diminuant ou augmentant le traitement par palier (
Trois stratégies de prescription
Il existe à présent trois stratégies pour prescrire les corticoïdes inhalés.
Traitement à doses fixes
Il s’agit de la stratégie la plus utilisée en France. Elle consiste à prescrire un CSI matin et soir à dose fixe. L’observance est donc particulièrement importante. Si, malgré une dose faible de CSI, l’asthme n’est pas contrôlé, un bronchodilatateur de longue durée d’action (BDLA) peut être ajouté, en association fixe, plutôt que de doubler la dose du CSI.
Les bronchodilatateurs d’action rapide (salbutamol, terbutaline) sont prescrits « à la demande », en fonction des symptômes. Dans la mesure du possible, il faut privilégier le même type de dispositif d’inhalation pour le traitement de fond et celui de secours, afin de limiter le risque d’erreur dans la technique de prise.
La dose recommandée de bronchodilatateurs d’action rapide est de 4 à 10 bouffées toutes les vingt minutes durant la première heure. La voie nébulisée est réservée à la prise en charge hospitalière, et sa prescription à domicile doit constituer une exception pour les asthmes sévères.
Traitement à la demande associant CSI et BDLA
Il s’agit de la stratégie la plus récemment développée, réservée aux asthmes légers (symptômes survenant moins de deux fois par mois), pour remplacer un traitement continu, souvent peu suivi.
L’association fixe contient, dans le même dispositif, un corticoïde inhalé et du formotérol (BDLA avec une action longue mais un délai d’action court permettant d’induire rapidement une bronchodilatation et de soulager les symptômes liés à l’hyper-réactivité).
En cas d’exacerbation, les symptômes s’installent progressivement, laissant le temps aux patients de les reconnaître, et donc de prendre et d’augmenter leur CSI pour enrayer la crise. Ainsi, la dose de corticoïdes inhalés augmente de façon proportionnelle aux symptômes. L’efficacité de cette stratégie a été évaluée dans plusieurs études, et est considérée comme comparable à une stratégie utilisant les CSI à doses fixes et du salbutamol à la demande. Elle est particulièrement adaptée aux patients ayant des difficultés d’observance et peu symptomatiques. Cette stratégie nécessite un plan d’action spécifique, sans salbutamol.
Traitement dit « de fond et symptômes »
Ce schéma de traitement consiste à prendre la même association CSI-formotérol (budésonide-formotérol ou béclométhasone-formotérol) en traitement de fond (matin et soir) mais également à la demande, en traitement des symptômes, à raison de 8 bouffées supplémentaires au maximum par jour.
Les nouvelles recommandations de la Société de pneumologie de langue française (SPLF)4 limitent cette stratégie aux patients avec un asthme persistant, un volume expiratoire maximal par seconde (VEMS) supérieur à 50 % et ayant présenté au moins une exacerbation sévère au cours de l’année précédente.
Elle est moins adaptée en cas d’utilisation de fortes doses de corticoïdes inhalés car l’augmentation de doses de CSI au-delà des fortes doses n’apporte pas de bénéfice mais augmente le risque d’effets indésirables liés au passage systémique de la corticothérapie inhalée. Elle a comme intérêt de simplifier le traitement du patient, avec un seul dispositif. Elle nécessite un plan d’action écrit précisant le nombre de doses « supplémentaires » définissant l’exacerbation, qui doit déclencher une consultation ou la prise de corticoïdes oraux. La rédaction de l’ordonnance doit être claire pour que la délivrance du traitement soit adaptée à une utilisation à la demande car elle peut être supérieure à un dispositif par mois.
Pour favoriser l’observance, des inhalateurs en monoprise et des triples associations fixes
L’observance du traitement de fond est réputée faible chez les asthmatiques. Le nombre de prises quotidiennes et le nombre d’inhalateurs différents sont autant de freins à une prise régulière.
Il existe désormais deux associations CSI-BDLA en prise unique quotidienne : furoate de fluticasone-vilantérol et furoate de mométasone -acétate d’indacatérol. Elles sont indiquées en traitement continu de l’asthme à partir de 12 ans, pour les patients insuffisamment contrôlés par un CSI et la prise d’un bronchodilatateur bêta-2-agoniste de courte durée pris « à la demande », et pour les patients bien contrôlés par l’administration d’un CSI associé à un traitement continu par bêta-2-agoniste de longue durée d’action par voie inhalée. Ces deux associations ont été comparées à une association « classique » par fluticasone-salmétérol.
L’ajout d’un anticholinergique de longue durée d’action (Long acting muscarinic antagonist [LAMA]) [tiotropium] à l’association CSI + BDLA est la dernière étape avant la prescription d’une biothérapie chez les asthmatiques sévères, mal contrôlés par une association CSI à forte dose-BDLA.
Jusque-là, cela nécessitait l’ajout d’un autre dispositif d’inhalation (Spiriva Respimat). Il existe à présent des associations fixes CSI-BDLA-LAMA réunies dans un même dispositif, dont l’intérêt principal est de réduire le nombre de dispositifs et de prises pour les patients. Il s’agit d’une part de l’association dipropionate de béclométasone-fumarate de formotérol-bromure de glycopyrronium (deux prises par jour) et d’autre part de l’association furoate de mométasone-acétate d’indacatérol-bromure de glycopyrronium (une prise unique par jour).
Tous ces traitements doivent être associés à la prescription d’un bronchodilatateur d’action rapide pour la prise en charge des symptômes.
Si cet arsenal thérapeutique, qui s’enrichit sans cesse, a pour objectif de simplifier le traitement pour le patient, il devient de plus en plus complexe pour les médecins, qui doivent, pour décider d’un traitement de fond, résoudre l’équation réunissant la dose de CSI adaptée au niveau de contrôle, l’association de molécules, d’un (ou plusieurs) dispositif(s) d’inhalation adapté(s) et de leur manipulation. Les prescripteurs perdus parmi les traitements inhalés peuvent se référer au guide Zéphir, réalisé par la Société de pneumologie de langue française (SPLF).11
Deux exacerbations par an nécessitent un avis spécialisé
Si malgré un traitement inhalé optimal pris régulièrement avec une bonne technique d’inhalation, l’asthme reste non contrôlé, les patients doivent être adressés à un pneumologue, voire à un centre expert de l’asthme, pour discuter de l’indication d’une biothérapie, après une évaluation exhaustive. On considère actuellement qu’un seuil de deux exacerbations par an n’est pas admissible pour un asthmatique et doit déclencher un avis spécialisé.
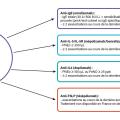
Les biothérapies, qui ciblent des molécules de l’inflammation T2 (
Il est important de dépister ces patients avec un asthme sévère ou non contrôlé malgré un traitement optimal afin qu’ils puissent bénéficier de ces traitements innovants.
Comment traiter les exacerbations ?
Selon les recommandations de la SPLF,4 l’exacerbation est définie comme la majoration des symptômes respiratoires habituels depuis plus de quarante-huit heures, une baisse du DEP matinal de plus de 15 % par rapport à la valeur théorique et nécessitant une modification du traitement habituel.
L’utilisation majorée et inhabituelle des bronchodilatateurs d’action rapide est souvent un signe annonciateur d’exacerbation.
Les exacerbations sévères sont définies par la présence de signes de gravité (dyspnée à la parole, fréquence respiratoire [FR] supérieure à 20 cycles par minute, saturation pulsée en oxygène [SpO2] inférieure à 94 %, DEP inférieur à 75 %).
En cas d’exacerbation non sévère, la première étape consiste à majorer les CSI et à réévaluer précocement le patient, avant de devoir initier une corticothérapie orale si la poussée ne cède pas. En cas d’exacerbation sévère, il faut recourir d’emblée aux corticoïdes oraux à la dose de 0,5 à 1 mg/kg/j de prednisone, pendant cinq à sept jours, sans décroissance.
À la suite d’une exacerbation, il est nécessaire de réévaluer les patients entre deux et sept jours après la consultation initiale. Le rôle du médecin traitant est donc primordial. Cette visite est l’occasion de vérifier la réponse au traitement mais aussi d’analyser les raisons de cette poussée, de réévaluer les techniques de prise avec les inhalateurs et la prise en charge des différents facteurs de mauvais contrôle. Analyser avec le patient la façon dont il a géré cette exacerbation fait également partie de l’accompagnement vers l’autonomisation.
Une très grande partie des exacerbations d’asthme étant d’origine virale, la vaccination contre la grippe et le SARS-CoV-2 doit être proposée de façon systématique à tous les asthmatiques.
Un traitement de fond ajusté limite les exacerbations
Un patient asthmatique bien contrôlé est moins à risque d’exacerbations, donc potentiellement d’événement fatal, mais aussi moins à risque de consommer des corticoïdes oraux, dont la toxicité cumulée est bien démontrée.
Un traitement de fond adapté au niveau de sévérité, prescrit dans le cadre d’un processus éducatif, est la première étape de cette prise en charge globale. Le rôle du médecin traitant est essentiel, pour éduquer le patient, évaluer la correction des facteurs de mauvais contrôle, prévenir les exacerbations sévères, assurer le suivi précoce post-exacerbation et dépister les patients les plus sévères, qui doivent être adressés en pneumologie pour évaluer l’intérêt de la mise en place d’une biothérapie.
Asthme et grossesse : maintenir le traitement de fond, quel que soit le terme
Le traitement de l’asthme durant la grossesse suscite des interrogations et des craintes de la part des patientes.
Chez la femme enceinte, l’asthme a tendance à rester stable dans un tiers des cas, à s’améliorer dans un tiers des cas, et à s’aggraver dans le tiers restant.13
La majorité des aggravations est liée à des arrêts intempestifs du traitement de fond et à un défaut de prise en charge. Pourtant, un asthme mal contrôlé est loin d’être anodin pour l’enfant à naître car il peut entraîner un retard de croissance intra-utérin ou une prématurité, et également des complications maternelles.
Un contrôle optimal de la maladie doit être obtenu, idéalement avant le début de la grossesse. Il convient donc de discuter avec toute patiente asthmatique de son désir de maternité, et de la nécessité de maintenir le traitement inhalé tout au long de la grossesse. Le médecin généraliste a un rôle primordial, en participant au suivi régulier de la femme enceinte asthmatique.
La plupart des traitements de fond de l’asthme peuvent continuer d’être utilisés sans danger, notamment les CSI, quel que soit le terme.4 Des pictogrammes « Contre-indication chez les femmes enceintes » sont présents sur certains inhalateurs (dont les CSI) et peuvent inquiéter les patientes, à tort. Il faut savoir les rassurer et leur conseiller de se référer au site du Centre de référence sur les agents tératogènes (CRAT : www.lecrat.fr). Les corticoïdes oraux ne doivent pas être interrompus. Il est également recommandé de ne pas arrêter un traitement par omalizumab. La poursuite des autres biothérapies doit être discutée en centres experts, mais le traitement ne doit pas être stoppé sans concertation avec le prescripteur, en raison du risque de perte de contrôle de l’asthme. Le traitement de l’exacerbation asthmatique chez la femme enceinte suit les mêmes modalités que pour tout autre patient.13
Par ailleurs, les patientes asthmatiques peuvent être confrontées à des difficultés à avoir des enfants.14 Dans une étude publiée en 2019, menée au Danemark auprès de 4 000 patientes asthmatiques, les femmes asthmatiques étaient plus susceptibles d’avoir eu recours à une aide à la procréation médicale pour avoir un enfant que les femmes non asthmatiques (12 % versus 8 %).15 Le rôle de l’inflammation chronique est suspecté, sans être démontré. Des recherches supplémentaires sont donc nécessaires pour explorer le lien entre asthme et infertilité.
1. von Mutius E, Smits HH. Primary prevention of asthma: From risk and protective factors to targeted strategies for prevention. Lancet 2020;396(10254):854‑66.
2. Louis R, Satia I, Ojanguren I, Schleich F, Bonini M, Tonia T, et al. European Respiratory Society Guidelines for the diagnosis of asthma in adults. Eur Respir J 2022;2101585.
3. Schleich FN, Seidel L, Sele J, Manise M, Quaedvlieg V, Michils A, et al. Exhaled nitric oxide thresholds associated with a sputum eosinophil count ≥ 3% in a cohort of unselected patients with asthma. Thorax 2010;65(12):1039‑44.
4. Raherison-Semjen C, Guilleminault L, Billiart I, Chenivesse C, De Oliveira A, Izadifar A, et al. Mise à jour des recommandations (2021) pour la prise en charge et le suivi des patients asthmatiques adultes sous l’égide de la Société de pneumologie de langue française (SPLF) et de la Société pédiatrique de pneumologie et allergologie (SP2A). Version longue. Revue des maladies respiratoires 2021;38(10):1048‑83.
5. Wenzel SE. Asthma phenotypes: The evolution from clinical to molecular approaches. Nat Med 2012;18(5):716‑25.
6. Chabane H, Metz-Favre C, Klingebiel C, Mailhol C, Le Pabic F, Castelain C, et al. Recommandations pour la prescription et l’interprétation des examens biologiques utilisables dans le cadre du diagnostic ou du suivi des allergies, disponibles en France. Partie 2 : allergie respiratoire. Revue française d’allergologie 2021;61(7):479‑94.
7. Villeneuve T, Guilleminault L. Asthma and obesity in adults. Rev Mal Respir 2020;37(1):60‑74.
8. Trzepizur W, Mansour Y, Gagnadoux F. Obstructive sleep apnea and asthma: Clinical implications. Rev Mal Respir 2021;38(5):506‑13.
9. Launois C, Mulette P, Ancel J, Dury S, Hagenburg J, Lebargy F, et al. Treatment of GERD in asthma. Rev Mal Respir 2021;38(7):733‑42.
10. Rolland-Debord C, Goriounov I, Pitron V. The psychological burden of asthma. Rev Mal Respir 2021;38(7):721‑32.
11. Guide Zéphir [internet]. Société de pneumologie de langue française. 2014 [cité 24 mai 2022]. Disponible sur splf.fr/guide-zephir
12. Holguin F, Cardet JC, Chung KF, Diver S, Ferreira DS, Fitzpatrick A, et al. Management of severe asthma: A European Respiratory Society/American Thoracic Society guideline. Eur Respir J 2020;55(1).
13. Stoup T, Chenivesse C. Prise en charge de l’asthme chez la femme enceinte. Revue des maladies respiratoires 2021;38(6):626‑37.
14. Gade EJ, Thomsen SF, Lindenberg S, Backer V. Fertility outcomes in asthma: A clinical study of 245 women with unexplained infertility. Eur Respir J 2016;47(4):1144‑51.
15. Vejen Hansen A, Ali Z, Malchau SS, Blafoss J, Pinborg A, Ulrik CS. Fertility treatment among women with asthma: A case-control study of 3689 women with live births. Eur Respir J 2019;53(2):1800597.
Dans cet article
- Mesure de la FeNO, un nouvel outil diagnostique ?
- Le défi du phénotypage : mieux décrire l’asthme pour mieux le prendre en charge
- Traitement de fond inhalé : vers une simplification pour les patients… mais pas pour les prescripteurs ?
- Pour favoriser l’observance, des inhalateurs en monoprise et des triples associations fixes
- Deux exacerbations par an nécessitent un avis spécialisé
- Comment traiter les exacerbations ?
- Un traitement de fond ajusté limite les exacerbations

 Encadrés
Encadrés