Le traitement et la prévention de l’infection par le virus de l’immunodéficience humaine (VIH) font l’objet d’innovations constantes. La réduction du risque de transmission, une meilleure tolérance des thérapies, un allègement des prises sont les objectifs actuellement visés. Les essais portent notamment sur de nouvelles molécules et sur l’évolution des modalités de traitement.
L’infection par le virus de l’immunodéficience humaine est connue depuis un peu plus de quarante ans et reste à ce jour une des plus grandes catastrophes sanitaires, responsable, selon l’Organisation mondiale de la santé (OMS), de 40,1 millions de décès. Aujourd’hui, on compte 38,4 millions de personnes vivant avec le VIH (PVVIH), dont 190 000 en France. Ces chiffres sont en constante augmentation du fait du nombre de nouvelles contaminations annuelles supérieur à celui des décès des PVVIH. En effet, depuis l’utilisation des premiers traitements antirétroviraux (ARV) en 1986 avec la zidovudine (ou azidothymidine, AZT), puis l’avènement des thérapies combinées en 1996, la recherche sur les ARV n’a cessé de faire reculer la mortalité liée au VIH et de permettre des progrès dans l’efficacité des traitements.1 À défaut de stratégie permettant d’obtenir une guérison, l’efficacité immunovirologique reste l’objectif principal du traitement. Celle-ci ayant atteint des taux satisfaisants, d’autres objectifs sont aujourd’hui explorés : réduction du risque de transmission du VIH, meilleure tolérance clinique et biologique à long terme, amélioration et préservation de la qualité de vie. Ces dernières années, l’innovation thérapeutique s’est donc attachée à répondre à ces nouveaux besoins.
Optimisation de l’utilisation des antirétroviraux contre l’infection par le VIH
Traitement précoce
L’objectif principal du traitement ARV est de bloquer la réplication du virus en rendant la charge virale plasmatique indétectable (tableau 1 ), ce qui permet de maintenir ou de restaurer le capital de lymphocytes T CD4+ au-dessus de 500/mm3, et ainsi d’empêcher la progression vers le stade sida (syndrome d’immunodéficience acquise) et le décès. En France, l’instauration précoce du traitement par ARV quel que soit le taux de CD4+ est promu depuis 2013 ; cela avait fait suite aux résultats de l’étude internationale HPTN 052 ayant démontré l’absence de transmission virale lorsque le partenaire séropositif au VIH était traité, avec obtention d’une charge virale indétectable.2 L’OMS a, par la suite, recommandé dès 2015 cette stratégie précoce à l’échelle universelle, à la suite de l’étude START qui confirmait le bénéfice d’un traitement précoce sur la morbi-mortalité et la restauration immunitaire.3 Cette recommandation est d’autant plus appuyée si le patient est en primo-infection, pour limiter la constitution de réservoirs cellulaires et tissulaires de virus.
Nouvelles molécules
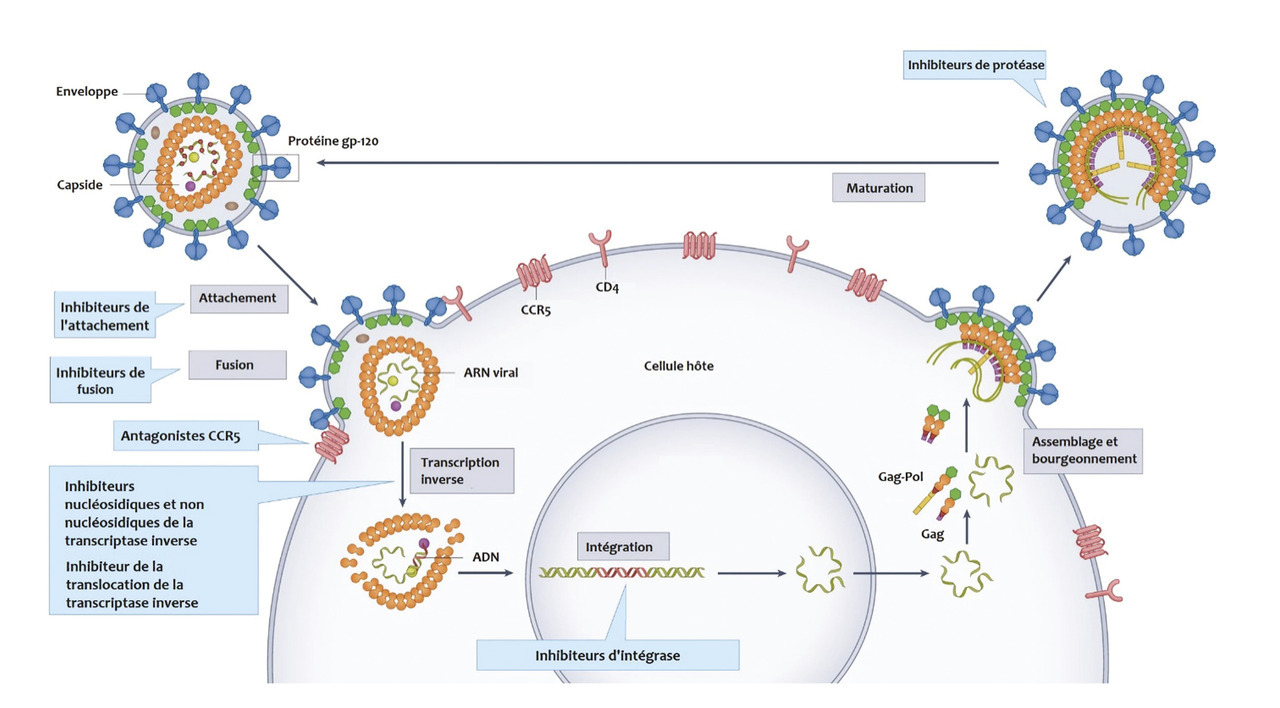
Le principe du traitement ARV est d’agir à différents niveaux du cycle de réplication virale (figure ).
Les molécules aujourd’hui majoritairement employées sont regroupées en quatre grandes classes thérapeutiques : inhibiteurs nucléosidiques de la transcriptase inverse (INTI), inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), inhibiteurs de protéase (IP) et inhibiteurs d’intégrase (INI) [tableau 2 ].
Parmi ces molécules, le cabotégravir, un nouvel INI, et la rilpivirine (INNTI) sont à présent disponibles sous une forme injectable à libération prolongée (LA pour Long Acting) permettant une administration par voie intramusculaire deux fois à un mois d’écart, puis tous les deux mois et utilisables en allègement thérapeutique chez les personnes vivant avec le VIH ayant une charge virale indétectable depuis plus d’un an.
Les molécules aujourd’hui majoritairement employées sont regroupées en quatre grandes classes thérapeutiques : inhibiteurs nucléosidiques de la transcriptase inverse (INTI), inhibiteurs non nucléosidiques de la transcriptase inverse (INNTI), inhibiteurs de protéase (IP) et inhibiteurs d’intégrase (INI) [
Parmi ces molécules, le cabotégravir, un nouvel INI, et la rilpivirine (INNTI) sont à présent disponibles sous une forme injectable à libération prolongée (LA pour Long Acting) permettant une administration par voie intramusculaire deux fois à un mois d’écart, puis tous les deux mois et utilisables en allègement thérapeutique chez les personnes vivant avec le VIH ayant une charge virale indétectable depuis plus d’un an.
Inhibiteurs d’entrée en dernier recours
Plus rarement, des inhibiteurs d’entrée sont utilisés : inhibiteurs de fusion (enfuvirtide) et antagoniste du corécepteur CCR5 (maraviroc).
Depuis peu, deux ARV sont venus enrichir cette famille : l’ibalizumab (un inhibiteur de fusion, sous forme intraveineuse) et le fostemsavir (un inhibiteur de l’attachement). L’ibalizumab a fait l’objet d’une abrogation d’AMM en France en décembre 2022 pour des raisons commerciales, et n’est donc disponible actuellement que dans le cadre d’études thérapeutiques.
Ces médicaments sont utilisés comme option de dernier recours, en association à d’autres ARV appropriés, pour le traitement des patients ayant une infection à VIH-1 multirésistant et pour lesquels les traitements ARV disponibles ne permettent pas d’atteindre la suppression virologique. Ils sont réservés à l’usage hospitalier et initiés en milieu spécialisé après réunion de concertation pluridisciplinaire.
Depuis peu, deux ARV sont venus enrichir cette famille : l’ibalizumab (un inhibiteur de fusion, sous forme intraveineuse) et le fostemsavir (un inhibiteur de l’attachement). L’ibalizumab a fait l’objet d’une abrogation d’AMM en France en décembre 2022 pour des raisons commerciales, et n’est donc disponible actuellement que dans le cadre d’études thérapeutiques.
Ces médicaments sont utilisés comme option de dernier recours, en association à d’autres ARV appropriés, pour le traitement des patients ayant une infection à VIH-1 multirésistant et pour lesquels les traitements ARV disponibles ne permettent pas d’atteindre la suppression virologique. Ils sont réservés à l’usage hospitalier et initiés en milieu spécialisé après réunion de concertation pluridisciplinaire.
Deux nouvelles classes prometteuses à l’étude
Enfin, deux nouvelles classes sont à l’essai actuellement, avec des résultats prometteurs : le lénacapavir, chef de file des inhibiteurs de capside, et l’islatravir, inhibiteur de la translocation de la transcriptase inverse.
Le lénacapavir agit à différents niveaux de la fonction de la capside, entraînant une inhibition de l’intégration nucléaire de l’ADN proviral du VIH-1, de l’assemblage et de la libération du virus, et de la formation du noyau de la capside. Outre sa place dans l’arsenal thérapeutique en cas de résistance à plusieurs classes, il présente l’intérêt d’une action longue durée (LA), avec une administration par voie sous-cutanée tous les six mois. Son efficacité chez les PVVIH porteuses d’un virus multirésistant a été démontrée en 2022 par l’essai clinique de phase III CAPELLA, montrant une diminution significative de la charge virale chez les PVVIH traitées en multithérapie et lénacapavir, comparées à celles traitées en multithérapie seule.4 L’effet indésirable le plus fréquent est une réaction inflammatoire aux points d’injection (60 % des patients environ expérimentent inflammation, douleur et/ou nodule post-injection) ; la tolérance globale reste cependant élevée. Il est commercialisé en France depuis fin 2023 ; son indication le réserve aux patients porteurs d’un virus multirésistant et en échec thérapeutique.
L’islatravir entrave l’action de la transcriptase inverse en empêchant la liaison et l’incorporation des nucléotides à la chaîne d’ADN, entraînant la production d’un ADN viral tronqué. Il a fait l’objet de plusieurs essais thérapeutiques sous différentes combinaisons de bithérapie : en prise orale quotidienne ou hebdomadaire et en traitement injectable LA. La survenue d’un effet indésirable grave a mis un frein à l’ensemble des essais thérapeutiques : une baisse significative des lymphocytes CD4+ a été mise en évidence dans les groupes recevant l’islatravir. La toxicité semble corrélée à la dose de traitement. De nouveaux essais thérapeutiques avec des doses réduites devraient débuter prochainement.
Le lénacapavir agit à différents niveaux de la fonction de la capside, entraînant une inhibition de l’intégration nucléaire de l’ADN proviral du VIH-1, de l’assemblage et de la libération du virus, et de la formation du noyau de la capside. Outre sa place dans l’arsenal thérapeutique en cas de résistance à plusieurs classes, il présente l’intérêt d’une action longue durée (LA), avec une administration par voie sous-cutanée tous les six mois. Son efficacité chez les PVVIH porteuses d’un virus multirésistant a été démontrée en 2022 par l’essai clinique de phase III CAPELLA, montrant une diminution significative de la charge virale chez les PVVIH traitées en multithérapie et lénacapavir, comparées à celles traitées en multithérapie seule.4 L’effet indésirable le plus fréquent est une réaction inflammatoire aux points d’injection (60 % des patients environ expérimentent inflammation, douleur et/ou nodule post-injection) ; la tolérance globale reste cependant élevée. Il est commercialisé en France depuis fin 2023 ; son indication le réserve aux patients porteurs d’un virus multirésistant et en échec thérapeutique.
L’islatravir entrave l’action de la transcriptase inverse en empêchant la liaison et l’incorporation des nucléotides à la chaîne d’ADN, entraînant la production d’un ADN viral tronqué. Il a fait l’objet de plusieurs essais thérapeutiques sous différentes combinaisons de bithérapie : en prise orale quotidienne ou hebdomadaire et en traitement injectable LA. La survenue d’un effet indésirable grave a mis un frein à l’ensemble des essais thérapeutiques : une baisse significative des lymphocytes CD4+ a été mise en évidence dans les groupes recevant l’islatravir. La toxicité semble corrélée à la dose de traitement. De nouveaux essais thérapeutiques avec des doses réduites devraient débuter prochainement.
Bi- ou trithérapie en initiation de traitement
Le premier choix de traitement ARV relève d’une consultation spécialisée et fait intervenir systématiquement une combinaison comportant au moins deux classes différentes. Le choix des traitements dépend, pour certains, du niveau de la charge virale préthérapeutique, des comorbidités, des comédications pouvant entraîner de potentielles interactions médicamenteuses et de la tolérance attendue. Depuis 2009, l’instauration des trithérapies combinées en un seul comprimé (single-tablet regimen) a permis une nette amélioration de la qualité de vie des PVVIH et une meilleure adhésion au soin. Elles sont donc à privilégier dès que cela est possible.
La trithérapie de première ligne était jusqu’alors la règle, avec l’association de deux INTI et d’un troisième agent parmi les INNTI, les IP ou les INI. Les combinaisons actuellement privilégiées sont celles comportant un INI, du fait d’une bonne tolérance (comparé notamment aux IP) et d’une meilleure barrière génétique (comparé notamment aux INNTI). C’est par exemple le cas de la combinaison ténofovir alafénamide-emtricitabine-bictégravir (TAF-FTC-BIC), recommandée en initiation depuis 2018, et utilisable indépendamment de la charge virale.5
Depuis 2020, une bithérapie orale peut également être instaurée en première intention : l’association dolutégravir (DTG) et lamivudine (3TC). Les études randomisées multicentriques GEMINI 1 et 2 publiées en 2019 ont permis de démontrer la non-infériorité de cette bithérapie, comparée à la trithérapie par ténofovir disoproxil (TDF)-FTC-DTG, dans une population de PVVIH naïfs d’ARV et de charge virale inférieure à 500 000 copies/mL.6 La réponse virologique attendue de moins de 50 copies/mL à 48 semaines de traitement était obtenue dans 91 % des cas sous bithérapie contre 93 % des cas en trithérapie (différence non significative). Le profil de tolérance était équivalent, voire meilleur, dans le bras DTG-3TC. Ces résultats ont permis l’indication de cette association pour les patients naïfs de traitement ayant plus de 200 CD4+/mm3, une charge virale inférieure à 100 000 copies/mL et sans résistance connue ou suspectée vis-à-vis de l’une des deux molécules.
La trithérapie de première ligne était jusqu’alors la règle, avec l’association de deux INTI et d’un troisième agent parmi les INNTI, les IP ou les INI. Les combinaisons actuellement privilégiées sont celles comportant un INI, du fait d’une bonne tolérance (comparé notamment aux IP) et d’une meilleure barrière génétique (comparé notamment aux INNTI). C’est par exemple le cas de la combinaison ténofovir alafénamide-emtricitabine-bictégravir (TAF-FTC-BIC), recommandée en initiation depuis 2018, et utilisable indépendamment de la charge virale.5
Depuis 2020, une bithérapie orale peut également être instaurée en première intention : l’association dolutégravir (DTG) et lamivudine (3TC). Les études randomisées multicentriques GEMINI 1 et 2 publiées en 2019 ont permis de démontrer la non-infériorité de cette bithérapie, comparée à la trithérapie par ténofovir disoproxil (TDF)-FTC-DTG, dans une population de PVVIH naïfs d’ARV et de charge virale inférieure à 500 000 copies/mL.6 La réponse virologique attendue de moins de 50 copies/mL à 48 semaines de traitement était obtenue dans 91 % des cas sous bithérapie contre 93 % des cas en trithérapie (différence non significative). Le profil de tolérance était équivalent, voire meilleur, dans le bras DTG-3TC. Ces résultats ont permis l’indication de cette association pour les patients naïfs de traitement ayant plus de 200 CD4+/mm3, une charge virale inférieure à 100 000 copies/mL et sans résistance connue ou suspectée vis-à-vis de l’une des deux molécules.
Allègement thérapeutique
L’allègement thérapeutique est une approche visant à réduire le nombre de prises ou de molécules ARV chez les patients bien contrôlés, pour gagner en tolérance et/ou en simplicité d’administration, tout en maintenant l’efficacité immunovirologique.
Parmi les stratégies d’allégement employées, trois retiennent aujourd’hui l’attention.
Parmi les stratégies d’allégement employées, trois retiennent aujourd’hui l’attention.
Prise intermittente
La prise intermittente de traitements ARV consiste à conserver chez les PVVIH contrôlées la trithérapie ARV en cours, mais avec une prise seulement 4 ou 5 jours par semaine sous condition d’une barrière génétique efficace (privilégiant les combinaisons avec un INI). L’essai randomisé de l’Agence nationale de recherche sur le sida et les hépatites virales (ANRS) QUATUOR a validé, en 2022, l’efficacité et la sécurité de ce régime intermittent (4 jours sur 7) dans une étude de non-infériorité par rapport au régime continu (7 jours sur 7) chez 636 patients.7 Elle présente pour la PVVIH l’avantage de conserver son traitement ARV habituel.Passage en bithérapie d’ARV orale
Le DTG-3TC, déjà décrit en traitement d’initiation, fait partie des combinaisons utilisées en allègement thérapeutique. Une autre combinaison est actuellement validée, uniquement en allégement : dolutégravir-rilpivirine (DTG/RPV). Elle s’adresse aux patients virologiquement contrôlés depuis plus de six mois, préférentiellement avec une charge virale indétectable depuis plus d’un an et sans antériorité de taux de CD4+ inférieur à 200 copies/mL. Ces combinaisons font l’objet d’une réflexion pour des essais thérapeutiques visant à diminuer le nombre de prises hebdomadaires.Bithérapie injectable à libération prolongée
La bithérapie LA cabotégravir-rilpivirine (CAB-RPV) a été rendue accessible en 2021 grâce aux résultats des études FLAIR et ATLAS démontrant la non-infériorité du passage d’une trithérapie conventionnelle à la bithérapie injectable CAB-RPV LA une fois par mois.8 L’espacement des injections a par la suite été rendu possible grâce aux résultats de l’étude ATLAS-2M qui a validé le maintien des objectifs immunovirologiques en espaçant les injections tous les deux mois, sous réserve de doses plus élevées de RPV (900 mg versus 600 mg).9 Le traitement est actuellement délivré en injection intramusculaire tous les deux mois, les deux molécules étant injectées le même jour par un opérateur entraîné dans chacun des muscles glutéaux. La PVVIH doit répondre à des critères stricts de contrôle de la charge virale depuis plus d’un an, de sous-type de VIH compatible, d’absence de mutation de résistance connue ou d’échec thérapeutique antérieur concernant les deux classes thérapeutiques utilisées. Le traitement est initié en milieu hospitalier pour assurer une surveillance rapprochée de son efficacité ; une administration en ville est ensuite possible. Chez les PVVIH présentant un indice de masse corporelle (IMC) supérieur à 30 kg/m2, l’utilisation d’une aiguille adaptée est recommandée pour ne pas risquer un défaut de diffusion du produit et un échappement thérapeutique par sous-dosage. Un dosage résiduel des molécules dans le plasma durant les premiers mois de traitement est recommandé. Le principal effet indésirable rapporté est la douleur et l’inflammation temporaire des tissus sous-cutanés aux points d’injection. Il constitue cependant un faible frein à cette thérapeutique. Le taux d’échec virologique rapporté à long terme chez les premières PVVIH étudiées reste très faible, mais parfois associé à l’apparition de mutations qu’il convient de ne pas négliger.Traitement préventif de l’infection à VIH
Prophylaxie préexposition
La prophylaxie préexposition (PrEP) est une stratégie innovante de prévention du VIH. Elle fait partie de l’offre de prévention diversifiée, au même titre que le traitement des personnes vivant avec le VIH comme prévention (TasP), l’utilisation de préservatif ou le dépistage. Elle est déployée en France depuis janvier 2016, à la suite des études cliniques favorables menées aux États-Unis, en Afrique et en Europe.
Elle consiste, pour les personnes séronégatives, à débuter une bithérapie antirétrovirale combinée orale par ténofovir disoproxil-emtricitabine (TDF-FTC) en amont d’une exposition sexuelle, afin de réduire le risque de contamination.
Elle s’adresse aux personnes les plus exposées au risque : personnes trans et hommes cis ayant des relations sexuelles avec les hommes (HSH) multipartenaires, travailleurs et travailleuses du sexe, usagers de drogues intraveineuses, personnes originaires d’un pays à haute prévalence, victimes de violences sexuelles.
Deux modalités de prise sont possibles : en continu (un comprimé tous les jours) ou « à la demande » (avant et après le rapport sexuel, pour encadrer un risque ponctuel). Les études ont montré une nette réduction de l’incidence des cas de VIH dans les populations cibles, particulièrement chez les HSH : cette réduction était de 44 % pour la PrEP en continu et de plus de 90 % dans l’analyse restreinte aux participants observants, dans l’étude états-unienne iPrEX,10 confirmée par les études anglaise PROUD11 et française IPERGAY12, avec une réduction du risque relatif de 86 %. Les résultats étaient moins probants dans les populations féminines, en lien avec la diminution de la concentration vaginale des traitements : sept jours d’exposition au traitement sont nécessaires dans cette population pour être efficacement protégée. De fait, le schéma « à la demande » n’est pas réalisable chez les femmes.
La PrEP est initiée par un médecin et implique un suivi trimestriel de tolérance et de dépistage du VIH et des autres infections sexuellement transmissibles. Depuis juin 2021, l’initiation du traitement peut être indifféremment réalisée par un spécialiste (hôpital ou centre de dépistage) ou par un généraliste (en ville).
Depuis son déploiement en 2016, la PrEP a permis la diminution de l’incidence du VIH dans ces populations : la cohorte ANRS PRÉVENIR rapporte ainsi 361 infections par le VIH évitées en ayant traité 3 000 individus par PrEP entre 2017 et 2019.13
Elle consiste, pour les personnes séronégatives, à débuter une bithérapie antirétrovirale combinée orale par ténofovir disoproxil-emtricitabine (TDF-FTC) en amont d’une exposition sexuelle, afin de réduire le risque de contamination.
Elle s’adresse aux personnes les plus exposées au risque : personnes trans et hommes cis ayant des relations sexuelles avec les hommes (HSH) multipartenaires, travailleurs et travailleuses du sexe, usagers de drogues intraveineuses, personnes originaires d’un pays à haute prévalence, victimes de violences sexuelles.
Deux modalités de prise sont possibles : en continu (un comprimé tous les jours) ou « à la demande » (avant et après le rapport sexuel, pour encadrer un risque ponctuel). Les études ont montré une nette réduction de l’incidence des cas de VIH dans les populations cibles, particulièrement chez les HSH : cette réduction était de 44 % pour la PrEP en continu et de plus de 90 % dans l’analyse restreinte aux participants observants, dans l’étude états-unienne iPrEX,10 confirmée par les études anglaise PROUD11 et française IPERGAY12, avec une réduction du risque relatif de 86 %. Les résultats étaient moins probants dans les populations féminines, en lien avec la diminution de la concentration vaginale des traitements : sept jours d’exposition au traitement sont nécessaires dans cette population pour être efficacement protégée. De fait, le schéma « à la demande » n’est pas réalisable chez les femmes.
La PrEP est initiée par un médecin et implique un suivi trimestriel de tolérance et de dépistage du VIH et des autres infections sexuellement transmissibles. Depuis juin 2021, l’initiation du traitement peut être indifféremment réalisée par un spécialiste (hôpital ou centre de dépistage) ou par un généraliste (en ville).
Depuis son déploiement en 2016, la PrEP a permis la diminution de l’incidence du VIH dans ces populations : la cohorte ANRS PRÉVENIR rapporte ainsi 361 infections par le VIH évitées en ayant traité 3 000 individus par PrEP entre 2017 et 2019.13
Nouvelles molécules à longue durée d’action en prévention
Renforcer l’adhésion aux prophylaxies reste un enjeu majeur. Plusieurs essais thérapeutiques ont à ce titre évalué les traitements de longue durée d’action.
Le cabotégravir, sous forme d’injection intramusculaire LA toutes les huit semaines, a été testé en PrEP comparativement au TDF-FTC quotidien par voie orale, avec des résultats très concluants chez les hommes comme chez les femmes.14,15 Il est autorisé en PrEP par la Food and Drug Administration (FDA) aux États-Unis depuis fin 2021, et appuyé par l’OMS. En France, un essai visant à évaluer son utilisation en PrEP démarrera sous peu, avec l’aide de l’ANRS.
Le lénacapavir LA fait également l’objet d’études en prophylaxie, avec des essais de phase III en cours de recrutement pour une utilisation par voie sous-cutanée tous les six mois chez les hommes et les femmes.
Plusieurs autres innovations sont également à l’essai, notamment le développement de produits combinant des molécules de prévention du VIH et des contraceptifs, ou d’autres formes de produits LA, comme les anneaux vaginaux.
Concernant la vaccination, malgré de nombreuses années de recherche et plusieurs essais prometteurs en cours, aucun vaccin n’est actuellement disponible pour prévenir l’infection à VIH.
Le cabotégravir, sous forme d’injection intramusculaire LA toutes les huit semaines, a été testé en PrEP comparativement au TDF-FTC quotidien par voie orale, avec des résultats très concluants chez les hommes comme chez les femmes.14,15 Il est autorisé en PrEP par la Food and Drug Administration (FDA) aux États-Unis depuis fin 2021, et appuyé par l’OMS. En France, un essai visant à évaluer son utilisation en PrEP démarrera sous peu, avec l’aide de l’ANRS.
Le lénacapavir LA fait également l’objet d’études en prophylaxie, avec des essais de phase III en cours de recrutement pour une utilisation par voie sous-cutanée tous les six mois chez les hommes et les femmes.
Plusieurs autres innovations sont également à l’essai, notamment le développement de produits combinant des molécules de prévention du VIH et des contraceptifs, ou d’autres formes de produits LA, comme les anneaux vaginaux.
Concernant la vaccination, malgré de nombreuses années de recherche et plusieurs essais prometteurs en cours, aucun vaccin n’est actuellement disponible pour prévenir l’infection à VIH.
Arsenal thérapeutique et préventif élargi
Malgré l’innovation des traitements prophylactiques et curatifs contre le VIH, ceux-ci ne permettent pas encore, à ce jour, la prévention universelle ni la guérison. Les objectifs de contrôle immunovirologique chez les PVVIH sont aujourd’hui accessibles partout et pour tous en France, avec un arsenal thérapeutique large permettant une prise en charge individualisée. Les traitements innovants s’attachent désormais, d’une part, pour les personnes séronégatives vis-à-vis du VIH, à renforcer l’offre de prévention diversifiée et, d’autre part, chez les PVVIH, à améliorer la tolérance médicamenteuse, les facilités de prise et la qualité de vie. Il semble que les traitements LA prendront une part de plus en plus importante dans l’avenir, avec toute la prudence qu’il reste à appliquer sur le risque d’émergence de mutations de résistance en cas d’échec virologique.
Références
1. Trickey A, May MT, Vehreschild JJ, Obel N, Gill MJ, Crane HM, et al. Survival of HIV-positive patients starting antiretroviral therapy between 1996 and 2013: a collaborative analysis of cohort studies. Lancet HIV 2017;4(8):e349-56.
2. Grinsztejn B, Hosseinipour MC, Ribaudo HJ, Swindells S, Fron J, Chen YQ, et al; HPTN 052-ACTG Study Team. Effects of early versus delayed initiation of antiretroviral treatment on clinical outcomes of HIV-1 infection: Results from the phase 3 HPTN 052 randomised controlled trial. Lancet Infect Dis 2014;14(4):281-90. Erratum in: Lancet Infect Dis 2014;14(4):269.
3. INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic HIV Infection. N Engl J Med 2015;373(9):795-807.
4. Gallant J, Lazzarin A, Mills A, Orkin C, Podsamczer D, Tebas P, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): A double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet 2017;390(10107):2063-72.
5. Segal-Maurer S, DeJesus E, Stellbrink HJ, Castagna A, Richmond GJ, Sinclair GI, et al. Capsid inhibition with lenacapavir in multidrug-resistant HIV-1 infection. N Engl J Med 2022;386(19):1793-803.
6. Cahn P, Madero JS, Arribas JR, Antinori A, Ortiz R, Clarke AE, et al; GEMINI Study Team. Dolutegravir plus lamivudine versus dolutegravir plus tenofovir disoproxil fumarate and emtricitabine in antiretroviral-naive adults with HIV-1 infection (GEMINI-1 and GEMINI-2): Week 48 results from two multicentre, double-blind, randomised, non-inferiority, phase 3 trials. Lancet 2019;393(10167):143-55.
7. Landman R, De Truchis P, Assoumou L, Lambert S, Bellet J, Amat K, et al. A 4-days-on and 3-days-off maintenance treatment strategy for adults with HIV-1 (ANRS 170 QUATUOR): A randomised, open-label, multicentre, parallel, non-inferiority trial. Lancet HIV 2022;9(2):e79-90.
8. Swindells S, Andrade-Villanueva JF, Richmond GJ, Rizzardini G, Baumgarten A, Masia M, et al. Long-acting cabotegravir and rilpivirine for maintenance of HIV-1 suppression. N Engl J Med 2020;382(12):1112-23.
9. Overton ET, Richmond G, Rizzardini G, Jaeger H, Orrell C, Nagimova F, et al. Long-acting cabotegravir and rilpivirine dosed every 2 months in adults with HIV-1 infection (ATLAS-2M), 48-week results: A randomised, multicentre, open-label, phase 3b, non-inferiority study. Lancet 2021;396(10267):1994-2005.
10. Grant RM, Lama JR, Anderson PL, McMahan V, Liu AY, Vargas L, et al. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men. N Engl J Med 2010;363(27):2587-99.
11. McCormack S, Dunn DT, Desai M, Dolling DI, Gafos M, Gilson R, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): Effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet 2016;387(10013):53-60.
12. Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I, et al. On-demand preexposure prophylaxis in men at high risk for HIV-1 infection. N Engl J Med 2015;373(23):2237-46.
13. Molina JM, Ghosn J, Delaugerre C, Pialoux G, Katlama C, Slama L, et al. Incidence of HIV infection with daily or on-demand oral prep with TDF/FTC in France. Topics in Antiviral Medicine 2021; 29(1):43-4.
14. Landovitz RJ, Donnell D, Clement ME, Hanscom B, Cottle L, Coelho L, et al. Cabotegravir for HIV prevention in cisgender men and transgender women. N Engl J Med 2021;385(7):595-608.
15. Delany-Moretlwe S, Hughes JP, Bock P, Ouma SG, Hunidzarira P, Kalonji D, et al. Cabotegravir for the prevention of HIV-1 in women: Results from HPTN 084, a phase 3, randomised clinical trial. Lancet 2022;399(10337):1779-89.
2. Grinsztejn B, Hosseinipour MC, Ribaudo HJ, Swindells S, Fron J, Chen YQ, et al; HPTN 052-ACTG Study Team. Effects of early versus delayed initiation of antiretroviral treatment on clinical outcomes of HIV-1 infection: Results from the phase 3 HPTN 052 randomised controlled trial. Lancet Infect Dis 2014;14(4):281-90. Erratum in: Lancet Infect Dis 2014;14(4):269.
3. INSIGHT START Study Group. Initiation of antiretroviral therapy in early asymptomatic HIV Infection. N Engl J Med 2015;373(9):795-807.
4. Gallant J, Lazzarin A, Mills A, Orkin C, Podsamczer D, Tebas P, et al. Bictegravir, emtricitabine, and tenofovir alafenamide versus dolutegravir, abacavir, and lamivudine for initial treatment of HIV-1 infection (GS-US-380-1489): A double-blind, multicentre, phase 3, randomised controlled non-inferiority trial. Lancet 2017;390(10107):2063-72.
5. Segal-Maurer S, DeJesus E, Stellbrink HJ, Castagna A, Richmond GJ, Sinclair GI, et al. Capsid inhibition with lenacapavir in multidrug-resistant HIV-1 infection. N Engl J Med 2022;386(19):1793-803.
6. Cahn P, Madero JS, Arribas JR, Antinori A, Ortiz R, Clarke AE, et al; GEMINI Study Team. Dolutegravir plus lamivudine versus dolutegravir plus tenofovir disoproxil fumarate and emtricitabine in antiretroviral-naive adults with HIV-1 infection (GEMINI-1 and GEMINI-2): Week 48 results from two multicentre, double-blind, randomised, non-inferiority, phase 3 trials. Lancet 2019;393(10167):143-55.
7. Landman R, De Truchis P, Assoumou L, Lambert S, Bellet J, Amat K, et al. A 4-days-on and 3-days-off maintenance treatment strategy for adults with HIV-1 (ANRS 170 QUATUOR): A randomised, open-label, multicentre, parallel, non-inferiority trial. Lancet HIV 2022;9(2):e79-90.
8. Swindells S, Andrade-Villanueva JF, Richmond GJ, Rizzardini G, Baumgarten A, Masia M, et al. Long-acting cabotegravir and rilpivirine for maintenance of HIV-1 suppression. N Engl J Med 2020;382(12):1112-23.
9. Overton ET, Richmond G, Rizzardini G, Jaeger H, Orrell C, Nagimova F, et al. Long-acting cabotegravir and rilpivirine dosed every 2 months in adults with HIV-1 infection (ATLAS-2M), 48-week results: A randomised, multicentre, open-label, phase 3b, non-inferiority study. Lancet 2021;396(10267):1994-2005.
10. Grant RM, Lama JR, Anderson PL, McMahan V, Liu AY, Vargas L, et al. Preexposure chemoprophylaxis for HIV prevention in men who have sex with men. N Engl J Med 2010;363(27):2587-99.
11. McCormack S, Dunn DT, Desai M, Dolling DI, Gafos M, Gilson R, et al. Pre-exposure prophylaxis to prevent the acquisition of HIV-1 infection (PROUD): Effectiveness results from the pilot phase of a pragmatic open-label randomised trial. Lancet 2016;387(10013):53-60.
12. Molina JM, Capitant C, Spire B, Pialoux G, Cotte L, Charreau I, et al. On-demand preexposure prophylaxis in men at high risk for HIV-1 infection. N Engl J Med 2015;373(23):2237-46.
13. Molina JM, Ghosn J, Delaugerre C, Pialoux G, Katlama C, Slama L, et al. Incidence of HIV infection with daily or on-demand oral prep with TDF/FTC in France. Topics in Antiviral Medicine 2021; 29(1):43-4.
14. Landovitz RJ, Donnell D, Clement ME, Hanscom B, Cottle L, Coelho L, et al. Cabotegravir for HIV prevention in cisgender men and transgender women. N Engl J Med 2021;385(7):595-608.
15. Delany-Moretlwe S, Hughes JP, Bock P, Ouma SG, Hunidzarira P, Kalonji D, et al. Cabotegravir for the prevention of HIV-1 in women: Results from HPTN 084, a phase 3, randomised clinical trial. Lancet 2022;399(10337):1779-89.