FOCUS
L’arachide, ou Arachis hypogaea, est une légumineuse faisant partie des fabacées, famille comptant également le pois, le soja, la lentille, la fève, le lupin, la caroube et des variétés de haricots.
Elle est largement consommée à travers le monde, le plus souvent entière (avec sa coque ou décortiquée) ou grillée (nature ou salée) mais également sous forme de beurre, pâte, farine ou huile.
Elle est aussi couramment employée dans l’industrie agroalimentaire pour enrichir certains aliments en protéines.
L’arachide, ou Arachis hypogaea, est une légumineuse faisant partie des fabacées, famille comptant également le pois, le soja, la lentille, la fève, le lupin, la caroube et des variétés de haricots.
Elle est largement consommée à travers le monde, le plus souvent entière (avec sa coque ou décortiquée) ou grillée (nature ou salée) mais également sous forme de beurre, pâte, farine ou huile.
Elle est aussi couramment employée dans l’industrie agroalimentaire pour enrichir certains aliments en protéines.
Une prévalence en hausse
Plus fréquente aux États-Unis dans les années 1980, l’allergie à l’arachide a connu une forte augmentation ces 15 dernières années dans tous les pays.1 La prévalence en France en population générale est estimée à 1 %. C’est la 1re cause d’allergie alimentaire chez l’enfant de plus de 3 ans.
Plusieurs facteurs seraient en cause : exposition limitée aux micro-organismes bactériens responsable d’une altération du microbiome gastro-intestinal et cutané, changement dans les habitudes alimentaires, évolution des modes de cuisson de l’arachide (crue ou rôtie, elle est plus allergisante que bouillie).
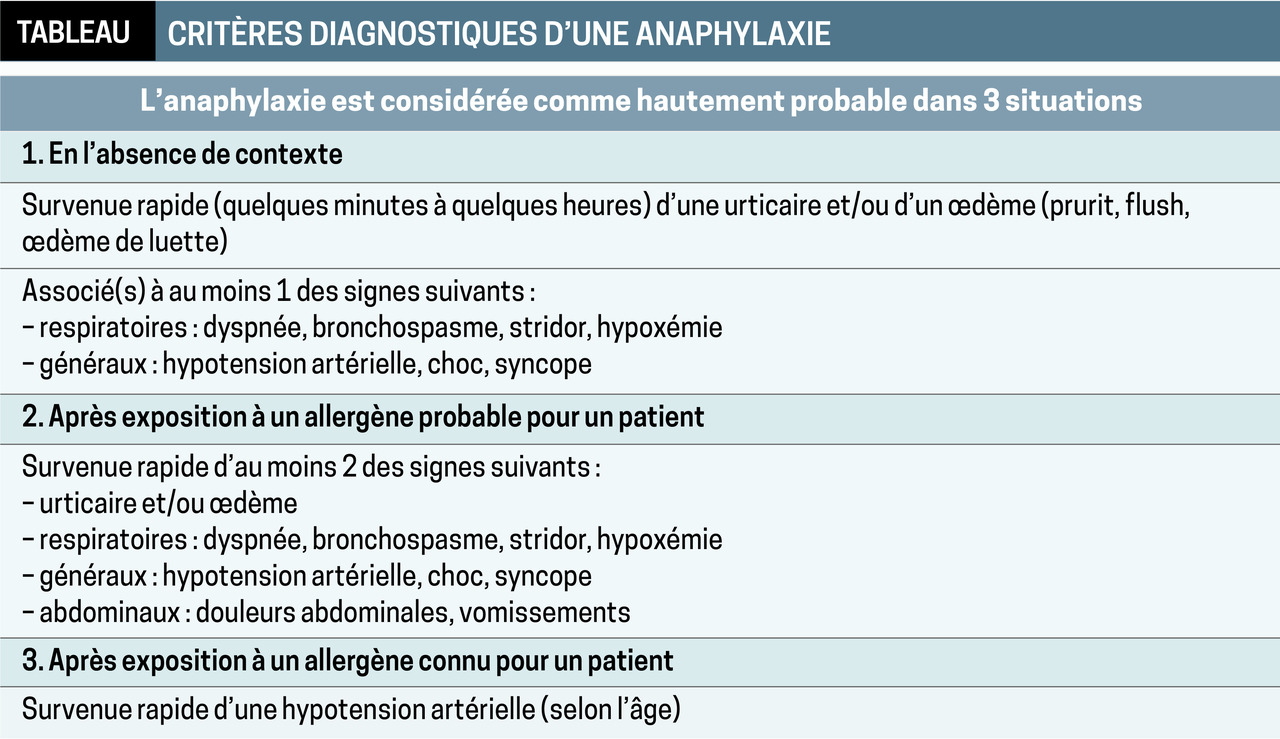
Il s’agit de la première cause d’anaphylaxie par allergie alimentaire, avec un impact significatif sur la vie sociale. Les voies de sensibilisation sont l’ingestion, l’inhalation et le contact (même indirect, comme le baiser d’un parent). Les différents symptômes possibles sont ceux de l’allergie immédiate (IgE-médiée) : urticaire, prurit, vomissement, douleurs abdominales, toux rauque, œdème de Quincke, bronchospasme, malaise, anaphylaxie (tableau ).
Plusieurs facteurs seraient en cause : exposition limitée aux micro-organismes bactériens responsable d’une altération du microbiome gastro-intestinal et cutané, changement dans les habitudes alimentaires, évolution des modes de cuisson de l’arachide (crue ou rôtie, elle est plus allergisante que bouillie).
Il s’agit de la première cause d’anaphylaxie par allergie alimentaire, avec un impact significatif sur la vie sociale. Les voies de sensibilisation sont l’ingestion, l’inhalation et le contact (même indirect, comme le baiser d’un parent). Les différents symptômes possibles sont ceux de l’allergie immédiate (IgE-médiée) : urticaire, prurit, vomissement, douleurs abdominales, toux rauque, œdème de Quincke, bronchospasme, malaise, anaphylaxie (
Un diagnostic plus précis
Comme pour toute allergie alimentaire, l’interrogatoire, les prick tests et les IgE spécifiques sont essentiels. Le test de provocation par voie orale, considéré comme le gold standard, peut être réalisé si l’histoire clinique est douteuse ou discordante avec les résultats, après avis spécialisé et dans des structures adaptées.
Si le diagnostic est confirmé, on recherche des réactions cliniques et/ou des sensibilisations (tests cutanés et/ou IgE spécifiques) vis-à-vis d’autres légumineuses, lupin, soja, et de plusieurs fruits à coque (30 % des cas), principalement pistache et noix de cajou mais aussi sésame, noisette, noix (de Grenoble), amande, pignon de pin, noix du Brésil, de coco, de pécan ou de macadamia.
Le dosage des allergènes recombinants est un nouvel outil permettant d’affiner le diagnostic. L’arachide contient plusieurs protéines qui se lient aux IgE spécifiques, désignées par le nom « Ara h » (Arachis hypogae) suivi du chiffre correspondant à l’ordre chronologique de leur identification. Les marqueurs biologiques les plus sensibles sont les albumines 2S Ara h 2 et 6, qui résistent au traitement thermique, aux acides gastriques et aux protéines digestives. Ara h 1 et 3 sont également associées à des réactions sévères. En revanche, une sensibilisation prédominante pour Ara h 8, homologue de Bet v 1 (allergène majeur du bouleau), témoigne d’une allergie croisée au pollen de bouleau. Dans ce cas, le patient a essentiellement un syndrome oral (prurit bucco-labial). D’autres aliments sont concernés par ce type de réactions croisées : les rosacées (pêche, pomme, poire, cerise…), la noisette ou encore le soja.2
Si le diagnostic est confirmé, on recherche des réactions cliniques et/ou des sensibilisations (tests cutanés et/ou IgE spécifiques) vis-à-vis d’autres légumineuses, lupin, soja, et de plusieurs fruits à coque (30 % des cas), principalement pistache et noix de cajou mais aussi sésame, noisette, noix (de Grenoble), amande, pignon de pin, noix du Brésil, de coco, de pécan ou de macadamia.
Le dosage des allergènes recombinants est un nouvel outil permettant d’affiner le diagnostic. L’arachide contient plusieurs protéines qui se lient aux IgE spécifiques, désignées par le nom « Ara h » (Arachis hypogae) suivi du chiffre correspondant à l’ordre chronologique de leur identification. Les marqueurs biologiques les plus sensibles sont les albumines 2S Ara h 2 et 6, qui résistent au traitement thermique, aux acides gastriques et aux protéines digestives. Ara h 1 et 3 sont également associées à des réactions sévères. En revanche, une sensibilisation prédominante pour Ara h 8, homologue de Bet v 1 (allergène majeur du bouleau), témoigne d’une allergie croisée au pollen de bouleau. Dans ce cas, le patient a essentiellement un syndrome oral (prurit bucco-labial). D’autres aliments sont concernés par ce type de réactions croisées : les rosacées (pêche, pomme, poire, cerise…), la noisette ou encore le soja.2
Quel régime ?
Actuellement, la prise en charge la plus sécuritaire repose sur l’éviction de l’arachide et des produits susceptibles d’en contenir. La consommation d’huile raffinée est tolérée. La réglementation INCO* a rendu obligatoire l’étiquetage de 14 allergènes notoires (dont l’arachide) sur les produits préemballés mais aussi dans la restauration et les commerces de bouche (boulangers, traiteurs…). Il est donc essentiel de savoir lire les étiquettes et demander la carte des allergènes. Les mentions « traces», « peut contenir », « fabriqué dans un lieu », notés sur les emballages, n’imposent pas l’éviction. Certaines situations sont particulièrement à risque d’accidents alimentaires : restauration asiatique ou créole, « semaine du goût » en collectivité... Il faut éviter les plats frits dans les lieux utilisant une même huile (qui peut se charger en protéines d’arachide et contaminer un aliment cuit ultérieurement). Dans tous les cas, l’enfant doit toujours refuser un plat dont la composition est douteuse.
Que faire en cas d’accident ?
Une trousse d’urgence comportant au moins un antihistaminique doit accompagner l’enfant dans tous ses déplacements.
Un stylo d’adrénaline est indispensable en cas d’antécédent d’anaphylaxie ou d’asthme modéré à sévère non contrôlé associé. Les recommandations françaises et européennes préconisent toutefois (indication relative) sa prescription chez toutes les personnes allergiques à l’arachide et/ou à un fruit à coque (allergènes considérés à risque).
Plusieurs stylos auto-injectables sont disponibles (Anapen, Epipen, Jext, Emerade), avec les dosages 0,15 mg, 0,30 mg et depuis peu 0,50 mg (administration IM dans la face antéro-externe de la cuisse).
Si l’enfant est asthmatique, un aérosol-doseur accompagné d’une chambre d’inhalation ainsi que des corticoïdes oraux sont fournis.
En crèche ou à l’école, un PAI (protocole d’action individualisé) précise les modalités de restauration pour l’enfant (lecture simple des menus avec contrôle parental anticipé, plateau sans allergènes, panier-repas…) ainsi que le contenu de la trousse d’urgence et la conduite à tenir en cas de réaction.3
Un stylo d’adrénaline est indispensable en cas d’antécédent d’anaphylaxie ou d’asthme modéré à sévère non contrôlé associé. Les recommandations françaises et européennes préconisent toutefois (indication relative) sa prescription chez toutes les personnes allergiques à l’arachide et/ou à un fruit à coque (allergènes considérés à risque).
Plusieurs stylos auto-injectables sont disponibles (Anapen, Epipen, Jext, Emerade), avec les dosages 0,15 mg, 0,30 mg et depuis peu 0,50 mg (administration IM dans la face antéro-externe de la cuisse).
Si l’enfant est asthmatique, un aérosol-doseur accompagné d’une chambre d’inhalation ainsi que des corticoïdes oraux sont fournis.
En crèche ou à l’école, un PAI (protocole d’action individualisé) précise les modalités de restauration pour l’enfant (lecture simple des menus avec contrôle parental anticipé, plateau sans allergènes, panier-repas…) ainsi que le contenu de la trousse d’urgence et la conduite à tenir en cas de réaction.3
Évolution et traitement
Seuls 20 % des patients sont susceptibles de guérir spontanément. Des stratégies thérapeutiques innovantes visent à prévenir les accidents et à induire à moyen ou long terme la tolérance.
L’immunothérapie spécifique est ainsi considérée comme une alternative, avec plusieurs voies d’administration à l’étude (orale, sublinguale, sous-cutanée ou épicutanée).
L’immunothérapie orale (ITO), initiée au décours d’un test de provocation par voie orale, est débutée habituellement à 10 % de la dose réactogène ; c’est actuellement la méthode la plus utilisée. Elle est possible chez les enfants à partir de l’âge de 4-5 ans, uniquement dans des centres experts. Le but est d’augmenter le seuil réactogène pour minimiser le risque d’anaphylaxie à des quantités faibles. En revanche, elle ne semble pas induire une tolérance durable après son interruption (il faut donc la continuer).4
Plus récemment, l’immunothérapie épicutanée (EPIT) a fait l’objet d’une investigation préclinique et clinique. En délivrant un antigène dans la peau intacte, cette technique est supposée induire une forte réponse immunitaire tout en évitant les réactions systémiques. Des résultats préliminaires ont indiqué une meilleure tolérance que l’ITO, avec des données qui sont toutefois à confirmer.4
L’immunothérapie spécifique est ainsi considérée comme une alternative, avec plusieurs voies d’administration à l’étude (orale, sublinguale, sous-cutanée ou épicutanée).
L’immunothérapie orale (ITO), initiée au décours d’un test de provocation par voie orale, est débutée habituellement à 10 % de la dose réactogène ; c’est actuellement la méthode la plus utilisée. Elle est possible chez les enfants à partir de l’âge de 4-5 ans, uniquement dans des centres experts. Le but est d’augmenter le seuil réactogène pour minimiser le risque d’anaphylaxie à des quantités faibles. En revanche, elle ne semble pas induire une tolérance durable après son interruption (il faut donc la continuer).4
Plus récemment, l’immunothérapie épicutanée (EPIT) a fait l’objet d’une investigation préclinique et clinique. En délivrant un antigène dans la peau intacte, cette technique est supposée induire une forte réponse immunitaire tout en évitant les réactions systémiques. Des résultats préliminaires ont indiqué une meilleure tolérance que l’ITO, avec des données qui sont toutefois à confirmer.4
Prévention primaire ?
Les dernières guidelines internationales et notamment américaines reprennent les conclusions de l’étude LEAP,5 à savoir l’intérêt d’une introduction précoce de l’arachide, principalement dans les populations dites à risque. Ainsi, il est conseillé d’en donner (sous forme de beurre de cacahuète ou équivalent, Curly écrasé, afin d’éviter une fausse route) dès l’âge de 4 à 6 mois chez les nourrissons ayant un eczéma et/ou une allergie à l’œuf, après un avis allergologique.
En Europe, l’ESPGHAN recommande une introduction entre 4 et 11 mois pour ces enfants, après avis allergologique.
Pour la population générale, il est conseillé de ne pas différer l’introduction des aliments considérés à risque allergénique (dont l’arachide). En pratique, il convient de tenir compte des habitudes alimentaires et culturelles, variables selon les pays.
L’arachide est le premier allergène alimentaire responsable d’anaphylaxie.
Le diagnostic repose sur l’histoire clinique, les tests cutanés et le dosage des IgE spécifiques.
L’enjeu est la prévention des accidents, grâce à l’éducation thérapeutique.
Des protocoles d’immunothérapie sont à l’étude.
En Europe, l’ESPGHAN recommande une introduction entre 4 et 11 mois pour ces enfants, après avis allergologique.
Pour la population générale, il est conseillé de ne pas différer l’introduction des aliments considérés à risque allergénique (dont l’arachide). En pratique, il convient de tenir compte des habitudes alimentaires et culturelles, variables selon les pays.
L’arachide est le premier allergène alimentaire responsable d’anaphylaxie.
Le diagnostic repose sur l’histoire clinique, les tests cutanés et le dosage des IgE spécifiques.
L’enjeu est la prévention des accidents, grâce à l’éducation thérapeutique.
Des protocoles d’immunothérapie sont à l’étude.
Remerciements à l’équipe médicale de l’hôpital de jour Ambroise-Paré pour leurs conseils : Grégoire Benoist, Étienne Bidat, Catherine Feuillet Dassonval.
Références
1. Samson HA. Peanut oral immunotherapy: Is it ready for clinical practice? J Allergy Clin Immunol Pract 2013;1:15-21.
2. Lefèvre S, Jacquenet S, Kanny G. Diagnostic d’allergie alimentaire à l’arachide. Rev Fr Allergol 2016;56:20-8.
3. Benoist G, Valean A. Conduite à tenir en urgence face à une réaction alimentaire chez un enfant. Rev Prat 2016;66:848-50.
4. Pajno GB, Fernandez-Rivas M, Arasi S. EAACI Guidelines on allergen immunotherapy: IgE-mediatedfood allergy. Allergy 2018;73:799-815. 5. Du Toit G, Sayre PH, Roberts G, et al. Allergen specificity of early peanut consumption and effect on development of allergic disease in the LEAP study cohort. J Allergy Clin Immunol 2018;141:1343-53.
2. Lefèvre S, Jacquenet S, Kanny G. Diagnostic d’allergie alimentaire à l’arachide. Rev Fr Allergol 2016;56:20-8.
3. Benoist G, Valean A. Conduite à tenir en urgence face à une réaction alimentaire chez un enfant. Rev Prat 2016;66:848-50.
4. Pajno GB, Fernandez-Rivas M, Arasi S. EAACI Guidelines on allergen immunotherapy: IgE-mediatedfood allergy. Allergy 2018;73:799-815. 5. Du Toit G, Sayre PH, Roberts G, et al. Allergen specificity of early peanut consumption and effect on development of allergic disease in the LEAP study cohort. J Allergy Clin Immunol 2018;141:1343-53.