Cinq principales familles allergéniques
Actuellement, cinq familles de protéines allergisantes sont répertoriées chez les mammifères (encadré 1 et tableau). Identifier le ou les responsables est impératif pour éviter le traumatisme psychologique d’une séparation. Il faut aussi savoir faire la différence entre l’allergie primaire à l’animal et une allergie croisée avec une autre espèce, ou même une sensibilisation asymptomatique.
L’allergie au chien (Canis familiaris ) affecte 5 à 10 % de la population adulte (8 allergènes identifiés, de Can f1 à Can f8). Le contact avec le canidé peut être domestique ou professionnel (vétérinaires, éleveurs, etc.). Le risque serait multiplié par 20 chez les dresseurs de chiens de la police selon une étude turque.
L’allergie au cheval(Equus caballus ; Equ c1, c2, c3 c4 et c6) peut être à l’origine de nombreuses réactions violentes respiratoires.
Concernant le lapin (Oryctolagus cuniculus ), l’allergène majeur est Ory c3 (sécréto-globuline) ; des cas exceptionnels d’anaphylaxie après ingestion de viande de lapin ont été décrits chez des personnes sensibilisées à l’animal quelques années auparavant par voie respiratoire.
Aujourd’hui, les nouveaux animaux de compagnie, d’origines diverses, parfois exotiques (mammifères, amphibiens, reptiles comme iguane, lézard, etc.) ont le vent en poupe : il faut connaître les pathologies cutanées qu’ils peuvent engendrer par morsure, les infections transmissibles, mais aussi les allergies respiratoires ou cutanées. Cependant, pour certains, les allergènes ne sont pas encore identifiés dans la nomenclature internationale.
Quelle symptomatologie ?
Les manifestations cliniques peuvent être de différentes natures selon la voie de contact. Il s’agit la plupart du temps de rhinoconjonctivite associée ou non à des crises d’asthme.
Une urticaire de contact a été décrite après piqûres d’épines de hérisson. Après contact avec un furet (Mustela putorius furo) ou un chinchilla (Chinchilla lanigera) : lésions papuleuses sur les mains, les avant-bras et le visage pouvant s’accompagner d’une crise d’asthme aiguë.
Pour les petits rongeurs (comme le rat ou la souris), il faut évoquer un asthme professionnel chez le personnel qui les manipule en laboratoire, surtout en cas d’antécédents atopiques. D’autres symptômes sont décrits : eczéma, poussée urticarienne, angiœdème, rhinite, souvent associés à une conjonctivite. Leur déclenchement est rythmé par l’exposition dans le cadre de l’activité.
Des réactions anaphylactiques ont été rapportées après morsure de gerbille (Meriones unguiculatus), de hamster nain (Phodorus sungorus), de souris blanche (Mus musculus).
Quant à l’araignée appelée Pholque de pluche (Holocnemus pluchei), deux allergènes ont été identifiés en 2011 : l’hémocyanine et l’arginine kinase, mais ils ne sont pas répertoriés dans la nomenclature internationale.
Comment faire le diagnostic ?
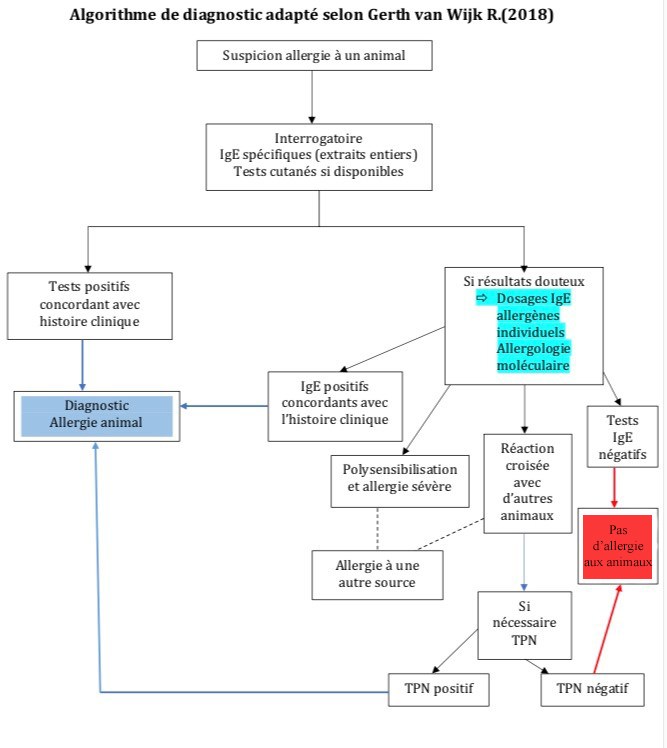
Le diagnostic repose sur l’interrogatoire, mais surtout sur le dosage des IgE spécifiques. Selon les recommandations (algorithme en figure) les dosages dirigés contre les extraits entiers suffisent généralement. Les IgE spécifiques dirigées contre les protéines des différentes familles allergéniques n’ont une place qu’en seconde intention, en cas de doute ou dans certaines circonstances (allergie au liquide séminal, allergies croisées). Les extraits commerciaux disponibles pour la réalisation des prick-tests sont peu nombreux et contiennent différentes quantités d’allergènes, ce qui explique la variabilité de certains résultats. Les tests de provocation nasale (TPN) ne sont pas de pratique courante.
En cas d’allergie au chien, les dosages des IgE spécifiques dirigées contre les différents allergènes permettent de cibler au mieux certains risques :
- en cas de positivité des IgE anti-Can f1 + IgE anti-Can f2 + anti-Can f5 : risque accru d’asthme ;
- une positivité uniquement des IgE anti-Can f5 indique une potentielle réaction au chien mâle chez les femmes (il s’agit de la kallicréine prostatique du chien qui est par définition absente chez la chienne). Cette protéine est responsable d’une allergie croisée avec le PSA humain. Ainsi, une positivité IgE Can f5 impose de rechercher chez la femme à l’interrogatoire de potentielles réactions allergiques lors du coït sans préservatif (urticaire locale, œdème de la vulve ou anaphylaxie) ;
- La positivité IgE anti-Canf 2 + IgE anti-Can f3 + IgE anti-Can f6 augmente le risque d’allergies croisées à d’autres animaux.
En ce qui concerne l’allergie au cheval, 76 % des allergiques réagissent à l’allergène majeur Equ c1, présent dans les squames et la salive de l’animal, et 33 % à l’allergène mineur Equ c2. La positivité à l’IgE anti Equ c6 implique une réaction croisée avec l’allergène lysozyme correspondant chez l’âne (99 % d’identité de structure ; risque de réactions par contact avec des cosmétiques contenant du lait d’ânesse). En cas de positivité de l’IgE anti-cheval (poils et squames ; code e 3), l’éviction de l’animal est fortement conseillée, avec également des mesures de prévention à prendre lorsqu’un membre de la famille pratique l’équitation (retrait des habits avant de rentrer dans la maison, etc.). Attention : les chevaux hypoallergéniques n’existent pas (encadré 2) !
Prise en charge et prévention
Dans la majorité des cas, l’éviction de l’animal est à préconiser si les symptômes sont sévères. Cependant, les propriétaires d’animaux domestiques ont souvent du mal à se séparer de leur animal. Ils préfèrent parfois prendre quotidiennement un traitement symptomatique (antihistaminique, corticoïdes locaux +/- si nécessaire traitement de fond pour l’asthme).
Les petits rongeurs sont souvent le petit compagnon proposé aux enfants. En préventif, l’animal ne doit jamais être installé dans la chambre. La cage doit toujours être changée en extérieur en raison de la présence des allergènes dans les urines.
La désensibilisation par voie sublinguale n’est disponible que pour le chat et le chien avec une variabilité dans son efficacité. Un vaccin humain contre le Feld 1 du chat est actuellement à l’étude.
1. Mammifères : 5 principales familles allergéniques
Les lipocalines, groupe allergénique, sont produites par les glandes sécrétoires et se retrouvent ensuite dans les urines, la salive, le sébum de l’animal. C’est le cas de Can f4 du chien, présent dans la salive et le pelage, contrairement à Can f2 (allergène mineur), isolé uniquement dans la salive. Can f1 est un allergène majeur reconnu par les IgE spécifiques chez 50 à 90 % des allergiques au chien. L’allergène majeur de la souris Mus m1 est une protéine urinaire qui se dépose sur les poils de l’animal. Quant à Cav p1 du cobaye, il est reconnu par les IgE spécifiques de 83 % d’allergiques au cochon d’Inde. Ces lipocalines sont à l’origine de réactions croisées (Can f6 du chien + Fel d4 du chat + Equi c1 du cheval ; Mus m1 de la souris + Rat n1 ; Cav p6 du cobaye peut entraîner des réactions croisées avec le Fel d4 du chat et le Can f6 du chien).
Les albumines sériques présentes dans le sang, les squames, le lait de mammifères, sont considérées comme des allergènes mineurs et responsables d’allergies croisées comme le syndrome porc-chat.
L’allergène Fel d1 du chat représente la tête de file de la famille des sécréto-globulines.
La kallicréine Can f5 du chien est à l’origine de l’allergie au liquide séminal humain.
Les lathérines sont essentiellement représentées par Equ c4, présent dans la salive et les squames des chevaux ; 77 % des allergiques à cet équidé y réagissent.
2. Les chevaux hypoallergéniques existent-ils ?
Depuis des décennies, certaines races de chevaux (le Curly américain et le Bashkir russe) sont présentées comme étant « hypoallergéniques ». Or une étude récente de 2022 sur 170 chevaux de 10 races différentes contredit cette hypothèse. En réalité, ni le Bashkir russe, ni le Curly américain n’ont des taux plus faibles de Equ c1, Equ c2 et Equ c3 comparés aux autres races d’équidés. De plus, la concentration en Equ c4 est plus élevée chez les étalons que chez les juments et les hongres.
Van Wijk RG. Diagnosis of dog allergy: beware of the dog. J Allergy Clin Immunol 2018;142:1058-9.
Konradsen JR, Fujisawa T, van Hage M, et al. Allergy to furry animals: new insights, diagnostic approaches, and challenges. J Allergy Clin Immunol 2015;135:616-25.
Martorell Calatayud C, Morales Rubio C, Bartolomé Zavala B, et al. Allergy to rabbit meat after sensitization by inhalation. J Investig Allergol Clin Immunol 2014;24(6):455-6.
Victor S, Lampa E, Rask Andersen A, et al. Measurement of Horse Allergens Equ c 1 and Equ c 2: A Comparison among Breeds. Int Arch Allergy Immunol 2022;183(11): 1166-77.
Díaz-Perales A, González-de-Olano D, Pérez-Gordo M, et al. Allergy to uncommon pets: new allergies but the same allergens. Front Immunol 2013;4:492.
Kesici GG, Karataþ A, Ünlü Y, et al. Occupational allergy to dog among police dog trainers. Eur Ann Allergy Clin Immunol 2019;51(6):265-73.
Martini M, Swiontek K, Antonicelli L, et al. Lysozyme, a new allergen in donkey’s milk. Clin Exp Allergy 2018;48(11):1521-3.
Hilger C, Kler S, Arumugam K, et al. Identification and isolation of a Fel d 1-like molecule as a major rabbit allergen. J Allergy Clin Immunol 2014;133(3):759-66.
Swiontek K, Kler S, Lehners C, et al. Component-resolved diagnosis using guinea-pig allergens elucidates allergen sensitization profiles in allergy to furry animals. Clin Exp Allergy 2021;51(6):829-35.
Curin M, Hilger C. Allergy to pets and new allergies to uncommon pets. Allergol Select 2017;1(2):214-21.

 Encadrés
Encadrés