Aujourd’hui, 25 % du total des greffes de cellules souches hématopoïétiques concernent des enfants, et l’âge des patients adultes bénéficiaires continue de croître. L’amélioration des techniques de préparation prégreffe et la prévention des complications ont contribué à ce changement.
Les travaux sur la greffe de moelle et l’identification de cellules souches pouvant reconstituer les lignées sanguines (« hématopoïétiques », ou CSH) ont débuté à la fin de la Seconde Guerre mondiale, après l’explosion nucléaire d’Hiroshima. Les premières greffes de moelle chez l’homme ont été réalisées par Edward Donnall Thomas en 1957 à New York1, non couronnées de succès, puisque les 6 receveurs sont décédés très rapidement, à une époque où le HLA (human leukocyte antigen) n’était pas encore connu. En effet, Jean Dausset ne décrit le premier antigène leucocytaire HLA que l’année suivante, en 1958. Edward Donnall Thomas et Jean Dausset reçoivent tous deux le prix Nobel de médecine pour leurs découvertes respectives. C’est également en 1958 que Georges Mathé, assistant de Jean Bernard à l’hôpital Saint-Louis (Paris), greffe 6 physiciens yougoslaves irradiés accidentellement dans un réacteur nucléaire, sauvant 4 d’entre eux. Il rapporte en 1963 la première allogreffe de moelle réussie chez un jeune patient atteint de leucémie aiguë réfractaire2, après irradiation corporelle totale, obtenant une rémission complète malgré le décès du garçon dix-huit mois plus tard d’une toxoplasmose cérébrale.
Aujourd’hui, la greffe de moelle est le seul traitement curatif de nombreuses hémopathies et représente, avec près de 2 000 allogreffes de CSH par an en France, la plus fréquente et la plus ancienne immunothérapie cellulaire anticancéreuse. Les CSH se trouvent dans la moelle osseuse et permettent de reconstituer les 3 lignées sanguines : les globules rouges transportant l’oxygène, les plaquettes permettant l’hémostase primaire, et les globules blancs ayant un rôle dans l’immunité. Ces derniers sont composés majoritairement des polynucléaires neutrophiles, combattant les infections bactériennes et fongiques, et dont le déficit prolongé est incompatible avec la vie à court terme (première barrière antimicrobienne), ainsi que des lymphocytes B (immunité humorale), T (immunité cellulaire) et NK (impliqués dans la réponse antivirale, antiparasitaire et anticancéreuse).
La greffe de CSH consiste à remplacer les CSH et le système immunitaire d’un patient par ceux issus du patient lui-même (autogreffe) ou d’un donneur de la même espèce (allogreffe), à la suite d’une courte phase de chimio- et/ou radiothérapie appelée « conditionnement ». Dans les jours suivant l’injection, les CSH colonisent la moelle osseuse du receveur et reconstituent les trois lignées sanguines en deux à quatre semaines. Les cellules lymphocytaires du système immunitaire, quant à elles, s’expandent dans le sang et les tissus lymphoïdes, et peuvent – dans le cas spécifique d’une allogreffe – reconnaître les cellules malignes du receveur comme étrangères et produire une réponse antitumorale (effet graft-versus-leukemia/lymphoma, ou GvL).
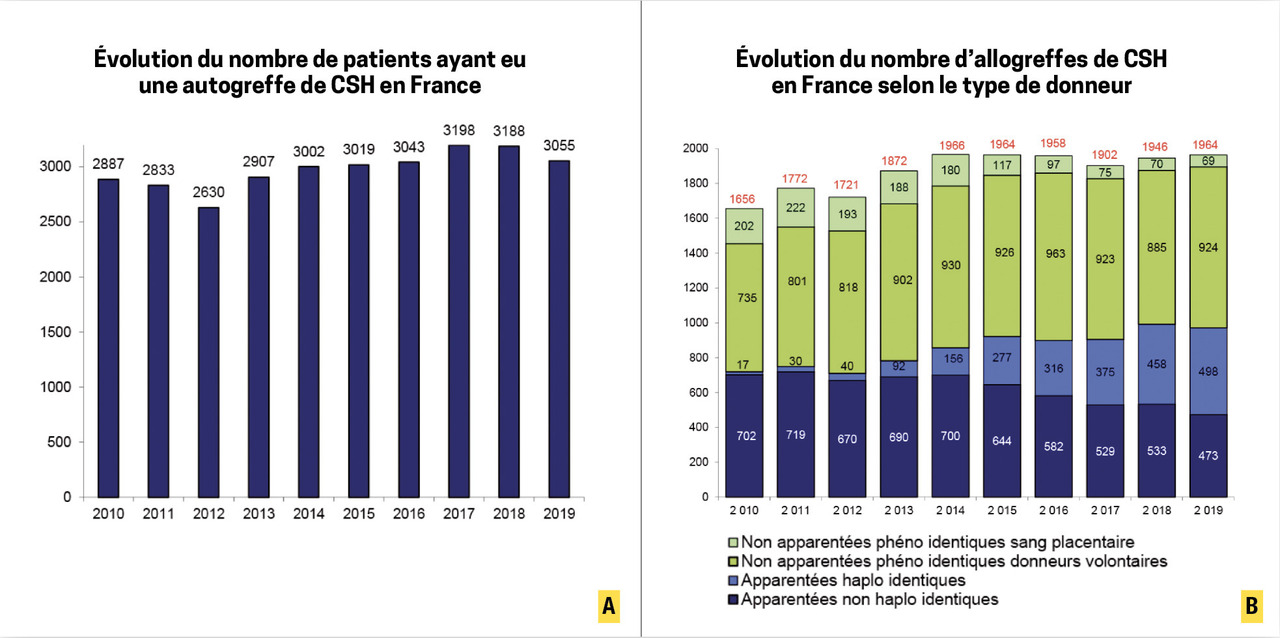
En France, près de 5 000 patients ont reçu une greffe de CSH au cours de l’année 2019, dont environ 60 % de greffes autologues et 40 % de greffes allogéniques (fig. 1A et 1B ).3
Aujourd’hui, la greffe de moelle est le seul traitement curatif de nombreuses hémopathies et représente, avec près de 2 000 allogreffes de CSH par an en France, la plus fréquente et la plus ancienne immunothérapie cellulaire anticancéreuse. Les CSH se trouvent dans la moelle osseuse et permettent de reconstituer les 3 lignées sanguines : les globules rouges transportant l’oxygène, les plaquettes permettant l’hémostase primaire, et les globules blancs ayant un rôle dans l’immunité. Ces derniers sont composés majoritairement des polynucléaires neutrophiles, combattant les infections bactériennes et fongiques, et dont le déficit prolongé est incompatible avec la vie à court terme (première barrière antimicrobienne), ainsi que des lymphocytes B (immunité humorale), T (immunité cellulaire) et NK (impliqués dans la réponse antivirale, antiparasitaire et anticancéreuse).
La greffe de CSH consiste à remplacer les CSH et le système immunitaire d’un patient par ceux issus du patient lui-même (autogreffe) ou d’un donneur de la même espèce (allogreffe), à la suite d’une courte phase de chimio- et/ou radiothérapie appelée « conditionnement ». Dans les jours suivant l’injection, les CSH colonisent la moelle osseuse du receveur et reconstituent les trois lignées sanguines en deux à quatre semaines. Les cellules lymphocytaires du système immunitaire, quant à elles, s’expandent dans le sang et les tissus lymphoïdes, et peuvent – dans le cas spécifique d’une allogreffe – reconnaître les cellules malignes du receveur comme étrangères et produire une réponse antitumorale (effet graft-versus-leukemia/lymphoma, ou GvL).
En France, près de 5 000 patients ont reçu une greffe de CSH au cours de l’année 2019, dont environ 60 % de greffes autologues et 40 % de greffes allogéniques (
Indications : hémopathies malignes surtout
Autogreffe et allogreffe doivent être bien distinguées, car ces deux traitements sont très différents.
L’autogreffe de CSH
Son but est de réinjecter les CSH d’un patient après une chimiothérapie lourde afin de raccourcir la durée des cytopénies, surtout la neutropénie, qui favorise les infections graves. Les lymphocytes du greffon autologue n’ont aucun effet immunologique contre la tumeur.
Son utilisation est limitée aux hémopathies chimio-sensibles pour lesquelles de fortes doses de chimiothérapie sont nécessaires. Après quelques cures, le greffon est prélevé chez le patient par cytaphérèse (cf. section « prélèvement »), puis congelé. Il est ensuite décongelé et réinjecté par voie veineuse au patient en fin de traitement de son hémopathie. On peut assimiler le processus d’autogreffe de CSH à une « super »-chimiothérapie de consolidation. La durée d’hospitalisation d’une autogreffe est de trois à quatre semaines. Les principales toxicités sont celles de la chimiothérapie et les infections liées à la neutropénie. Une fois les cellules hématologiques reconstituées (environ 12 jours post-greffe), il n’y a pas de complications attendues (notamment immunologiques), et le patient peut rentrer à domicile.
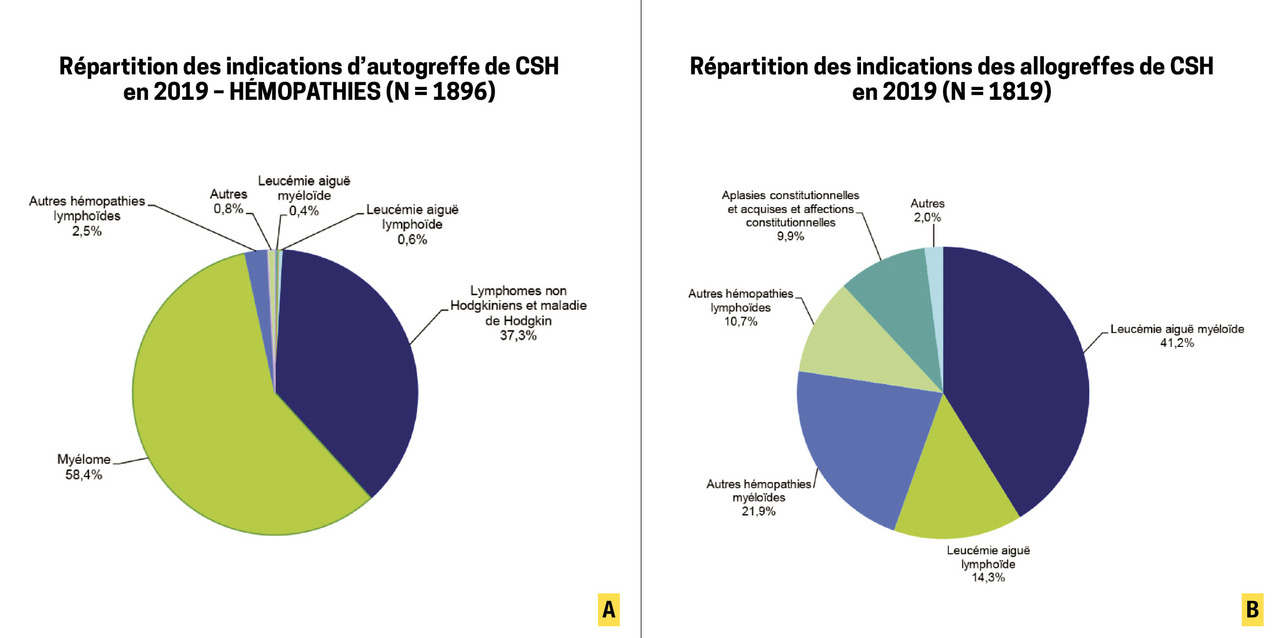
Les deux principales indications d’autogreffe sont le myélome multiple et les lymphomes (hodgkiniens et non hodgkiniens) (fig. 2A ). Beaucoup plus rarement, une autogreffe peut également être proposée pour traiter certaines tumeurs solides ou maladies auto-immunes.
Son utilisation est limitée aux hémopathies chimio-sensibles pour lesquelles de fortes doses de chimiothérapie sont nécessaires. Après quelques cures, le greffon est prélevé chez le patient par cytaphérèse (cf. section « prélèvement »), puis congelé. Il est ensuite décongelé et réinjecté par voie veineuse au patient en fin de traitement de son hémopathie. On peut assimiler le processus d’autogreffe de CSH à une « super »-chimiothérapie de consolidation. La durée d’hospitalisation d’une autogreffe est de trois à quatre semaines. Les principales toxicités sont celles de la chimiothérapie et les infections liées à la neutropénie. Une fois les cellules hématologiques reconstituées (environ 12 jours post-greffe), il n’y a pas de complications attendues (notamment immunologiques), et le patient peut rentrer à domicile.
Les deux principales indications d’autogreffe sont le myélome multiple et les lymphomes (hodgkiniens et non hodgkiniens) (
L’allogreffe de CSH
Elle est réservée aux hémopathies malignes que la chimiothérapie seule ne peut pas guérir, quelle que soit la dose utilisée, et pour lesquelles une immunothérapie antitumorale complémentaire est nécessaire (effet GvL). Ses principales indications chez l’adulte sont d’ordre tumoral et incluent leucémies aiguës, syndromes myélodysplasiques, néoplasies myéloprolifératives et lymphomes en rechute. Par ailleurs, il existe également de nombreuses hémopathies non malignes congénitales ou acquises pour lesquelles une allogreffe peut être envisagée : aplasies médullaires, drépanocytose, thalassémies sévères, déficits immunitaires, adrénoleucodystrophies (maladie génétique liée à l’X entraînant notamment une démyélinisation cérébrale), etc. (fig. 2B ). Des préconisations d’allogreffe dans le traitement de certaines maladies auto-immunes réfractaires existent, mais sont marginales.
Ces indications évoluent en fonction des progrès médicaux obtenus dans le domaine de la thérapie ciblée et de l’immunothérapie. Ainsi, la leucémie myéloïde chronique était l’une des principales jusqu’à la fin du XXe siècle. Cette indication a chuté depuis le début des années 2000, avec l’avènement des inhibiteurs de tyrosine kinase tels que l’imatinib (Glivec). De même pour les hémopathies lymphoïdes B : l’avènement des CAR-T cells et des traitements ciblés a considérablement réduit les indications d’allogreffe dans le myélome, la leucémie lymphoïde chronique B et les lymphomes à grandes cellules B. D’un autre côté, les améliorations des techniques de greffe ont diminué les toxicités de cette procédure, ouvrant cette option thérapeutique à des patients plus âgés ou comorbides, ainsi qu’aux pathologies non tumorales. In fine, le nombre d’allogreffes réalisées en France est stable depuis plusieurs années, même s’il n’augmente plus.
Ces indications évoluent en fonction des progrès médicaux obtenus dans le domaine de la thérapie ciblée et de l’immunothérapie. Ainsi, la leucémie myéloïde chronique était l’une des principales jusqu’à la fin du XXe siècle. Cette indication a chuté depuis le début des années 2000, avec l’avènement des inhibiteurs de tyrosine kinase tels que l’imatinib (Glivec). De même pour les hémopathies lymphoïdes B : l’avènement des CAR-T cells et des traitements ciblés a considérablement réduit les indications d’allogreffe dans le myélome, la leucémie lymphoïde chronique B et les lymphomes à grandes cellules B. D’un autre côté, les améliorations des techniques de greffe ont diminué les toxicités de cette procédure, ouvrant cette option thérapeutique à des patients plus âgés ou comorbides, ainsi qu’aux pathologies non tumorales. In fine, le nombre d’allogreffes réalisées en France est stable depuis plusieurs années, même s’il n’augmente plus.
Entre GvL, effet attendu, et GvHD, redoutée
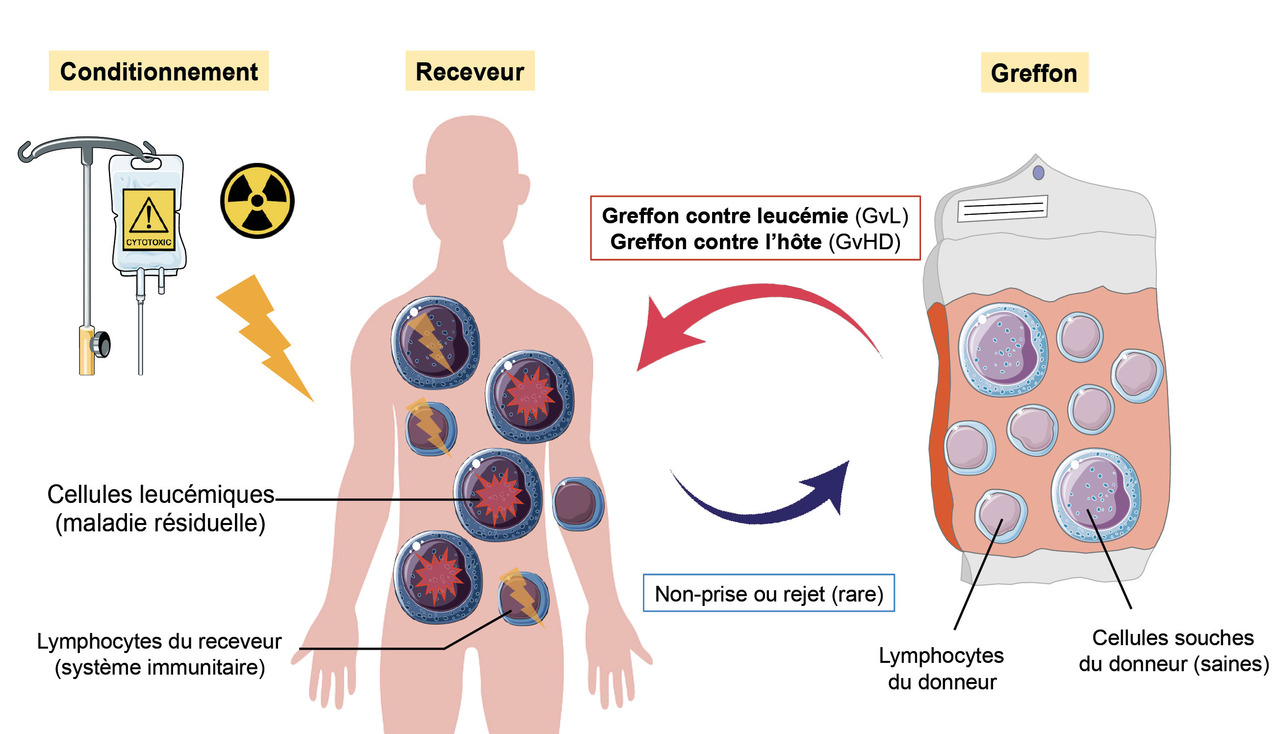
L’intérêt principal de l’allogreffe de CSH dans les hémopathies malignes est de remplacer le système immunitaire du patient par celui issu d’un donneur allogénique, qui produit un effet immunologique antitumoral appelé « effet GvL » (fig. 3 ). Même si le donneur allogénique est HLA-identique au receveur, il n’est pas son vrai jumeau monozygote, et son système immunitaire va donc reconnaître le receveur comme différent de lui.
La GvL est médiée par les lymphocytes T alloréactifs du donneur, et cette réaction est indispensable à la guérison des patients cancéreux. Cependant, les lymphocytes T alloréactifs du donneur peuvent également attaquer les tissus sains de l’hôte et provoquer une réaction potentiellement grave, la GvHD (pour graft-versus-host disease, cf. section GvHD). Cette GvHD est responsable d’une véritable « seconde maladie » potentiellement très sévère. Malheureusement, il est à ce jour impossible de dissocier l’effet GvL de l’effet GvH, et les deux sont très liés. La difficulté de l’allogreffe consiste à trouver un juste équilibre entre GvL et GvHD.
La GvL est médiée par les lymphocytes T alloréactifs du donneur, et cette réaction est indispensable à la guérison des patients cancéreux. Cependant, les lymphocytes T alloréactifs du donneur peuvent également attaquer les tissus sains de l’hôte et provoquer une réaction potentiellement grave, la GvHD (pour graft-versus-host disease, cf. section GvHD). Cette GvHD est responsable d’une véritable « seconde maladie » potentiellement très sévère. Malheureusement, il est à ce jour impossible de dissocier l’effet GvL de l’effet GvH, et les deux sont très liés. La difficulté de l’allogreffe consiste à trouver un juste équilibre entre GvL et GvHD.
Couple donneur-receveur
Score HCT-CI : sélection des patients
Lorsqu’une indication potentielle de greffe de CSH est posée, la faisabilité de la procédure doit être vérifiée, en particulier la capacité du patient à en supporter la toxicité possible. Un bilan prégreffe doit être programmé au préalable, permettant une évaluation globale (clinique et paraclinique). Bien qu’il soit rare de greffer des patients âgés de plus de 70 ans, l’âge physiologique compte davantage que l’âge chronologique. Le score HCT-CI (Hematopoietic Cell Transplantation-specific Comorbidity Index) est largement utilisé pour l’évaluation des comorbidités et du risque de complications chez un patient candidat à la greffe. Une évaluation gériatrique peut également s’avérer utile chez les plus âgés.
Sélection du donneur
Si, par définition, la question du donneur ne se pose pas dans la programmation d’une autogreffe de CSH, il faut en revanche identifier aussi rapidement que possible un donneur adéquat lorsqu’une indication d’allogreffe est retenue. À la différence des transplantations d’organes solides, l’allogreffe de CSH se fait à partir d’un donneur vivant sélectionné essentiellement en fonction de son typage HLA. Ce sont des greffes envisagées souvent dès le diagnostic de l’hémopathie, et nécessitant environ trois mois pour être organisées.
L’identité HLA entre le donneur et le receveur est primordiale pour une allogreffe de CSH, afin de d’éviter d’une part le rejet, d’une part (réaction HvG : host-vs-graft), et d’autre part une réaction sévère du greffon contre les cellules du receveur (réaction GvHD), d’autre part. Les molécules HLA sont impliquées dans la reconnaissance du soi et du non-soi à la surface des cellules immunitaires. Puisque tous ces gènes sont situés sur le chromosome 6 et sont transmis en bloc, deux membres d’une même fratrie auront 25 % de chances d’être HLA-identiques, c’est-à-dire d’avoir reçu les mêmes haplotypes HLA paternel et maternel. On parle alors de donneur « géno-identique ».
En l’absence de donneur géno-identique, on recherche dans les registres internationaux un donneur volontaire de CSH, autrement dit une personne non apparentée « phéno-identique » 10/10. En raison de la grande diversité allélique des gènes HLA, la probabilité que deux individus non apparentés expriment la même combinaison de molécules HLA est très faible. Cependant, le HLA est assez conservé dans les ethnies. La probabilité de trouver un donneur identique dans le fichier international dépend donc de la taille de ce registre et de la représentation ethnique des donneurs qui y sont inscrits.
Il y a actuellement 38 millions de donneurs volontaires inscrits dans les registres internationaux, dont 760 000 unités de sang placentaire (USP). À noter que le registre allemand comporte 9 300 000 donneurs, et 80 % des allogreffes non familiales en France sont réalisées à partir d’un donneur allemand. En France, le fichier comporte 320 000 donneurs et 38 000 USP (https://statistics.wmda.info/). Malgré cela, il reste environ 30 % de patients pour lesquels on n’identifie aucun donneur HLA-identique. Il est alors possible de faire appel à des donneurs alternatifs, c’est-à-dire ayant une ou plusieurs incompatibilités HLA. C’est le cas des donneurs non apparentés avec une incompatibilité HLA (« mismatch 9/10 »), des greffons issus du sang de cordon placentaire, ou des donneurs familiaux semi-HLA-identiques, dits « haplo-identiques » ou « haplo-mismatch » (fratrie, parents, enfants, voire cousins, oncles, etc.), avec lesquels des résultats très prometteurs ont été obtenus ces dernières années.
L’identité HLA entre le donneur et le receveur est primordiale pour une allogreffe de CSH, afin de d’éviter d’une part le rejet, d’une part (réaction HvG : host-vs-graft), et d’autre part une réaction sévère du greffon contre les cellules du receveur (réaction GvHD), d’autre part. Les molécules HLA sont impliquées dans la reconnaissance du soi et du non-soi à la surface des cellules immunitaires. Puisque tous ces gènes sont situés sur le chromosome 6 et sont transmis en bloc, deux membres d’une même fratrie auront 25 % de chances d’être HLA-identiques, c’est-à-dire d’avoir reçu les mêmes haplotypes HLA paternel et maternel. On parle alors de donneur « géno-identique ».
En l’absence de donneur géno-identique, on recherche dans les registres internationaux un donneur volontaire de CSH, autrement dit une personne non apparentée « phéno-identique » 10/10. En raison de la grande diversité allélique des gènes HLA, la probabilité que deux individus non apparentés expriment la même combinaison de molécules HLA est très faible. Cependant, le HLA est assez conservé dans les ethnies. La probabilité de trouver un donneur identique dans le fichier international dépend donc de la taille de ce registre et de la représentation ethnique des donneurs qui y sont inscrits.
Il y a actuellement 38 millions de donneurs volontaires inscrits dans les registres internationaux, dont 760 000 unités de sang placentaire (USP). À noter que le registre allemand comporte 9 300 000 donneurs, et 80 % des allogreffes non familiales en France sont réalisées à partir d’un donneur allemand. En France, le fichier comporte 320 000 donneurs et 38 000 USP (https://statistics.wmda.info/). Malgré cela, il reste environ 30 % de patients pour lesquels on n’identifie aucun donneur HLA-identique. Il est alors possible de faire appel à des donneurs alternatifs, c’est-à-dire ayant une ou plusieurs incompatibilités HLA. C’est le cas des donneurs non apparentés avec une incompatibilité HLA (« mismatch 9/10 »), des greffons issus du sang de cordon placentaire, ou des donneurs familiaux semi-HLA-identiques, dits « haplo-identiques » ou « haplo-mismatch » (fratrie, parents, enfants, voire cousins, oncles, etc.), avec lesquels des résultats très prometteurs ont été obtenus ces dernières années.
Trois sources de greffons de CSH
Les CSH peuvent être obtenues à partir de moelle osseuse, de sang périphérique ou de sang de cordon.
Le prélèvement de moelle osseuse s’effectue au bloc opératoire sous anesthésie générale. Le greffon est prélevé directement dans le bassin par ponctions dans les crêtes iliaques.
Le deuxième mode de recueil utilisé consiste à mobiliser les CSH de la moelle vers le sang périphérique par des administrations sous-cutanées de facteur de croissance granulocytaire (G-CSF) pendant quelques jours, avant de recueillir les CSH circulantes par cytaphérèse (processus proche des collectes de sang lors des dons de plaquettes) sur cathéter périphérique lors d’une à trois séances de quelques heures, en ambulatoire. Lors de la collecte des greffons autologues, cette méthode est privilégiée.
La troisième source alternative de CSH est le sang placentaire, prélevé à partir du cordon ombilical juste après l’accouchement, transporté vers une banque de sang placentaire, où il est analysé et congelé. Ces greffons de sang placentaire sont efficaces chez l’enfant mais beaucoup moins utilisés chez l’adulte.
Le prélèvement de moelle osseuse s’effectue au bloc opératoire sous anesthésie générale. Le greffon est prélevé directement dans le bassin par ponctions dans les crêtes iliaques.
Le deuxième mode de recueil utilisé consiste à mobiliser les CSH de la moelle vers le sang périphérique par des administrations sous-cutanées de facteur de croissance granulocytaire (G-CSF) pendant quelques jours, avant de recueillir les CSH circulantes par cytaphérèse (processus proche des collectes de sang lors des dons de plaquettes) sur cathéter périphérique lors d’une à trois séances de quelques heures, en ambulatoire. Lors de la collecte des greffons autologues, cette méthode est privilégiée.
La troisième source alternative de CSH est le sang placentaire, prélevé à partir du cordon ombilical juste après l’accouchement, transporté vers une banque de sang placentaire, où il est analysé et congelé. Ces greffons de sang placentaire sont efficaces chez l’enfant mais beaucoup moins utilisés chez l’adulte.
Complications de l’allogreffe
Du conditionnement
L’hospitalisation de l’allogreffé dure en moyenne cinq semaines. La première phase consiste en l’administration du conditionnement prégreffe, comprenant habituellement une chimiothérapie plus ou moins associée à une irradiation corporelle totale. Ce conditionnement joue, d’une part, un rôle antitumoral (myélotoxicité), en contribuant à éradiquer au maximum les cellules cancéreuses en cas d’hémopathie maligne ; et, d’autre part, un rôle immunosuppresseur (lymphotoxicité), facilitant la prise de greffe (prévention du rejet) et réduisant le risque de GvHD. Selon la pathologie, l’âge et les comorbidités du patient, il peut être plus ou moins lourd. Le greffon est ensuite réinjecté par voie veineuse.
Les complications précédant la sortie d’aplasie, définie par un taux de polynucléaires neutrophiles > 0,5 G/L, sont identiques à celles de l’autogreffe et liées à la toxicité du conditionnement et aux infections. Elles sont principalement muqueuses (mucite), digestives (diarrhées, vomissements), pulmonaires, hépatiques, cardiaques ou rénales, et doivent être anticipées en adaptant les traitements (choix de la chimiothérapie et doses) en fonction des comorbidités et de l’âge du patient.
Les complications précédant la sortie d’aplasie, définie par un taux de polynucléaires neutrophiles > 0,5 G/L, sont identiques à celles de l’autogreffe et liées à la toxicité du conditionnement et aux infections. Elles sont principalement muqueuses (mucite), digestives (diarrhées, vomissements), pulmonaires, hépatiques, cardiaques ou rénales, et doivent être anticipées en adaptant les traitements (choix de la chimiothérapie et doses) en fonction des comorbidités et de l’âge du patient.
Immunologiques
GvHD aiguë
Contrairement à l’autogreffe où les complications régressent avec la reconstitution hématologique, les problèmes « commencent » lorsque le système immunitaire du donneur allogénique se manifeste, classiquement vers la fin du premier mois de l’allogreffe (mais parfois plus tard).
Le rejet de greffe est exceptionnel (2 %) car le système immunitaire du receveur a été majoritairement éliminé par le conditionnement de greffe.
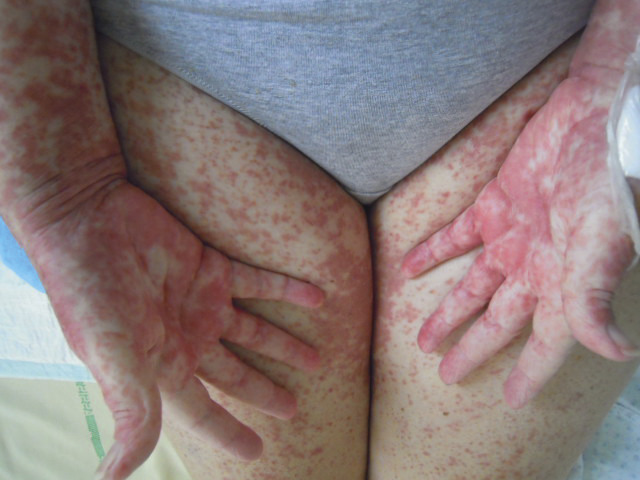
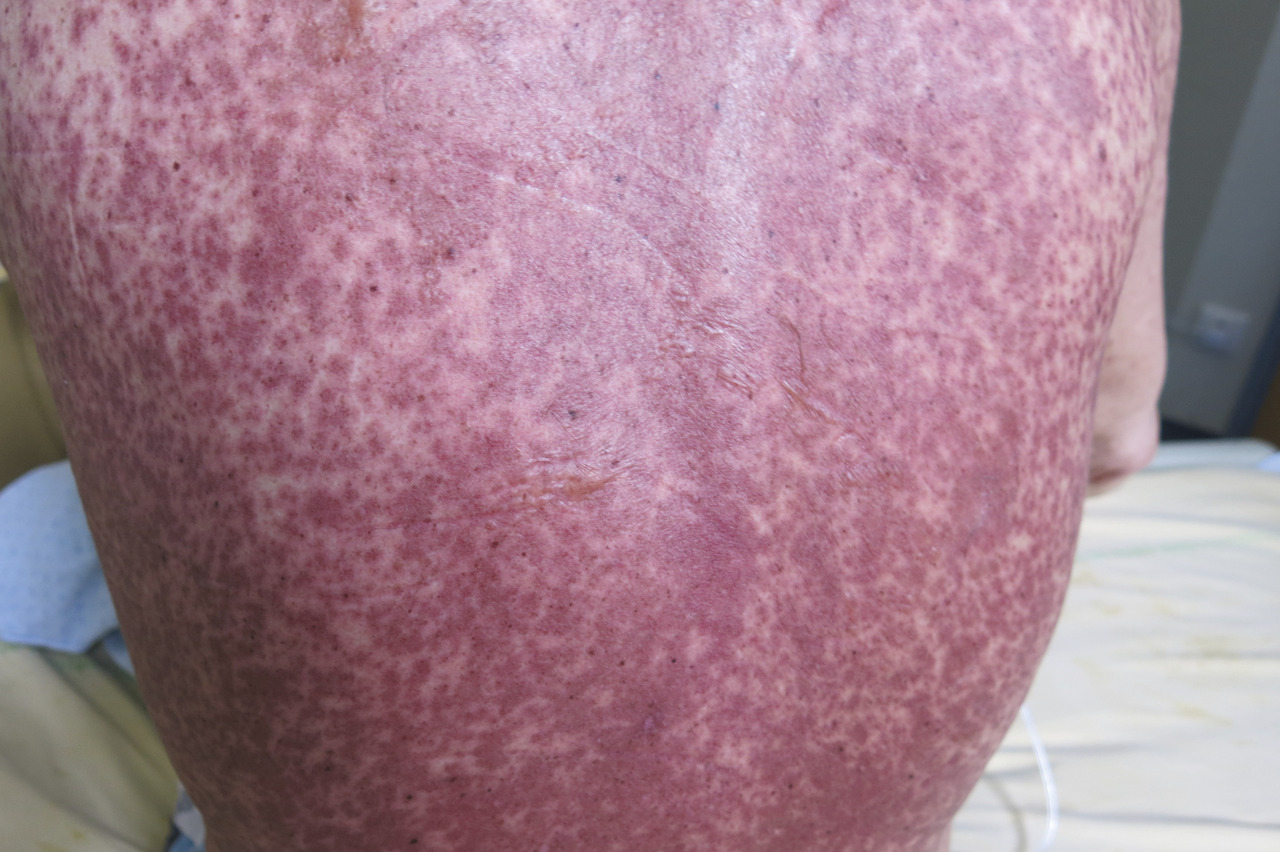
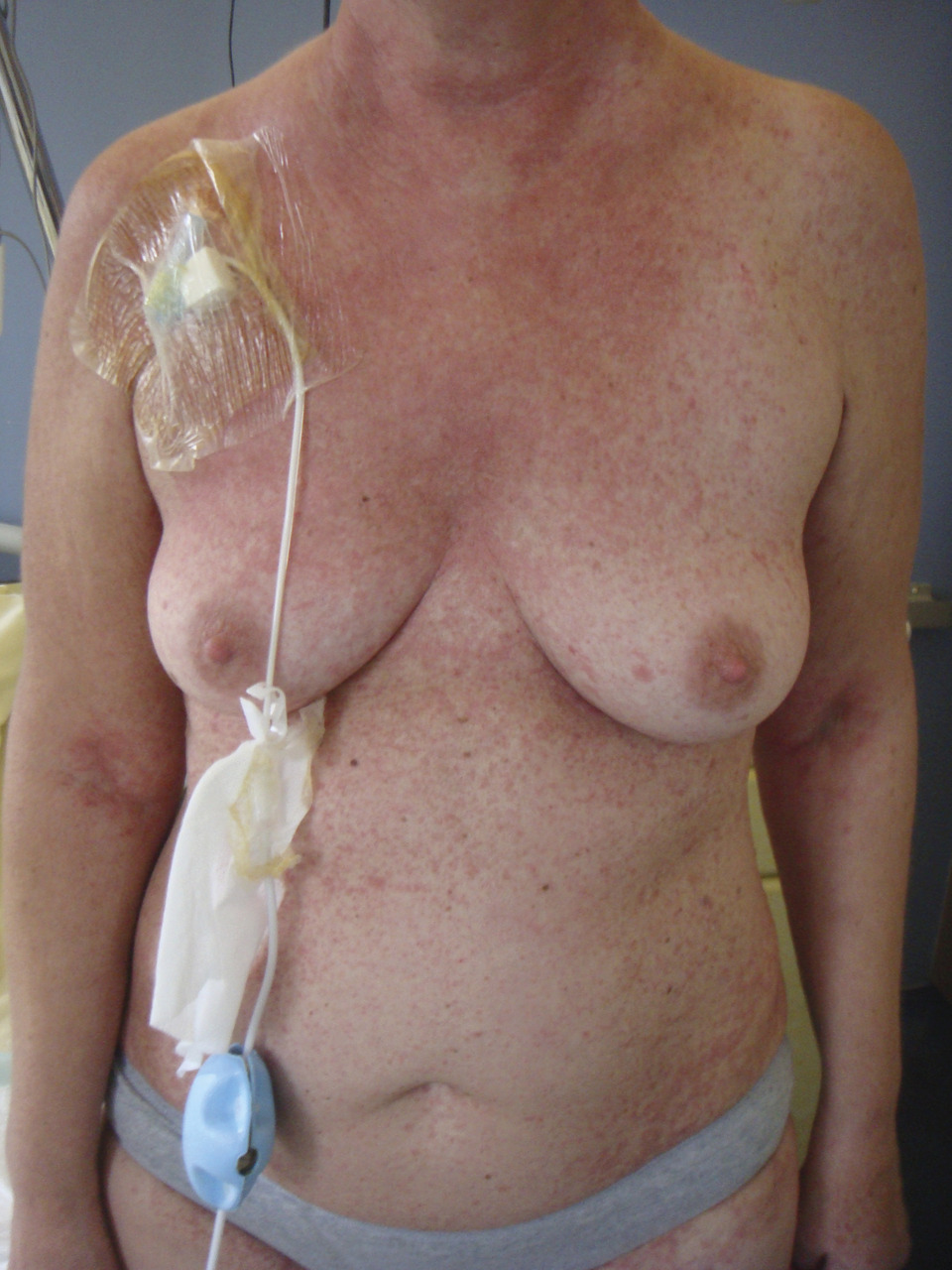
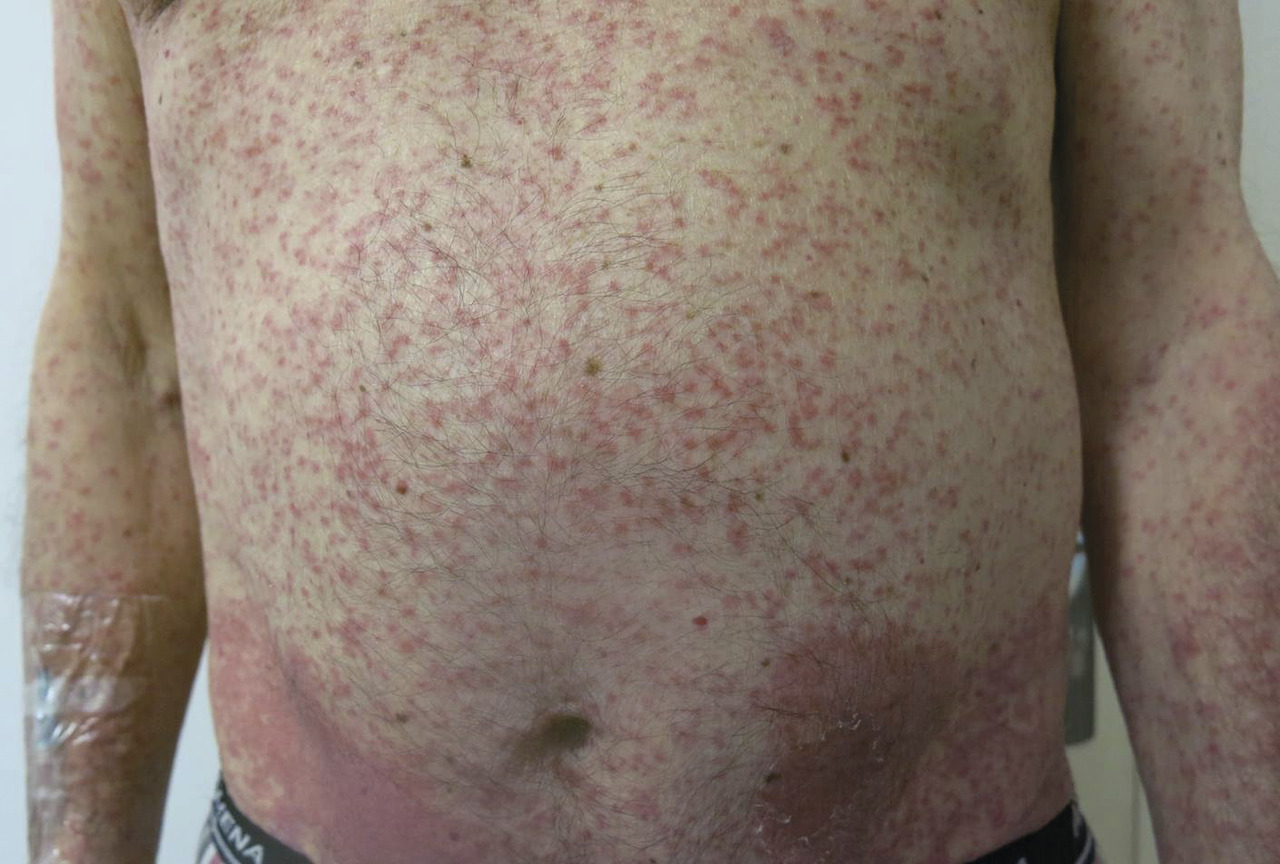
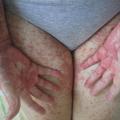
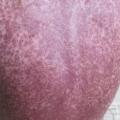
En revanche, la GvHD est la principale complication immunologique observée après une allogreffe. Elle résulte de l’activation des cellules immunocompétentes du donneur (lymphocytes T matures) par les cellules présentatrices d’antigènes, dans un environnement cytokinique propice. La GvH aiguë apparaît classiquement dans les 100 premiers jours et se manifeste par une inflammation de la peau (simple érythème maculo-papuleux localisé allant jusqu’au décollement bulleux Lyell-like [fig. 4 à 6 ]), du tube digestif (colite avec diarrhées liquides pouvant aboutir à un syndrome occlusif ou des rectorragies) et du foie (hépatite biologique).
Elle est stratifiée de grade I à IV selon l’étendue et l’intensité des lésions. Traitée par des corticoïdes à fortes doses par voie générale à partir du grade II, elle s’accompagne d’une morbi-mortalité importante en cas de corticorésistance et/ou de grade III-IV. Elle survient dans environ 30 % des greffes apparentées et 40-50 % des greffes non apparentées. Le traitement préventif comporte de la ciclosporine, parfois associée à d’autres immunosuppresseurs tels que le mycophénolate mofétil (Cellcept), le méthotrexate ou le sérum antilymphocytaire.
GvH chronique
Une GvHD peut survenir de façon plus retardée, classiquement à partir du 100e jour post-greffe mais jusqu’à plusieurs semaines ou mois après l’arrêt des immunosuppresseurs – on parle alors de GvH chronique.
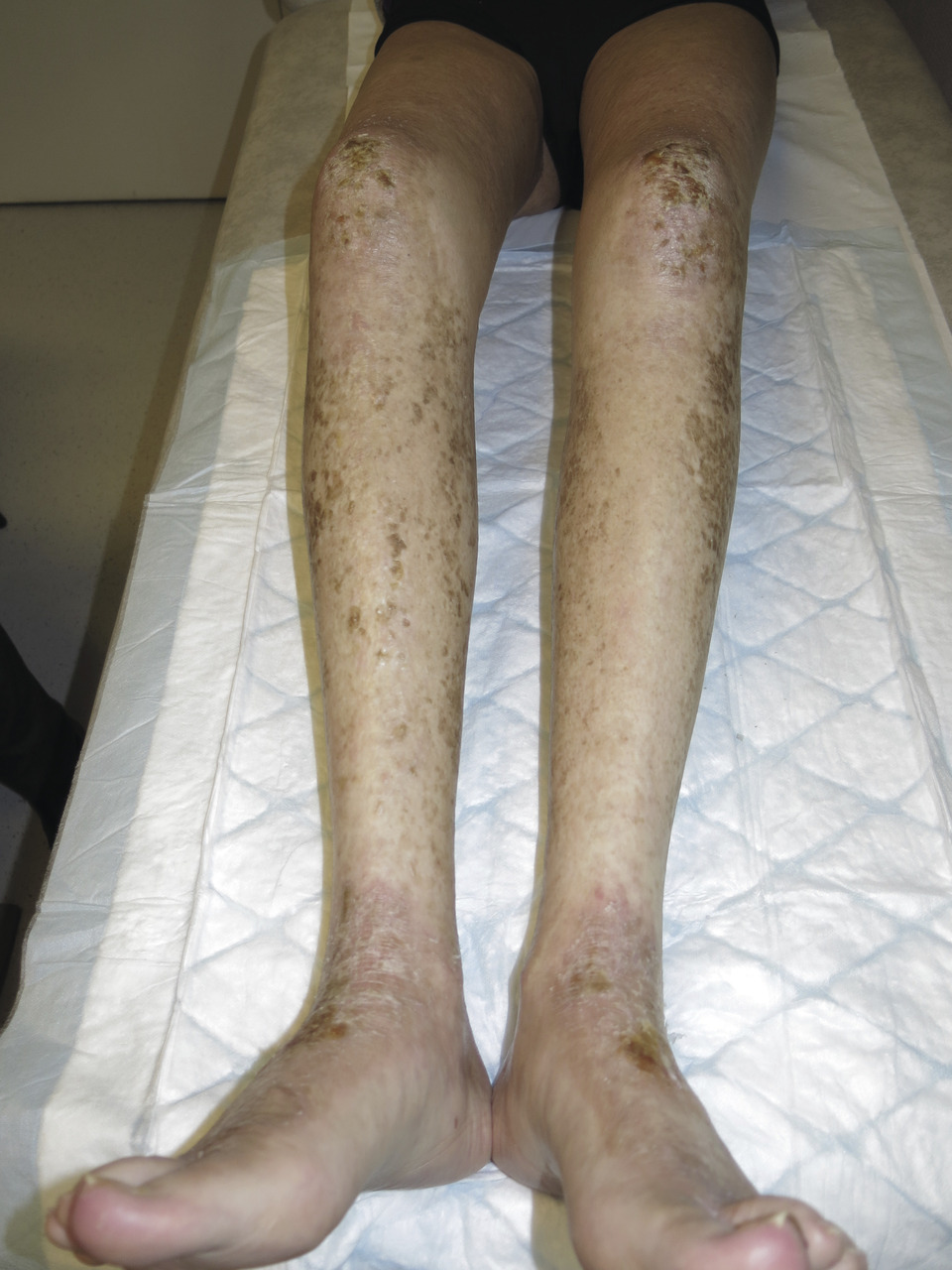
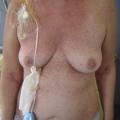
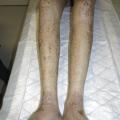
Ses manifestations s’apparentent davantage à des maladies auto-immunes avec des lésions sclérodermiformes (fig. 7 ), eczématiformes (fig. 8 ), le syndrome sec, le lichen, la bronchiolite oblitérante ou la myosite. Comme son nom l’indique, la GvHD chronique peut durer pendant des années, et est source de morbi-mortalité importante altérant considérablement la qualité de vie des patients allogreffés.
Sa physiopathologie est incomplètement élucidée mais semble résulter de la reconnaissance de certains antigènes du receveur par des cellules immunocompétentes issues du greffon selon des mécanismes allo-immuns impliquant les lymphocytes T alloréactifs, et d’une production d’allo-anticorps par des lymphocytes B.
La GvHD chronique s’accompagne le plus souvent d’un déficit immunitaire mixte, associant cytopénies auto-immunes (prédominant sur les lymphocytes CD4+) et hypogammaglobulinémie. Ces patients ont donc un risque infectieux important, exacerbé par les immunosuppresseurs utilisés – au premier rang desquels la corticothérapie. D’autres traitements peuvent être indiqués, tels qu’anticalcineurines, photothérapie extracorporelle, ruxolitinib (Jakavi), méthotrexate, rituximab (MabThera, Rixathon) ou ibrutinib (Imbruvica).
Un classement en légère, modérée ou sévère est retenu. La prise en charge de la GvHD chronique modérée à sévère est souvent pluridisciplinaire et implique un travail en réseau : greffeurs, pneumologues, dermatologues, ophtalmologues, hépatologues, gynécologues, internistes, rhumatologues, etc.
Elle est souvent associée à une diminution des rechutes de l’hémopathie maligne, donc souhaitable, mais à un degré n’impactant pas la qualité de vie des patients.
Contrairement à l’autogreffe où les complications régressent avec la reconstitution hématologique, les problèmes « commencent » lorsque le système immunitaire du donneur allogénique se manifeste, classiquement vers la fin du premier mois de l’allogreffe (mais parfois plus tard).
Le rejet de greffe est exceptionnel (2 %) car le système immunitaire du receveur a été majoritairement éliminé par le conditionnement de greffe.
En revanche, la GvHD est la principale complication immunologique observée après une allogreffe. Elle résulte de l’activation des cellules immunocompétentes du donneur (lymphocytes T matures) par les cellules présentatrices d’antigènes, dans un environnement cytokinique propice. La GvH aiguë apparaît classiquement dans les 100 premiers jours et se manifeste par une inflammation de la peau (simple érythème maculo-papuleux localisé allant jusqu’au décollement bulleux Lyell-like [
Elle est stratifiée de grade I à IV selon l’étendue et l’intensité des lésions. Traitée par des corticoïdes à fortes doses par voie générale à partir du grade II, elle s’accompagne d’une morbi-mortalité importante en cas de corticorésistance et/ou de grade III-IV. Elle survient dans environ 30 % des greffes apparentées et 40-50 % des greffes non apparentées. Le traitement préventif comporte de la ciclosporine, parfois associée à d’autres immunosuppresseurs tels que le mycophénolate mofétil (Cellcept), le méthotrexate ou le sérum antilymphocytaire.
GvH chronique
Une GvHD peut survenir de façon plus retardée, classiquement à partir du 100e jour post-greffe mais jusqu’à plusieurs semaines ou mois après l’arrêt des immunosuppresseurs – on parle alors de GvH chronique.
Ses manifestations s’apparentent davantage à des maladies auto-immunes avec des lésions sclérodermiformes (
Sa physiopathologie est incomplètement élucidée mais semble résulter de la reconnaissance de certains antigènes du receveur par des cellules immunocompétentes issues du greffon selon des mécanismes allo-immuns impliquant les lymphocytes T alloréactifs, et d’une production d’allo-anticorps par des lymphocytes B.
La GvHD chronique s’accompagne le plus souvent d’un déficit immunitaire mixte, associant cytopénies auto-immunes (prédominant sur les lymphocytes CD4+) et hypogammaglobulinémie. Ces patients ont donc un risque infectieux important, exacerbé par les immunosuppresseurs utilisés – au premier rang desquels la corticothérapie. D’autres traitements peuvent être indiqués, tels qu’anticalcineurines, photothérapie extracorporelle, ruxolitinib (Jakavi), méthotrexate, rituximab (MabThera, Rixathon) ou ibrutinib (Imbruvica).
Un classement en légère, modérée ou sévère est retenu. La prise en charge de la GvHD chronique modérée à sévère est souvent pluridisciplinaire et implique un travail en réseau : greffeurs, pneumologues, dermatologues, ophtalmologues, hépatologues, gynécologues, internistes, rhumatologues, etc.
Elle est souvent associée à une diminution des rechutes de l’hémopathie maligne, donc souhaitable, mais à un degré n’impactant pas la qualité de vie des patients.
Infectieuses
Précoces, elles débutent lors de la phase de neutropénie profonde suivant le conditionnement de la greffe. Cette période appelée « aplasie » dure entre 12 et 28 jours selon le type de conditionnement, de greffon et le donneur utilisé.
Elle expose le patient à un risque d’infection bactérienne, essentiellement à point de départ digestif ou urinaire (bacilles Gram négatif de type entérobactéries) ou cutané (cathéter central, principalement les staphylocoques). Une neutropénie prolongée expose également au risque d’infection fongique, notamment l’aspergillose, raison pour laquelle les patients sont greffés dans un secteur protégé, avec une pression d’air positive et/ou un air filtré.
Par ailleurs, la reconstitution de l’immunité spécifique lymphocytaire à partir des CSH du greffon est lente, jusqu’à 1 à 2 ans post-greffe, voire davantage si les immunosuppresseurs sont poursuivis. Par conséquent, pendant cette période, les patients encourent un risque d’infections opportunistes (pneumocystose, CMV…) et respiratoires (grippe, VRS, adénovirus…), surtout en cas de GvHD chronique et de corticothérapie systémique concomitante.
De même, la majorité des patients perdent leur immunité vaccinale, et acquièrent difficilement celle du donneur. La revaccination des patients est donc indispensable à partir du sixième mois post-greffe, lorsque les immunosuppresseurs sont arrêtés. Les vaccinations contre la diphtérie, le tétanos, la poliomyélite, la coqueluche, le pneumocoque, Haemophilus influenzae et la grippe saisonnière sont recommandées. Les vaccins vivants (BCG, antipoliomyélitique oral, fièvre jaune) sont contre-indiqués. Le vaccin contre la rougeole est un vaccin vivant atténué, mais il est possible de l’administrer sous certaines conditions (absence de traitement immunosuppresseur, absence de GvHD, etc.). Les patients cancéreux et transplantés sont considérés à risque de développer des formes graves de la COVID-19 et sont candidats à la vaccination à partir de vaccins non vivants (à ARNm ou peptidique).
Elle expose le patient à un risque d’infection bactérienne, essentiellement à point de départ digestif ou urinaire (bacilles Gram négatif de type entérobactéries) ou cutané (cathéter central, principalement les staphylocoques). Une neutropénie prolongée expose également au risque d’infection fongique, notamment l’aspergillose, raison pour laquelle les patients sont greffés dans un secteur protégé, avec une pression d’air positive et/ou un air filtré.
Par ailleurs, la reconstitution de l’immunité spécifique lymphocytaire à partir des CSH du greffon est lente, jusqu’à 1 à 2 ans post-greffe, voire davantage si les immunosuppresseurs sont poursuivis. Par conséquent, pendant cette période, les patients encourent un risque d’infections opportunistes (pneumocystose, CMV…) et respiratoires (grippe, VRS, adénovirus…), surtout en cas de GvHD chronique et de corticothérapie systémique concomitante.
De même, la majorité des patients perdent leur immunité vaccinale, et acquièrent difficilement celle du donneur. La revaccination des patients est donc indispensable à partir du sixième mois post-greffe, lorsque les immunosuppresseurs sont arrêtés. Les vaccinations contre la diphtérie, le tétanos, la poliomyélite, la coqueluche, le pneumocoque, Haemophilus influenzae et la grippe saisonnière sont recommandées. Les vaccins vivants (BCG, antipoliomyélitique oral, fièvre jaune) sont contre-indiqués. Le vaccin contre la rougeole est un vaccin vivant atténué, mais il est possible de l’administrer sous certaines conditions (absence de traitement immunosuppresseur, absence de GvHD, etc.). Les patients cancéreux et transplantés sont considérés à risque de développer des formes graves de la COVID-19 et sont candidats à la vaccination à partir de vaccins non vivants (à ARNm ou peptidique).
Tardives
Outre la GvHD chronique et les complications infectieuses associées, de nombreuses autres complications peuvent émailler l’évolution post-greffe.
En comparaison avec la population générale, ces patients ont une incidence plus élevée de complications cardiovasculaires. Le maintien d’un poids corporel normal et le respect de règles hygiéno-diététiques (diminution des graisses saturées, exercice physique régulier) est donc fondamental.
Ces patients sont aussi exposés à des troubles endocriniens, tels que l’hypothyroïdie (favorisée par l’irradiation corporelle totale), l’insuffisance gonadique (avec troubles de la fertilité et ménopause précoce) et l’ostéoporose, qui justifient un suivi spécifique. Les complications psychosociales ne doivent pas être négligées6.
Enfin, il existe à long terme un risque d’apparition de cancer secondaire, en raison des traitements administrés prégreffe et des immunosuppresseurs prolongés en post-greffe, requérant une attention particulière à chaque consultation. Pour ces raisons, les patients allogreffés sont généralement suivis à vie.
En comparaison avec la population générale, ces patients ont une incidence plus élevée de complications cardiovasculaires. Le maintien d’un poids corporel normal et le respect de règles hygiéno-diététiques (diminution des graisses saturées, exercice physique régulier) est donc fondamental.
Ces patients sont aussi exposés à des troubles endocriniens, tels que l’hypothyroïdie (favorisée par l’irradiation corporelle totale), l’insuffisance gonadique (avec troubles de la fertilité et ménopause précoce) et l’ostéoporose, qui justifient un suivi spécifique. Les complications psychosociales ne doivent pas être négligées6.
Enfin, il existe à long terme un risque d’apparition de cancer secondaire, en raison des traitements administrés prégreffe et des immunosuppresseurs prolongés en post-greffe, requérant une attention particulière à chaque consultation. Pour ces raisons, les patients allogreffés sont généralement suivis à vie.
Les résultats de l’allogreffe
Le succès dépend des complications toxiques (GvHD et infections essentiellement) et du risque de rechute. La rechute de l’hémopathie, essentiellement maligne, est la cause principale d’échec de l’allogreffe. Cette notion est difficile à expliquer aux patients, qui portent beaucoup d’espoir en la greffe et se considèrent guéris dès la réinjection du greffon.
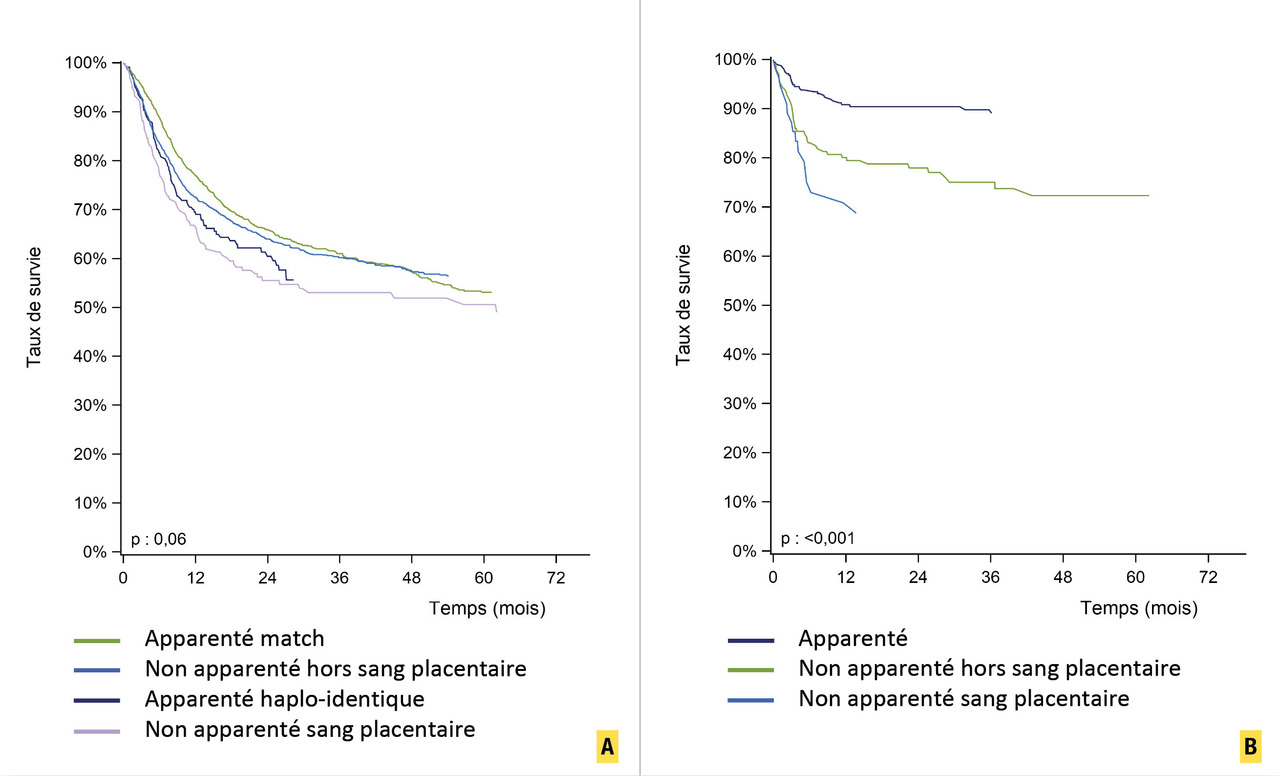
Malheureusement, l’alloréactivité du donneur est parfois insuffisante pour contrôler des maladies très agressives ou réfractaires à la chimiothérapie. Ainsi, les résultats sont très variables en fonction de la maladie causale (hémopathie maligne ou non maligne), l’âge du receveur, les comorbidités, le type de donneur, le statut de l’hémopathie à la greffe (maladie contrôlée ou évolutive), l’intensité du conditionnement, etc. (fig. 9 ).
Par exemple, un patient de 20 ans allogreffé dès le diagnostic pour une aplasie médullaire idiopathique avec son frère HLA-identique a une probabilité de guérison de plus de 90 %. À l’inverse, un patient de 70 ans allogreffé pour une leucémie aiguë myéloïde de mauvais pronostic et mal contrôlée à la greffe a une probabilité de guérison de son hémopathie inférieure à 30 %. On peut retenir en général que les chances de guérison d’une leucémie aiguë myéloïde en première rémission sont de l’ordre de 60 % après une allogreffe de CSH. Afin d’améliorer les résultats, des traitements visant à maintenir la rémission sont souvent entrepris en post-allogreffe (immunomodulation, traitements ciblés lorsque c’est possible, traitements hypométhylants, etc.).
On considère aujourd’hui que l’allogreffe est une plateforme :
– la prégreffe est essentielle et a pour but d’amener le patient au meilleur état général possible et à une maladie résiduelle la plus basse possible ;
– le moment autour de la greffe est crucial, car il faut limiter les complications précoces du conditionnement, des infections pendant la phase aplasique et de la GvHD aiguë ;
– la période post-greffe est un équilibre à obtenir entre l’immunosuppression, pour prévenir/traiter une GvHD aiguë ou chronique, et une immunomodulation ou des traitements post-greffe permettant d’activer le greffon et la GVL, et de maintenir la rémission de façon prolongée ;
– même si le patient est guéri de son hémopathie, il est nécessaire de le suivre à vie pour dépister les complications à long terme et évaluer le retentissement social, professionnel et affectif.
Malheureusement, l’alloréactivité du donneur est parfois insuffisante pour contrôler des maladies très agressives ou réfractaires à la chimiothérapie. Ainsi, les résultats sont très variables en fonction de la maladie causale (hémopathie maligne ou non maligne), l’âge du receveur, les comorbidités, le type de donneur, le statut de l’hémopathie à la greffe (maladie contrôlée ou évolutive), l’intensité du conditionnement, etc. (
Par exemple, un patient de 20 ans allogreffé dès le diagnostic pour une aplasie médullaire idiopathique avec son frère HLA-identique a une probabilité de guérison de plus de 90 %. À l’inverse, un patient de 70 ans allogreffé pour une leucémie aiguë myéloïde de mauvais pronostic et mal contrôlée à la greffe a une probabilité de guérison de son hémopathie inférieure à 30 %. On peut retenir en général que les chances de guérison d’une leucémie aiguë myéloïde en première rémission sont de l’ordre de 60 % après une allogreffe de CSH. Afin d’améliorer les résultats, des traitements visant à maintenir la rémission sont souvent entrepris en post-allogreffe (immunomodulation, traitements ciblés lorsque c’est possible, traitements hypométhylants, etc.).
On considère aujourd’hui que l’allogreffe est une plateforme :
– la prégreffe est essentielle et a pour but d’amener le patient au meilleur état général possible et à une maladie résiduelle la plus basse possible ;
– le moment autour de la greffe est crucial, car il faut limiter les complications précoces du conditionnement, des infections pendant la phase aplasique et de la GvHD aiguë ;
– la période post-greffe est un équilibre à obtenir entre l’immunosuppression, pour prévenir/traiter une GvHD aiguë ou chronique, et une immunomodulation ou des traitements post-greffe permettant d’activer le greffon et la GVL, et de maintenir la rémission de façon prolongée ;
– même si le patient est guéri de son hémopathie, il est nécessaire de le suivre à vie pour dépister les complications à long terme et évaluer le retentissement social, professionnel et affectif.
Pour plus d’informations sur la greffe :
consulter le site de la Société francophone de greffe de moelle et de thérapie cellulaire : https://www.sfgm-tc.com/
consulter le site de la Société francophone de greffe de moelle et de thérapie cellulaire : https://www.sfgm-tc.com/
Merci au Dr Stéphane Barete (Dermatologie et vénéréologie, groupe hospitalier La Pitié-Salpêtrière, Paris Cedex 13, France) pour les photos 4 à 8.
Références
1. Thomas ED, Lochte HL Jr, Lu WC, et al. Intravenous infusion of bone marrow in patients receiving radiation and chemotherapy. N Engl J Med 1957;257:491-6.
2. Mathé G, Amiel JL, Schwarzenberg L, et al. Haematopoietic Chimera in Man After Allogenic (Homologous) Bone-marrow Transplantation. Br Med J 1963 December 28;2(5373):1633-5. PMID 14066188.
3. Rapport médical et scientifique de l’Agence de la biomédecine 2019. https://rams.agence-biomedecine.fr/activite-nationale-de-greffe-de-csh-0
4. Singh AK, McGuirk JP. Allogeneic Stem Cell Transplantation: A Historical and Scientific Overview. Cancer Res 2016 Nov 15;76(22):6445-51. PMID: 27784742
5. Bair SM, Brandstadter JD, Ayers EC, et al. Hematopoietic stem cell transplantation for blood cancers in the era of precision medicine and immunotherapy. Cancer 2020 Jan 1; 126(9):1837-55. PMID: 32073653
6. Alsuliman T, Baylet C, Casabona A, et al. Vie sexuelle et affective après allogreffe de cellules souches hématopoïétiques : recommandations et livret patient de la SFGM-TC (Société francophone de greffe de moelle et de thérapie cellulaire). Bull Cancer 2020 Jul 31:S0007-4551(20)30297-6. PMID: 32747052
2. Mathé G, Amiel JL, Schwarzenberg L, et al. Haematopoietic Chimera in Man After Allogenic (Homologous) Bone-marrow Transplantation. Br Med J 1963 December 28;2(5373):1633-5. PMID 14066188.
3. Rapport médical et scientifique de l’Agence de la biomédecine 2019. https://rams.agence-biomedecine.fr/activite-nationale-de-greffe-de-csh-0
4. Singh AK, McGuirk JP. Allogeneic Stem Cell Transplantation: A Historical and Scientific Overview. Cancer Res 2016 Nov 15;76(22):6445-51. PMID: 27784742
5. Bair SM, Brandstadter JD, Ayers EC, et al. Hematopoietic stem cell transplantation for blood cancers in the era of precision medicine and immunotherapy. Cancer 2020 Jan 1; 126(9):1837-55. PMID: 32073653
6. Alsuliman T, Baylet C, Casabona A, et al. Vie sexuelle et affective après allogreffe de cellules souches hématopoïétiques : recommandations et livret patient de la SFGM-TC (Société francophone de greffe de moelle et de thérapie cellulaire). Bull Cancer 2020 Jul 31:S0007-4551(20)30297-6. PMID: 32747052