L’alopécie androgénique masculine (AAGM), ou calvitie, est la cause la plus fréquente de perte de cheveux chez les hommes. Elle varie selon les individus mais touche particulièrement la région temporale et le vertex s’étendant vers la région occipitale. La prévalence et l’incidence sont fonction de l’âge et de l’origine ethnique. Ainsi 30 % des hommes caucasiens de plus de 30 ans seraient concernés, ce taux augmentant au fur et à mesure du vieillissement : 50 % à 50 ans et jusqu’à 80 % après 70 ans !1
Pathogénie²
La physiopathologie, complexe, fait intervenir une hypersensibilité aux androgènes médiée par une prédisposition génétique. Le risque d’AAGM est plus élevé chez les sujets dont les parents ou les grands-parents en sont affectés. Les androgènes sont de puissants régulateurs du cycle pilaire. Leur influence s’exerce via une expression génique différente selon les zones du corps. Ainsi ils favorisent la pousse des poils dans les zones androgénodépendantes (axillaires, pubiennes, barbe) mais entraînent paradoxalement au niveau capillaire une miniaturisation, un arrêt de la croissance et un raccourcissement de la phase anagène des cheveux chez les hommes prédisposés.
L’action de ces hormones dépend aussi de leur biodisponibilité locale. Chez les sujets atteints d’AAGM, le taux des androgènes circulants est normal mais demeure élevé au niveau de la peau. Au sein du tissu cutané, la testostérone est convertie en dihydrotestostérone (DHT) par l’intermédiaire de la 5α-réductase.3 Cette DHT a une affinité supérieure à celle de la testostérone pour le récepteur aux androgènes (RA) et forme avec ce dernier un complexe plus stable. Les RA sont présents au sein du derme papillaire des glandes sébacées et sudorales et des unités pilo-sébacées. L’action hormonale est fonction de la capacité plus ou moins élevée de ces RA à capter ces androgènes. Chez les patients atteints d’AAGM, ces récepteurs plus « voraces » induisent une action hormonale plus importante. Cette hypersensibilité des récepteurs est sous influence génétique – probablement polygénique –, pas de gène(s) précis identifié(s).
L’action de ces hormones dépend aussi de leur biodisponibilité locale. Chez les sujets atteints d’AAGM, le taux des androgènes circulants est normal mais demeure élevé au niveau de la peau. Au sein du tissu cutané, la testostérone est convertie en dihydrotestostérone (DHT) par l’intermédiaire de la 5α-réductase.3 Cette DHT a une affinité supérieure à celle de la testostérone pour le récepteur aux androgènes (RA) et forme avec ce dernier un complexe plus stable. Les RA sont présents au sein du derme papillaire des glandes sébacées et sudorales et des unités pilo-sébacées. L’action hormonale est fonction de la capacité plus ou moins élevée de ces RA à capter ces androgènes. Chez les patients atteints d’AAGM, ces récepteurs plus « voraces » induisent une action hormonale plus importante. Cette hypersensibilité des récepteurs est sous influence génétique – probablement polygénique –, pas de gène(s) précis identifié(s).
Diagnostic : clinique⁴
L’interrogatoire recherche des antécédents de calvitie du côté des hommes du 1er et 2e degré.
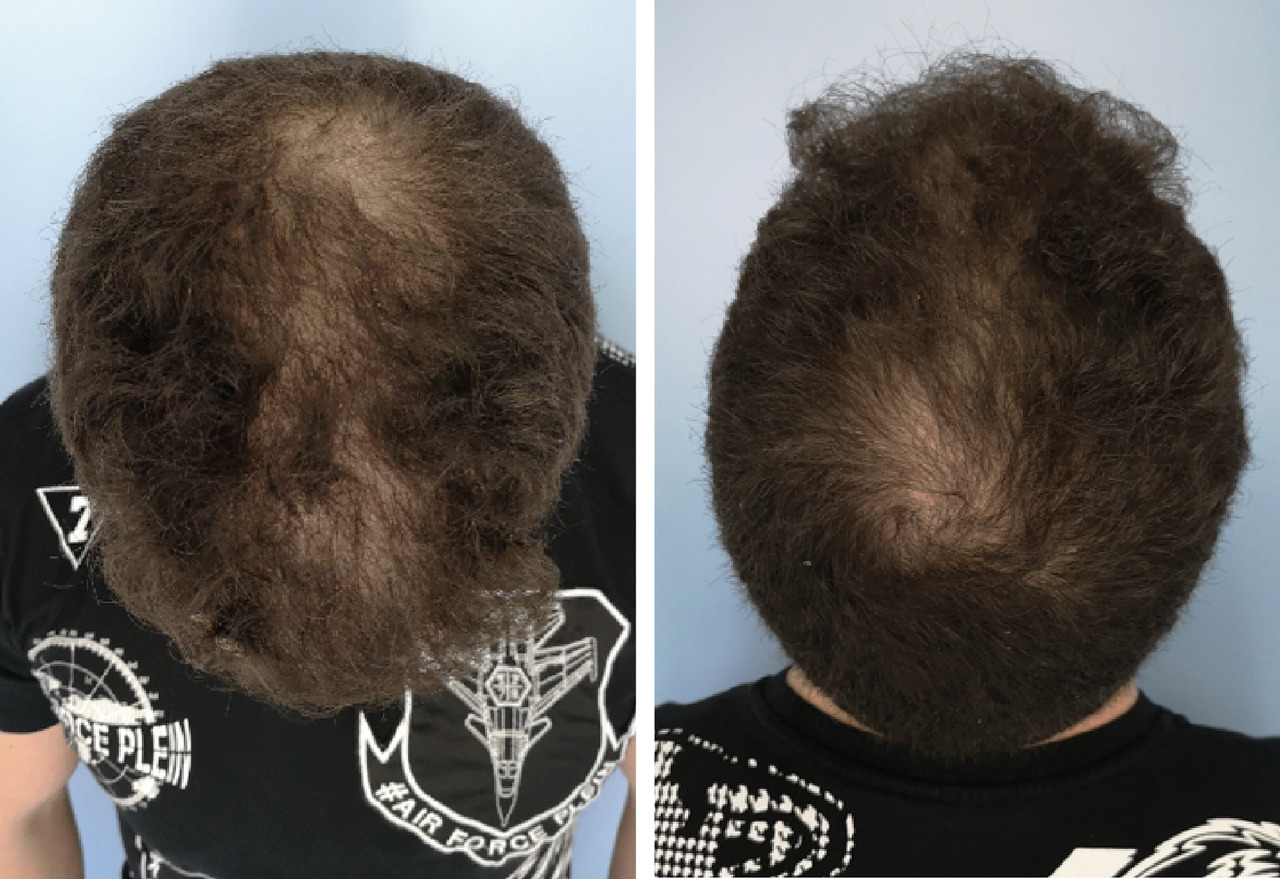
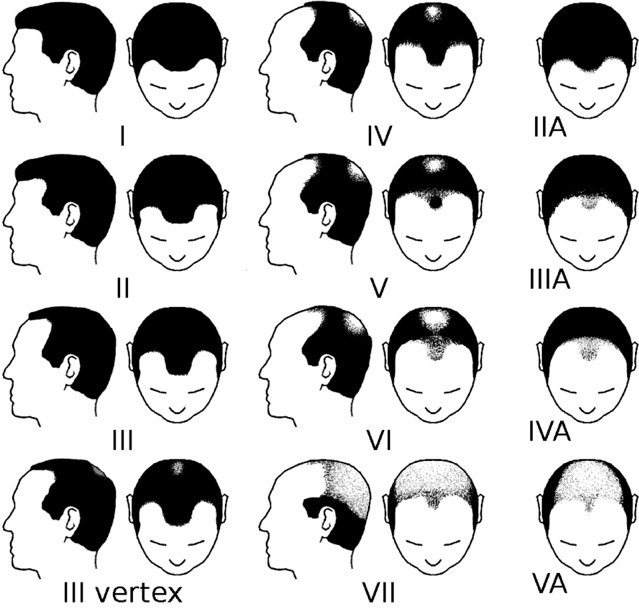
L’alopécie se manifeste par un dégarnissement progressif et symétrique du cuir chevelu, associé à une miniaturisation des tiges pilaires (fig. 1 ). À l’examen clinique et dermoscopique, on observe des cheveux intermédiaires, des duvets sur les zones concernées ainsi que d’autres de plus gros calibre (fig. 2 ). L’atteinte peut être classée selon les schémas de Norwood-Hamilton (fig. 3 ). Le recul des golfes frontaux, la tonsure et la couronne de cheveux sus-auriculaire et occipitale sont les manifestations les plus fréquentes. Chez certains hommes, l’AAGM peut être plus diffuse et se rapproche alors des manifestations féminines (fig. 1 ). Au début, le patient consulte pour une chute de cheveux jugée anormale mais sans dégarnissement net. Il faut rechercher les antécédents, réaliser un examen dermoscopique, voire un trichogramme. En cas de doute, revoir le patient 6 mois plus tard.
L’alopécie se manifeste par un dégarnissement progressif et symétrique du cuir chevelu, associé à une miniaturisation des tiges pilaires (
Examens complémentaires
Aucun examen biologique n’est nécessaire au diagnostic.
La dermoscopie est une aide précieuse. On observe entre autres une diminution de la densité folliculaire au vertex, une franche anisotrichie (cheveux de calibre hétérogène) et des unités folliculaires à cheveu unique. Souvent, examen clinique et dermoscopie font le diagnostic.
Le trichogramme, indiqué dans les cas douteux, requiert un équipement spécifique. Il consiste à prélever une trentaine de cheveux sur la zone frontale, au vertex et sur la zone occipitale. On observe les bulbes étalés sur une lame de verre avec un lecteur de microfiches (ou microscope optique).
Dans l’AAG, le rapport A/T (anagènes/télogène) est diminué. Les cheveux ont des diamètres de taille hétérogène, les plus fins atteignant au moins 20 % du total.
La dermoscopie est une aide précieuse. On observe entre autres une diminution de la densité folliculaire au vertex, une franche anisotrichie (cheveux de calibre hétérogène) et des unités folliculaires à cheveu unique. Souvent, examen clinique et dermoscopie font le diagnostic.
Le trichogramme, indiqué dans les cas douteux, requiert un équipement spécifique. Il consiste à prélever une trentaine de cheveux sur la zone frontale, au vertex et sur la zone occipitale. On observe les bulbes étalés sur une lame de verre avec un lecteur de microfiches (ou microscope optique).
Dans l’AAG, le rapport A/T (anagènes/télogène) est diminué. Les cheveux ont des diamètres de taille hétérogène, les plus fins atteignant au moins 20 % du total.
Traitement⁵
Objectif : prévenir la chute et de ralentir le processus de miniaturisation. Seuls 2 médicaments sont approuvés.
Le minoxidil, traitement suspensif, est à prendre au long cours. Appliqué en lotion ou en mousse à la dose de 5 %, 2 fois par jour, il ralentit la chute et redonne du calibre aux cheveux. L’application se fait sur cuir chevelu sec sans rinçage. Principaux effets secondaires : irritation du scalp et pellicules. On évalue son efficacité à 6 mois. Il faut prévenir (et rassurer) de la survenue attendue d’un effluvium au cours des 3 premiers mois, ce qui est un marqueur de bonne réponse.
Inhibiteur de la 5α-réductase, le finastéride à raison de 1 mg (un comprimé) par jour fait diminuer d’environ 65 % le taux de DHT dans le sang, la prostate et le cuir chevelu. L’efficacité commence à se manifester à 6, voire à 12 mois selon les patients. Il stabilise la progression de l’AAGM et entraîne une repousse dans un tiers des cas. Le bénéfice ne persiste que tant que dure le traitement. Les effets indésirables possibles sont d’ordre sexuel : baisse de la libido, trouble de l’érection et diminution du volume de l’éjaculat. Ils sont réversibles à l’arrêt. On décrit également des cas de gynécomastie (risque multiplié par 3 sans augmentation du risque de cancer du sein) et plus récemment des troubles de l’humeur.
Ces aspects doivent être pris en compte lors de la prescription, et le patient doit en être averti.
Le dutastéride est un nouvel inhibiteur de la 5α-réductase approuvé pour le traitement de l’hypertrophie bénigne de la prostate. Il est 100 fois plus puissant que le finastéride et, à la dose de 0,5 mg, réduit de 90 % le taux de DHT circulante. Plusieurs études ont montré son efficacité versus placebo et versus finastéride dans le traitement de l’AAGM : jusqu’à 81 % des patients ont eu une repousse photographiquement visible à 6 mois, et 85 % à 12 mois.6 Il n’a d’AMM ni en France ni aux États-Unis. À noter que les effets secondaires d’ordre sexuel sont plus fréquents et durables qu’avec le finastéride.
Syndrome post-finastéride (SPF). En 2017, l’Ansm a mis en garde contre la possibilité de dépression ou d’idées suicidaires chez les hommes sous finastéride pour une AAGM ou une HBP. Tout changement d’humeur doit conduire à l’interrompre et à une surveillance rapprochée. Le SPF consiste en la persistance d’effets secondaires sexuels, d’asthénie, de perte de poids, de troubles cognitifs, de syndrome dépressif, d’attaque de panique, d’insomnies, de douleurs musculaires, d’idées suicidaires ou de sensation de diminution du volume du pénis. Il est actuellement discuté mais les données sont peu convaincantes quant à sa réelle existence. Une étude épidémiologique anglaise chez 77 732 patients et 11 333 contrôles n’a pas mis en évidence de surrisque de dépression traitée chez les hommes recevant un inhibiteur de la 5α-réductase pour une HBP versus ceux traités par α-bloquant [OR : 0,94 ; IC à 95% : 0,85-1,04].7 D’autres sont en cours, mais il convient de rester vigilant et de prévenir les patients de ces possibles effets secondaires actuellement insuffisamment documentés.
Les autres traitements de l’alopécie androgénétique féminine peuvent également être proposés : chirurgie dans les cas sévères (microgreffes capillaires par bandelettes ou par extraction d’unités folliculaires) en association au traitement médicamenteux si l’AAGM est stabilisée. Les compléments alimentaires utiles ponctuellement pour lutter contre un effluvium télogène n’ont pas prouvé d’efficacité sur l’évolution de l’AAGM. Maquillage (HairMaker, Hair Fiber, etc.) et prothèses capillaires dans les cas les plus sévères.
Le minoxidil, traitement suspensif, est à prendre au long cours. Appliqué en lotion ou en mousse à la dose de 5 %, 2 fois par jour, il ralentit la chute et redonne du calibre aux cheveux. L’application se fait sur cuir chevelu sec sans rinçage. Principaux effets secondaires : irritation du scalp et pellicules. On évalue son efficacité à 6 mois. Il faut prévenir (et rassurer) de la survenue attendue d’un effluvium au cours des 3 premiers mois, ce qui est un marqueur de bonne réponse.
Inhibiteur de la 5α-réductase, le finastéride à raison de 1 mg (un comprimé) par jour fait diminuer d’environ 65 % le taux de DHT dans le sang, la prostate et le cuir chevelu. L’efficacité commence à se manifester à 6, voire à 12 mois selon les patients. Il stabilise la progression de l’AAGM et entraîne une repousse dans un tiers des cas. Le bénéfice ne persiste que tant que dure le traitement. Les effets indésirables possibles sont d’ordre sexuel : baisse de la libido, trouble de l’érection et diminution du volume de l’éjaculat. Ils sont réversibles à l’arrêt. On décrit également des cas de gynécomastie (risque multiplié par 3 sans augmentation du risque de cancer du sein) et plus récemment des troubles de l’humeur.
Ces aspects doivent être pris en compte lors de la prescription, et le patient doit en être averti.
Le dutastéride est un nouvel inhibiteur de la 5α-réductase approuvé pour le traitement de l’hypertrophie bénigne de la prostate. Il est 100 fois plus puissant que le finastéride et, à la dose de 0,5 mg, réduit de 90 % le taux de DHT circulante. Plusieurs études ont montré son efficacité versus placebo et versus finastéride dans le traitement de l’AAGM : jusqu’à 81 % des patients ont eu une repousse photographiquement visible à 6 mois, et 85 % à 12 mois.6 Il n’a d’AMM ni en France ni aux États-Unis. À noter que les effets secondaires d’ordre sexuel sont plus fréquents et durables qu’avec le finastéride.
Syndrome post-finastéride (SPF). En 2017, l’Ansm a mis en garde contre la possibilité de dépression ou d’idées suicidaires chez les hommes sous finastéride pour une AAGM ou une HBP. Tout changement d’humeur doit conduire à l’interrompre et à une surveillance rapprochée. Le SPF consiste en la persistance d’effets secondaires sexuels, d’asthénie, de perte de poids, de troubles cognitifs, de syndrome dépressif, d’attaque de panique, d’insomnies, de douleurs musculaires, d’idées suicidaires ou de sensation de diminution du volume du pénis. Il est actuellement discuté mais les données sont peu convaincantes quant à sa réelle existence. Une étude épidémiologique anglaise chez 77 732 patients et 11 333 contrôles n’a pas mis en évidence de surrisque de dépression traitée chez les hommes recevant un inhibiteur de la 5α-réductase pour une HBP versus ceux traités par α-bloquant [OR : 0,94 ; IC à 95% : 0,85-1,04].7 D’autres sont en cours, mais il convient de rester vigilant et de prévenir les patients de ces possibles effets secondaires actuellement insuffisamment documentés.
Les autres traitements de l’alopécie androgénétique féminine peuvent également être proposés : chirurgie dans les cas sévères (microgreffes capillaires par bandelettes ou par extraction d’unités folliculaires) en association au traitement médicamenteux si l’AAGM est stabilisée. Les compléments alimentaires utiles ponctuellement pour lutter contre un effluvium télogène n’ont pas prouvé d’efficacité sur l’évolution de l’AAGM. Maquillage (HairMaker, Hair Fiber, etc.) et prothèses capillaires dans les cas les plus sévères.
Références
1. Severi G, Sinclair R, Hopper JL, et al. Androgenetic alopecia in men aged 40-69 years: prevalence and risk factors. Br J Dermatol 2003;149:1207-13.
2. Lolli F, Pallotti F, Rossi A, et al. Androgenetic alopecia: a review. Endocrine 2017;57:9-17.
3. Poor V, Juricskay S, Telegdy E. Urinary steroids in men with male-pattern alopecia. J Biochem Biophys Methods 2002;53:123-30.
4. Blume-Peytavi U, Blumeyer A, Tosti A, et al. S1 guideline for diagnostic evaluation in androgenetic alopecia in men, women and adolescents. Br J Dermatol 2011;164:5-15.
5. Kanti V, Messenger A, Dobos G, et al. Evidence-based (S3) guideline for the treatment of androgenetic alo- pecia in women and in men - short version. J Eur Acad Dermatol Venereol 2018;32:11-22.
6. Lee S, Lee YB, Choe SJ, Lee WS. Adverse Sexual Effects of Treatment with Finasteride or Dutasteride for Male Androgenetic Alopecia: A Systematic Review and Meta-analysis. Acta Derm Venereol 2019;99:12-7.
7. Hagberg KW, Divan HA, Nickel JC, Jick SS. Risk of Incident Antidepressant-Treated Depression Associated with Use of 5alpha-Reductase Inhibitors Compared with Use of alpha-Blockers in Men with Benign Prostatic Hyperplasia: A Population-Based Study Using the Clinical Practice Research Datalink. Pharmacotherapy 2017;37:517-27.
2. Lolli F, Pallotti F, Rossi A, et al. Androgenetic alopecia: a review. Endocrine 2017;57:9-17.
3. Poor V, Juricskay S, Telegdy E. Urinary steroids in men with male-pattern alopecia. J Biochem Biophys Methods 2002;53:123-30.
4. Blume-Peytavi U, Blumeyer A, Tosti A, et al. S1 guideline for diagnostic evaluation in androgenetic alopecia in men, women and adolescents. Br J Dermatol 2011;164:5-15.
5. Kanti V, Messenger A, Dobos G, et al. Evidence-based (S3) guideline for the treatment of androgenetic alo- pecia in women and in men - short version. J Eur Acad Dermatol Venereol 2018;32:11-22.
6. Lee S, Lee YB, Choe SJ, Lee WS. Adverse Sexual Effects of Treatment with Finasteride or Dutasteride for Male Androgenetic Alopecia: A Systematic Review and Meta-analysis. Acta Derm Venereol 2019;99:12-7.
7. Hagberg KW, Divan HA, Nickel JC, Jick SS. Risk of Incident Antidepressant-Treated Depression Associated with Use of 5alpha-Reductase Inhibitors Compared with Use of alpha-Blockers in Men with Benign Prostatic Hyperplasia: A Population-Based Study Using the Clinical Practice Research Datalink. Pharmacotherapy 2017;37:517-27.