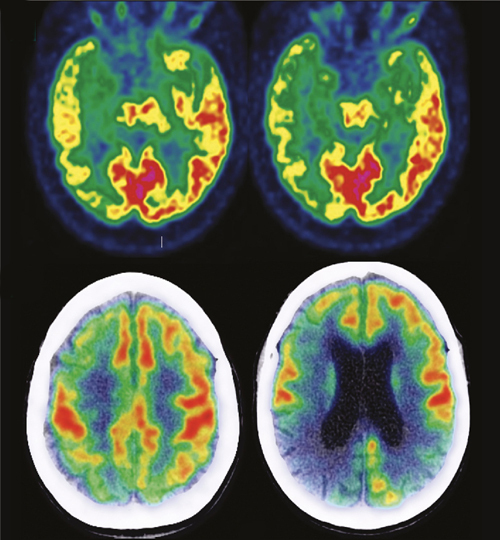
Qu’est-ce que l’aducanumab et quelle est son indication ?
Il s’agit d’un anticorps monoclonal ciblant les plaques amyloïdes cérébrales* développé par le laboratoire Biogen. Son effet sur la charge cérébrale de ces lésions a été montré (en utilisant des techniques telles que la tomographie par émission de positons) par les dernières études de phase III, mais son bénéfice clinique reste controversé.
L’autorisation accordée par la FDA ouvre l’accès à ce médicament aux patients aux États-Unis en dehors des essais cliniques. Ce traitement ne pourra être administré qu’aux stades très débutants de la maladie d’Alzheimer et ne concernera qu’une minorité des patients chez qui cette pathologie a été diagnostiquée.
Cependant, il pourrait, à moyen terme, si les bénéfices attendus se confirment dans ce groupe de patients, être évalué à des stades encore plus précoces de la maladie (par exemple, pour des patients ayant une plainte cognitive isolée).
Sur quoi repose la controverse – et l’importance – de cette autorisation ?
Cette autorisation a été accordée contre l’avis négatif d’un comité d’experts indépendants, rendu quelque mois plus tôt, via une procédure accélérée qui permet aux patients souffrant d’une maladie grave sans option thérapeutique d’accéder plus rapidement à des médicaments, alors qu’une incertitude persiste quant à leur bénéfice. Un effet significatif de l’aducanumab sur le déclin cognitif a été montré par les analyses secondaires d’un essai, uniquement dans le sous-groupe recevant la plus forte des deux doses par rapport au groupe recevant un placebo ; le médicament n’a par ailleurs pas montré d’effet bénéfique à quelque dose que ce soit dans un second essai. Aussi, la pérennisation de cette décision est-elle soumise aux résultats d’essais cliniques de phase IV, qui doivent être menés par le laboratoire pour confirmer le bénéfice clinique.
Mais cette autorisation fait doublement date : elle est la première pour un médicament dans cette pathologie depuis 2003. Et, surtout, c’est la première accordée à un médicament agissant sur les lésions à l’origine de la maladie d’Alzheimer – donc susceptible d’agir sur son évolution. Elle fera incontestablement progresser les connaissances sur les bénéfices et les conditions d’administration, mais aussi sur les risques associés à ce type de traitement – l’immunothérapie passive – qui a fait l’objet de multiples expérimentations au cours de la dernière décennie, suscitant attentes et souvent déceptions.
Et en France, sera-t-il disponible ?
Cela dépend de la décision des instances françaises et européennes. Cependant, l’avancée des connaissances sur ce traitement, secondaire à cette autorisation, lui ouvrira peut-être un jour les portes de l’Europe et de la France si, comme nous l’espérons, les bénéfices se confirment !
À cet égard, soulignons les implications économiques de cette telle décision : aux États-Unis, ces traitements sont financés par les assurances médicales privées et sont donc principalement accessibles aux patients ayant les moyens financiers d’y souscrire. Et leur coût est conséquent : l’aducanumab sera commercialisé au prix de 56 000 dollars par an (le cours de l’action de Biogen a d’ailleurs augmenté de 40 % après l’annonce de la FDA). En France, où le système de santé est majoritairement financé par la collectivité et les traitements sont accessibles à tous, les enjeux économiques sont différents…
Par ailleurs, rappelons aussi la polémique suscitée par le déremboursement en France en 2018 des traitements symptomatiques de la maladie d’Alzheimer, les seuls ayant fait à ce jour la preuve d’un bénéfice, si modeste soit-il, sur le déclin cognitif (ce qui n’est pas, à ce jour, le cas de l’aducanumab). Or dans les essais cliniques, l’aducanumab était très souvent administré à des patients recevant déjà l’un de ces traitements. Nous espérons donc que cette actualité sera l’occasion de reconsidérer cette question importante afin que ces médicaments, toujours largement prescrits dans les consultations mémoire, ne soient plus à la charge des patients – un comble pour une telle pathologie.
*Les connaissances sur la maladie d’Alzheimer, qui ont largement progressé ces 5 dernières années, suggèrent que sa physiopathologie pourrait commencer par une accumulation anormale de peptide amyloïde suivie d’une agrégation anormale de protéine tau, ou de tau anormalement phosphorylée (d’autres facteurs pourraient intervenir comme facteurs d’aggravation ou de protection, tels que la neuro-inflammation et l’activation des cellules microgliales, les facteurs vasculaires que sont les micro-lacunes, les micro-saignements et les anomalies de la barrière hémato-encéphalique ou enfin la réserve cognitive).
Laura Martin Agudelo, La Revue du Praticien
À lire aussi :
Hugon J et Ménard J. Dossier. Maladie d’Alzheimer : aspects précliniques et précoces.Rev Prat 2020;70(2);147-77.
Benisty S. Déremboursement des traitements symptomatiques de la maladie d’Alzheimer : renouons le dialogue.Rev Prat Med Gen 2018;32(1009);729-30.