L’aménorrhée est définie par l’absence de règles. Elle est dite primaire en l’absence de tout antécédent de saignement. Chez l’adolescente, un bilan est nécessaire à partir de l’âge de 13 ans en l’absence de développement mammaire, ou après l’âge de 15 ans en cas de développement mammaire. En effet, le délai moyen entre l’augmentation de volume des seins et l’apparition des règles est le plus souvent inférieur à trois ans. L’aménorrhée est dite secondaire en l’absence de saignements pendant au moins trois mois chez une femme préalablement réglée.
La prévalence de l’aménorrhée est de 3 à 4 % chez les femmes en âge de procréer.
La première étape est de rechercher la cause de l’aménorrhée avant même de débuter un traitement. Il n’est pas souhaitable de débuter un traitement estroprogestatif d’emblée en cas d’aménorrhée. En effet, un saignement de privation survient obligatoirement après la prise d’estroprogestatif, sauf en cas de grossesse, d’anomalie utérine ou d’absence totale d’utérus. L’exploration d’une aménorrhée permet, dans la très grande majorité des cas, d’en identifier la cause.
Caractériser l’aménorrhée
La distinction peut se faire entre aménorrhée primaire ou secondaire, mais surtout selon les origines. Les principales causes d’aménorrhée sont hypothalamo-hypophysaires, ovariennes ou utérines. Les quatre diagnostics les plus fréquents sont le syndrome des ovaires polykystiques (SOPK), l’aménorrhée hypothalamique fonctionnelle, l’hyperprolactinémie et l’insuffisance ovarienne prématurée.
Aménorrhée primaire
En cas d’aménorrhée primaire, l’interrogatoire recherche un autre cas de retard pubertaire, d’aménorrhée ou d’infertilité au sein de la famille. L’âge d’apparition de la glande mammaire chez la patiente est à préciser.
Aménorrhée secondaire
Devant une aménorrhée secondaire, la grossesse est toujours à éliminer. La notion d’un rapport potentiellement fécondant est à rechercher.
L’interrogatoire évalue la régularité ou non des cycles depuis l’adolescence, la prise de certains médicaments (neuroleptiques, antidépresseurs, corticothérapie, progestatifs), des troubles du comportement alimentaire avec, en particulier, une sélection alimentaire et une diminution de la prise de lipides au profit des glucides. Le nombre d’heures d’activité physique par semaine doit être questionné, à la recherche d’une activité physique intense, en particulier lors de pratique de sports nécessitant un contrôle du poids. Une balance énergétique négative est en effet une cause fréquente d’aménorrhée secondaire. De plus, toute pathologie chronique, pulmonaire ou digestive en particulier, peut induire une aménorrhée, essentiellement par le biais d’une insuffisance pondérale.
Quel bilan ?
La clinique d’abord !
L’examen clinique permet d’évaluer le développement mammaire (absent ou quasi « normal ») selon la classification de Tanner. En cas d’aménorrhée primaire, la notion d’anosmie ou d’hyposmie est à évaluer car elle est en faveur d’un hypogonadisme hypogonadotrope congénital.1 De plus, il est important de rechercher la présence de douleurs pelviennes ou d’une masse pelvienne, en faveur d’une anomalie utérine, appelée hématocolpos. Il est souhaitable de mesurer la taille, le poids, de calculer l’IMC et d’apprécier l’évolution du poids au cours des derniers mois. Les signes de carence nutritionnelle sont la cyanose des extrémités ou un lanugo. Les signes en faveur d’une hyperandrogénie sont l’acné et la pilosité au niveau du visage, du menton, de la ligne intermamelonnaire, des cuisses et des jambes. La pression du mamelon permet de mettre en évidence une éventuelle galactorrhée.
En cas d’aménorrhée secondaire, la date des dernières règles est à préciser.
Bilan biologique hormonal
Le bilan biologique initial comporte les dosages de la gonadotropine chorionique humaine (hCG) plasmatique, de l’hormone de stimulation folliculaire (FSH), de l’hormone lutéinisante (LH), de l’estradiol, de la prolactine. La testostéronémie totale est associée s’il existe des signes cliniques d’hyperandrogénie, à type d’acné ou d’hirsutisme. Le bilan peut être réalisé à tout moment chez une patiente en aménorrhée ou après dix jours de progestérone (test au progestatif). Un saignement dans les deux semaines suivant l’arrêt du progestatif indique que le test est positif ; il signe la présence d’un utérus et d’une imprégnation estrogénique normale. En revanche, il est négatif dans les circonstances suivantes : imprégnation estrogénique trop faible, grossesse, aménorrhée d’origine utérine. Il est souhaitable de ne pas attendre plus de deux mois avant de réaliser le bilan hormonal devant une aménorrhée. En effet, même à l’arrêt d’une pilule estroprogestative, l’axe gonadotrope doit redémarrer rapidement, et l’aménorrhée « post-pilule » signe une pathologie sous-jacente.
Il n’y a pas d’indication à prescrire le dosage de l’hormone antimüllerienne (AMH) en première intention. L’AMH est sécrétée par les cellules de la granulosa. Elle est un reflet du capital folliculaire et peut aider à évaluer la réserve ovarienne : l’AMH est souvent effondrée lors d’une insuffisance ovarienne prématurée ; elle est basse en cas d’aménorrhée hypothalamique fonctionnelle ou sous pilule estroprogestative ; elle est élevée en cas de SOPK. Il est nécessaire d’attendre trois mois après l’arrêt de la pilule que le taux d’AMH soit interprétable.
Le caryotype doit-il être systématique ?
Le caryotype – après consentement éclairé – est demandé en cas d’hypogonadisme hypergonadotrope, que l’aménorrhée soit primaire ou secondaire. Cet examen peut mettre en évidence un syndrome de Turner avec une monosomie 45,X ou un caryotype de formule mosaïque 45,X/46,XX. En France, le syndrome de Turner est diagnostiqué en moyenne à l’âge de 8 ans, mais il est parfois établi chez la femme adulte devant une insuffisance ovarienne prématurée, c’est-à-dire une aménorrhée avec un taux de FSH supérieur à 25 UI/L et un estradiol bas, avant l’âge de 40 ans.2 Le caryotype peut aussi identifier une formule 46,XY, évocatrice d’une dysgénésie gonadique ou d’un syndrome de résistance aux androgènes.
Quels sont les examens d’imagerie à réaliser ?
Échographie pelvienne par voie vaginale, si possible
L’échographie pelvienne est utile au diagnostic étiologique.
Elle est particulièrement informative lorsqu’elle est réalisée par voie vaginale. Cependant, elle doit être réalisée par voie sus-pubienne chez des adolescentes n’ayant pas encore eu de rapport sexuel.
Cet examen permet de préciser la présence, la taille et la position des gonades et l’existence ou non d’un utérus, ainsi que la taille de celui-ci. Une longueur utérine supérieure à 25 mm signe une imprégnation estrogénique et donc un début de puberté. En cas d’aménorrhée primaire, l’échographie peut montrer une agénésie utérine (syndrome de Rokitansky-syndrome d’insensibilité aux androgènes) et/ou une rétention utérine par imperforation hyménéale (hématocolpos).
Une IRM pelvienne peut être utile pour confirmer l’absence d’utérus ou identifier un hématocolpos si l’échographie n’est pas contributive.
IRM hypothalamo-hypophysaire
L’IRM hypothalamo-hypophysaire n’est pas utile en cas d’élévation des taux de FSH et de LH.
En revanche, une aménorrhée primaire avec un estradiol bas, une FSH et une LH basses ou non élevées fait évoquer une origine hypothalamo-hypophysaire. Il est alors souhaitable de réaliser une IRM de cette région pour éliminer un syndrome tumoral hypothalamo-hypophysaire. Parmi les causes congénitales d’hypogonadisme hypogonadotrope, les troubles de l’olfaction de type anosmie ou hyposmie orientent vers un syndrome de Kallmann de Morsier. En cas d’hypogonadisme hypogonadotrope congénital, l’IRM hypophysaire est le plus souvent normale. L’agénésie des bulbes olfactifs présente dans ce syndrome est mise en évidence sur une IRM dédiée.
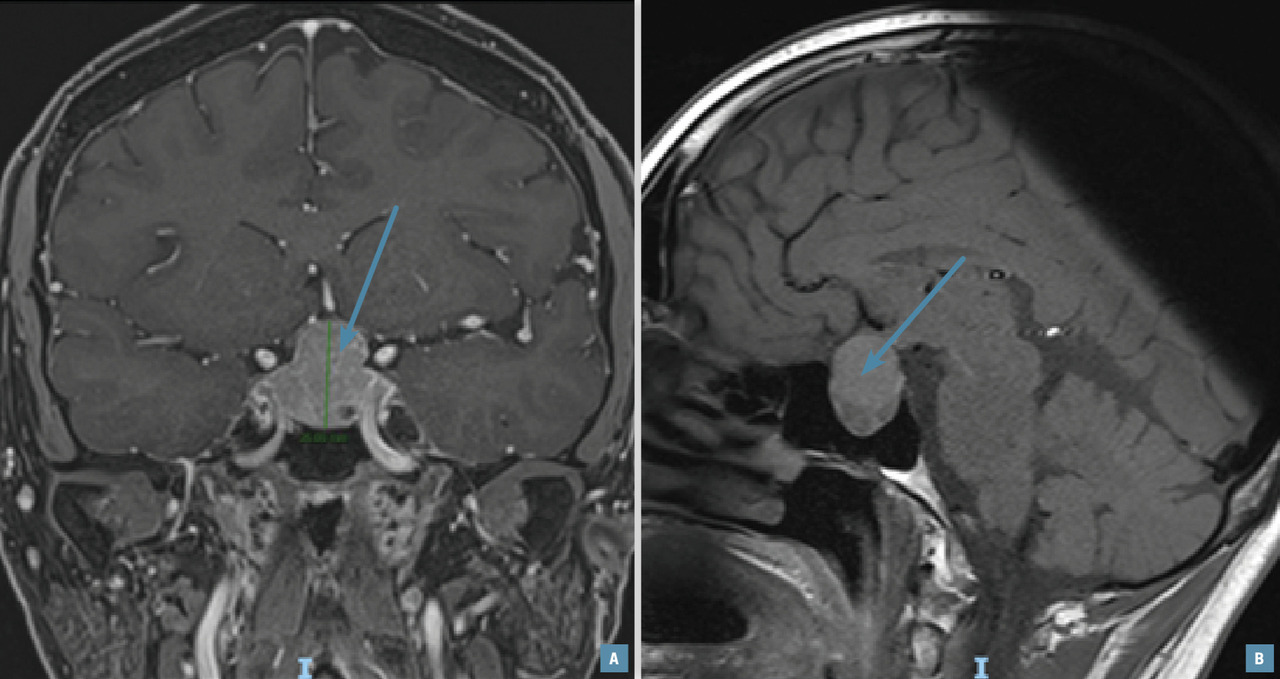
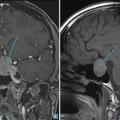
Lors de l’exploration d’une aménorrhée secondaire, une IRM hypophysaire (fig. 1) doit être réalisée en cas d’hypogonadisme hypogonadotrope, avec ou sans hyperprolactinémie.
Cet examen peut mettre en évidence des tumeurs de la région hypothalamo-hypophysaire, en particulier un adénome à prolactine, un méningiome ou un craniopharyngiome. En cas d’aménorrhée dite fonctionnelle ou nutritionnelle, l’IRM est normale ; ce diagnostic est retenu après avoir éliminé les causes organiques.
SOPK, cause la plus fréquente d’aménorrhée secondaire
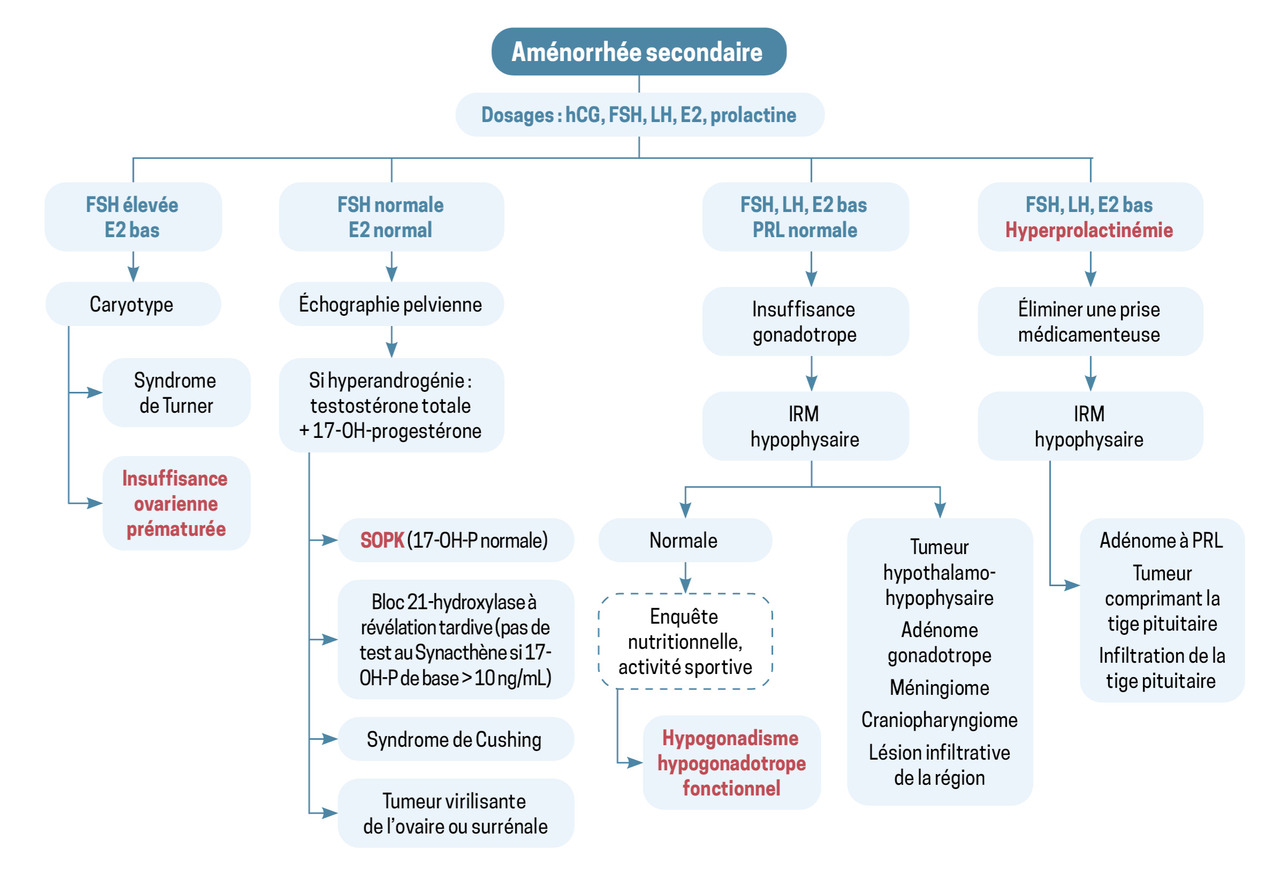
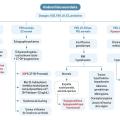
La conduite à tenir en cas d’aménorrhée secondaire selon les différentes causes est résumée dans la figure 2 ci-dessus.
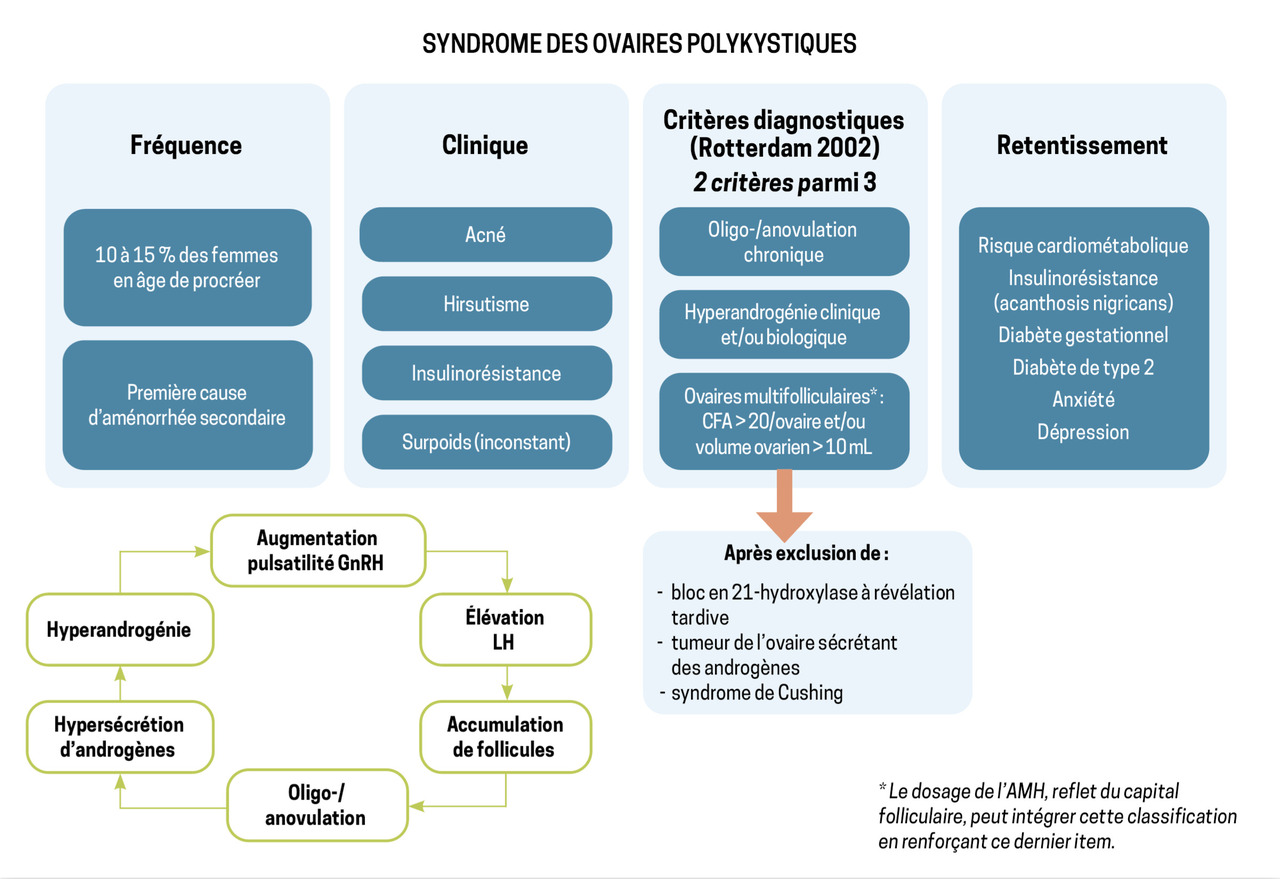
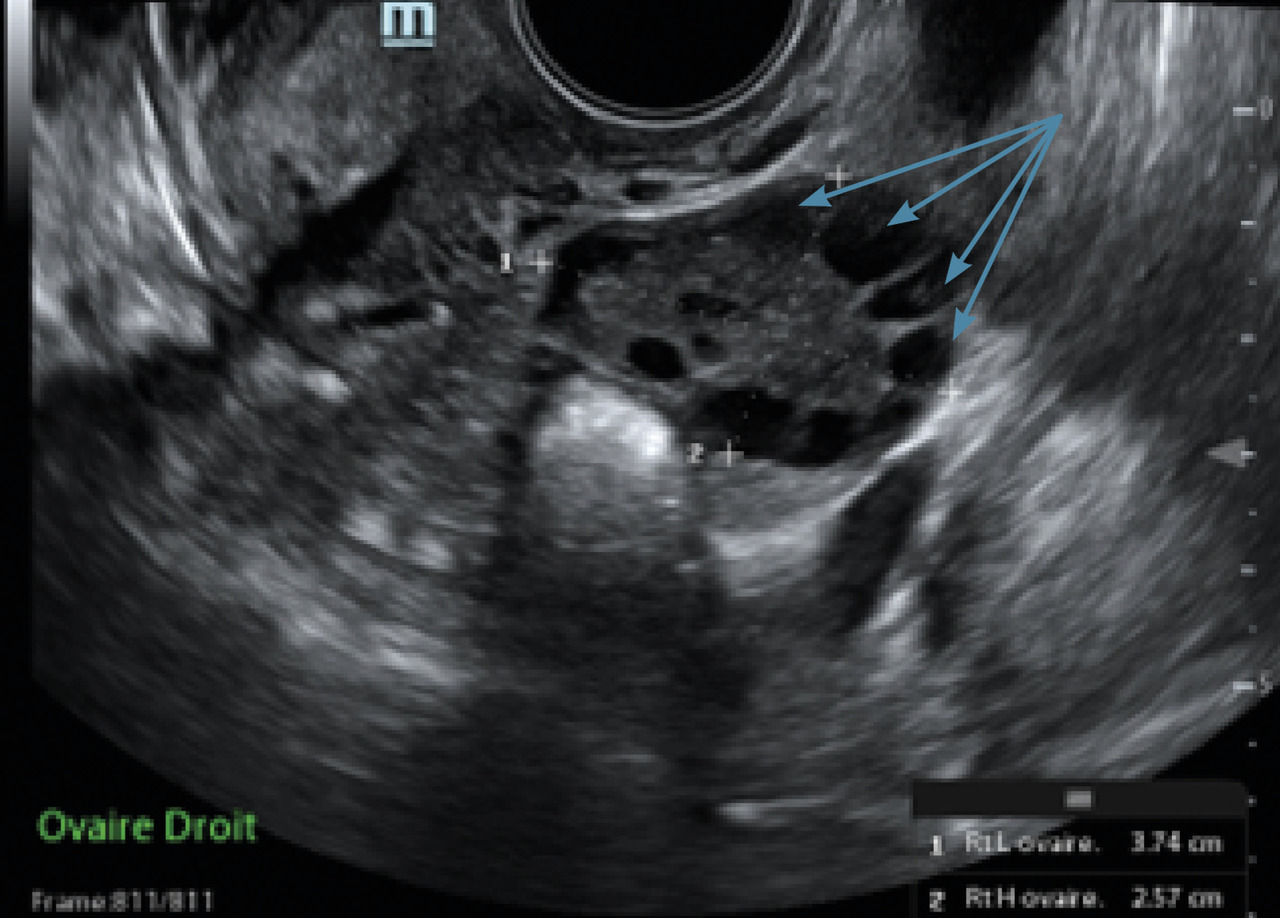
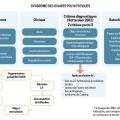
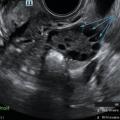
L’immense majorité des cas d’aménorrhée secondaire est due à un SOPK (fig. 3 et 4).
Le SOPK concerne 10 à 15 % des femmes.3 Le surpoids ou l’obésité sont fréquents mais ne sont pas nécessaires au diagnostic.
Ce syndrome est défini par la présence d’au moins deux des trois critères suivants :
- une oligo- ou anovulation ;
- des signes d’hyperandrogénie clinique et/ou biologique ;
- un compte des follicules antraux (CFA) supérieur ou égal à 20 par ovaire (ou un volume ovarien augmenté, supérieur à 10 mL).
Le CFA correspond au compte des follicules antraux mesurant 2 à 9 mm à l’échographie par voie vaginale. Le dosage de l’AMH peut être utile car il est corrélé au nombre de follicules antraux.
Il n’est pas recommandé de réaliser une échographie pelvienne avec CFA pour le diagnostic de syndrome des ovaires polykystiques moins de huit années suivant la ménarche, en raison de la fréquence très élevée d’un aspect multifolliculaire des ovaires chez les adolescentes.
Quels risques à ne pas prendre en charge une aménorrhée ?
Risques liés à la carence estrogénique
Les principaux risques sont liés à la carence estrogénique chez une femme jeune.
Une carence estrogénique chez l’adolescente induit une diminution du pic de masse osseuse. Il est à noter que la diminution de la masse osseuse apparaît significativement dès dix-huit mois d’aménorrhée.
L’ostéopénie est définie lors de l’ostéodensitométrie par un T score entre - 1 et - 2,5 DS et l’ostéoporose par un T score inférieur à - 2,5 DS. L’ostéoporose entraîne un sur-risque de fracture.
Il est important de réaliser une ostéodensitométrie devant une aménorrhée avec carence en estrogènes.
La carence en estrogènes chez la femme jeune est également associée à un risque cardiovasculaire accru. Des études épidémiologiques ont montré que la probabilité de mortalité cardiovasculaire chez les femmes est proportionnelle à l’âge d’arrêt du fonctionnement ovarien. Lorsque celui-ci survient avant l’âge de 40 ans, c’est-à-dire lors d’une insuffisance ovarienne prématurée, le risque de mortalité par infarctus du myocarde augmente de manière statistiquement significative en l’absence de traitement hormonal substitutif (THS).
Il existe un « effet âge » du traitement estrogénique : lorsqu’il est administré chez une femme ayant des artères saines, il induit une vasodilatation, diminue l’activation de l’inflammation et la progression des lésions d’athérome ; à l’inverse, quand les estrogènes sont administrés chez des femmes plus âgées, souvent après l’âge de 60 ans, ayant des plaques d’athérome au niveau des artères, ils augmentent l’inflammation et l’instabilité des plaques, et donc le risque cardiovasculaire. Ainsi, pour diminuer le risque cardiovasculaire chez les femmes jeunes en aménorrhée avec carence estrogénique, il est recommandé de proposer un THS jusqu’à l’âge physiologique de la ménopause, soit environ 51 ans.
La carence estrogénique peut également être à l’origine de troubles des fonctions sexuelles avec dyspareunie.
Enfin, en cas d’aménorrhée d’origine ovarienne, les bouffées de chaleur peuvent être invalidantes.
Infertilité
Les causes d’aménorrhée sont, dans la majorité des cas, associées à une infertilité. La prise en charge de certaines pathologies permet de rétablir la fertilité : les conseils diététiques dans le cadre d’une aménorrhée fonctionnelle peuvent permettre le retour des cycles ; en cas de surpoids et/ou d’obésité, la perte de poids, en particulier dans le SOPK, peut rétablir l’ovulation ; un traitement par agoniste dopaminergique peut diminuer le volume d’un adénome à prolactine, diminuer la sécrétion de prolactine et donc rétablir l’ovulation. En cas d’origine hypothalamo-hypophysaire, un traitement de stimulation par les gonadotrophines peut être envisagé.
Risque tumoral
Il est important d’éliminer une tumeur de la région hypothalamo-hypophysaire avant la mise en place d’un THS devant un hypogonadisme hypogonadotrope. En effet, l’enquête étiologique permet d’éviter des complications secondaires à l’évolution tumorale, en particulier une atteinte visuelle par compression du chiasma optique.
Plus rarement, il existe des causes tumorales responsables d’aménorrhée, comme les tumeurs virilisantes ovariennes et/ou surrénaliennes. Elles sont rares et s’associent à une hyperandrogénie sévère, avec des signes de virilisation comme une hypertrophie clitoridienne, une hypertrophie musculaire, une raucité de la voix ou une alopécie androgénique.
Une aménorrhée secondaire dans le cadre d’un SOPK, non traitée par administration de progestatifs au moins tous les deux mois, peut être responsable d’un cancer de l’endomètre, à la suite d’une hyperplasie endométriale.
Il est à noter que le THS n’augmente pas le risque de cancer du sein. Ainsi, il ne nécessite pas de mammographie plus précoce que pour la population générale.
Quand faut-il rechercher une aménorrhée ?
Certaines patientes ne consultent pas pour une aménorrhée mais pour un autre symptôme qui les inquiète ou qui est visible. Si la question de l’aménorrhée n’est pas posée, sa cause peut rester méconnue. Il est donc important d’identifier les motifs qui peuvent amener au diagnostic d’aménorrhée (tableau).
Retard pubertaire
La première manifestation de la puberté chez la fille est le développement des seins. Il est considéré comme physiologique s’il survient entre 8 et 13 ans. Les règles apparaissent environ deux ans plus tard. Leur apparition est ainsi physiologique, dans la population caucasienne, entre 10 et 15 ans. Le retard pubertaire est défini par l’absence de développement des seins à 13 ans ou l’absence de règles à 15 ans. Ce retard peut être associé à une cassure de la courbe de croissance.
Parmi les causes centrales, il est nécessaire d’éliminer une tumeur hypophysaire. Parmi les causes périphériques, une petite taille, une implantation basse des cheveux et/ou des oreilles sont le plus souvent en rapport avec un syndrome de Turner.
Le retard pubertaire simple est défini par un déclenchement spontané de la puberté avant l’âge de 18 ans. Il s’agit d’un diagnostic d’élimination, beaucoup plus rare chez la fille que chez le garçon.
Hyperandrogénie
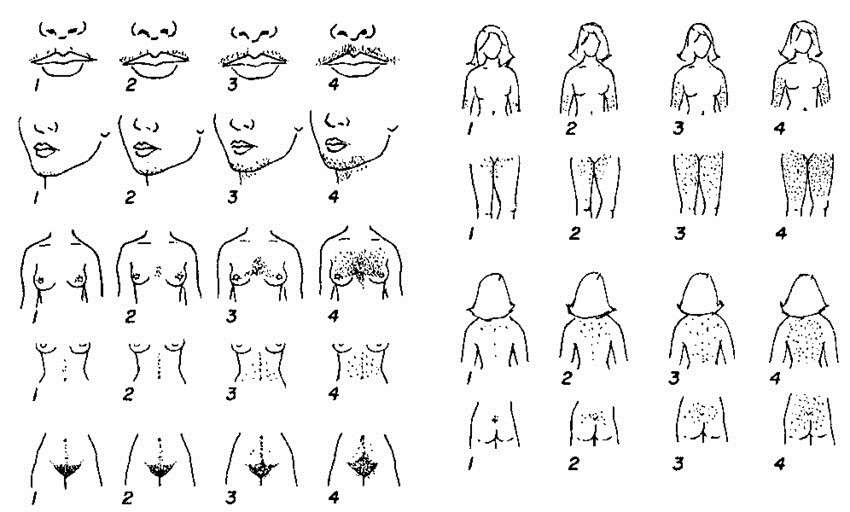
Dans la majorité des cas, il s’agit d’un SOPK. Le signe clinique le plus fréquent est l’hirsutisme, défini comme le développement excessif de la pilosité dans les régions où elle est normalement absente chez la femme : visage, thorax, ligne blanche. La sévérité de l’hirsutisme est classiquement évaluée par le score de Ferriman-Gallwey : à chacune des neuf régions les plus androgénosensibles est assignée une cotation de 0 à 4. Un score supérieur à 8 définit arbitrairement l’hirsutisme. Cependant, ce score a une faible valeur prédictive car il varie selon l’opérateur, et beaucoup de patientes utilisent des mesures dépilatoires avant de consulter. Il peut être utile de demander à la patiente de faire une autoévaluation de ce score en montrant le schéma (fig. 5).
L’hyperandrogénie associée à une érythrose faciale et une amyotrophie quadricipitale plaide en faveur d’un syndrome de Cushing.
L’acanthosis nigricans, coloration brune de la peau au niveau du cou ou des aisselles, est un signe en faveur d’une insulinorésistance ; il est fréquent dans le SOPK.
Troubles du comportement alimentaire
La cause la plus fréquente d’aménorrhée hypothalamique est fonctionnelle, secondaire à une restriction calorique associée ou non à une activité physique intense.4 Elle peut être précédée d’une spanioménorrhée (espacement des cycles de plus de six à huit semaines). Celle-ci s’explique par une sécrétion insuffisante d’estrogènes ovariens, secondaire à l’arrêt de pulsatilité de la sécrétion hypothalamique de GnRH, elle-même conséquence d’un apport énergétique insuffisant. Chez l’athlète, l’inhibition de la sécrétion pulsatile de GnRH est accentuée par l’augmentation de la sécrétion de cortisol liée au stress physique et psychologique du sport de haut niveau. Les autres signes souvent associés sont le stress intense et les variations de poids rapides. Les femmes pratiquant du sport en compétition sont trois fois plus à risque d’aménorrhée que les autres ; la prévalence est encore plus importante chez les athlètes de longue distance. L’aménorrhée hypothalamique fonctionnelle est généralement partielle et réversible.
Des recommandations de prise en charge de l’aménorrhée hypothalamique ont été publiées :5 elles insistent sur l’importance de détailler les apports alimentaires et la dépense énergétique. Quoique fréquent, il s’agit néanmoins d’un diagnostic d’élimination : il est nécessaire d’éliminer préalablement une cause organique.
Que dire à vos patientes ?
- Une adolescente doit consulter en l’absence de premières règles au plus tard à l’âge de 15 ans.
- L’aménorrhée est une absence totale de règles chez une adolescente (aménorrhée primaire) ou un arrêt des règles depuis plus de trois mois (aménorrhée secondaire) chez une femme préalablement réglée.
- La grossesse est la première cause d’aménorrhée.
- La « pilule » ne doit pas être prescrite pour rétablir les saignements avant d'avoir trouvé la cause de l’aménorrhée.
- Il est utile de trouver la cause de l’aménorrhée, car les traitements diffèrent selon ses causes.
- Si l’aménorrhée est en lien avec un manque d’estrogènes, le risque principal est la baisse de masse osseuse et les fractures.
2. Christin-Maitre S, Givony M, Albarel F, et al. Position statement on the diagnosis and management of premature/primary ovarian insufficiency (except Turner Syndrome). Ann Endocrinol 2021;82:555-71.
3. Joham AE, Norman RJ, Stener-Victorin E, et al. Polycystic ovary syndrome. Lancet Diabetes Endocrinol 2022;10:668-80.
4. Klein DA, Paradise SL, Reeder RM. Amenorrhea: A systematic approach to diagnosis and management. Am Fam Physician 2019;100(1):39-48
5. Gordon C, Ackerman KE, Berga SL, et al. Functional Hypothalamic Amenorrhea: An Endocrine Society Clinical Practice Guideline. JCEM 2017;102(5):1413-39.

 Encadrés
Encadrés