Certaines altérations moléculaires sont désormais recherchées en pratique courante, pour adapter le suivi et la décision thérapeutique dans les CCR localisés et métastatiques.
Le cancer colorectal est un problème de santé publique mondial qui touche près de 1,9 million de personnes par an et cause plus de 900 000 décès. En France, cette maladie concerne près de 43 000 personnes chaque année et est responsable de plus de 17 000 décès, classant ce cancer en troisième position en matière d’incidence, et en deuxième position en matière de mortalité par cancer.1 La survie globale à cinq ans tous stades confondus s’est nettement améliorée durant les trente dernières années, passant de 53 % pour les patients avec un diagnostic posé dans les années 1990 à 65 % pour les personnes prises en charge en 2015. Cette amélioration concerne l’ensemble des aspects de la prise en charge médico-chirurgicale avec notamment l’arrivée de nouvelles thérapeutiques en plus des molécules de chimiothérapie classique pour la partie médicale. L’essor de la biologie moléculaire a ainsi permis de mettre en évidence des altérations des voies de signalisation cellulaire intervenant dans la prolifération tumorale avec, pour certaines d’entre elles, le développement de thérapeutiques spécifiques, dites « thérapies ciblées », qui sont actuellement utilisées en pratique clinique dans les formes de CCR métastatiques (CCRm).2 Plus récemment, le développement des connaissances sur les interactions entre la tumeur et son micro-environnement (interaction hôte-tumeur) a permis d’identifier des voies régulatrices importantes – points de contrôle ou « checkpoints » immunitaires – pour lesquelles des thérapeutiques d’immunothérapie ont été développées, et sont utilisées depuis en pratique clinique courante dans certains cancers digestifs, et dans le CCRm avec instabilité microsatellitaire en particulier.
Cancer colique localisé : recherche d’une instabilité microsatellitaire
Le traitement de référence du cancer colique localisé non accessible à une résection endoscopique carcinologiquement satisfaisante repose sur une résection chirurgicale première. L’analyse anatomopathologique de la pièce opératoire permet d’établir une classification histopronostique (ou pTNM) et de définir ainsi le stade du cancer (du stade I ou stade III). Un traitement par chimiothérapie complémentaire dite adjuvante est proposé en cas de cancers à risque de récidive. Si l’intérêt de cette chimiothérapie est validé dans les formes avec un envahissement ganglionnaire sur la pièce opératoire (stade III), son bénéfice est plus discuté pour le CCR de stade II (sans envahissement ganglionnaire) avec un risque de récidive, en effet, très hétérogène dans cette population. Ainsi, des facteurs cliniques et histologiques (tumeur T4, syndrome occlusif initial, tumeur peu ou indifférenciée, présence d’emboles lymphatiques et vasculonerveux à l’histologie) et la recherche d’une instabilité microsatellitaire sur le tissu tumoral sont des critères intégrés dans l’évaluation du risque de récidive et par conséquent pour l’aide à la décision de chimiothérapie adjuvante chez les patients avec un CCR de stade II.
Schématiquement, les microsatellites sont des petites séquences d’ADN, non codantes, réparties aléatoirement dans le génome. Du fait de leur séquence répétitive, ces structures sont particulièrement exposées aux erreurs de réplication (RER). Ces erreurs sont, lors du processus normal, automatiquement corrigées par un ensemble de protéines : les protéines du système MMR (mismatch repair) dont les principales sont MSH2, MLH1, MSH6, PMS1, PMS2. En cas de CCR, le système MMR est défaillant dans presque 100 % des formes héréditaires avec syndrome de Lynch, et dans 15 % des formes sporadiques. L’instabilité microsatellitaire est recherchée sur le tissu tumoral par immunohistochimie (deficient MMR [dMMR]) et confirmée par la biologie moléculaire (statut MSI). Dans les cas de CCR de stade II, la recherche du statut MMR/MSI est actuellement systématique. En cas de tumeur dMMR/MSI, la chimiothérapie adjuvante n’est pas recommandée compte tenu du bon pronostic de ce sous-groupe de cancer.3
Cancer rectal localisé : bons résultats en cas de statut MSI
Le traitement du cancer du rectum localisé repose sur la résection chirurgicale. En cas de tumeur localement avancée, la séquence thérapeutique standard repose actuellement sur la résection chirurgicale précédée d’un traitement premier, dit néoadjuvant, fondé sur la chimiothérapie pendant trois mois, puis une association de radio-chimiothérapie.
Actuellement, l’optimisation de cette séquence de traitement fait l’objet d’importantes recherches, avec notamment l’évaluation d’une possible désescalade thérapeutique selon la réponse à la chimiothérapie/radiochimiothérapie, ou selon les données de la biologie tumorale. Ainsi, des données récentes chez les patients avec un cancer du rectum MSI ont montré un taux de réponse complète de 100 % après un traitement par immunothérapie.4 Si ces excellents résultats laissent entrevoir la possibilité d’instaurer une surveillance en cas de réponse complète et de surseoir ainsi aux autres traitements, ces données sont en cours de confirmation sur des études avec de plus larges effectifs.
Cancers colorectaux avec métastases non opérables d’emblée : identification d’altérations moléculaires
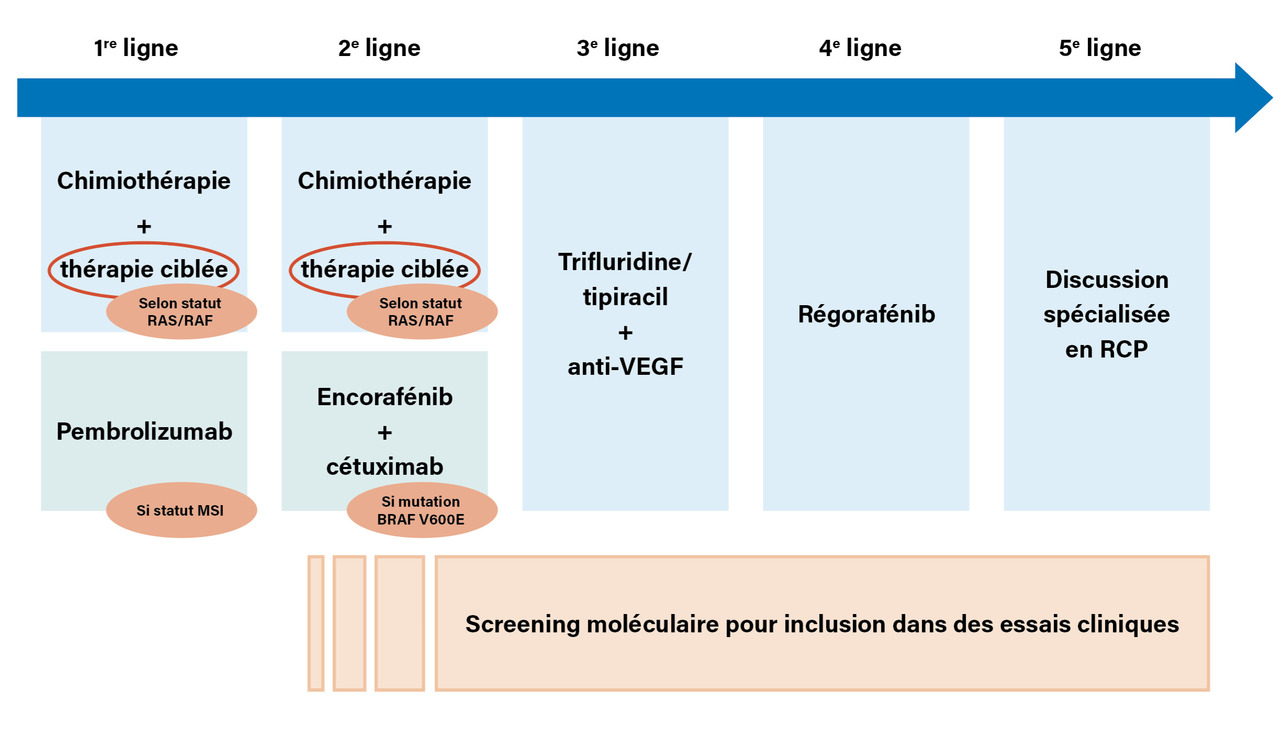
La biologie moléculaire occupe une place déterminante dans la prise en charge des patients avec un CCRm compliqué de métastases d’emblée non résécables. Dans cette situation, la stratégie thérapeutique repose sur les polychimiothérapies associées, les thérapies ciblées ou l’immunothérapie dont le choix est guidé par le profil du patient (âge, statut OMS, comorbidités) et les caractéristiques moléculaires de la tumeur (figure). L’obtention d’un échantillon tissulaire (biopsie du site primitif ou d’une métastase) est obligatoire afin de réaliser l’analyse de trois biomarqueurs indispensables : la recherche d’une instabilité microsatellitaire (en biologie moléculaire [statut MSS/MSI] et/ou en immunohistochimie à travers l’évaluation des quatre protéines du complexe de réparation MLH1, MSH2, PMS2, MSH6), le statut du gène RAS (KRAS et NRAS) ainsi que le statut du gène BRAF.
Schématiquement, en cas de statut MSS, la première ligne de traitement repose sur une chimiothérapie (fluoropyrimidine et/ou oxaliplatine et/ou irinotécan) associée à une thérapie ciblée selon le statut RAS et RAF de la tumeur. Un anticorps anti-VEGF (bévacizumab) est proposé en présence d’une mutation sur les gènes RAS (environ 50 % des CCR) ou BRAF (environ 8 % des CCR), alors qu’un anticorps anti-EGFR (cétuximab ou panitumumab) est privilégié en l’absence de mutation (tableau). En cas de statut MSI (environ 5 % des CCR), un traitement par immunothérapie anti-PD1 (pembrolizumab) est préconisé. Ce traitement, plus efficace que la chimiothérapie conventionnelle, permet parfois d’obtenir une rémission complète ou partielle prolongée.5
Concernant les stratégies thérapeutiques sur les lignes ultérieures, la recherche d’autres biomarqueurs n’est pas validée en dehors d’essais thérapeutiques. Les choix thérapeutiques dépendent des traitements utilisés en première ligne et du statut RAS-BRAF et MSI, la présence d’une mutation BRAF étant une indication à un traitement ciblé spécifique cétuximab + encorafénib (anti-EGFR + anti-BRAF).6
Autres altérations d’intérêt dans le CCRm
Le démembrement moléculaire du cancer colorectal a permis d’identifier d’autres altérations de fréquence relativement faible mais jouant également un rôle important dans la transformation tumorale et dont l’inhibition spécifique a montré des premiers résultats très prometteurs, comme notamment la surexpression d’HER2 (présente dans 2 à 3 % des cas), les mutations RASG12C (environ 2 à 4 %) et une fusion des gènes NTRK (tropomyosin related kinase fusion proteins) [moins de 1 % des cas]. Par exemple, chez les patients traités pour un CCRm avec une surexpression HER2 par les cellules tumorales, une étude sur 78 patients traités par un anticorps anti-HER2 conjugué à un inhibiteur de topo-isomérase de type I a permis d’obtenir une réponse objective chez 45 % des patients.7 Dans une série de 32 patients CCRm avec mutation KRAS G12C, l’utilisation d’inhibiteur spécifique (adagrasib) en association avec un anticorps anti-EGFR (cétuximab) a montré des taux de réponse des cibles tumorales au scanner de 46 % et un taux de contrôle global (réponse et stabilité) de 100 %.8 À ce jour, ces altérations ne sont pas encore recherchées en routine, et des études sur de plus larges effectifs sont en cours pour confirmer ces premiers résultats et déterminer si ces nouvelles options peuvent intégrer l’arsenal thérapeutique.
Prédire la tolérance de la chimiothérapie par 5 -fluoro-uracile
Le 5 -fluoro-uracile (5FU) et sa prodrogue, la capécitabine, sont très souvent utilisés dans la prise en charge des cancers digestifs. Ils sont dégradés par la dihydropyrimidine déshydrogénase (DPD), enzyme limitante du métabolisme d’inactivation de ces chimiothérapies. En cas de déficit (partiel ou complet) de cette enzyme, les patients sont exposés à un risque accru de toxicité. Ce déficit peut être indirectement mis en évidence en dosant l’uracilémie. L’uracile est en effet naturellement présent dans l’organisme et est dégradé par la DPD. Une uracilémie comprise entre 16 et 150 ng/mL traduit donc un déficit partiel en DPD, imposant une réduction de dose de la chimiothérapie, alors qu’une uracilémie supérieure à 150 ng/mL signe un déficit complet, contre-indiquant le traitement.
Biopsie liquide et CCR : du concept à la pratique ?
Des fragments du génome tumoral sont susceptibles d’être relargués dans le sang à partir de la tumeur primitive et/ou des métastases et selon différentes formes allant des cellules tumorales (cellules tumorales circulantes) à de petits fragments d’acides nucléiques (ARN ou ADN tumoral circulant [ADNtc]) et porteurs des mêmes altérations que la tumeur. À ce jour, l’ADNtc est considéré comme le biomarqueur le plus prometteur, avec un intérêt clinique potentiel à tous les stades de la maladie ; une recherche intensive est réalisée afin d’évaluer l’intérêt de l’intégrer dans la pratique.9
Dans le CCR localisé, des données récentes suggèrent l’intérêt du dosage de l’ADNtc en postopératoire pour guider cette stratégie. En effet, des travaux ont montré que la présence d’ADNtc détectable dans les semaines qui suivent la résection serait associée à un risque très élevé de récidive.10 L’intérêt du dosage d’ADNtc est actuellement évalué dans le cadre de grands essais prospectifs randomisés en France, soit pour décider de la réalisation ou non de la chimiothérapie en cas de CCR de stade II, soit pour décider de sa durée dans le CCR de stade III.
Dans le CCRm, des travaux en cours évaluent l’intérêt du dosage de l’ADNtc pendant le traitement, afin de modifier la stratégie selon l’importance de sa variation et/ou les caractéristiques des altérations détectées.
Intégration de la biologie moléculaire à tous les stades
La biologie moléculaire est désormais intégrée dans la prise en charge du CCR, quel que soit le stade, afin de fournir des informations complémentaires pronostiques, et également à visée thérapeutique, en particulier dans le CCRm. Si les biomarqueurs recherchés systématiquement en pratique quotidienne sont encore en nombre limité (RAS, BRAF, MSI), d’autres altérations pertinentes devraient prochainement venir enrichir la liste ; des études sont en cours afin d’évaluer des thérapeutiques spécifiques sur ces différents sous-groupes moléculaires.
2. Phelip JM, Tougeron D, Leonard D, Benhaim L, Desolneux G, Dupre A, et al. Metastatic colorectal cancer (mCRC): French intergroup clinical practice guidelines for diagnosis, treatments and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO, SFR). Dig Liver Dis 2019;51(10):1357‑63.
3. Argiles G, Tabernero J, Labianca R, Hochhauser D, Salazar R, Iveson T, et al. Localised colon cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2020;31(10):1291‑305.
4. Cercek A, Lumish M, Sinopoli J, Weiss J, Shia J, Lamendola-Essel M, et al. PD-1 blockade in mismatch repair-deficient, locally advanced rectal cancer. N Engl J Med 2022;386(25):2363‑76.
5. André T, Shiu KK, Kim TW, Jensen BV, Jensen LH, Punt C, et al. Pembrolizumab in microsatellite-instability-high advanced colorectal cancer. N Engl J Med 2020;383(23):2207‑18.
6. Kopetz S, Grothey A, Yaeger R, Van Cutsem E, Desai J, Yoshino T, et al. Encorafenib, binimetinib, and cetuximab in BRAF V600E-mutated colorectal cancer. N Engl J Med 2019;381(17):1632‑43.
7. Siena S, Di Bartolomeo M, Raghav K, Masuishi T, Loupakis F, Kawakami H, et al. Trastuzumab deruxtecan (DS-8201) in patients with HER2-expressing metastatic colorectal cancer (DESTINY-CRC01): A multicentre, open-label, phase 2 trial. Lancet Oncol 2021;22(6):779‑89.
8. Yaeger R, Weiss J, Pelster MS, Spira AI, Barve M, Ou SHI, et al. Adagrasib with or without cetuximab in colorectal cancer with mutated KRAS G12C. N Engl J Med 2023;388(1):44‑54.
9. Malla M, Loree JM, Kasi PM, Parikh AR. Using circulating tumor DNA in colorectal cancer: Current and evolving practices. J Clin Oncol 2022;40(24):2846‑57.
10. Tie J, Cohen JD, Lahouel K, Lo SN, Wang Y, Kosmider S, et al. Circulating tumor DNA analysis guiding adjuvant therapy in stage II colon cancer. N Engl J Med 2022;386(24):2261-72.
Dans cet article
- Cancer colique localisé : recherche d’une instabilité microsatellitaire
- Cancer rectal localisé : bons résultats en cas de statut MSI
- Cancers colorectaux avec métastases non opérables d’emblée : identification d’altérations moléculaires
- Autres altérations d’intérêt dans le CCRm
- Prédire la tolérance de la chimiothérapie par 5 -fluoro-uracile
- Biopsie liquide et CCR : du concept à la pratique ?
- Intégration de la biologie moléculaire à tous les stades