objectifs
Qu’il persiste ou non une activité électrique, l’arrêt cardiocirculatoire (ACC) correspond à une absence d’activité mécanique efficace du cœur. Cet arrêt circulatoire se traduit par une disparition du pouls, et s’accompagne d’une perte de conscience et, à terme, d’un arrêt de la respiration.
En l’absence de rétablissement rapide d’une circulation efficace, des lésions irréversibles s’observent en quelques minutes dans les organes les plus sensibles à l’anoxo-ischémie (cerveau en particulier). Lorsque l’anoxo-ischémie a été prolongée, la reperfusion peut engendrer des lésions supplémentaires. Ces phénomènes d’ischémie-reperfusion peuvent aggraver les lésions viscérales (notamment cérébrales) au cours des premières heures et des premiers jours.
Épidémiologie
Incidence
En France, l’incidence annuelle de l’arrêt cardiocirculatoire chez l’adulte est d’environ 40 000 cas. Il s’agit d’hommes dans deux tiers des cas, âgés d’environ 65 ans en moyenne. La majorité des arrêts cardiocirculatoires surviennent au domicile, et un témoin est présent dans 80 % des cas. De nombreux progrès ont été réalisés ces dernières années, non seulement dans le domaine de la sensibilisation de la population à la reconnaissance précoce et à la pratique des gestes de survie mais également grâce à la mise à disposition de défibrillateurs automatiques dans les lieux publics et à l’amélioration des techniques de réanimation. Cependant, le pronostic de cette affection demeure extrêmement sombre. L’arrêt cardiocirculatoire reste ainsi une cause majeure de mortalité dans les pays occidentaux, avec un taux de survie souvent compris entre 5 et 10 %. Cette mortalité élevée est associée à une morbidité importante chez les survivants qui présentent fréquemment des séquelles neurologiques pouvant aller de simples troubles cognitifs à un état de dépendance totale. Parmi les victimes d’arrêt cardiocirculatoire ayant pu faire l’objet d’une tentative de réanimation, environ 35 % sont admis vivants à l’hôpital, le plus souvent dans les services de réanimation. Parmi ces survivants de la phase initiale, la mortalité hospitalière est également très importante, de l’ordre de 70 % ; elle est la conséquence des défaillances d’organes et du choc post-arrêt cardiocirculatoire, puis, dans un second temps, des lésions cérébrales post-anoxiques.
Toutes les études montrent que l’identification rapide de la situation et la mise en œuvre immédiate des mesures de réanimation sont les déterminants essentiels du pronostic immédiat, intermédiaire et à distance.
Causes
Les causes d’arrêt cardiocirculatoire sont nombreuses et varient en fonction de l’âge, du sexe et des comorbidités du sujet, mais elles sont essentiellement d’origine primitivement cardiaque ou respiratoire. La prise en charge étiologique de l’arrêt cardiocirculatoire est primordiale pour adapter les thérapeutiques, éviter la récidive, limiter la défaillance hémodynamique survenant secondairement, mais aussi le cas échéant pour proposer un dépistage familial, par exemple en cas de suspicion de cardiopathie familiale. Il est crucial de rechercher des causes rapidement réversibles. Le
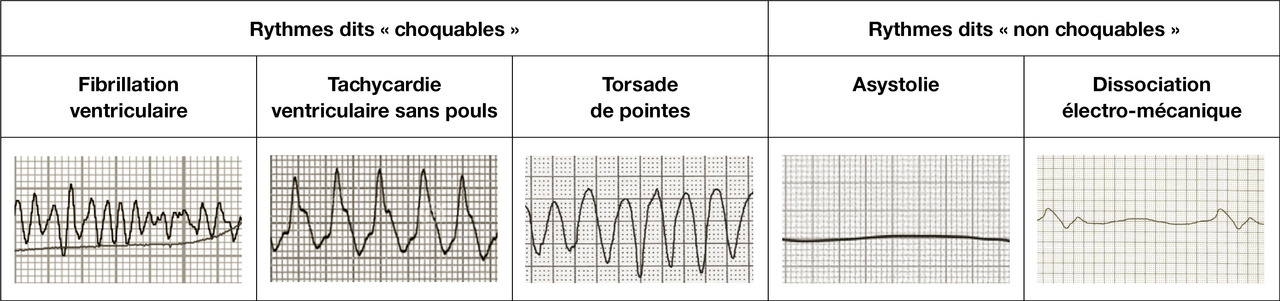
Lorsque la cause est primitivement cardiaque, l’électrocardiogramme (ECG) initial, contemporain de l’arrêt cardiocirculatoire, montre le plus souvent une arythmie ventriculaire (mais qui peut ensuite évoluer vers une asystolie). Lorsque la cause est extracardiaque, le rythme initial est souvent une asystolie ou un autre rythme dit « non choquable » car non accessible à une défibrillation externe (
Concept de chaîne de survie
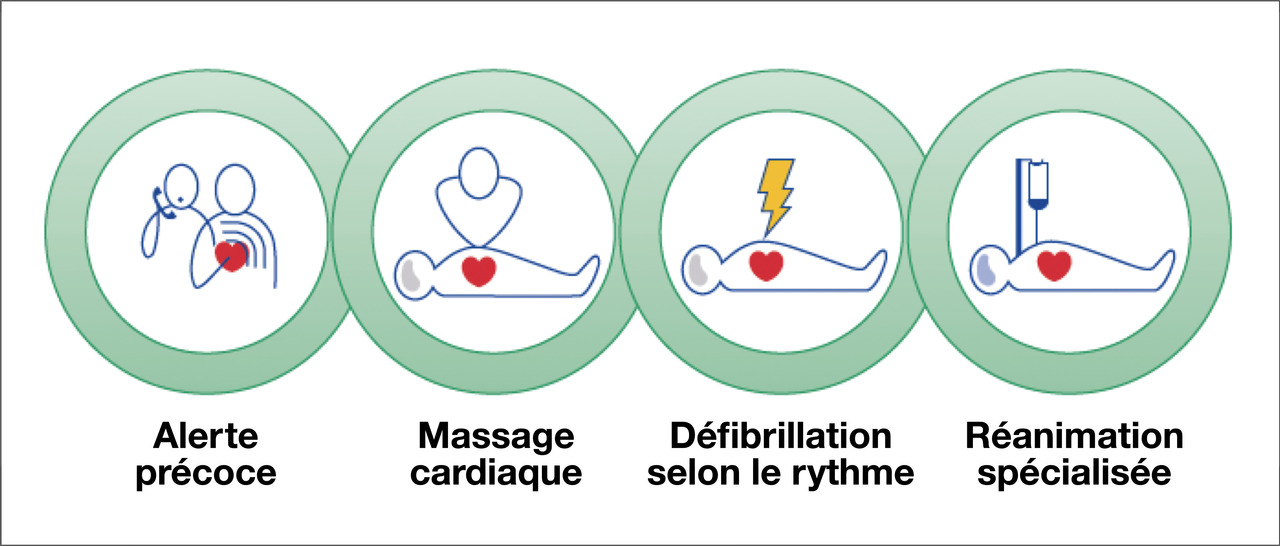
La prise en charge de l’arrêt cardiocirculatoire fait l’objet de recommandations internationales émises par l’International Liaison Committee on Resuscitation (ILCOR), dont la dernière version date de 2015. Ces recommandations sont centrées sur la notion de « chaîne de survie », qui constitue un concept essentiellement pédagogique et organisationnel (
- 1er maillon : reconnaissance de l’arrêt cardiocirculatoire et alerte rapide des secours ;
- 2e maillon : massage cardiaque externe précoce par les premiers témoins ;
- 3e maillon : défibrillation cardiaque immédiate ;
- 4e maillon : réanimation médicalisée précoce et réanimation post-arrêt cardiocirculatoire.
Au cours de la dernière décennie, l’impact de la chaîne de survie sur l’amélioration du pronostic a été établi au travers de larges études, le bénéfice semblant principalement reposer sur l’alerte, le massage cardiaque et la défibrillation précoce.
Identification et appel des secours
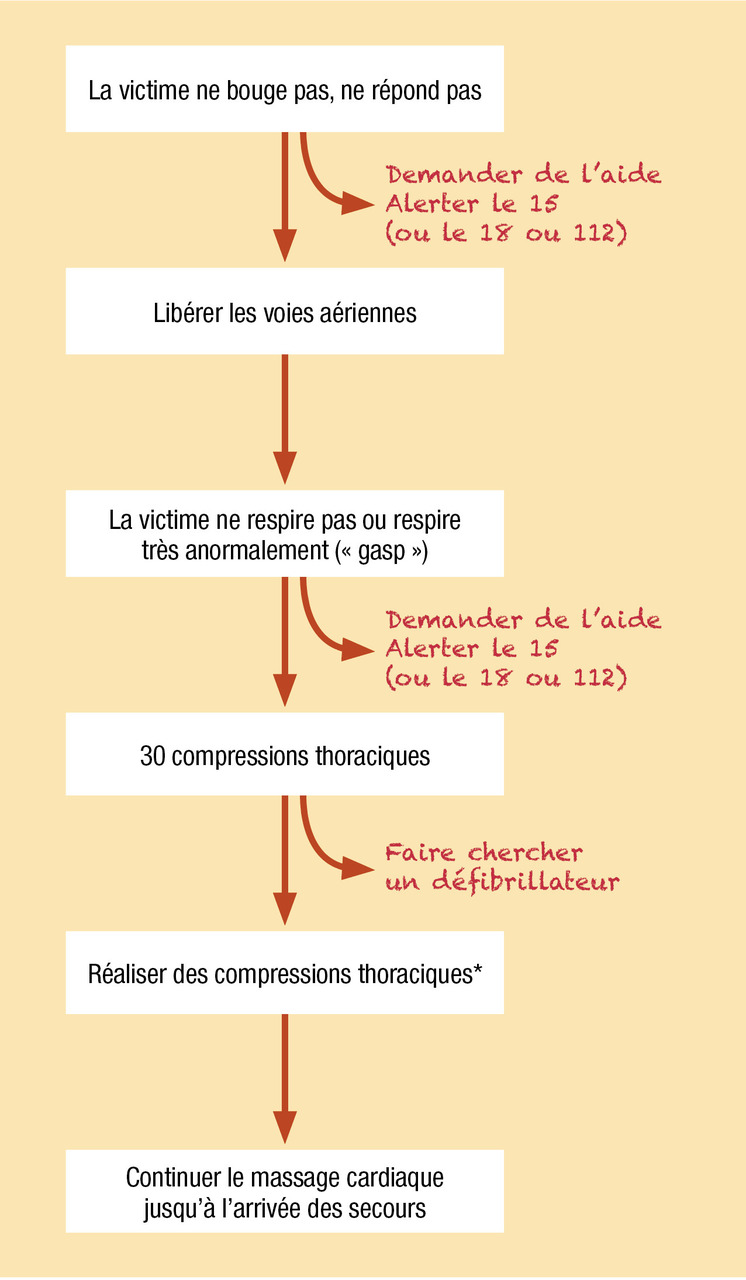
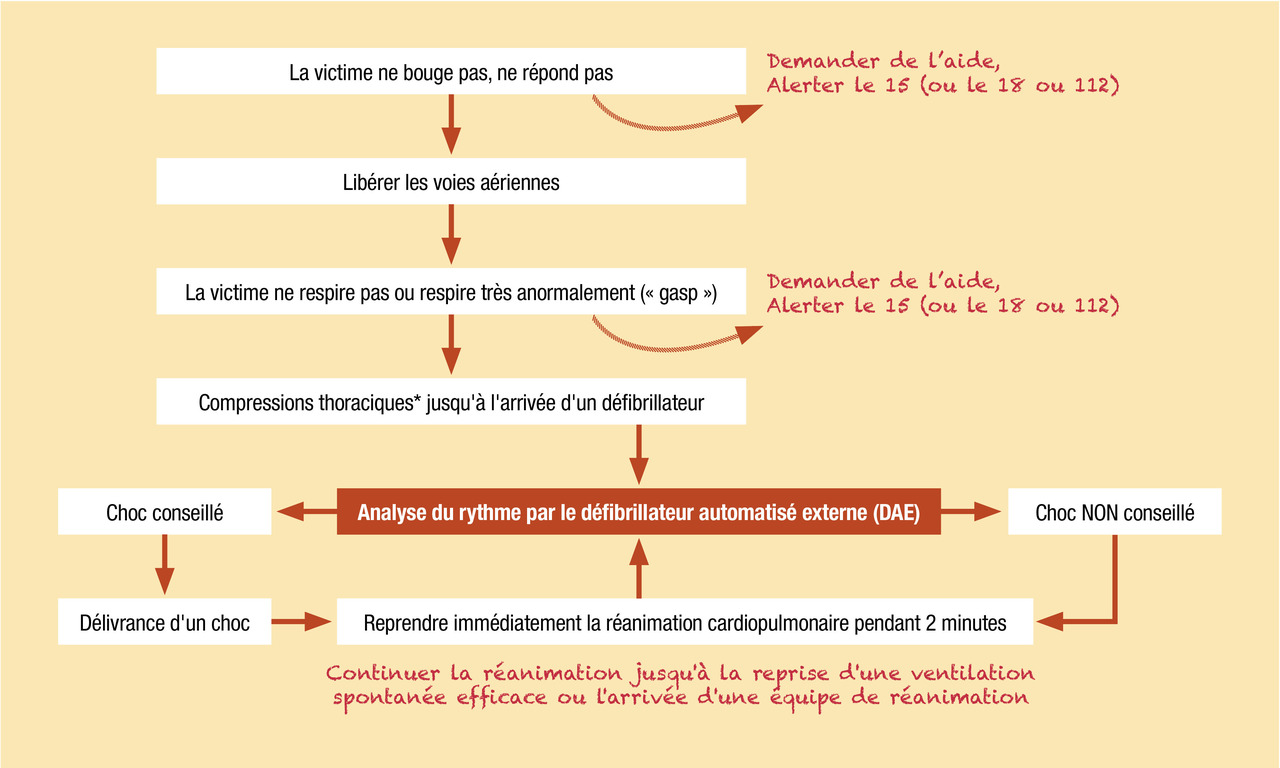
Le premier maillon de la chaîne de survie repose sur l’identification précoce de l’arrêt cardiocirculatoire. La reconnaissance par le témoin doit reposer sur des éléments simples mais fiables, permettant à toute personne de porter le diagnostic d’arrêt cardiocirculatoire en quelques secondes. Les modalités suivantes sont recommandées :
- pour le public et pour les témoins non entraînés à la recherche du pouls, l’arrêt cardiocirculatoire doit être reconnu devant une personne inconsciente et qui ne respire pas ou qui respire de manière anormale (« gasp »). En effet, lors de la phase initiale de l’arrêt cardiocirculatoire, il existe fréquemment une respiration agonique et inefficace, appelée « gasp ». Ce « gasp » ne doit pas être confondu avec la persistance d’une respiration ;
- pour les personnels de secours et les professionnels de santé (entraînés à la recherche du pouls), la reconnaissance de l’arrêt cardiocirculatoire repose sur la constatation d’une personne inconsciente sans pouls central (carotidien ou fémoral).
Dans tous les cas, cette reconnaissance de l’arrêt cardiocirculatoire doit être la plus rapide possible (moins de 10 secondes pour la prise du pouls), imposant alors le déclenchement des secours par une alerte au 15 (Samu), au 18 (pompiers) ou au 112 (numéro d’urgence européen), ainsi que le début immédiat de la réanimation cardiopulmonaire (RCP) de base par les personnes présentes (
Réanimation cardiopulmonaire de base
Le second maillon de la chaîne de survie repose sur la réanimation cardiopulmonaire de base, dont la pierre angulaire est le massage cardiaque externe, pratiqué le plus précocement possible. La réanimation cardiopulmonaire comporte une série de mesures visant à vérifier la liberté des voies aériennes (LVA), à assurer une ventilation minimale, et surtout à engendrer une circulation minimale grâce à la création d’un débit sanguin réduit (ou « low flow »). Son objectif essentiel est de maintenir une perfusion et une oxygénation tissulaires suffisantes pour protéger les principaux organes (et notamment le cerveau et le cœur) d’altérations irréversibles, en attendant la reprise d’une activité circulatoire spontanée (RACS) efficace.
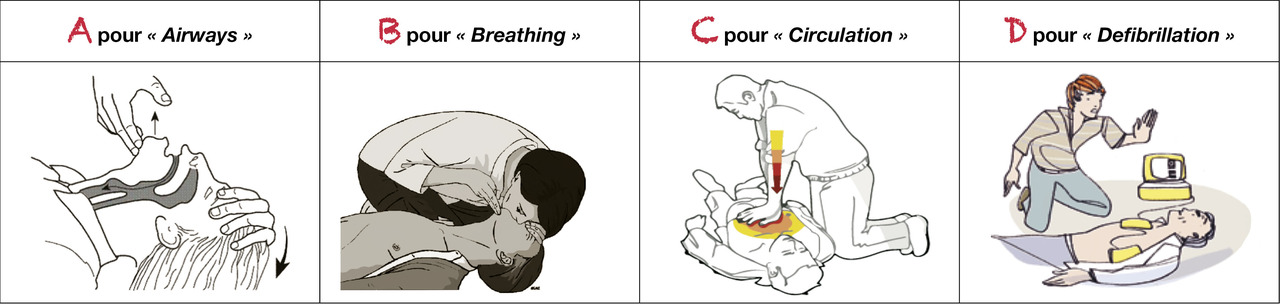
L’acronyme universel « ABCD » permet de mémoriser les éléments constitutifs de la réanimation cardiopulmonaire (
Massage cardiaque externe
Parmi les éléments constitutifs de la réanimation cardiopulmonaire, la circulation engendrée par le massage cardiaque externe constitue le point prioritaire car elle permet de maintenir une perfusion et une oxygénation tissulaires minimales, notamment cérébrales et coronaires, en attendant la reprise d’une activité circulatoire spontanée. Ainsi, le délai entre l’effondrement et le début du massage cardiaque externe (correspondant à la période dite de « no flow ») est directement corrélé au taux de survie après un arrêt cardiocirculatoire, notamment parce que des dommages tissulaires (cerveau en particulier) peuvent s’installer dès la 3e minute d’arrêt cardiocirculatoire.
Le massage cardiaque externe est appliqué sur la moitié inférieure du sternum, sur un plan dur, bras tendus, à un rythme de 100 à 120 compressions par minute. Il a pour objectif d’engendrer une dépression de la paroi antérieure thoracique de 5 à 6 cm. Chaque compression thoracique est suivie d’une période de relaxation passive de même durée, permettant au thorax de se décomprimer complètement.
Le massage cardiaque externe doit être interrompu le moins souvent et le moins longtemps possible (en particulier lors des insufflations, des défibrillations et des relais entre sauveteurs). Si plusieurs témoins participent à la réanimation cardiopulmonaire, un relais régulier entre sauveteurs est recommandé, sans attendre la sensation de fatigue.
Des systèmes ont été récemment développés pour faciliter la poursuite du massage cardiaque externe sur des périodes de temps prolongées en automatisant sa réalisation soit à l’aide d’une bande constrictive placée autour du thorax, soit à l’aide d’un piston pneumatique. Ces systèmes (parfois appelés « planches à masser ») sont utilisables dans le contexte d’un arrêt cardiocirculatoire prolongé ou lors du transport vers l’hôpital d’une victime d’arrêt cardiocirculatoire réfractaire (en attendant la mise en place d’une assistance mécanique circulatoire), ou encore dans le cadre de programmes visant à préserver une perfusion viscérale optimale avant la réalisation de prélèvements d’organes à visée thérapeutique (situation du « donneur décédé après arrêt cardiaque non contrôlé » ou DDAC). Cependant, ces systèmes n’ont pas démontré d’amélioration de la survie dans le cadre d’une utilisation systématique.
Ventilation
La ventilation n’est pas prioritaire par rapport au massage cardiaque externe, en particulier lors des toutes premières minutes de la réanimation cardiopulmonaire. Ainsi, lorsque les sauveteurs ne veulent pas ou ne savent pas réaliser le bouche-à-bouche, il est préférable qu’ils entreprennent le massage cardiaque externe seul.
Lorsque le témoin est formé et peut pratiquer la ventilation, celle-ci débute par l’ouverture des voies aériennes supérieures qui doit se faire par l’hyperextension de la tête et par surélévation du menton. À ce stade, seule la visualisation d’un corps étranger solide dans l’oropharynx impose la désobstruction des voies aériennes par la méthode des « doigts en crochet ».
Le sauveteur pratique alors un massage cardiaque externe couplé à une ventilation artificielle au bouche-à-bouche, chaque insufflation étant d’une durée de 1 seconde et devant conduire à une expansion thoracique visible. Pour les professionnels qui en sont équipés, la ventilation est d’emblée réalisée à l’aide d’un insufflateur manuel (ballon auto-remplisseur à valve unidirectionnelle, ou BAVU) et d’un masque, au mieux reliés à une source d’oxygène.
L’alternance recommandée est de 30 compressions pour 2 insufflations chez l’adulte.
Défibrillation précoce
Le premier rythme ECG enregistré lors d’un arrêt cardiocirculatoire est un rythme choquable à type de fibrillation ventriculaire (ou de tachycardie ventriculaire dans 20 à 30 % des cas [
La défibrillation peut être réalisée à l’aide d’un défibrillateur traditionnel, notamment en milieu hospitalier ; dans ce cas, ce sont les professionnels de santé présents qui analysent le rythme cardiaque et prennent la décision de délivrer ou non un choc électrique. La défibrillation peut être réalisée par les témoins présents sur les lieux à l’aide de défibrillateurs automatisés externes (DAE) lorsqu’ils sont disponibles. Ces appareils, désormais déployés dans de nombreux lieux publics, ont la capacité d’analyser la nature du rythme cardiaque de la victime, d’indiquer la nécessité éventuelle d’une défibrillation et de délivrer un ou plusieurs chocs électriques externes. Leur utilisation en extrahospitalier par des non-médecins est possible et sans risque, améliorant significativement la survie des patients atteints de fibrillation ventriculaire. Un décret datant de 2007 autorise leur utilisation par n’importe quel citoyen formé ou non. L’emploi généralisé des défibrillateurs automatisés externes permet la réalisation d’une défibrillation précoce dans de nombreuses situations, avant même l’arrivée des secours médicalisés. Ces défibrillateurs automatisés externes peuvent aussi guider la réanimation cardiopulmonaire par des messages vocaux, notamment pour encourager la réalisation des compressions thoraciques. Il existe deux types de défibrillateurs automatisés externes : les défibrillateurs semi-automatiques (DSA) et les défibrillateurs entièrement automatisés (DEA). Dans les deux cas, l’analyse du rythme cardiaque et la charge sont réalisées par la machine. Dans le cas du semi-automatique, l’opérateur doit appuyer sur un bouton pour délivrer le choc électrique, tandis que dans le cas d’un défibrillateur entièrement automatisé, le choc (s’il est indiqué) est délivré automatiquement à la fin de l’analyse.
La séquence recommandée pour la défibrillation d’un arrêt cardiocirculatoire est la suivante (
- application des palettes ou mise en place des électrodes adhésives (apicale sous le mamelon gauche et parasternale droite) ;
- analyse du rythme avec une durée d’interruption minimale du massage cardiaque externe ;
- en cas de rythme choquable, interruption la plus brève possible du massage cardiaque externe, et délivrance d’un seul choc électrique externe (CEE) à 150 joules (J), après avoir écarté les secouristes qui ne doivent pas être en contact avec le patient ;
- au décours, reprise immédiate du massage cardiaque externe pour une durée de 2 minutes, sans vérifier la reprise d’activité circulatoire ;
- après un nouveau cycle de massage cardiaque externe de 2 minutes, nouvelle analyse du rythme cardiaque pour dépister une éventuelle reprise d’activité circulatoire : si cette analyse montre un rythme organisé, prise du pouls par un professionnel de santé pour éliminer une dissociation électromécanique et confirmer la reprise d’une activité circulatoire spontanée ;
- en cas de persistance d’un rythme choquable, administration d’un nouveau choc d’énergie identique ou supérieur au précédent (jusqu’à 200 J) et reprise d’un nouveau cycle de réanimation cardiopulmonaire ;
- pendant toute la durée de la procédure, les périodes d’interruption du massage cardiaque doivent être réduites au minimum (idéalement moins de 5 secondes).
Réanimation médicalisée préhospitalière
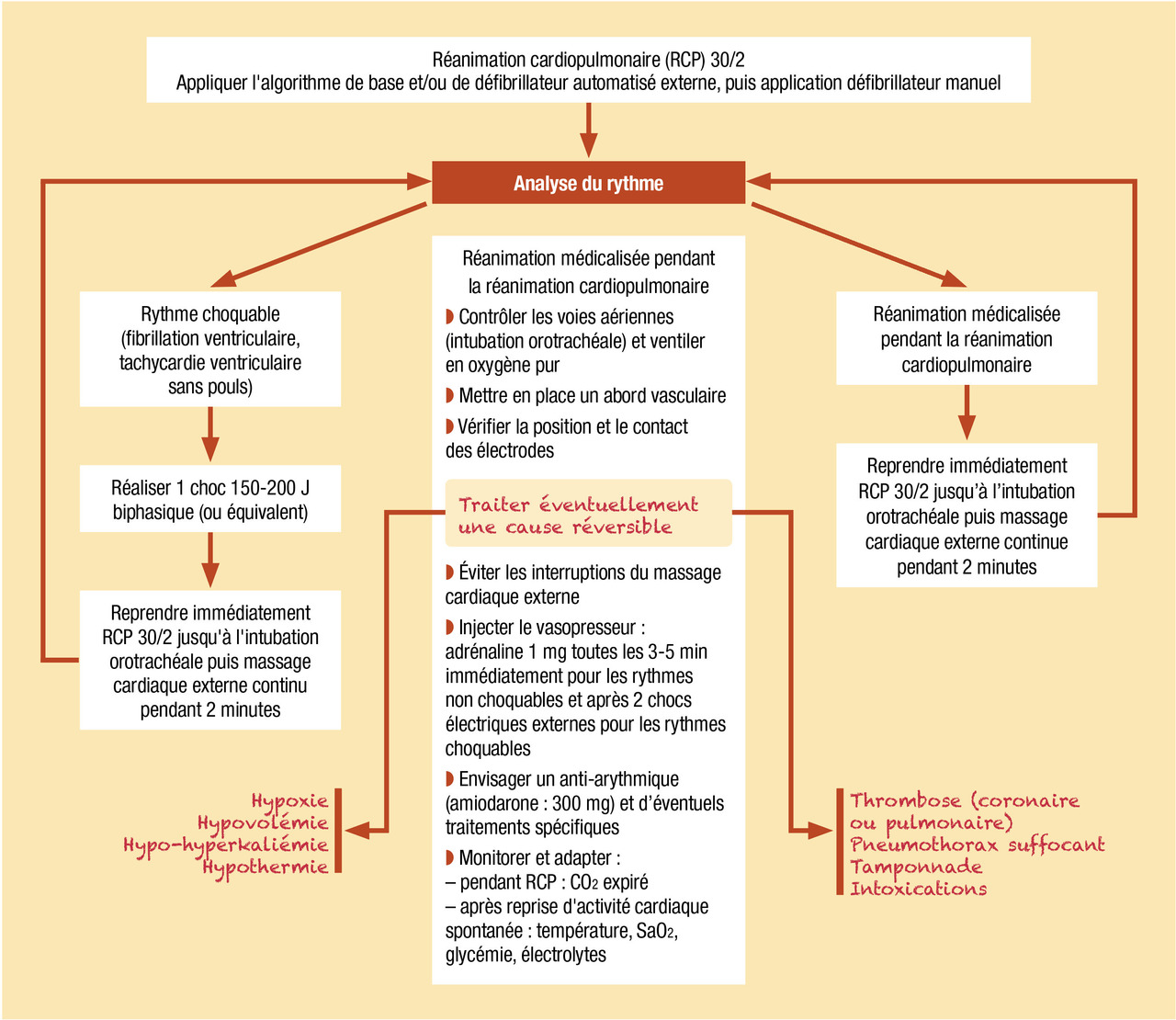
L’arrivée des secours médicalisés permet la poursuite de la réanimation avec mise en œuvre de techniques spécialisées. La réanimation médicalisée constitue le dernier maillon de la « chaîne de survie ». Réalisée par une équipe médicale préhospitalière formée et régulièrement entraînée, elle comporte plusieurs volets. L’agencement de ces différents volets entre eux et leur séquence d’utilisation sont résumés dans un algorithme global (
Poursuite du massage cardiaque externe
Après l’arrivée des secours médicalisés, la mise en œuvre d’une réanimation spécialisée ne doit pas se faire au détriment de la poursuite d’un massage cardiaque externe de bonne qualité. Toutes les interventions supplémentaires (abord vasculaire, intubation, défibrillation...) doivent s’accompagner d’interruptions du massage cardiaque les plus brèves possible.
Abord vasculaire
La mise en place d’un abord vasculaire veineux est indispensable pour la poursuite de la réanimation, notamment pour l’administration des médicaments injectables. La voie privilégiée reste la voie veineuse périphérique située dans le territoire cave supérieur, sauf si une voie veineuse centrale est déjà en place. Si l’abord veineux périphérique est retardé ou ne peut être obtenu, l’abord intra-osseux doit être envisagé et nécessite chez l’adulte un dispositif approprié. La voie intratrachéale n’est pas recommandée.
Abord des voies aériennes supérieures et ventilation
Réalisée par un personnel entraîné avec une interruption minimale du massage cardiaque externe, l’intubation trachéale reste la technique recommandée en France pour améliorer les échanges gazeux et assurer une protection des voies aériennes. Une fois l’intubation réalisée et vérifiée, elle permet une ventilation sans interruption du massage cardiaque externe à l’aide d’un respirateur automatique.
Pendant l’intubation et au décours, il est préconisé d’utiliser un monitorage du CO2 expiré (capnographie), à la fois pour confirmer la bonne position de la sonde d’intubation et comme indicateur de l’efficacité circulatoire du massage cardiaque externe.
Traitements médicamenteux
Deux médicaments, l’adrénaline et l’amiodarone, sont recommandés pendant la réanimation médicalisée de l’arrêt cardiocirculatoire (
L’adrénaline : malgré la controverse autour de son efficacité sur la survie et la récupération neurologique, l’adrénaline demeure la molécule vasopressive à utiliser en première intention à la dose de 1 mg tous les 2 cycles de réanimation cardiopulmonaire, soit toutes les 3 à 5 minutes. La première dose est injectée d’emblée lorsque le rythme n’est pas choquable (asystolie, dissociation), l’injection pouvant permettre d’obtenir un rythme choquable, et de délivrer alors un choc électrique externe. Lors du traitement d’un rythme choquable (fibrillation ventriculaire ou tachycardie ventriculaire), l’injection d’adrénaline est réalisée après le 3e choc électrique externe alors que les compressions thoraciques ont été reprises, puis toutes les 3 à 5 minutes pendant les cycles ultérieurs de réanimation cardiopulmonaire. Après chaque bolus d’adrénaline, un cycle de 2 minutes de compressions thoraciques est réalisé, et une nouvelle analyse du rythme est effectuée à l’issue de ce cycle. Il n’existe pas de preuve de l’intérêt d’utiliser de plus fortes doses, même en cas d’arrêt cardiaque réfractaire.
L’amiodarone : c’est l’antiarythmique recommandé en cas de fibrillation ou de tachycardie ventriculaire sans pouls résistant à la cardioversion électrique. Elle doit être utilisée après le 3e choc électrique externe à la dose de 300 mg injectés par voie intraveineuse directe. Une dose complémentaire de 150 mg peut être administrée après le 5e choc électrique externe. La lidocaïne peut être utilisée à la dose de 1 mg/kg en alternative si l’amiodarone n’est pas disponible.
D’autres médicaments ont été proposés, mais sont à l’heure actuelle réservés à des indications spécifiques, et ne sont pas recommandés dans la prise en charge standardisée de l’arrêt cardiaque. Il s’agit principalement des traitements suivants :
- alcalinisation par bicarbonate de sodium en cas d’hyperkaliémie ou d’intoxication par des médicaments à effet stabilisateur de membrane ;
- gluconate de calcium en cas d’hyperkaliémie, d’hypocalcémie ou d’intoxication aux inhibiteurs calciques ;
- thrombolyse intraveineuse en cas d’embolie pulmonaire prouvée ou fortement suspectée.
Recherche rapide d'une cause curable
Concomitamment aux mesures de réanimation symptomatique préalablement mentionnées, une démarche diagnostique étiologique doit être menée par l’interrogatoire des témoins, le recueil des antécédents et l’examen clinique, afin d’identifier une cause à l’arrêt cardiaque, en particulier une cause curable pouvant conduire à une intervention thérapeutique urgente (
Arrêt cardiocirculatoire réfractaire : quand arrêter, quand continuer ?
À l’issue de la phase préhospitalière, les patients avec reprise d’une activité circulatoire spontanée sont transportés à l’hôpital, le plus souvent en réanimation (voir paragraphe suivant). Il est en revanche usuel de stopper la réanimation et de prononcer le décès en cas d’asystolie persistante malgré 30 minutes de réanimation bien conduite, sauf en cas d’hypothermie, de contexte toxique ou de persistance d’une cause favorisante et curable. Si une thrombolyse a été entreprise pour une suspicion d’embolie pulmonaire, la réanimation doit être poursuivie au moins 60 minutes, correspondant au délai d’action du fibrinolytique. Dans le cas particulier de l’hypothermie accidentelle, la réanimation doit être poursuivie jusqu’à réchauffement, avec discussion de mise en place d’une assistance extracorporelle. Dans tous les cas, arrêter la réanimation constitue une décision difficile, qui doit prendre en considération les circonstances de survenue, l’organisation des premiers gestes de secours et le contexte lié au patient et à son environnement. Lorsque cela est possible, il convient d’y intégrer une éventuelle volonté exprimée par le patient. Cette décision est si possible collégiale (médecin régulateur du Samu/médecin sur place, réanimateur et médecin du service…) et elle est mise en œuvre avec l’accord de l’ensemble des personnels impliqués (pompiers, paramédicaux…).
Dans certains cas très particuliers d’arrêt cardiaque réfractaire, il est parfois justifié de recourir à la mise en place d’une assistance mécanique circulatoire externe (circulation extracorporelle veino-artérielle). Cette stratégie nécessite l’emploi d’un dispositif de massage cardiaque automatisé et elle est réservée à certains centres très spécialisés. Il s’agit toujours de situations d’exception (sujet jeune, fibrillation réfractaire, cause curable) et pour lesquelles le pronostic neurologique est encore préservé.
En l’absence d’espoir thérapeutique et sous couvert de l’emploi d’un dispositif de massage cardiaque automatisé, certains patients présentant des conditions drastiques de sélection sont parfois orientés vers un centre hospitalier capable de réaliser un prélèvement d’organe (reins) destiné à une greffe. Dans la nomenclature française, ce type de donneur d’organes est appelé « donneur décédé après arrêt cardiaque non contrôlé » (ou DDAC).
Prise en charge hospitalière
Grâce à la chaîne de survie, la prise en charge préhospitalière permet un retour à une activité circulatoire spontanée et le transport du patient à l’hôpital dans 30 à 40 % des cas. Cependant, les heures qui suivent la reprise d’une activité circulatoire spontanée après un arrêt cardiocirculatoire sont fréquemment marquées par la survenue d’un syndrome post-arrêt cardiaque qui peut, à lui seul, entraîner le décès. Conséquence d’une ischémie-reperfusion globale, ce syndrome est caractérisé par un ensemble de manifestations viscérales, notamment neurologiques, cardiocirculatoires, respiratoires et rénales, qui peuvent conduire à des défaillances d’organes multiples. Il nécessite des soins spécialisés post-arrêt cardiocirculatoire, qui associent une prise en charge thérapeutique et diagnostique.
Prise en charge thérapeutique
Dans les suites d’une reprise d’activité circulatoire, un syndrome post-arrêt cardiaque peut survenir, qui comporte une insuffisance circulatoire aiguë et qui peut se compliquer d’une défaillance multiviscérale. Ce syndrome est une complication très fréquente (50-70 % des patients), de gravité variable, apparaissant souvent au cours des 24 premières heures, et il est responsable de la grande majorité des décès observés pendant les premiers jours.
Choc post-arrêt cardiaque : cette insuffisance circulatoire aiguë est le plus souvent mixte, comportant une composante vasoplégique et une composante cardiogénique caractérisée essentiellement par une dysfonction myocardique temporaire. Ces phénomènes sont plus fréquents et plus sévères lorsque la réanimation a été longue et difficile et qu’il existe une cause cardiaque à l’origine de l’arrêt cardiocirculatoire. Ils sont résumés dans le Focus. Outre l’ischémie-reperfusion globale, d’autres éléments peuvent concourir à la survenue ou à l’aggravation du choc. Il peut s’agir d’une hémorragie post-traumatique compliquant le massage cardiaque externe (hémothorax, hémopéricarde, rupture hépatique ou splénique), d’une vasoplégie secondaire à un passage en mort encéphalique, d’un choc obstructif (dissection aortique, tamponnade), ou encore d’une complication myocardique mécanique (rupture septale, insuffisance mitrale massive par rupture de pilier).
Le choc post-arrêt cardiaque nécessite une prise en charge étiologique (par exemple, reperfusion coronaire ou contrôle d’une hémorragie) et des mesures symptomatiques qui associent optimisation de la volémie et support vasopresseur. L’échocardiographie répétée et le monitorage hémodynamique permettront d’adapter ces traitements. En cas de dysfonction cardiaque réfractaire aux thérapeutiques précédentes, et lorsque le pronostic neurologique est préservé (absence de critères de mauvais pronostic), un traitement par assistance mécanique circulatoire peut être proposé.
Neuroprotection : au décours immédiat de la reprise d’activité circulatoire, la grande majorité des patients sont comateux et nécessitent une assistance respiratoire en milieu de réanimation. De durée peu prévisible, cette dysfonction cérébrale est parfois transitoire, en particulier lorsque l’arrêt cardiocirculatoire a été bref. En revanche, certains patients demeurent comateux, et une aggravation des lésions cérébrales anoxo-ischémiques est possible (phénomène d’ischémie-reperfusion). En l’absence de médicament actif sur ces lésions, la prévention des agressions cérébrales secondaires d’origine systémique (ACSOS) est capitale, notamment au travers du contrôle ciblé de la température. Les recommandations actuelles préconisent un contrôle thermique compris entre 32 et 36 °C durant les 24 premières heures, sous couvert d’une anesthésie générale de courte durée d’action. Parmi les autres agressions cérébrales secondaires d’origine systémique, l’hypoxémie doit être évitée (maintien d’une SaO2 au-dessus de 92 %) en évitant une hyperoxie (inutile et possiblement délétère), et la ventilation artificielle doit être réglée pour cibler une normocapnie (en évitant en particulier l’hypocapnie).
Prise en charge diagnostique
Dès l’arrivée à l’hôpital, tous les efforts doivent être entrepris pour identifier la cause de l’arrêt cardiocirculatoire, afin de mettre en œuvre des traitements spécifiques et prévenir la récidive. Le syndrome coronaire aigu étant la cause la plus fréquente d’arrêt cardiocirculatoire extrahospitalier, l’indication de coronarographie précoce doit être évoquée en fonction du contexte clinique, dès la prise en charge préhospitalière, de manière à orienter le patient vers un centre susceptible de pouvoir réaliser ce geste lorsque celui-ci s’avère nécessaire. Lorsqu’une cause neurologique ou respiratoire est suspectée, la réalisation d’un scanner cérébral et thoracique peut être utile. Lorsqu’aucune cause n’a été identifiée à la phase initiale, des investigations complémentaires doivent être réalisées dès que possible, à la recherche d’une cardiopathie structurelle (échocardiographie, imagerie par résonance magnétique [IRM] cardiaque) ou électrique. Dans certains cas, cette recherche étiologique doit être étendue aux apparentés de la victime lorsqu’il existe un risque de maladie à caractère familial.
Spécificités chez l’enfant
Les arrêts cardiocirculatoires extrahospitaliers de l’enfant sont beaucoup plus rares que chez l’adulte. Ils ne représentant que 2 % du total des arrêts cardiocirculatoires, les cas de « mort subite » représentant la moitié de ces arrêts cardiocirculatoires. Sur le plan épidémiologique, il existe une prédominance masculine, l’arrêt cardiocirculatoire se déroule majoritairement à domicile, sans témoin, et seuls 30 % des enfants bénéficient d’un massage cardiaque externe par le témoin. L’asystolie est le rythme initial le plus fréquent (les rythmes choquables ne représentant que 10 % des cas) et l’origine principale de l’arrêt cardiocirculatoire est respiratoire. Le pronostic reste sombre, avec un taux de survie entre 1 et 3 % ; elle est associée à des séquelles neurologiques chez la quasi-totalité des enfants survivants.
La reconnaissance de l’arrêt cardiocirculatoire obéit aux mêmes principes que chez l’adulte : enfant immobile et sans réaction, et qui ne respire pas. La réanimation cardiopulmonaire de base consiste à appeler les secours, libérer les voies aériennes supérieures en ôtant éventuellement un corps étranger intrabuccal et débuter une ventilation avec 5 insufflations initiales. La libération des voies aériennes supérieures se fait en basculant la tête en arrière, et en surélevant le menton. La ventilation se fait par bouche-à-bouche ou bouche-à-bouche + nez chez le nourrisson de moins de 1 an.
Si après 5 insufflations l'enfant ne montre pas de signe de vie, la réanimation cardiopulmonaire est poursuivie avec un cycle de massage cardiaque externe de 15 compressions alternant avec 2 insufflations. Chez le nourrisson, le massage cardiaque externe se pratique avec les deux pouces, les mains encerclant le thorax, si le secouriste est moins expérimenté, il peut n’utiliser que deux doigts d’une même main au tiers inférieur du sternum. Pour l’enfant de plus de 1 an, le massage cardiaque externe se fait avec la paume d’une seule main, puis chez le grand enfant il est identique à l’adulte. Les défibrillateurs entièrement automatisés doivent être employés pour analyser le rythme et défibriller l’enfant le cas échéant. Pour les enfants de moins de 8 ans, il existe des défibrillateurs spécifiques avec atténuateurs de dose, mais s’ils ne sont pas disponibles, un défibrillateur adulte peut être utilisé. Les palettes sont également adaptées au poids du patient sans modifier la disposition. Si le rythme est non choquable, des bolus répétés d’adrénaline à 0,01 mg/kg toutes les 3 à 5 minutes sont entrepris par voie osseuse ou veineuse. Si le rythme s’avère choquable, un choc électrique externe à 4 J/kg est délivré, et ce toutes les 2 minutes comme l’adulte. En cas de rythme choquable persistant, de l’adrénaline à 0,01 mg/kg en bolus est instaurée après le 3e choc électrique externe ainsi que 5 mg/kg d’amiodarone.
Conclusion
Par sa fréquence et sa gravité, l’arrêt cardiocirculatoire constitue un enjeu de santé publique majeur. La prise en charge préhospitalière repose essentiellement sur la mise en œuvre des principes issus de la chaîne de survie, axée sur la reconnaissance précoce et l’appel des secours, la réalisation immédiate d’un massage cardiaque externe performant, la réalisation d’une défibrillation précoce lorsqu’elle est indiquée, et la réanimation spécialisée préhospitalière.
Le pronostic de l’arrêt cardiocirculatoire dépend de la rapidité avec laquelle la circulation spontanée est rétablie. L’enseignement de la réanimation cardiopulmonaire de base au grand public est indispensable pour améliorer le pronostic des arrêts cardiocirculatoires. C’est un élément crucial de la « chaîne de survie » au même titre que la défibrillation précoce. Enfin, si le pronostic reste sombre, il existe une amélioration de la survie, notamment au prix d’une amélioration de la formation du grand public aux gestes de premiers secours.•
Arrêt cardiocirculatoire -
Seul le rétablissement précoce d’une circulation suffisante procure une chance de survie. Le massage cardiaque externe (MCE) pratiqué par les premiers témoins constitue ainsi la pierre angulaire du traitement de l’arrêt cardiocirculatoire (ACC).
En complément du massage cardiaque externe, la défibrillation est l’élément indispensable du traitement des arrêts cardiocirculatoires consécutifs à un trouble du rythme ventriculaire.
Lorsque la ventilation est employée, l’alternance recommandée est de 30 compressions pour 2 insufflations chez l’adulte.
Le vasopresseur recommandé reste l’adrénaline (à la dose de 1 mg toutes les 3 à 5 minutes), et l’amiodarone est l’antiarythmique de référence en cas de fibrillation ventriculaire résistante à la défibrillation.
Outre les traitements symptomatiques habituels, le contrôle ciblé de la température (hypothermie thérapeutique) et le traitement éventuel d’une cause coronaire sont les deux aspects principaux de cette réanimation post-arrêt cardiaque.
Message de l'auteur
Le dossier progressif typique de cet item serait une mort subite de l’adulte compliquant un syndrome coronaire aigu. Les questions pourraient porter sur la reconnaissance de l’arrêt cardiocirculatoire (ACC) par le témoin et sa réaction (alerte des secours), le recours à la défibrillation, la prise en charge médicalisée (abord vasculaire, médicaments, gestion des voies aériennes), la détection de la cause de l’arrêt cardiocirculatoire (interprétation d’un tracé ECG), l’orientation appropriée du patient vers un centre hospitalier permettant de pratiquer une exploration coronarographique immédiate, le traitement médicamenteux du syndrome coronaire aigu, la gestion d’une complication de la réanimation cardiopulmonaire (traumatisme thoracique ou abdominal lié au massage cardiaque, pneumopathie d’inhalation), la prise en charge d’un choc post-arrêt cardiaque.
Les items qui peuvent être facilement associés sont les suivants :
– syndrome coronaire aigu ;
– mort cérébrale (qui concerne environ 5 à 10 % des patients qui sont comateux après un arrêt cardiocirculatoire) ;
– traumatisme thoracique, hépatique ou splénique (complication du massage cardiaque) ;
– troubles du rythme ventriculaire (reconnaissance ECG, traitement) ;
– choc cardiogénique ;
– pneumopathie d’inhalation.
Collège national des enseignants de réanimation. Réanimation, urgences et défaillances viscérales aiguës » (5e éd.). Elsevier Masson, 2015.
Monsieurs KG, Nolan JP, Bossaert LL, et al.; ERC Guidelines 2015 Writing Group. European Resuscitation Council Guidelines for Resuscitation 2015: Section 1. Executive summary. Resuscitation. 2015 Oct;95:1-80.

 Encadrés
Encadrés