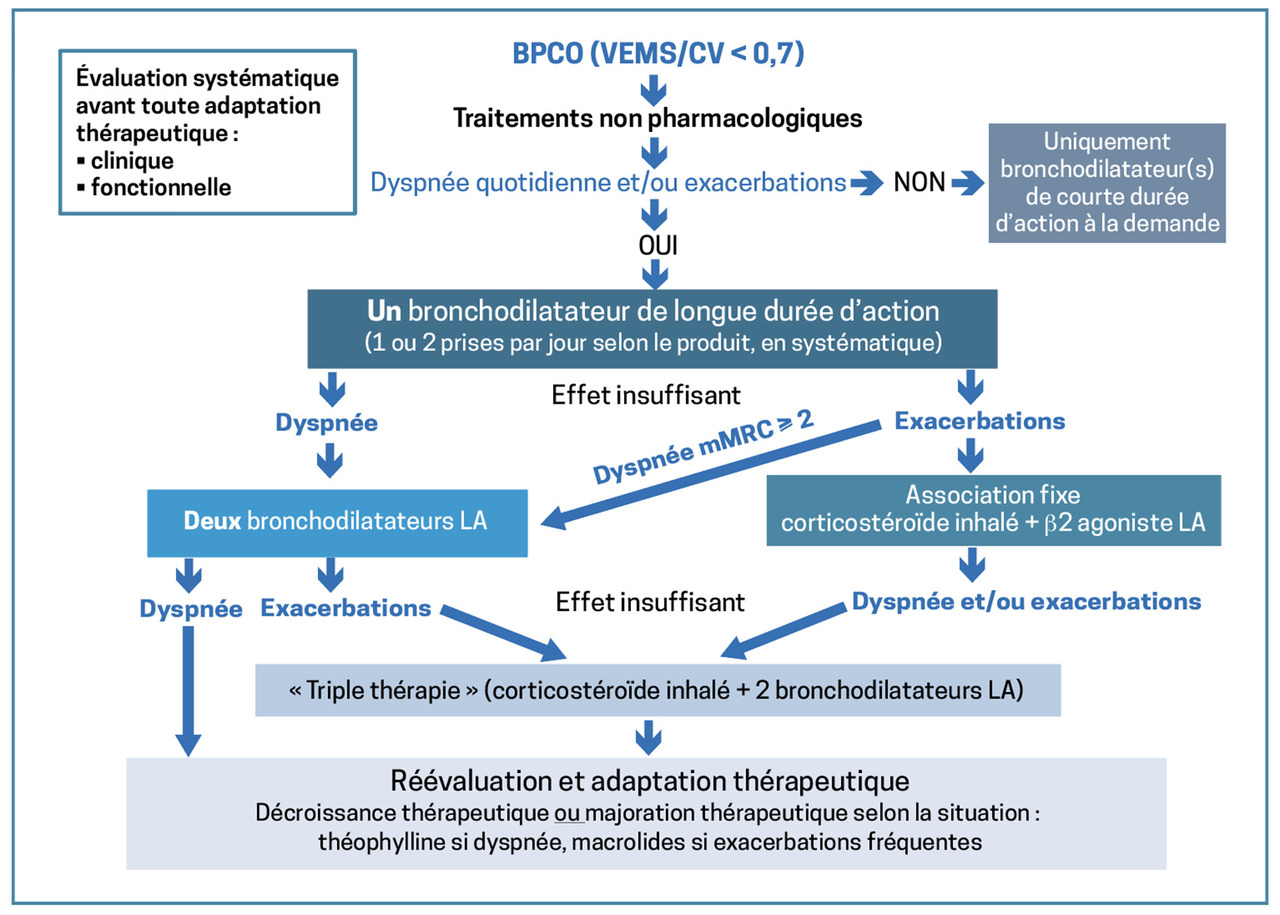
La prise en charge non pharmacologique de la BPCO (sevrage tabagique, vaccinations, activité physique, voire réhabilitation en cas de limitation des activités) s’accompagne bien souvent d’un traitement médicamenteux d’intensité croissante.1
Le premier palier doit contenir des bronchodilatateurs de courte durée d’action. En cas de dyspnée quotidienne et/ou de profil dit « exacerbateur » – patient ayant fait au moins 2 exacerbations dans l’année ou un épisode requérant une hospitalisation –, on propose un bronchodilatateur de longue durée d’action : antimuscarinique (LAMA) ou β2-agoniste (LABA). Une réévaluation clinique et fonctionnelle à 3 mois recherche des comorbidités, un diagnostic différentiel (asthme, insuffisance cardiaque, dilatation de bronches), un mésusage des dispositifs inhalés et apprécie l’observance.
Si la dyspnée persiste (mMRC > 2)*, une double bronchodilatation (LABA + LAMA) est proposée. En cas d’exacerbations fréquentes malgré un traitement optimal, on peut tenter une association LABA et LAMA ou la combinaison LABA et corticostéroïdes inhalés (CSI).
Chez les patients insuffisamment contrôlés par une bithérapie, doit-on changer de molécules ou instaurer une trithérapie (encadré ) ?
Le premier palier doit contenir des bronchodilatateurs de courte durée d’action. En cas de dyspnée quotidienne et/ou de profil dit « exacerbateur » – patient ayant fait au moins 2 exacerbations dans l’année ou un épisode requérant une hospitalisation –, on propose un bronchodilatateur de longue durée d’action : antimuscarinique (LAMA) ou β2-agoniste (LABA). Une réévaluation clinique et fonctionnelle à 3 mois recherche des comorbidités, un diagnostic différentiel (asthme, insuffisance cardiaque, dilatation de bronches), un mésusage des dispositifs inhalés et apprécie l’observance.
Si la dyspnée persiste (mMRC > 2)*, une double bronchodilatation (LABA + LAMA) est proposée. En cas d’exacerbations fréquentes malgré un traitement optimal, on peut tenter une association LABA et LAMA ou la combinaison LABA et corticostéroïdes inhalés (CSI).
Chez les patients insuffisamment contrôlés par une bithérapie, doit-on changer de molécules ou instaurer une trithérapie (
Stade avancé : bi- ou tritherapie ?
En faveur d’un remplacement de la combinaison LABA/CSI par =LABA/LAMA, on peut avancer les effets indésirables des CSI, en premier lieu le surrisque de pneumonie et des données de la littérature en faveur d’une efficacité de la double bronchodilatation sur la réduction des exacerbations.2
Ainsi, dans l’essai CRYSTAL, on a substitué l’association indacatérol-glycopyrronium (LAMA-LABA) à la bithérapie LABA-CSI chez des patients atteints de BPCO modérée mais dyspnéiques (selon l’échelle mMRC ≥ 1). À 12 semaines, on constatait une amélioration significative du VEMS (+ 71 mL) et de la dyspnée (Transition Dyspnea Index, TDI : + 1,1 point).
La triple thérapie LABA-LAMA-CSI, quant à elle, a fait la preuve de sa supériorité par rapport à la double bronchodilatation en termes de réduction du taux annuel d’exacerbations dans des essais contrôlés randomisés d’envergure chez des patients à un stade avancé (en majorité de grade GOLD 3 – obstruction bronchique sévère avec VEMS post- bronchodilatation entre 30 et 49 % – et exacerbateurs fréquents).
Dans l’étude IMPACT, le taux d’exacerbations modérées à sévères dans le bras triple thérapie était de 0,91 versus 1,21 avec la double bronchodilatation (p < 0,001).3 Les résultats étaient similaires mais plus réduits dans TRIBUTE (0,5 vs 0,59 ; p = 0,043).4 La fonction pulmonaire, critère secondaire d’IMPACT et TRIBUTE, était également améliorée de manière statistiquement significative mais peu pertinente cliniquement, avec une différence de VEMS prébronchodilatation de respectivement 54 et 22 mL. De manière plus modeste, IMPACT a aussi démontré une amélioration de la qualité de vie, avec une diminution de - 5,5 versus - 3,7 du St George’s respiratory questionnaire (SGRQ).3
D’autres études ayant comparé LABA- LAMA-CSI à LABA-CSI ont démontré un bénéfice en termes de VEMS prébronchodilatation avec une différence de 63 mL (p < 0,01, TRILOGY5) à 171 mL (p < 0,001, FULFIL6). Le taux d’exacerbations sur 1 an, un des critères secondaires, apparaissait diminué dans les 2 études (TRILOGY : 0,41 vs 0,57 exacerbation modérée à sévère ; p = 0,05 ; FULFIL : 0,25 vs 0,39 toutes exacerbations confondues ; p < 0,001). Enfin, la qualité de vie était prise en compte, mais seul FULFIL a mis en évidence une amélioration significative de ce paramètre (p < 0,001) avec baisse de - 6,6 versus - 4,3 du score SGRQ.6
Néanmoins, du fait des effets indésirables secondaires à la prise de CSI,1 un enjeu majeur reste la désescalade en cas d’inefficacité des triples thérapies ou d’intolérance. Plusieurs méta-analyses confirment que l’arrêt des corticoïdes inhalés n’augmente pas le risque de survenue d’exacerbations de BPCO modérée à sévère et entraîne un déclin statistiquement significatif mais non pertinent cliniquement du VEMS de 30 mL en moyenne. En revanche, l’arrêt des CSI ne semble pas prudent chez les exacerbateurs fréquents ou ayant un taux d’éosinophiles élevés (≥ 300/µL).
Ainsi, un défi important reste l’identification de facteurs prédictifs d’une réponse aux diverses thérapeutiques disponibles. Le dosage des éosinophiles sanguins comme biomarqueur pourrait guider l’utilisation des CSI en prévention des exacerbations, avec un seuil proposé à 300/µL.7 En effet, chez les patients insuffisamment contrôlés sous LABA-CSI, avec éosinophiles 300/µL, un switch pour une double bronchodilatation semble préférable à la triple thérapie.
De même, une désescalade de la triple thérapie vers la bithérapie LABA-LAMA est logique en cas d’effet indésirable de la corticothérapie inhalée ou si le taux d’éosinophile est inférieur au seuil de 300/µL.
Ainsi, dans l’essai CRYSTAL, on a substitué l’association indacatérol-glycopyrronium (LAMA-LABA) à la bithérapie LABA-CSI chez des patients atteints de BPCO modérée mais dyspnéiques (selon l’échelle mMRC ≥ 1). À 12 semaines, on constatait une amélioration significative du VEMS (+ 71 mL) et de la dyspnée (Transition Dyspnea Index, TDI : + 1,1 point).
La triple thérapie LABA-LAMA-CSI, quant à elle, a fait la preuve de sa supériorité par rapport à la double bronchodilatation en termes de réduction du taux annuel d’exacerbations dans des essais contrôlés randomisés d’envergure chez des patients à un stade avancé (en majorité de grade GOLD 3 – obstruction bronchique sévère avec VEMS post- bronchodilatation entre 30 et 49 % – et exacerbateurs fréquents).
Dans l’étude IMPACT, le taux d’exacerbations modérées à sévères dans le bras triple thérapie était de 0,91 versus 1,21 avec la double bronchodilatation (p < 0,001).3 Les résultats étaient similaires mais plus réduits dans TRIBUTE (0,5 vs 0,59 ; p = 0,043).4 La fonction pulmonaire, critère secondaire d’IMPACT et TRIBUTE, était également améliorée de manière statistiquement significative mais peu pertinente cliniquement, avec une différence de VEMS prébronchodilatation de respectivement 54 et 22 mL. De manière plus modeste, IMPACT a aussi démontré une amélioration de la qualité de vie, avec une diminution de - 5,5 versus - 3,7 du St George’s respiratory questionnaire (SGRQ).3
D’autres études ayant comparé LABA- LAMA-CSI à LABA-CSI ont démontré un bénéfice en termes de VEMS prébronchodilatation avec une différence de 63 mL (p < 0,01, TRILOGY5) à 171 mL (p < 0,001, FULFIL6). Le taux d’exacerbations sur 1 an, un des critères secondaires, apparaissait diminué dans les 2 études (TRILOGY : 0,41 vs 0,57 exacerbation modérée à sévère ; p = 0,05 ; FULFIL : 0,25 vs 0,39 toutes exacerbations confondues ; p < 0,001). Enfin, la qualité de vie était prise en compte, mais seul FULFIL a mis en évidence une amélioration significative de ce paramètre (p < 0,001) avec baisse de - 6,6 versus - 4,3 du score SGRQ.6
Néanmoins, du fait des effets indésirables secondaires à la prise de CSI,1 un enjeu majeur reste la désescalade en cas d’inefficacité des triples thérapies ou d’intolérance. Plusieurs méta-analyses confirment que l’arrêt des corticoïdes inhalés n’augmente pas le risque de survenue d’exacerbations de BPCO modérée à sévère et entraîne un déclin statistiquement significatif mais non pertinent cliniquement du VEMS de 30 mL en moyenne. En revanche, l’arrêt des CSI ne semble pas prudent chez les exacerbateurs fréquents ou ayant un taux d’éosinophiles élevés (≥ 300/µL).
Ainsi, un défi important reste l’identification de facteurs prédictifs d’une réponse aux diverses thérapeutiques disponibles. Le dosage des éosinophiles sanguins comme biomarqueur pourrait guider l’utilisation des CSI en prévention des exacerbations, avec un seuil proposé à 300/µL.7 En effet, chez les patients insuffisamment contrôlés sous LABA-CSI, avec éosinophiles 300/µL, un switch pour une double bronchodilatation semble préférable à la triple thérapie.
De même, une désescalade de la triple thérapie vers la bithérapie LABA-LAMA est logique en cas d’effet indésirable de la corticothérapie inhalée ou si le taux d’éosinophile est inférieur au seuil de 300/µL.
* modified Medical Research Council. Le patient marche plus lentement que les personnes de son âge ou doit s’arrêter pour respirer lorsqu’il avance à son propre rythme sur terrain plat.
Encadre
BPCO : plusieurs trithérapies à doses fixes CSI-LAMA-LABA
Furoate de fluticasone, uméclidinium et vilantérol 92/55/22 μg (Elebrato Ellipta, Trelegy Ellipta), 1 dose/j
Dipropionate de béclométasone-fumarate de formotérol-glycopyrronium 87/5/9 μg/dose (Trimbow), 2 prises matin et soir
Ces spécialités doivent être prescrites par un pneumologue.
Références
1. Zysman M, Chabot F, Devillier P, et al. Pharmacological treatment optimization for stable chronic obstructive pulmonary disease. Proposals from the SPLF. Rev Mal Respir 2016;33:911-36.
2. Wedzicha JA, Banerji D, Chapman KR, et al. Indacaterol-Glycopyrronium versus Salmeterol-Fluticasone for COPD. N Engl J Med 2016;374:2222-34.
3. Lipson DA, Barnhart F, Brealey N, et al. Once-Daily Single-Inhaler Triple versus Dual Therapy in Patients with COPD. N Engl J Med 2018;378:1671-80.
4. Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet 2018;391:1076-84.
5. Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet 2016;388:963-73.
6. Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: Once-Daily Triple Therapy for Patients with Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2017;196:438-46.
7. Papi A, Kostikas K, Wedzicha JA, et al. Dual Bronchodilation Response by Exacerbation History and Eosinophilia in the FLAME Study. Am J Respir Crit Care Med 2018;197:1223-6.
2. Wedzicha JA, Banerji D, Chapman KR, et al. Indacaterol-Glycopyrronium versus Salmeterol-Fluticasone for COPD. N Engl J Med 2016;374:2222-34.
3. Lipson DA, Barnhart F, Brealey N, et al. Once-Daily Single-Inhaler Triple versus Dual Therapy in Patients with COPD. N Engl J Med 2018;378:1671-80.
4. Papi A, Vestbo J, Fabbri L, et al. Extrafine inhaled triple therapy versus dual bronchodilator therapy in chronic obstructive pulmonary disease (TRIBUTE): a double-blind, parallel group, randomised controlled trial. Lancet 2018;391:1076-84.
5. Singh D, Papi A, Corradi M, et al. Single inhaler triple therapy versus inhaled corticosteroid plus long-acting beta2-agonist therapy for chronic obstructive pulmonary disease (TRILOGY): a double-blind, parallel group, randomised controlled trial. Lancet 2016;388:963-73.
6. Lipson DA, Barnacle H, Birk R, et al. FULFIL Trial: Once-Daily Triple Therapy for Patients with Chronic Obstructive Pulmonary Disease. Am J Respir Crit Care Med 2017;196:438-46.
7. Papi A, Kostikas K, Wedzicha JA, et al. Dual Bronchodilation Response by Exacerbation History and Eosinophilia in the FLAME Study. Am J Respir Crit Care Med 2018;197:1223-6.

 Encadrés
Encadrés