Elle est essentielle au bon contrôle de l’asthme, mais son efficacité se heurte à un certain nombre de difficultés. Retour sur les principaux écueils rencontrés et les bonnes pratiques d’utilisation de la corticothérapie inhalée.
La corticothérapie inhalée est le pilier central du traitement de fond de l’asthme et a démontré son efficacité dans le contrôle de la maladie, la réduction des exacerbations, et la baisse de la mortalité. Bien que banal, le traitement peut être mal prescrit par le médecin, mal compris et mal utilisé par le patient, ce qui contribue à une faible efficacité et au contrôle globalement insuffisant de l’asthme en France (25 à 38 % des 4 millions d’asthmatiques en France ont une maladie non contrôlée selon l’Assurance maladie).
Les corticoïdes inhalés seuls sont la première ligne du traitement de fond
L’asthme est une maladie inflam- matoire chronique, majoritairement de type Th2 et donc corticosensible dans l’immense majorité des cas. En effet, les lymphocytes T résidant dans la muqueuse bronchique des asthmatiques sécrètent des cytokines dites « Th2 » (interleukines 5, 4 et 13) qui entraînent et pérennisent une inflammation locale via notamment le recrutement d’éosinophiles. Ceux-ci peuvent être mis en évidence en pratique clinique sur l’expectoration induite ou le lavage broncho- alvéolaire. La corticothérapie inhalée est donc le traitement principal pour réduire le risque d’exacerbations et permettre un bon contrôle de la maladie.
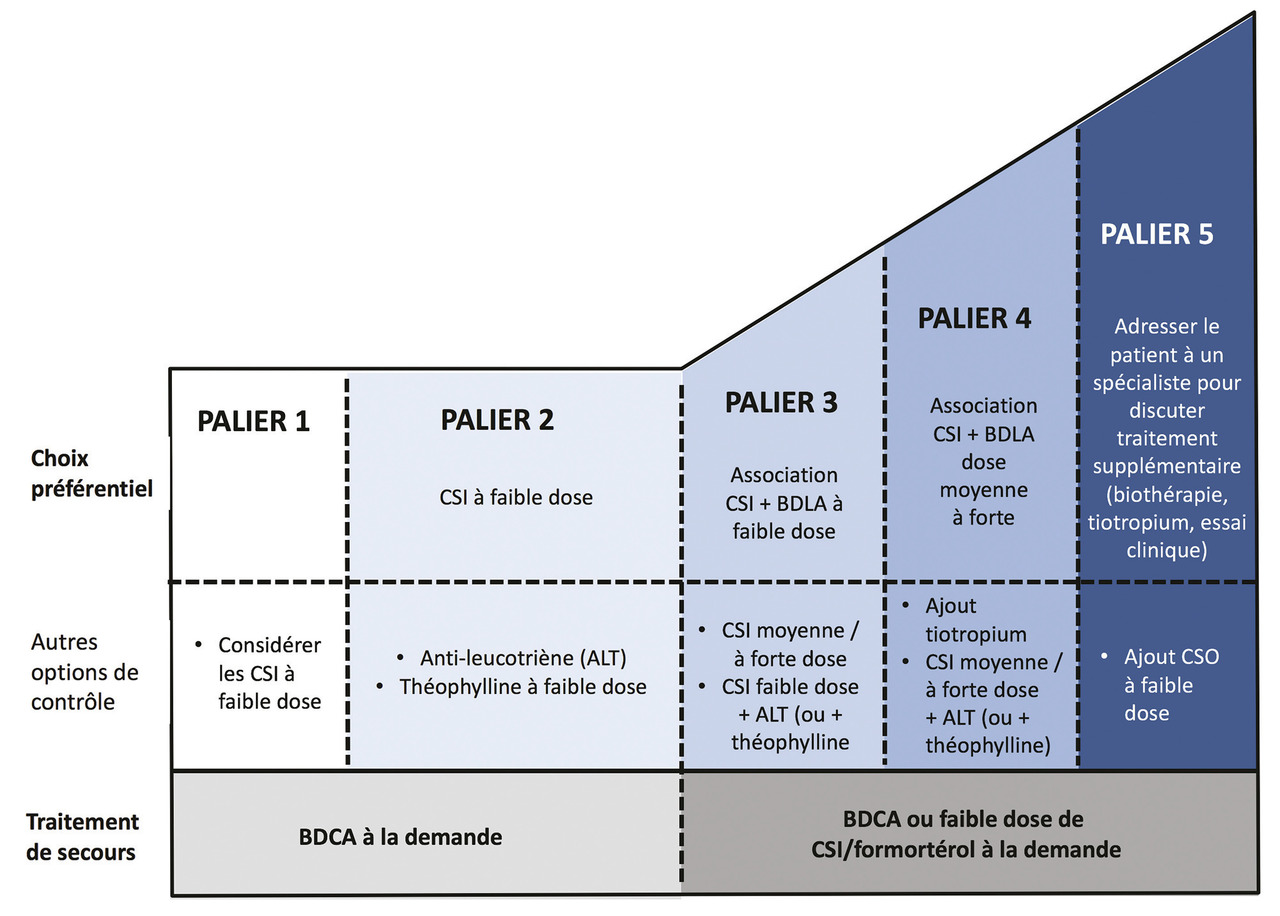
La variabilité du contrôle de l’asthme dans la vie du patient asthmatique amène à un ajustement constant du traitement de fond à la dose minimale efficace. L’approche se fait en 5 paliers ascendants ou descendants selon les symptômes (v. figure). L’initiation d’un traitement de fond doit se faire par des corticostéroïdes inhalés à faible dose. Si le contrôle, évalué idéalement par un score chiffré, reste insuffisant, on ajoute un traitement par bronchodilatateur de longue durée d’action, de préférence dans le même dispositif (association fixe), en gardant la même dose de corticostéroïdes inhalés. Si nécessaire, on poursuivra l’escalade thérapeutique en doublant ensuite les doses de corticostéroïdes inhalés.
L’association fixe est préférée à la prescription de deux dispositifs séparés, pour éviter que le patient ne privilégie la prise du bronchodilatateur, qu’il peut ressentir comme efficace compte tenu de la rapidité de l’effet, à celle du corticostéroïde inhalé, sans effet immédiat. La monothérapie par bronchodilatateur de longue durée d’action est associée à une surmortalité par asthme aux États-Unis.
Les associations fixes sont encore trop fréquemment prescrites aux dépens des corticostéroïdes inhalés seuls, alors que leur coût est plus élevé et qu’ils n’apportent pas de bénéfice dans l’asthme léger.
La variabilité du contrôle de l’asthme dans la vie du patient asthmatique amène à un ajustement constant du traitement de fond à la dose minimale efficace. L’approche se fait en 5 paliers ascendants ou descendants selon les symptômes (v. figure). L’initiation d’un traitement de fond doit se faire par des corticostéroïdes inhalés à faible dose. Si le contrôle, évalué idéalement par un score chiffré, reste insuffisant, on ajoute un traitement par bronchodilatateur de longue durée d’action, de préférence dans le même dispositif (association fixe), en gardant la même dose de corticostéroïdes inhalés. Si nécessaire, on poursuivra l’escalade thérapeutique en doublant ensuite les doses de corticostéroïdes inhalés.
L’association fixe est préférée à la prescription de deux dispositifs séparés, pour éviter que le patient ne privilégie la prise du bronchodilatateur, qu’il peut ressentir comme efficace compte tenu de la rapidité de l’effet, à celle du corticostéroïde inhalé, sans effet immédiat. La monothérapie par bronchodilatateur de longue durée d’action est associée à une surmortalité par asthme aux États-Unis.
Les associations fixes sont encore trop fréquemment prescrites aux dépens des corticostéroïdes inhalés seuls, alors que leur coût est plus élevé et qu’ils n’apportent pas de bénéfice dans l’asthme léger.
Une prescription par paliers permet de trouver la dose minimale efficace de corticostéroïdes inhalés
Les corticostéroïdes par voie inhalée ont largement moins d’effets que les corticoïdes pris par voie orale. Néanmoins, ils ont un passage systémique, et les patients y sont exposés pendant plusieurs années, parfois des dizaines, ce qui rend important de rechercher la dose minimale efficace pour maintenir un contrôle optimal tout en minimisant les effets indésirables.1 Comme on augmente la dose de corticostéroïdes inhalés en cas de mauvais contrôle, on diminue la dose en cas de bon contrôle, selon des paliers de 25 à 50 %, en général de 3 mois.2 Les patients connaissant bien leur maladie sont invités à faire eux-mêmes cette adaptation de traitement en fonction de leurs symptômes. La plupart des corticostéroïdes inhalés sont disponibles en plusieurs dosages, ce qui permet, tout en gardant le même dispositif, de moduler la dose.
En revanche, l’arrêt d’un traitement par corticostéroïdes inhalés n’est envisageable que devant un asthme totalement contrôlé depuis au moins 1 an chez un patient prévenu du risque de récidive.1
Il existe quatre molécules en France (budésonide, béclométasone, fluticasone, ciclésonide), dont l’activité anti-inflammatoire n’est pas équivalente. Les fortes doses sont trop souvent prescrites d’emblée, et rarement diminuées ensuite, exposant inutilement les patients à leurs effets indésirables. Un patient qui nécessite une forte dose de corticostéroïdes inhalés est potentiellement un asthmatique sévère qui doit être pris en charge par un spécialiste. Les équivalences de doses sont rappelées dans le tableau ci-contre. Rappelons qu’il n’y a pas de place pour les corticoïdes par voie nébulisée dans le traitement de fond de l’adulte.
En revanche, l’arrêt d’un traitement par corticostéroïdes inhalés n’est envisageable que devant un asthme totalement contrôlé depuis au moins 1 an chez un patient prévenu du risque de récidive.1
Il existe quatre molécules en France (budésonide, béclométasone, fluticasone, ciclésonide), dont l’activité anti-inflammatoire n’est pas équivalente. Les fortes doses sont trop souvent prescrites d’emblée, et rarement diminuées ensuite, exposant inutilement les patients à leurs effets indésirables. Un patient qui nécessite une forte dose de corticostéroïdes inhalés est potentiellement un asthmatique sévère qui doit être pris en charge par un spécialiste. Les équivalences de doses sont rappelées dans le tableau ci-contre. Rappelons qu’il n’y a pas de place pour les corticoïdes par voie nébulisée dans le traitement de fond de l’adulte.
Le choix du dispositif d’inhalation est au moins aussi important que le choix de la molécule
Il existe aujourd’hui plus de 50 dispositifs différents, ce qui rend leur maîtrise difficile par les praticiens. Il n’y a pas de dispositif idéal. Chacun a des avantages et des inconvénients, une facilité propre d’utilisation et un risque d’erreur de prise.3 Sans surprise, le nombre d’erreurs de manipulation est directement corrélé au mauvais contrôle de l’asthme, et donc à l’observance. Le choix du dispositif doit être adapté aux envies et aux capacités de compréhension et de manipulation de chacun.
Il paraît impensable de prescrire un traitement inhalé sans en faire la démonstration, puis de vérifier la technique de manipulation par le patient et de le corriger jusqu’à ce que la technique soit maîtrisée, voire changer de dispositif si le premier choisi n’est pas maîtrisé en moins de 10 minutes. Cela prend quelques minutes de plus dans une consultation, mais le temps pris à expliquer garantit une partie du succès du traitement. Cela nécessite évidemment que le praticien sache manipuler lui-même les dispositifs… La Société de pneumologie de langue française (SPLF) a mis en ligne une vidéo à destination des soignants et des patients pour expliquer l’utilisation de chaque dispositif disponible en France*. Il est recommandé de vérifier la technique de prise à chaque consultation. Un traitement inefficace est souvent en réalité pris mais mal manipulé (inspiration insuffisante, pas d’apnée après l’inspiration...). Une mauvaise technique d’inhalation peut induire des effets indésirables (mycoses buccales, voix rauque) qui vont conduire à l’arrêt du traitement. Des explications simples (revoir la prise, se rincer la bouche, utiliser une chambre d’inhalation…) peuvent éviter facilement ces situations. Pour les patients ayant le plus de difficultés, on peut se faire aider par une structure d’éducation, où on pourra prendre plus de temps pour la manipulation du traitement. Actuellement, le pharmacien ne peut substituer un dispositif pour un autre, même contenant les mêmes molécules.
Il paraît impensable de prescrire un traitement inhalé sans en faire la démonstration, puis de vérifier la technique de manipulation par le patient et de le corriger jusqu’à ce que la technique soit maîtrisée, voire changer de dispositif si le premier choisi n’est pas maîtrisé en moins de 10 minutes. Cela prend quelques minutes de plus dans une consultation, mais le temps pris à expliquer garantit une partie du succès du traitement. Cela nécessite évidemment que le praticien sache manipuler lui-même les dispositifs… La Société de pneumologie de langue française (SPLF) a mis en ligne une vidéo à destination des soignants et des patients pour expliquer l’utilisation de chaque dispositif disponible en France*. Il est recommandé de vérifier la technique de prise à chaque consultation. Un traitement inefficace est souvent en réalité pris mais mal manipulé (inspiration insuffisante, pas d’apnée après l’inspiration...). Une mauvaise technique d’inhalation peut induire des effets indésirables (mycoses buccales, voix rauque) qui vont conduire à l’arrêt du traitement. Des explications simples (revoir la prise, se rincer la bouche, utiliser une chambre d’inhalation…) peuvent éviter facilement ces situations. Pour les patients ayant le plus de difficultés, on peut se faire aider par une structure d’éducation, où on pourra prendre plus de temps pour la manipulation du traitement. Actuellement, le pharmacien ne peut substituer un dispositif pour un autre, même contenant les mêmes molécules.
Écouter les craintes des patients vis-à-vis des corticostéroïdes inhalés pour lutter contre les idées reçues
Est-ce que les corticostéroïdes inhalés font grossir puisque « c’est de la cortisone » ? Est-ce que l’on devient dépendant du traitement ? Est-ce que le traitement risque d’aggraver le diabète ?
Devoir prendre un traitement au long cours, surtout un corticoïde, génère souvent des inquiétudes. Il est important de répondre par la négative à ces questions pour faciliter l’adhésion au traitement et l’observance ultérieure. La dose quotidienne (microgrammes), l’intérêt de la voie inhalée (déposition locale), la possibilité de réduire la posologie en fonction des symptô- mes doivent être mis en avant. Les complications (insuffisance surré- nalienne, ostéoporose, pathologies neuropsychiatriques, cataracte) sont exceptionnelles aux doses usuelles et sont décrites au-delà de 1 000 µg/j d’équivalent béclométhasone sur des durées supérieures à 1 an, soulignant encore une fois l’intérêt d’une stratégie de réduction des doses (v. tableau).
Devoir prendre un traitement au long cours, surtout un corticoïde, génère souvent des inquiétudes. Il est important de répondre par la négative à ces questions pour faciliter l’adhésion au traitement et l’observance ultérieure. La dose quotidienne (microgrammes), l’intérêt de la voie inhalée (déposition locale), la possibilité de réduire la posologie en fonction des symptô- mes doivent être mis en avant. Les complications (insuffisance surré- nalienne, ostéoporose, pathologies neuropsychiatriques, cataracte) sont exceptionnelles aux doses usuelles et sont décrites au-delà de 1 000 µg/j d’équivalent béclométhasone sur des durées supérieures à 1 an, soulignant encore une fois l’intérêt d’une stratégie de réduction des doses (v. tableau).
Des stratégies différentes pour chaque niveau de sévérité
L’observance est une problématique majeure dans toutes les maladies chroniques, et tout particulièrement dans l’asthme. La variabilité temporelle des symptômes à l’échelle de la journée, du mois ou de la vie limite, de façon compréhensible, l’adhésion des patients à un traitement quotidien au long cours, notamment en cas d’asthme léger.4 Les difficultés d’observance doivent être discutées à chaque consultation, par un dialogue empathique et un questionnement ouvert et sans jugement.
L’observance peut être améliorée, entre autres, par un choix thérapeutique discuté entre le médecin et le malade, selon des stratégies validées, l’objectif restant le niveau de contrôle.5 L’utilisation des corticostéroïdes inhalés en une prise par jour peut être efficace chez les asthmatiques légers. Des traitements intermittents (« à la demande ») peuvent être également proposés. Quelle que soit la stratégie, le patient doit être évalué selon les mêmes critères, avec un score de contrôle et une évaluation régulière de la spirométrie.
L’observance peut être améliorée, entre autres, par un choix thérapeutique discuté entre le médecin et le malade, selon des stratégies validées, l’objectif restant le niveau de contrôle.5 L’utilisation des corticostéroïdes inhalés en une prise par jour peut être efficace chez les asthmatiques légers. Des traitements intermittents (« à la demande ») peuvent être également proposés. Quelle que soit la stratégie, le patient doit être évalué selon les mêmes critères, avec un score de contrôle et une évaluation régulière de la spirométrie.
Les corticostéroïdes inhalés peuvent être prescrits à tous les termes de la grossesse
La grossesse est associée à une détérioration des symptômes de l’asthme dans environ 50 % des cas, et une femme enceinte asthmatique sur cinq a une exacerbation modérée à sévère durant sa grossesse.6 Cela entraîne une augmentation des complications périnatales, et l’optimisation du contrôle de l’asthme doit donc être une priorité de la prise en charge anténatale.6 Le Centre de référence sur les agents tératogènes (CRAT**) statue donc que « chez la femme enceinte, l’asthme doit être traité aussi efficacement qu’en dehors de la grossesse » et que « les corticoïdes par voie inhalée peuvent être utilisés, quelle que soit la molécule ». Il en va de même pendant la période d’allaitement du fait d’un passage systémique faible dans le lait maternel.
En France, les récentes appositions de pictogrammes alarmistes (médicament x + grossesse = danger/interdit) sur les emballages de corticostéroïdes inhalés entraîne des inter- ruptions spontanées du traitement de fond par les femmes enceintes. La SPLF s’est positionnée*** clairement en défaveur de ce dispositif.
En France, les récentes appositions de pictogrammes alarmistes (médicament x + grossesse = danger/interdit) sur les emballages de corticostéroïdes inhalés entraîne des inter- ruptions spontanées du traitement de fond par les femmes enceintes. La SPLF s’est positionnée*** clairement en défaveur de ce dispositif.
À la dose minimale efficace
La corticothérapie inhalée a permis de réduire drastiquement la mor- talité par asthme en France. Elle est essentielle au contrôle de tout malade asthmatique et doit être prescrite à la dose minimale efficace, selon une stratégie de paliers guidée par le niveau de contrôle. L’observance du traitement reste un problème difficile en pratique, qui doit pouvoir être discuté ouvertement avec le patient.
La manipulation correcte des dis- positifs d’inhalation est un élément clé de l’efficacité du traitement, qui doit être intégrée à chaque consultation. V
La manipulation correcte des dis- positifs d’inhalation est un élément clé de l’efficacité du traitement, qui doit être intégrée à chaque consultation. V
* https://splf.fr/videos-zephir/** https://lecrat.fr/ *** http://splf.fr/pictogrammes-grossesse/
Références
1. Raherison C, Bourdin A, Bonniaud P, et al. Updated guidelines (2015) for management and monitoring of adult and adolescent asthmatic patients (from 12 years and older) of the Société de pneumologie de langue française (SPLF) (Full length text). Rev Mal Respir 2016;33:279‑325.
2. Global Initiative for Asthma. Global strategy for asthma management and prevention, 2018. www.ginasthma.org ou https://bit.ly/2PgEnOn
3. Nelson HS. Inhalation devices, delivery systems, and patient technique. Ann Allergy Asthma Immunol 2016;117:606‑12.
4. Bårnes CB, Ulrik CS. Asthma and adherence to inhaled corticosteroids: current status and future perspectives. Respir Care 2015;60:455‑68.
5. Blake KV. Improving adherence to asthma medications: current knowledge and future perspectives. Curr Opin Pulm Med 2017;23:62‑70.
6. Grzeskowiak LE, Grieger JA, Clifton VL. Strategies towards improving pharmacological management of asthma during pregnancy. Pharmacol Res 2018;130:85‑92.
2. Global Initiative for Asthma. Global strategy for asthma management and prevention, 2018. www.ginasthma.org ou https://bit.ly/2PgEnOn
3. Nelson HS. Inhalation devices, delivery systems, and patient technique. Ann Allergy Asthma Immunol 2016;117:606‑12.
4. Bårnes CB, Ulrik CS. Asthma and adherence to inhaled corticosteroids: current status and future perspectives. Respir Care 2015;60:455‑68.
5. Blake KV. Improving adherence to asthma medications: current knowledge and future perspectives. Curr Opin Pulm Med 2017;23:62‑70.
6. Grzeskowiak LE, Grieger JA, Clifton VL. Strategies towards improving pharmacological management of asthma during pregnancy. Pharmacol Res 2018;130:85‑92.
Dans cet article
- Les corticoïdes inhalés seuls sont la première ligne du traitement de fond
- Une prescription par paliers permet de trouver la dose minimale efficace de corticostéroïdes inhalés
- Le choix du dispositif d’inhalation est au moins aussi important que le choix de la molécule
- Écouter les craintes des patients vis-à-vis des corticostéroïdes inhalés pour lutter contre les idées reçues
- Des stratégies différentes pour chaque niveau de sévérité
- Les corticostéroïdes inhalés peuvent être prescrits à tous les termes de la grossesse
- À la dose minimale efficace