Avant 3 ans, le sous-diagnostic est fréquent.
Maladie chronique la plus fréquente chez l’enfant, l’asthme affecte 20 % des moins de 36 mois : à cet âge, il a des particularités cliniques, exploratoires et théra- peutiques. La période allant de la naissance à 3 ans est un moment charnière puisque, pour plus de la moitié des asthmatiques, la pathologie débute dans la petite enfance.
Malgré sa grande fréquence, cette affection reste insuffisamment (ou tardivement) diagnostiquée et sous-traitée : c’est la première cause d’hospitalisation liée à une maladie chronique.
Malgré sa grande fréquence, cette affection reste insuffisamment (ou tardivement) diagnostiquée et sous-traitée : c’est la première cause d’hospitalisation liée à une maladie chronique.
Quelle définition ?
Avant 3 ans, est considéré comme un asthme « tout épisode dyspnéique avec sibilants qui se reproduit au moins 3 fois avant l’âge de 2 ans, quels que soient l’âge de début, l’existence ou non de stigmates d’atopie, et la cause apparemment déclenchante ». Cette définition peut paraître large dans la mesure où une partie seulement de ces nourrissons continueront à faire des exacerbations tandis que les autres auront des manifestations transitoires. Cependant, en l’absence de critère prédictif fiable, la reconnaissance de la maladie favorise le recours aux thérapeutiques ciblées, réellement bénéfiques.
Avant de retenir le diagnostic, on doit éliminer les autres origines de dyspnée, notamment des maladies graves dont le pronostic dépend d’un dépistage précoce.
Avant de retenir le diagnostic, on doit éliminer les autres origines de dyspnée, notamment des maladies graves dont le pronostic dépend d’un dépistage précoce.
Manifestations cliniques
Les sibilants sont les signes les plus fréquemment rapportés chez l’enfant préscolaire. Leur observation récurrente et/ou pendant le sommeil et/ou en situations déclenchantes (activité physique, rires, pleurs, tabagisme et/ou pollution environnementale) est très évocatrice d’asthme.
Avant 3 ans, l’exacerbation prend habituellement le caractère d’une bronchiolite aiguë virale. Elle débute par une rhinite ou rhinopharyngite banale qui précède de 2 à 3 jours une toux sèche, quinteuse, avec polypnée, signes de lutte et wheezing. L’évolution spontanée se fait vers la guérison en quelques jours.
Le terme d’exacerbation, aujourd’hui distingué de celui de crise, désigne des symptômes aigus durant plus de 24 heures et/ou nécessitant un changement du traitement inhalé de fond et/ou des corticoïdes oraux et/ou un recours aux soins hospitaliers
Avant 3 ans, l’exacerbation prend habituellement le caractère d’une bronchiolite aiguë virale. Elle débute par une rhinite ou rhinopharyngite banale qui précède de 2 à 3 jours une toux sèche, quinteuse, avec polypnée, signes de lutte et wheezing. L’évolution spontanée se fait vers la guérison en quelques jours.
Le terme d’exacerbation, aujourd’hui distingué de celui de crise, désigne des symptômes aigus durant plus de 24 heures et/ou nécessitant un changement du traitement inhalé de fond et/ou des corticoïdes oraux et/ou un recours aux soins hospitaliers
Autres tableaux
– Wheezing continu avec persistance d’une obstruction bronchiolaire dont l’importance varie en fonction des épisodes infectieux ORL et de l’activité de l’enfant. Les symptômes augmentent lors de l’agitation, des repas, à l’effort, mais diminuent au repos et pendant le sommeil. Ces bébés « siffleurs » gardent une activité et un développement staturo-pondéral normaux (« happy wheezers »).
– Épisodes dyspnéiques et sifflants modérés, toux spasmodique avec sibilants en fin de quinte, survenant en dehors des viroses, plus volontiers la nuit, lors des rires ou d’épisodes d’agitation.
– Exacerbations sévères pouvant conduire à un asthme aigu grave avec passage en réanimation.
Plusieurs phénotypes ont été décrits en fonction du facteur déclenchant (unique comme une infection virale, ou multiples tels que l’exercice, l’excitation, le rire), de l’existence d’une atopie ou rétrospectivement selon le caractère transitoire, persistant, précoce ou tardif des crises.
– Épisodes dyspnéiques et sifflants modérés, toux spasmodique avec sibilants en fin de quinte, survenant en dehors des viroses, plus volontiers la nuit, lors des rires ou d’épisodes d’agitation.
– Exacerbations sévères pouvant conduire à un asthme aigu grave avec passage en réanimation.
Plusieurs phénotypes ont été décrits en fonction du facteur déclenchant (unique comme une infection virale, ou multiples tels que l’exercice, l’excitation, le rire), de l’existence d’une atopie ou rétrospectivement selon le caractère transitoire, persistant, précoce ou tardif des crises.
Quelles explorations ?
L’enquête allergologique est réservée aux enfants ayant des symptômes respiratoires persistants, récidivants, nécessitant un traitement continu, ou associés à des manifestations extrarespiratoires compatibles avec une origine allergique. Les prick tests sont recommandés en première intention.
Une radio du thorax de face, en inspiration et expiration, est nécessaire lors du diagnostic. Sa normalité permet d’écarter une grande partie des autres pathologies mimant l’asthme.
Une radio du thorax de face, en inspiration et expiration, est nécessaire lors du diagnostic. Sa normalité permet d’écarter une grande partie des autres pathologies mimant l’asthme.
Diagnostic différentiel
Plus l’enfant est jeune, plus l’éventualité d’une pathologie alternative est élevée. Le tableau 1 résume les principales et l’encadré 1 les éléments faisant douter du diagnostic d’asthme. Pour les écarter, soulignons l’importance de l’interrogatoire, des antécédents y compris néonataux, de l’examen clinique complet, de la courbe de croissance staturo-pondérale et des explorations complémentaires antérieures (radiographies pulmonaires).
Un piégeage expiratoire localisé évoque d’abord un obstacle (corps étranger ++) qui justifie une endoscopie bronchique.
Un hippocratisme digital signe le plus souvent une insuffisance respiratoire chronique, quelle qu’en soit la cause.
Une cassure franche de la courbe de croissance oriente vers une maladie plus sévère (respiratoire, digestive, endocrinienne) simulant ou s’ajoutant à l’asthme.
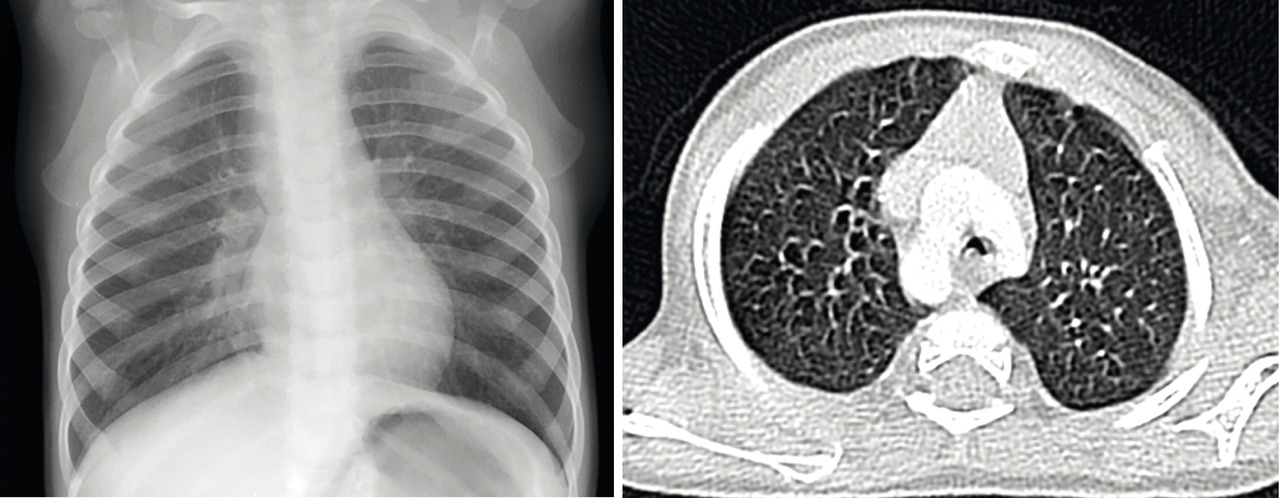
En cas de doute, si les manifestations sont fréquentes et/ou sévères, il est indispensable d’élargir les explorations (endo-scopie bronchique, scanner thoracique, étude de la motilité ciliaire, bilan immunitaire, test de la sueur) en milieu spécialisé. La figure 1 illustre le cas d’un enfant qui après 3 bronchiolites a été considéré comme asthmatique. La persistance des symptômes malgré le traitement par corticoïdes inhalés a motivé un avis spécialisé : les explorations ont abouti à la découverte d’un double arc aortique (anomalie cardiaque fœtale responsable de compression trachéobronchique et/ou œsophagienne).
Un piégeage expiratoire localisé évoque d’abord un obstacle (corps étranger ++) qui justifie une endoscopie bronchique.
Un hippocratisme digital signe le plus souvent une insuffisance respiratoire chronique, quelle qu’en soit la cause.
Une cassure franche de la courbe de croissance oriente vers une maladie plus sévère (respiratoire, digestive, endocrinienne) simulant ou s’ajoutant à l’asthme.
En cas de doute, si les manifestations sont fréquentes et/ou sévères, il est indispensable d’élargir les explorations (endo-scopie bronchique, scanner thoracique, étude de la motilité ciliaire, bilan immunitaire, test de la sueur) en milieu spécialisé. La figure 1 illustre le cas d’un enfant qui après 3 bronchiolites a été considéré comme asthmatique. La persistance des symptômes malgré le traitement par corticoïdes inhalés a motivé un avis spécialisé : les explorations ont abouti à la découverte d’un double arc aortique (anomalie cardiaque fœtale responsable de compression trachéobronchique et/ou œsophagienne).
Prise en charge
Elle vise à limiter les exacerbations, les symptômes intercritiques (manifestations ponctuelles ne nécessitant qu’un bronchodilatateur à la demande) et les besoins en bêta 2-adrénergiques de secours.
Les corticoïdes inhalés (CI) sont la pierre angulaire du traitement de fond. S’ils sont maniés selon les recommandations (HAS), le bénéfice pour l’enfant dépasse très largement les possibles effets secondaires.
Les corticoïdes inhalés (CI) sont la pierre angulaire du traitement de fond. S’ils sont maniés selon les recommandations (HAS), le bénéfice pour l’enfant dépasse très largement les possibles effets secondaires.
Médicaments disponibles
les CI autorisés sont la fluticasone (aérosols-doseurs à 50 µg), le budésonide (suspension pour nébulisation 0,5 et 1 mg), la béclométasone (solution pour nébulisation à 0,4 et 0,8 mg). Deux administrations sont possibles : aérosol-doseur avec chambre d’inhalation adéquate (et masque facial) ou nébulisation avec un générateur pneumatique (loué et adapté par un prestataire) pour les cas les plus sévères (< 5 %). Aux doses faibles à moyennes la tolérance est bonne.
Les bronchodilatateurs de courte durée d’action (BDCA) sont essentiellement utilisés pour soulager les symptômes. Cependant ils peuvent être associés au CI en traitement de fond.
Les bronchodilatateurs de longue durée d’action (BDLA) n’ont d’AMM qu’à partir de l’âge de 4 ans. Le montélukast, inhibiteur des récepteurs aux leucotriènes (granules à 4 mg), est autorisé dès l’âge de 6 mois, en association avec les CI et à partir de 2 ans avec les mêmes indications que chez le grand enfant.
Les bronchodilatateurs de courte durée d’action (BDCA) sont essentiellement utilisés pour soulager les symptômes. Cependant ils peuvent être associés au CI en traitement de fond.
Les bronchodilatateurs de longue durée d’action (BDLA) n’ont d’AMM qu’à partir de l’âge de 4 ans. Le montélukast, inhibiteur des récepteurs aux leucotriènes (granules à 4 mg), est autorisé dès l’âge de 6 mois, en association avec les CI et à partir de 2 ans avec les mêmes indications que chez le grand enfant.
Stratégie thérapeutique
Chez l’enfant préscolaire, elle est fondée essentiellement sur la fréquence des symptômes intercritiques et l’évaluation des facteurs de risque d’exacerbation.
D’une manière générale, ces derniers sont un asthme non contrôlé, au moins une crise sévère dans l’année précédente, un tabagisme environnemental, la pollution intérieure et extérieure, une exposition allergénique, une mauvaise compliance et des problèmes psycho-sociaux importants. L’évolution vers une obstruction bronchique pérenne est liée à la fréquence des hospitalisations antérieures.
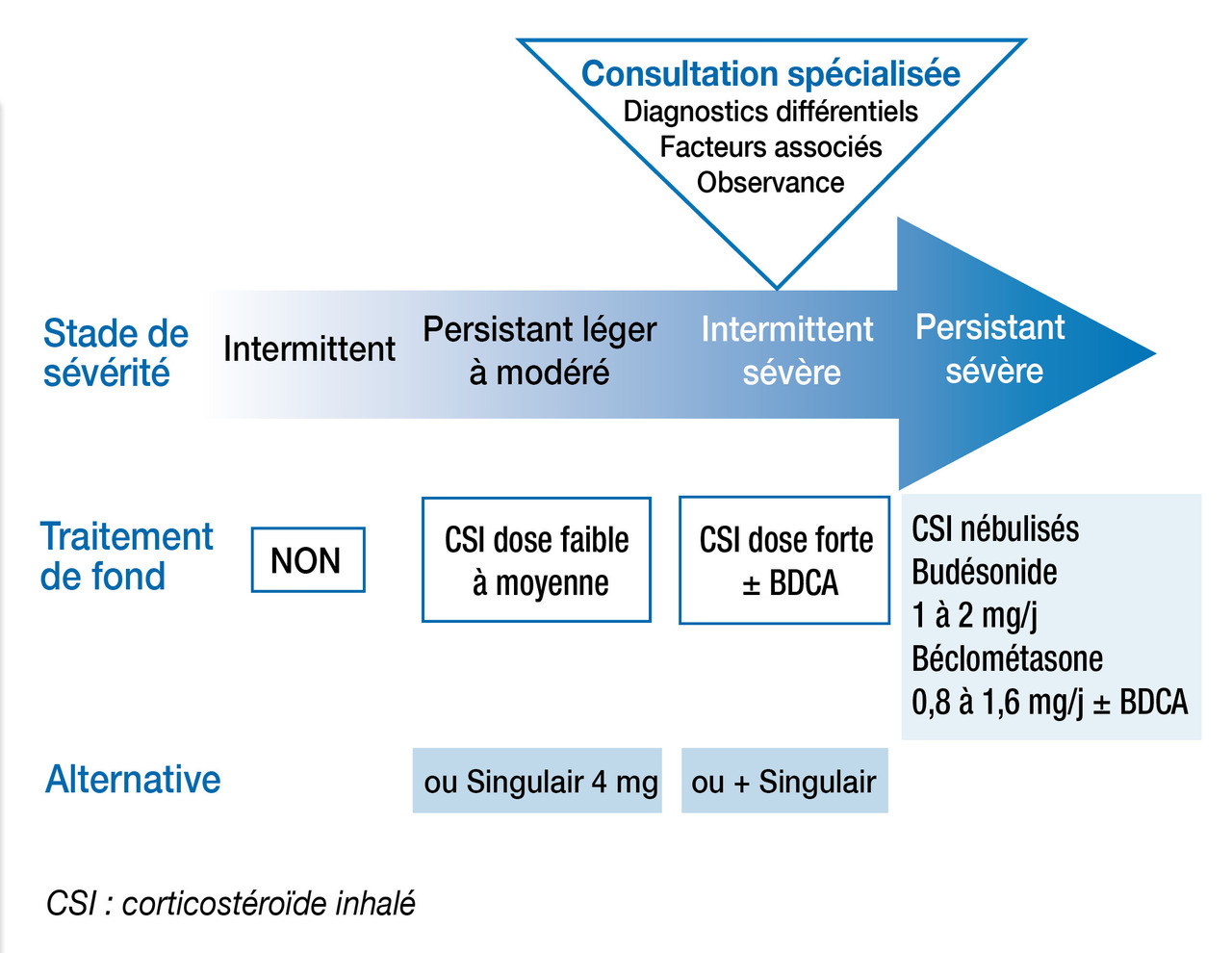
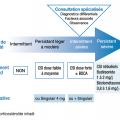
L’algorithme décisionnel (fig. 2 ) distingue 4 paliers où la pression thérapeutique croît avec la sévérité de la maladie :
– palier 1 : sifflements viro-induits peu fréquents ET peu de symptômes intercritiques : pas de traitement de fond ;
– palier 2 : signes insuffisamment contrôlés ou plus d’une exacerbation dans l’année ayant nécessité des corticoïdes : CI à faible dose quotidienne. Un test thérapeutique de 3 mois avec ce schéma peut être proposé en cas de symptômes peu compatibles avec un asthme quand les sifflements sont fréquents (toutes les 6-8 semaines). Une alternative est possible par des CI intermittents (mais la littérature est contradictoire) ou par le montélukast lorsque les manifestations sont essentiellement viro-induites ou favorisées par l’exercice, en l’absence de terrain atopique ;
– palier 3 : situation hors de contrôle malgré des CI à faible dose : doublement de la posologie (jusqu’à la dose moyenne) ou adjonction de montélukast ;
– palier 4 : état respiratoire toujours incontrôlé : vérifier la technique, l’observance, l’exposition, avant d’adresser l’enfant en mileu spécialisé pour discuter le diagnostic et la nébulisation de corticoïdes inhalés.
La réponse au traitement doit être régulièrement évaluée : tous les 3 à 6 mois.
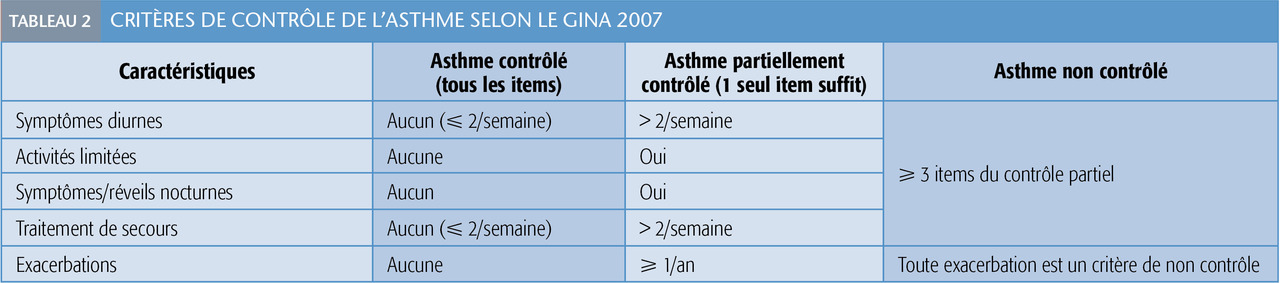
La clinique prime dans la surveillance du nourrisson : efficacité du traitement (tableau 2 ), observance, tolérance : croissance staturale, muguet buccal ou péribuccal…
Après stabilisation, on tente de réduire la posologie corticoïde progressivement jusqu’au seuil minimal efficace (tableau 2). Chez la plupart des jeunes enfants, il est possible de l’interrompre pendant la période estivale :
– si l’asthme est bien contrôlé cliniquement et fonctionnellement depuis 2-3 mois, on diminue le CI par paliers de 25 à 50 % en fonction de la posologie initiale, en visant le maintien du contrôle total. Lors de cette décroissance, le passage à une monoprise quotidienne est envisageable pour favoriser l’observance ;
– si la situation paraît insuffisamment contrôlée : avant de renforcer le traitement, il est essentiel de rechercher un défaut d’observance, une technique d’inhalation inadaptée, un environnement délétère (cf. infra).
D’une manière générale, ces derniers sont un asthme non contrôlé, au moins une crise sévère dans l’année précédente, un tabagisme environnemental, la pollution intérieure et extérieure, une exposition allergénique, une mauvaise compliance et des problèmes psycho-sociaux importants. L’évolution vers une obstruction bronchique pérenne est liée à la fréquence des hospitalisations antérieures.
L’algorithme décisionnel (
– palier 1 : sifflements viro-induits peu fréquents ET peu de symptômes intercritiques : pas de traitement de fond ;
– palier 2 : signes insuffisamment contrôlés ou plus d’une exacerbation dans l’année ayant nécessité des corticoïdes : CI à faible dose quotidienne. Un test thérapeutique de 3 mois avec ce schéma peut être proposé en cas de symptômes peu compatibles avec un asthme quand les sifflements sont fréquents (toutes les 6-8 semaines). Une alternative est possible par des CI intermittents (mais la littérature est contradictoire) ou par le montélukast lorsque les manifestations sont essentiellement viro-induites ou favorisées par l’exercice, en l’absence de terrain atopique ;
– palier 3 : situation hors de contrôle malgré des CI à faible dose : doublement de la posologie (jusqu’à la dose moyenne) ou adjonction de montélukast ;
– palier 4 : état respiratoire toujours incontrôlé : vérifier la technique, l’observance, l’exposition, avant d’adresser l’enfant en mileu spécialisé pour discuter le diagnostic et la nébulisation de corticoïdes inhalés.
La réponse au traitement doit être régulièrement évaluée : tous les 3 à 6 mois.
La clinique prime dans la surveillance du nourrisson : efficacité du traitement (
Après stabilisation, on tente de réduire la posologie corticoïde progressivement jusqu’au seuil minimal efficace (tableau 2). Chez la plupart des jeunes enfants, il est possible de l’interrompre pendant la période estivale :
– si l’asthme est bien contrôlé cliniquement et fonctionnellement depuis 2-3 mois, on diminue le CI par paliers de 25 à 50 % en fonction de la posologie initiale, en visant le maintien du contrôle total. Lors de cette décroissance, le passage à une monoprise quotidienne est envisageable pour favoriser l’observance ;
– si la situation paraît insuffisamment contrôlée : avant de renforcer le traitement, il est essentiel de rechercher un défaut d’observance, une technique d’inhalation inadaptée, un environnement délétère (cf. infra).
Mesures non médicamenteuses
élément capital, contribue à la lutte contre l’inflammation bronchique et sa pérennisation. Les facteurs allergiques y tiennent une place importante (déclenchement des exacerbations mais pas seulement).
Plusieurs interventions cherchent à réduire l’exposition aux acariens :
– baisse de l’humidité relative ;
– choix d’une literie synthétique, de housses anti-acariens ;
– suppression des tapis, tentures et moquettes, ou nettoyage régulier avec des acaricides, ou produits textiles incorporant ces produits ;
– lavage régulier des draps à une température supérieure à 55 °C, aspirateurs munis de filtres spéciaux.
L’hygiène domestique comporte :
– désinsectisation (blattes) ;
– limitation des contacts allergènes extérieurs, en particulier les pollens ;
– éviction des animaux domestiques auxquels l’enfant est allergique ;
– lutte contre les moisissures ;
– suppression du tabagisme environnemental.
Plusieurs interventions cherchent à réduire l’exposition aux acariens :
– baisse de l’humidité relative ;
– choix d’une literie synthétique, de housses anti-acariens ;
– suppression des tapis, tentures et moquettes, ou nettoyage régulier avec des acaricides, ou produits textiles incorporant ces produits ;
– lavage régulier des draps à une température supérieure à 55 °C, aspirateurs munis de filtres spéciaux.
L’hygiène domestique comporte :
– désinsectisation (blattes) ;
– limitation des contacts allergènes extérieurs, en particulier les pollens ;
– éviction des animaux domestiques auxquels l’enfant est allergique ;
– lutte contre les moisissures ;
– suppression du tabagisme environnemental.
manifestations aiguës
La gestion des exacerbations doit être anticipée. Un plan d’action écrit et expliqué doit permettre aux parents de reconnaître et traiter la crise dès ses prodromes, selon leur sévérité. Il les incite à appeler le médecin (ou le système de soins) en l’absence de réponse à un bêta 2-mimétique au bout d’1 heure ou lorsque la crise est inhabituelle.
Pour soulager les symptômes ponctuels, on privilégie les BDCA disponibles en plusieurs dispositifs : aérosols-doseurs (AD) pressurisés couplés à une chambre d’inhalation, et nébulisations.
Les épisodes aigus minimes à modérés peuvent être traités en ambulatoire, à domicile ou au cabinet médical : bouffées de BDCA (en aérosol-doseur,encadré 2 ) dans une chambre d’inhalation avec masque facial pendant 1 heure au maximum si nécessaire, puis traitement d’entretien de 5 à 7 jours avec ces mêmes médicaments.
En cas de persistance de la dyspnée après 1 heure, ou plus tôt si elle est importante, le plan d’action comporte aussi des corticoïdes oraux à administrer à la maison ou au cabinet médical s’ils n’ont pas été donnés à domicile. En l’absence d’amélioration de la gêne respiratoire au bout d’1 heure de ce traitement bien conduit, l’épisode aigu est considéré comme sévère et impose le passage aux urgences pour mettre en place des nébulisations de BDCA en première intention et poursuivre la corticothérapie systémique (orale, voire IV pour les plus sévères).
Pour soulager les symptômes ponctuels, on privilégie les BDCA disponibles en plusieurs dispositifs : aérosols-doseurs (AD) pressurisés couplés à une chambre d’inhalation, et nébulisations.
Les épisodes aigus minimes à modérés peuvent être traités en ambulatoire, à domicile ou au cabinet médical : bouffées de BDCA (en aérosol-doseur,
En cas de persistance de la dyspnée après 1 heure, ou plus tôt si elle est importante, le plan d’action comporte aussi des corticoïdes oraux à administrer à la maison ou au cabinet médical s’ils n’ont pas été donnés à domicile. En l’absence d’amélioration de la gêne respiratoire au bout d’1 heure de ce traitement bien conduit, l’épisode aigu est considéré comme sévère et impose le passage aux urgences pour mettre en place des nébulisations de BDCA en première intention et poursuivre la corticothérapie systémique (orale, voire IV pour les plus sévères).
Prise en charge à l’hôpital
Les BDCA sont donc nébulisés et accompagnés d’oxygène au masque à un débit de 6 à 8 L/min en surveillant la saturation en O2 (oxymètre de pouls).
Une oxygénothérapie par lunettes nasales peut être nécessaire entre les nébulisations : elle vise à maintenir des saturations cibles : 92 % lors du sommeil et 94 % à l’éveil.
Posologie du salbutamol : 2,5 mg/2,5 mL si le poids est inférieur à 16 kg et 5 mg/2,5 mL au-delà de 16 kg (ou 0,15 mg/kg ; au minimum 1,25 mg, au maximum 5 mg) ;
Ou terbutaline : 0,1 à 0,2 mg/kg (au maximum 5 mg = 1 dosette de 2 mL).
Les nébulisations sont répétées toutes les 15 minutes avec un minimum de 3 dans l’heure d’administration.
En cas d’exacerbation sévère, on peut leur associer de l’ipratropium par la même voie (Atrovent, 0,25 mg, jusqu’à 6 ans).
En l’absence d’amélioration, les nébulisations sont remplacées par des BDCA injectables :
– salbutamol par voie intraveineuse avec une dose de charge de 1,5 à 5 μg/kg administrée en 3 minutes ;
– ou terbutaline par voie sous-cutanée (à partir de 2 ans) à la posologie de 10 μg/kg.
La corticothérapie orale est la prednisone ou prednisolone (1 à 2 mg/kg) ou la bétaméthasone (0,15 à 0,3 mg/kg) durant 3 à 5 jours.
Les antibiotiques sont généralement inutiles.
Après une exacerbation, il est recommandé chez les jeunes enfants déjà traités d’augmenter le traitement de fond par corticoïdes inhalés (passer au palier supérieur), ou d’en instaurer un chez ceux qui n’en avaient pas (fig. 2 ).
Une oxygénothérapie par lunettes nasales peut être nécessaire entre les nébulisations : elle vise à maintenir des saturations cibles : 92 % lors du sommeil et 94 % à l’éveil.
Posologie du salbutamol : 2,5 mg/2,5 mL si le poids est inférieur à 16 kg et 5 mg/2,5 mL au-delà de 16 kg (ou 0,15 mg/kg ; au minimum 1,25 mg, au maximum 5 mg) ;
Ou terbutaline : 0,1 à 0,2 mg/kg (au maximum 5 mg = 1 dosette de 2 mL).
Les nébulisations sont répétées toutes les 15 minutes avec un minimum de 3 dans l’heure d’administration.
En cas d’exacerbation sévère, on peut leur associer de l’ipratropium par la même voie (Atrovent, 0,25 mg, jusqu’à 6 ans).
En l’absence d’amélioration, les nébulisations sont remplacées par des BDCA injectables :
– salbutamol par voie intraveineuse avec une dose de charge de 1,5 à 5 μg/kg administrée en 3 minutes ;
– ou terbutaline par voie sous-cutanée (à partir de 2 ans) à la posologie de 10 μg/kg.
La corticothérapie orale est la prednisone ou prednisolone (1 à 2 mg/kg) ou la bétaméthasone (0,15 à 0,3 mg/kg) durant 3 à 5 jours.
Les antibiotiques sont généralement inutiles.
Après une exacerbation, il est recommandé chez les jeunes enfants déjà traités d’augmenter le traitement de fond par corticoïdes inhalés (passer au palier supérieur), ou d’en instaurer un chez ceux qui n’en avaient pas (
Devenir de l’enfant asthmatique préscolaire
Moins de la moitié des nourrissons siffleurs resteront asthmatiques après l’âge de 6 ans. Les risques de persistance sont la sévérité et la fréquence des manifestations initiales, une atopie (en particulier une sensibilisation précoce) et un tabagisme environnemental. Les CI permettent un contrôle efficace des symptômes mais ne changent pas l’histoire naturelle de la maladie.
Encadre
1. Signes évoquant un autre diagnostic
Encadre
2. Salbutamol en traitement d’urgence
• Aérosol-doseur : 4 à 10 bouffées toutes les 20 minutes trois fois, puis toutes les 1 à 4 heures en ambulatoire.
• Nébulisation : 0,15 mg/kg (au maximum 5 mg) toutes les 20 minutes, au minimum 3 dans l’heure, à l’hôpital. Unidose de 2,5 mg si le poids est inférieur à 16 kg
pour en savoir plus
– HAS. Asthme de l’enfant de moins de 36 mois : diagnostic, prise en charge et traitement en dehors des épisodes aigus. Mars 2009.
– Global Initiative for Asthma (GINA). Global Strategy for Asthma Management and Prevention, 2017. www.ginasthma.org
– Dubus JC, Baravalle-Einaudi M, Sterling B, Carsin A. Asthme du nourrisson et du jeune enfant : de quoi parle-t-on ? Rev Fr Allergol 2016;56:240-1.
– Pin I, Hullo E, Lierena C, Siroux V. Les corticoïdes inhalés peuvent-il influencer l’histoire naturelle de l’asthme de l’enfant ? Rev Fr Allergol 2016; 56:120-1.
– Le Bourgeois M. Effets sur la croissance des corticoïdes inhalés dans l’asthme de l’enfant. Rev Fr Allergol 2016;56:122-3.
– Global Initiative for Asthma (GINA). Global Strategy for Asthma Management and Prevention, 2017. www.ginasthma.org
– Dubus JC, Baravalle-Einaudi M, Sterling B, Carsin A. Asthme du nourrisson et du jeune enfant : de quoi parle-t-on ? Rev Fr Allergol 2016;56:240-1.
– Pin I, Hullo E, Lierena C, Siroux V. Les corticoïdes inhalés peuvent-il influencer l’histoire naturelle de l’asthme de l’enfant ? Rev Fr Allergol 2016; 56:120-1.
– Le Bourgeois M. Effets sur la croissance des corticoïdes inhalés dans l’asthme de l’enfant. Rev Fr Allergol 2016;56:122-3.

 Encadrés
Encadrés