L’asthme allergique touche préférentiellement les femmes à l’âge adulte. Ce biais pourrait être lié à un rôle protecteur des androgènes.
Évidence pour un biais lié au sexe
Ce biais paraît évident dans la prévalence, l’incidence et la sévérité de l’asthme allergique.
L’asthme allergique est une des pathologies chroniques les plus fréquentes affectant les moins de 45 ans en Europe.1 L’asthme est défini cliniquement et recouvre plusieurs entités phénotypiques. C’est une maladie hétérogène marquée par des symptômes persistants et des poussées aiguës. La notion d’hyperréactivité bronchique réversible est une notion importante à prendre en compte dans le diagnostic de l’asthme allergique. Les réponses immunes de type 2 sont très fréquemment associées à cette pathologie.1, 2 Des stratifications associées à une forte réponse inflammatoire de type 2, un profil mixte avec la détection de cytokines de type 2 et 17 ou majoritairement de l’interleukine (IL) 17 sont décrites et importantes en termes de phénotype de sévérité et de réponse au traitement. Une réponse inflammatoire associée aux lymphocytes Th17 est plus fréquemment notée dans les asthmes sévères avec la contribution de neutrophiles dans la réponse inflammatoire.1, 2 Il existe des différences liées au sexe, tant en ce qui concerne la prévalence de l’asthme que son phénotype.3 L’asthme est plus fréquent chez les garçons avant la puberté puis le biais s’inverse à l’âge adulte. La prévalence de l’asthme et sa sévérité sont plus importantes chez les filles après la puberté. Les femmes de plus de 25 ans ont davantage un asthme sévère et mal contrôlé, en partie associé à une résistance aux corticoïdes.1 Il est possible que cela soit en partie dû à la survenue d’asthmes tardifs chez les femmes.4, 5 Il faut toutefois souligner un taux de rémission plus élevé chez les garçons que chez les filles.6 Ce biais de sexe féminin dans la prévalence de l’asthme allergique est également retrouvé dans d’autres maladies respiratoires, comme le rhume des foins et la sinusite chronique, et ce quelle que soit l’origine ethnique des patients (v . tableau ). L’analyse de l’histoire naturelle de l’asthme au cours de l’enfance et de l’adolescence révèle une plus grande sévérité chez les garçons avant l’âge de 7 ans qui pourrait être due à une maturation des poumons plus lente et une production de surfactant moindre tôt dans la vie chez les garçons par comparaison avec les filles.7 La sévérité de l’asthme est la même dans les deux sexes entre 7 et 9 ans. Puis la pathologie s’améliore le plus souvent entre 7 et 17 ans.7 L’amélioration de la symptomatologie s’observe aussi chez les filles avant la puberté. En revanche, la puberté féminine s’accompagne fréquemment d’une aggravation des symptômes s’amplifiant au moins jusqu’à l’âge de 17 ans.7 De plus, l’étude longitudinale des enfants et des adolescents montre que l’augmentation de prévalence chez les filles précisément à la puberté est associée à un taux de rémission plus faible chez les filles que chez les garçons.1, 7 L’ensemble de ces observations suggère un rôle aggravant des hormones sexuelles féminines dans l’asthme. En contraste, la chute de l’incidence de l’asthme et l’augmentation du nombre de rémissions au moment de la puberté masculine plaident pour un rôle protecteur des hormones mâles. Il est communément admis que les androgènes jouent un rôle immunosuppresseur global.8 Les effets des androgènes sur l’asthme entreraient bien dans ce cadre. Bien qu’un rôle bénéfique des androgènes dans l’asthme via un effet sur le développement et les fonctions du poumon ne puisse pas être exclu,9 nous avons, avec d’autres auteurs, posé l’hypothèse que les changements de prédominance de l’asthme chez les mâles versus les femelles au moment de la puberté soient dus à des processus biologiques au cours desquels les hormones sexuelles en particulier masculines affectent directement le système immunitaire.3 Ci-dessous, nous rendrons compte des découvertes récentes pointant le rôle majeur des hormones sexuelles sur la régulation des acteurs de la réponse allergique en insistant sur l’effet récemment décrit des androgènes dans la régulation négative des cellules lymphoïdes innées de type 2 (ILC2), avec des conséquences bénéfiques dans l’asthme (fig. 1 ).
L’asthme allergique est une des pathologies chroniques les plus fréquentes affectant les moins de 45 ans en Europe.1 L’asthme est défini cliniquement et recouvre plusieurs entités phénotypiques. C’est une maladie hétérogène marquée par des symptômes persistants et des poussées aiguës. La notion d’hyperréactivité bronchique réversible est une notion importante à prendre en compte dans le diagnostic de l’asthme allergique. Les réponses immunes de type 2 sont très fréquemment associées à cette pathologie.1, 2 Des stratifications associées à une forte réponse inflammatoire de type 2, un profil mixte avec la détection de cytokines de type 2 et 17 ou majoritairement de l’interleukine (IL) 17 sont décrites et importantes en termes de phénotype de sévérité et de réponse au traitement. Une réponse inflammatoire associée aux lymphocytes Th17 est plus fréquemment notée dans les asthmes sévères avec la contribution de neutrophiles dans la réponse inflammatoire.1, 2 Il existe des différences liées au sexe, tant en ce qui concerne la prévalence de l’asthme que son phénotype.3 L’asthme est plus fréquent chez les garçons avant la puberté puis le biais s’inverse à l’âge adulte. La prévalence de l’asthme et sa sévérité sont plus importantes chez les filles après la puberté. Les femmes de plus de 25 ans ont davantage un asthme sévère et mal contrôlé, en partie associé à une résistance aux corticoïdes.1 Il est possible que cela soit en partie dû à la survenue d’asthmes tardifs chez les femmes.4, 5 Il faut toutefois souligner un taux de rémission plus élevé chez les garçons que chez les filles.6 Ce biais de sexe féminin dans la prévalence de l’asthme allergique est également retrouvé dans d’autres maladies respiratoires, comme le rhume des foins et la sinusite chronique, et ce quelle que soit l’origine ethnique des patients (
Mécanismes immunologiques responsables de l’asthme allergique
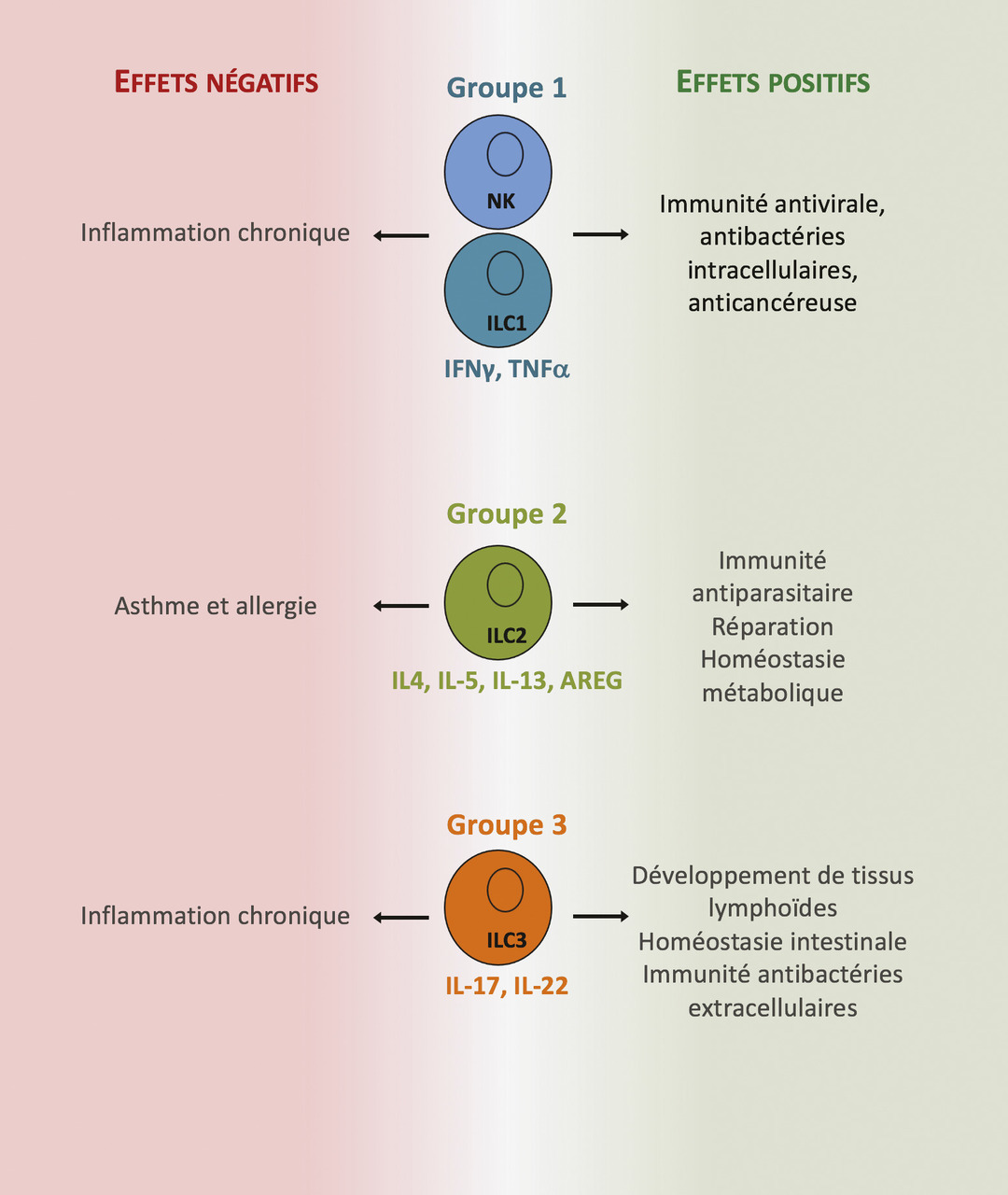
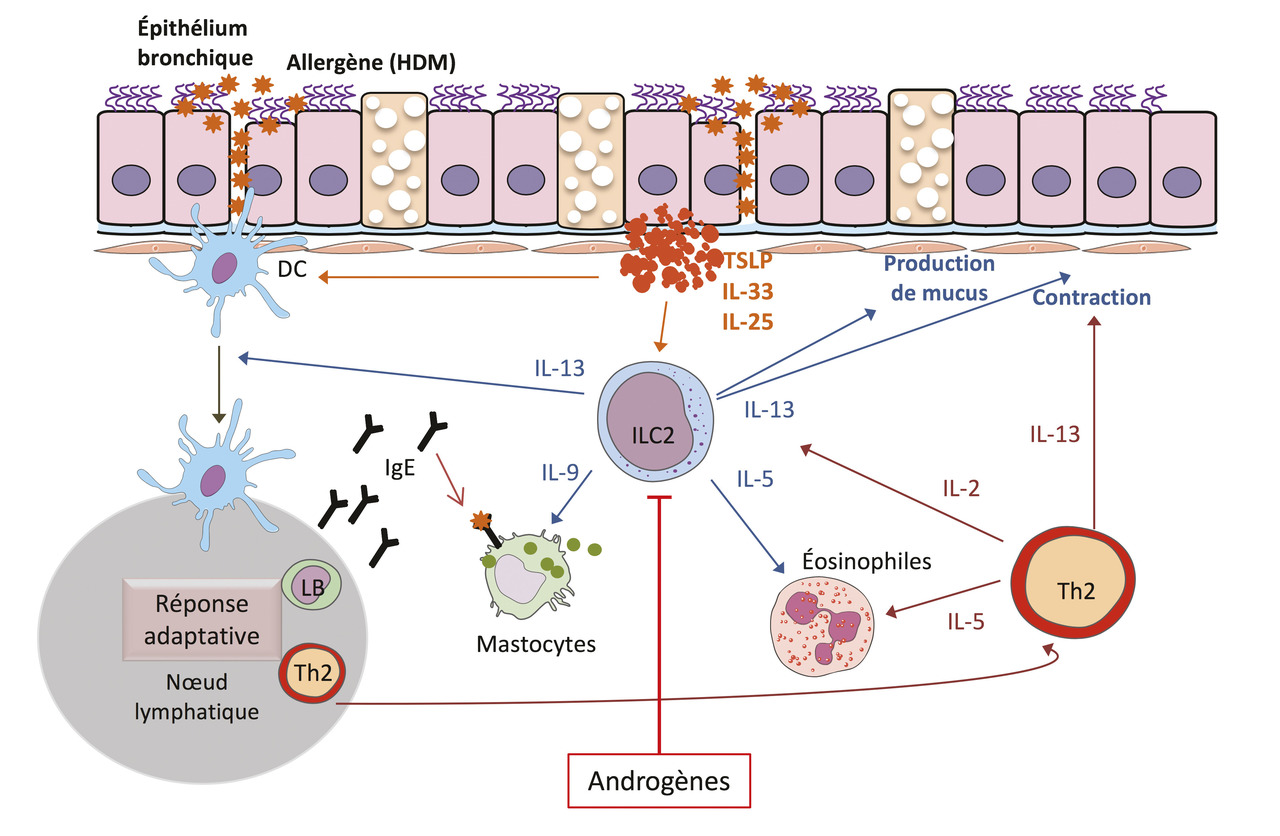
Les mécanismes immunologiques responsables de l’asthme allergique associé à une réponse inflammatoire de type 2 ont été décrits dans de nombreux articles y compris l’excellente revue de Lloyd et Snelgrove.2 Ici, nous nous focaliserons sur les événements clés conduisant à la maladie et l’inflammation de type 2. La découverte il y a plus de 10 ans des ILC2, cellules de l’immunité innée, comme une source importante et précoce de cytokines de type 2 (IL-5, IL-13, IL-9) dans le parenchyme pulmonaire a permis d’ajouter un acteur cellulaire pouvant jouer un rôle primordial dans l’initiation de la pathologie. Des alarmines (IL-33) et des cytokines (IL-25 et la lymphopoïétine stromale thymique [thymic stromal lymphopoietin, TSLP]) libérées par les cellules épithéliales à la suite de l’exposition à des allergènes sont capables d’activer les ILC2 localement. Un large panel d’allergènes de l’environnement (champignons, pollen, extraits d’acariens) ont une activité protéolytique intrinsèque permettant le clivage et l’activation complète de l’IL-33.10 Après activation, les ILC2 prolifèrent et sécrètent de grandes quantités d’IL-5 et d’IL-13. L’IL-5 promeut la différenciation et le recrutement d’éosinophiles dans le poumon, tandis que l’IL-13 joue un rôle pléiotropique conduisant à une production accrue de mucus et la bronchoconstriction. L’IL-9 favorise la prolifération des mastocytes et leur activation. Un modèle de souris déficientes en ILC2 a permis de démontrer non seulement leur rôle prédominant dans la réponse immune innée mais aussi leur rôle clé dans la génération de lymphocytes Th2 spécifiques des protéases de l’allergène ainsi que dans leur activité dans le poumon.11 L’IL-13 produite par les ILC2 instruisent les cellules dendritiques locales ayant capté l’allergène leur permettant de migrer dans le ganglion drainant et d’induire la différenciation de lymphocytes T spécifiques en lymphocytes Th2.11 Ces derniers vont contrôler la production d’immunoglobulines de type E (IgE) par des lymphocytes B spécifiques. Les immunoglobulines de type E ayant lié l’allergène se fixent au récepteur de forte affinité des IgE induisant la dégranulation des mastocytes et basophiles, participant ainsi à la réponse inflammatoire dans le poumon. Les Th2 migreront dans le poumon où ils seront réactivés localement et entretiendront la réaction inflammatoire via la sécrétion de cytokines de type 2. Ainsi, les ILC2 contribueraient à initier et augmenter la réponse immune adaptative de type 2 en agissant à plusieurs niveaux (fig. 2 ).
Chez l’humain, de nombreuses études ont aussi démontré une augmentation du nombre et de l’état d’activation des ILC2 dans des échantillons biologiques (sputum*, sang) provenant d’enfants ou d’adultes asthmatiques par comparaison avec des sujets non malades.12 De plus, des études génétiques à large échelle ont identifié des gènes de susceptibilité à l’asthme parmi ceux codant des protéines impliquées dans la biologie ILC2 (IL33, le récepteur à l’IL33 IL1RL1, RORA, IL2RB, et IL13).13, 14 Plus marquant encore, une étude récente a montré un polymorphisme génétique associé à l’asthme dans des éléments régulateurs de l’expression génique dans les ILC2.15 Toutes ces études chez l’humain sont en faveur d’un rôle pathogène des ILC2 dans l’asthme allergique.
Chez l’humain, de nombreuses études ont aussi démontré une augmentation du nombre et de l’état d’activation des ILC2 dans des échantillons biologiques (sputum*, sang) provenant d’enfants ou d’adultes asthmatiques par comparaison avec des sujets non malades.12 De plus, des études génétiques à large échelle ont identifié des gènes de susceptibilité à l’asthme parmi ceux codant des protéines impliquées dans la biologie ILC2 (IL33, le récepteur à l’IL33 IL1RL1, RORA, IL2RB, et IL13).13, 14 Plus marquant encore, une étude récente a montré un polymorphisme génétique associé à l’asthme dans des éléments régulateurs de l’expression génique dans les ILC2.15 Toutes ces études chez l’humain sont en faveur d’un rôle pathogène des ILC2 dans l’asthme allergique.
Impact des hormones sexuelles dans l’inflammation allergique de type 2
Comme chez l’humain, les souris femelles sont plus susceptibles à l’asthme que les mâles. Tous les signes cardinaux de l’asthme (concentration d’IgE, éosinophilie dans le poumon, présence de cytokines de type 2 dans le liquide bronchoalvéolaire et le parenchyme pulmonaire, hyperréactivité bronchique) sont plus marqués chez les femelles que ce soit dans les modèles d’asthme allergiques induits par l’ovalbumine (OVA) ou les extraits d’acariens (house dust mite [HDM]).3 Le biais lié au sexe pose la question du rôle respectif des hormones sexuelles masculines et féminines. Les effets des estrogènes dans l’asthme sont complexes rapportés par des études difficiles à réconcilier. Ainsi, des souris femelles castrées ont une production d’IgE, une infiltration d’éosinophiles et une hyperréactivité bronchiques moindres dans les modèles OVA et HDM16 suggérant que les hormones ovariennes amplifient la réponse inflammatoire de type 2. En revanche, les souris déficientes pour le récepteur aux estrogènes ERα développent une hyperréactivité bronchique après exposition à un allergène et même avant toute immunisation, sans effet sur l’inflammation. Il est possible que le récepteur ERα régule négativement l’hyperréactivité bronchique en agissant sur les cellules musculaires lisses ou les fibres nerveuses indépendamment de toute action sur les cellules immunocompétentes.17 Néanmoins cet effet protecteur d’ERα va à l’encontre des observations montrant la sévérité accrue de l’asthme chez les femmes pubères. Il faudra d’autres études pour montrer de façon claire si et comment les hormones sexuelles inclus les estrogènes (et la signalisation par ERα) ont un effet sur les cellules de type 2.
Par opposition, le rôle des androgènes et de la signalisation via le récepteur aux androgènes est clair permettant de conclure à un rôle protecteur des androgènes sur l’inflammation pulmonaire dans l’asthme. En effet, la castration des souris mâles abolit le biais lié aux sexe16 avec des souris développant une maladie aussi sévère que les femelles. L’administration de 5α-dihydrotestostérone (DHT) ou de déhydroépiandrostérone (DHEA), une hormone stéroïde naturelle produite par la glande surrénale pouvant être convertie en androgènes ou estrogènes, limite l’asthme induit par l’ovalbumine chez la souris mâle.3 Un effet bénéfique de l’administration de DHEA-3-sulfate par voie intranasale a même été rapporté dans une étude clinique chez des patients ayant un asthme modéré à sévère.18 De plus, des souris mutées pour le gène codant le récepteur aux androgènes (AR) de façon à ce que les androgènes ne puissent pas signaliser après fixation de l’hormone ont une éosinophilie en réponse aux acariens exacerbée par rapport aux contrôles, montrant que la signalisation par le récepteur AR limite la réponse de type 2 dans ce modèle.16 En conclusion, il apparaît que les androgènes et les estrogènes jouent des rôles opposés dans la susceptibilité à l’asthme. Des approches pharmacologiques et génétiques permettent de dresser un tableau plus clair des acteurs cellulaires impliqués dans ce biais lié au sexe de la susceptibilité à l’asthme. En particulier se dessine nettement la relation entre ILC2, androgènes et protection contre l’asthme.
Par opposition, le rôle des androgènes et de la signalisation via le récepteur aux androgènes est clair permettant de conclure à un rôle protecteur des androgènes sur l’inflammation pulmonaire dans l’asthme. En effet, la castration des souris mâles abolit le biais lié aux sexe16 avec des souris développant une maladie aussi sévère que les femelles. L’administration de 5α-dihydrotestostérone (DHT) ou de déhydroépiandrostérone (DHEA), une hormone stéroïde naturelle produite par la glande surrénale pouvant être convertie en androgènes ou estrogènes, limite l’asthme induit par l’ovalbumine chez la souris mâle.3 Un effet bénéfique de l’administration de DHEA-3-sulfate par voie intranasale a même été rapporté dans une étude clinique chez des patients ayant un asthme modéré à sévère.18 De plus, des souris mutées pour le gène codant le récepteur aux androgènes (AR) de façon à ce que les androgènes ne puissent pas signaliser après fixation de l’hormone ont une éosinophilie en réponse aux acariens exacerbée par rapport aux contrôles, montrant que la signalisation par le récepteur AR limite la réponse de type 2 dans ce modèle.16 En conclusion, il apparaît que les androgènes et les estrogènes jouent des rôles opposés dans la susceptibilité à l’asthme. Des approches pharmacologiques et génétiques permettent de dresser un tableau plus clair des acteurs cellulaires impliqués dans ce biais lié au sexe de la susceptibilité à l’asthme. En particulier se dessine nettement la relation entre ILC2, androgènes et protection contre l’asthme.
Régulation des ILC2 par la signalisation dépendant du récepteur aux androgènes
Le rôle central des ILC2 dans la pathophysiologie de l’asthme et le biais lié au sexe nous ont poussé à suspecter une régulation différente des ILC2 chez les hommes et les femmes. En effet, la fréquence et le nombre absolu d’ILC2 sont supérieures dans les poumons, le tissu adipeux et les ganglions mésentériques chez les souris femelles par comparaison avec les mâles.19 Cette proportion plus élevée d’ILC2 dans les poumons des femelles se retrouve aussi dans des conditions inflammatoires en réponse à l’IL-33,19 ou à l’administration d’extraits du champignon Alternaria alternata.20 Les différences dans le nombre et le phénotype des ILC2 entre mâles et femelles sont associées à la plus grande capacité des ILC2 femelles à produire de IL-5 et de l’IL-13.21 L’ensemble des travaux réalisés montre que les androgènes produits naturellement chez les mâles pourraient être responsables des différences liées au sexe dans le nombre et le phénotype des ILC2. En effet, nous avons démontré que l’activation du récepteur aux androgènes dans les ILC2 serait un frein majeur pour leur développement et leur expansion in vivo.3 Dans un modèle in vitro de différenciation des ILC2 sous l’influence de l’IL-33, l’ajout d’androgène 5α-DHT ou d’un agoniste sélectif du récepteur AR diminue le développement des ILC2 suggérant que l’effet des androgènes dépend de la signalisation via leur récepteur nucléaire AR dans les ILC2 et/ou leurs précurseurs (ILC2p) dans la moelle osseuse.19 En effet, les ILC2p et les ILC2 du poumon expriment sélectivement le gène Ar et non ceux codant les autres récepteurs aux hormones sexuelles, comme les récepteurs aux estrogènes ou à la progestérone.22 L’absence de récepteur aux estrogènes dans les ILC2 du poumon explique bien l’absence d’effet de l’ovariectomie, de l’administration d’estrogènes ou de la délétion du récepteur aux estrogènes Esr-1 sur le nombre d’ILC2 dans le poumon.19
Chez l’homme, en accord avec les données chez la souris, le nombre d’ILC2 circulants est plus élevé chez les femmes asthmatiques que chez les hommes asthmatiques.20 Ces résultats seront cependant à confirmer sur une cohorte de patients asthmatiques de plus grande envergure. Enfin, il reste à déterminer le rôle des androgènes dans la biologie des ILC2 chez l’humain et établir si des modulateurs du récepteur aux androgènes (SARM) peuvent avoir leur place dans le traitement de l’asthme.
Chez l’homme, en accord avec les données chez la souris, le nombre d’ILC2 circulants est plus élevé chez les femmes asthmatiques que chez les hommes asthmatiques.20 Ces résultats seront cependant à confirmer sur une cohorte de patients asthmatiques de plus grande envergure. Enfin, il reste à déterminer le rôle des androgènes dans la biologie des ILC2 chez l’humain et établir si des modulateurs du récepteur aux androgènes (SARM) peuvent avoir leur place dans le traitement de l’asthme.
* Sputum : expectorations constituées d’un mélange de salive et de mucus provenant des voies respiratoires, généralement à la suite d’une infection ou d’une maladie comme l’asthme allergique, et souvent examiné au microscope pour faciliter le diagnostic médical.
Références
1. Edwards MR, Saglani S, Schwarze J, et al. Addressing unmet needs in understanding asthma mechanisms: from the European Asthma Research and Innovation Partnership (EARIP) Work Package (WP)2 collaborators. Eur Respir J 2017;49. pii:1602448.
2. Lloyd CM, Snelgrove RJ. Type 2 immunity: expanding our view. Sci Immunol 2018;3. pii:eaat1604.
3. Laffont S, Blanquart E, Guery JC. Sex differences in asthma: a key role of androgen-signaling in group 2 innate lymphoid cells. Front Immunol 2017;8:1069.
4. Almqvist C, Worm M, Leynaert B, working group of GA2LEN WP 2.5 Gender. Impact of gender on asthma in childhood and adolescence: a GA2LEN review. Allergy 2008;63:47-57.
5. Nicolai T, Pereszlenyiova-Bliznakova L, Illi S, Reinhardt D, von Mutius E. Longitudinal follow-up of the changing gender ratio in asthma from childhood to adulthood: role of delayed manifestation in girls. Pediatr Allergy Immunol 2003;14:280-3.
6. Arshad SH, Raza A, Lau L, et al. Pathophysiological characterization of asthma transitions across adolescence. Respir Res 2014;15:153.
7. Fu L, Freishtat RJ, Gordish-Dressman H, et al. Natural progression of childhood asthma symptoms and strong influence of sex and puberty. Ann Am Thorac Soc 2014;11:939-44.
8. Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol 2016;16:626-38.
9. Townsend EA, Miller VM, Prakash YS. Sex differences and sex steroids in lung health and disease. Endocr Rev 2012;33:1-47.
10. Cayrol C, Girard JP. Interleukin-33 (IL-33): a nuclear cytokine from the IL-1 family. Immunol Rev 2018;281:154-68.
11. Halim TY, Steer CA, Mathä L, et al. Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation. Immunity 2014;40:425-35.
12. Doherty TA, Broide DH. Airway innate lymphoid cells in the induction and regulation of allergy. Allergol Int 2019;68:9-16.
13. Moffatt MF, Gut IG, Demenais F, et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med 2010;363:1211-21.
14. Torgerson DG, Ampleford EJ, Chiu GY, et al. Meta-analysis of genome-wide association studies of asthma in ethnically diverse North American populations. Nat Genet 2011;43:887-92.
15. Stadhouders R, Li BWS, de Bruijn MJW, et al. Epigenome analysis links gene regulatory elements in group 2 innate lymphocytes to asthma susceptibility. J Allergy Clin Immunol 2018;142:1793-807.
16. Fuseini H, Yung JA, Cephus JY, et al. Testosterone decreases house dust mite-induced type 2 and IL-17A-mediated airway inflammation. J Immunol 2018;201:1843-54.
17. Carey MA, Card JW, Bradbury JA, et al. Spontaneous airway hyperresponsiveness in estrogen receptor-alpha-deficient mice. Am J Respir Crit Care Med 2007;175:126-35.
18. Wenzel SE, Robinson CB, Leonard JM, Panettieri Jr RA. Nebulized dehydroepiandrosterone-3-sulfate improves asthma control in the moderate-to-severe asthma results of a 6-week, randomized, double-blind, placebo-controlled study. Allergy Asthma Proc 2010;31:461-71.
19. Laffont S, Blanquart E, Savignac M, et al. Androgen signaling negatively controls group 2 innate lymphoid cells. J Exp Med 2017;214:1581-92.
20. Cephus JY, Stier MT, Fuseini H, et al. Testosterone attenuates group 2 innate lymphoid cell-mediated airway inflammation. Cell Reports 2017;21:2487-99.
21. Warren KJ, Sweeter JM, Pavlik JA, et al. Sex differences in activation of lung-related type 2 innate lymphoid cells in experimental asthma. Ann Allergy Asthma Immunol 2017;118:233-4.
22. Laffont S, Guery JC. Deconstructing the sex bias in allergy and autoimmunity: From sex hormones and beyond. Adv Immunol 2019;142:35-64.
2. Lloyd CM, Snelgrove RJ. Type 2 immunity: expanding our view. Sci Immunol 2018;3. pii:eaat1604.
3. Laffont S, Blanquart E, Guery JC. Sex differences in asthma: a key role of androgen-signaling in group 2 innate lymphoid cells. Front Immunol 2017;8:1069.
4. Almqvist C, Worm M, Leynaert B, working group of GA2LEN WP 2.5 Gender. Impact of gender on asthma in childhood and adolescence: a GA2LEN review. Allergy 2008;63:47-57.
5. Nicolai T, Pereszlenyiova-Bliznakova L, Illi S, Reinhardt D, von Mutius E. Longitudinal follow-up of the changing gender ratio in asthma from childhood to adulthood: role of delayed manifestation in girls. Pediatr Allergy Immunol 2003;14:280-3.
6. Arshad SH, Raza A, Lau L, et al. Pathophysiological characterization of asthma transitions across adolescence. Respir Res 2014;15:153.
7. Fu L, Freishtat RJ, Gordish-Dressman H, et al. Natural progression of childhood asthma symptoms and strong influence of sex and puberty. Ann Am Thorac Soc 2014;11:939-44.
8. Klein SL, Flanagan KL. Sex differences in immune responses. Nat Rev Immunol 2016;16:626-38.
9. Townsend EA, Miller VM, Prakash YS. Sex differences and sex steroids in lung health and disease. Endocr Rev 2012;33:1-47.
10. Cayrol C, Girard JP. Interleukin-33 (IL-33): a nuclear cytokine from the IL-1 family. Immunol Rev 2018;281:154-68.
11. Halim TY, Steer CA, Mathä L, et al. Group 2 innate lymphoid cells are critical for the initiation of adaptive T helper 2 cell-mediated allergic lung inflammation. Immunity 2014;40:425-35.
12. Doherty TA, Broide DH. Airway innate lymphoid cells in the induction and regulation of allergy. Allergol Int 2019;68:9-16.
13. Moffatt MF, Gut IG, Demenais F, et al. A large-scale, consortium-based genomewide association study of asthma. N Engl J Med 2010;363:1211-21.
14. Torgerson DG, Ampleford EJ, Chiu GY, et al. Meta-analysis of genome-wide association studies of asthma in ethnically diverse North American populations. Nat Genet 2011;43:887-92.
15. Stadhouders R, Li BWS, de Bruijn MJW, et al. Epigenome analysis links gene regulatory elements in group 2 innate lymphocytes to asthma susceptibility. J Allergy Clin Immunol 2018;142:1793-807.
16. Fuseini H, Yung JA, Cephus JY, et al. Testosterone decreases house dust mite-induced type 2 and IL-17A-mediated airway inflammation. J Immunol 2018;201:1843-54.
17. Carey MA, Card JW, Bradbury JA, et al. Spontaneous airway hyperresponsiveness in estrogen receptor-alpha-deficient mice. Am J Respir Crit Care Med 2007;175:126-35.
18. Wenzel SE, Robinson CB, Leonard JM, Panettieri Jr RA. Nebulized dehydroepiandrosterone-3-sulfate improves asthma control in the moderate-to-severe asthma results of a 6-week, randomized, double-blind, placebo-controlled study. Allergy Asthma Proc 2010;31:461-71.
19. Laffont S, Blanquart E, Savignac M, et al. Androgen signaling negatively controls group 2 innate lymphoid cells. J Exp Med 2017;214:1581-92.
20. Cephus JY, Stier MT, Fuseini H, et al. Testosterone attenuates group 2 innate lymphoid cell-mediated airway inflammation. Cell Reports 2017;21:2487-99.
21. Warren KJ, Sweeter JM, Pavlik JA, et al. Sex differences in activation of lung-related type 2 innate lymphoid cells in experimental asthma. Ann Allergy Asthma Immunol 2017;118:233-4.
22. Laffont S, Guery JC. Deconstructing the sex bias in allergy and autoimmunity: From sex hormones and beyond. Adv Immunol 2019;142:35-64.