Le traitement de la tuberculose connaît de grands progrès. Des combinaisons de nouveaux antituberculeux permettent de réduire la durée du traitement aussi bien dans les formes à bacilles sensibles que dans celles à bacilles multirésistants. La prise en compte de l’importance de l’atteinte anatomique et de la charge bacillaire permet d’envisager des stratégies personnalisées de durée variable… dans l’attente d’un « traitement universel ».
Mycobacterium tuberculosis, agent causal de la tuberculose (TB), reste, à ce jour, la première cause de décès par cause infectieuse due à un seul agent microbien. Ceci peut être expliqué, en partie, par le fait que le traitement standard de la tuberculose à bacilles sensibles, efficace dans 95 % des cas en situation d’essai contrôlé, est bien moins efficace dans « la vraie vie » du fait des difficultés d’observance inhérentes à un traitement long et complexe (6 mois, 4 antibiotiques) et à l’inefficacité de ce protocole contre le demi-million de nouveaux cas annuels de TB à bacilles multirésistants aux antibiotiques dans le monde (TB MDR, définie par une résistance à au moins la rifampicine et l’isoniazide).
Ce traitement standard des tuberculoses à bacilles sensibles est inchangé depuis quarante ans et celui des TB MDR a longtemps reposé sur des méta-analyses de cohortes conduisant à des recommandations de l’Organisation mondiale de la santé (OMS) fondées sur de faibles niveaux de preuve mais reprises par différentes sociétés savantes. Heureusement, depuis quelques années, la publication de plusieurs essais thérapeutiques a permis de valider de nouveaux protocoles, susceptibles de révolutionner le traitement de la tuberculose.
Ce traitement standard des tuberculoses à bacilles sensibles est inchangé depuis quarante ans et celui des TB MDR a longtemps reposé sur des méta-analyses de cohortes conduisant à des recommandations de l’Organisation mondiale de la santé (OMS) fondées sur de faibles niveaux de preuve mais reprises par différentes sociétés savantes. Heureusement, depuis quelques années, la publication de plusieurs essais thérapeutiques a permis de valider de nouveaux protocoles, susceptibles de révolutionner le traitement de la tuberculose.
Tuberculose à bacilles sensibles
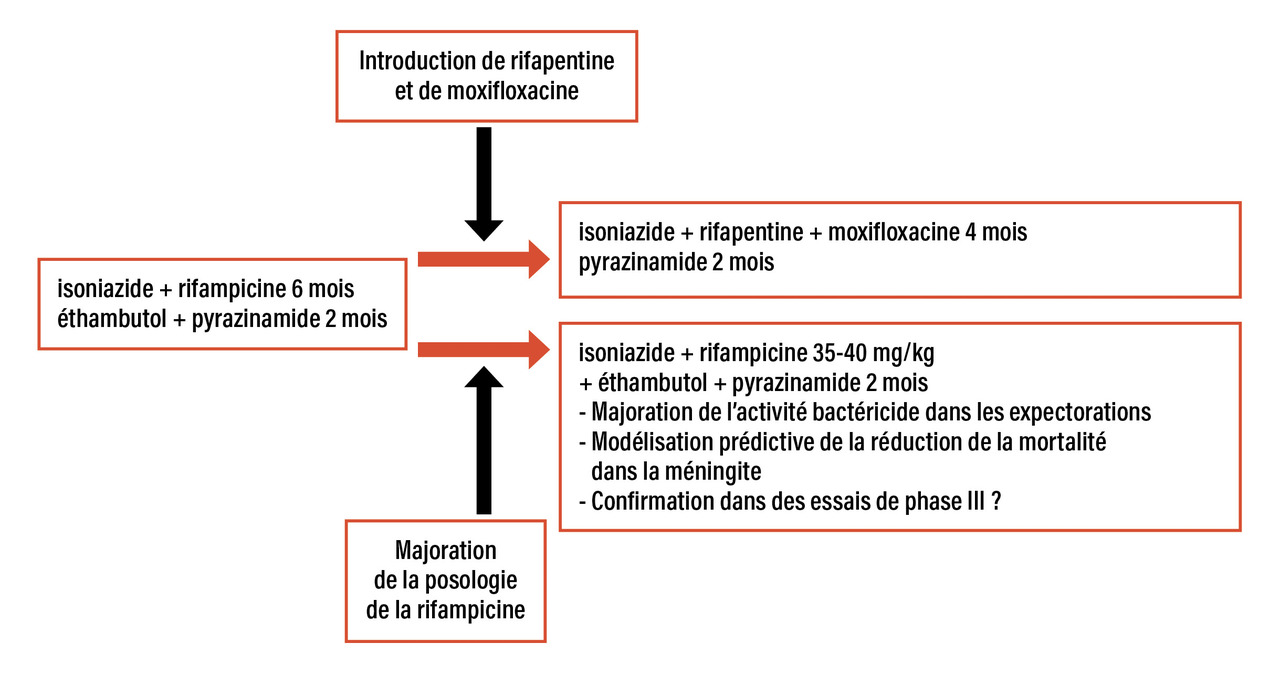
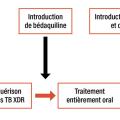
L’antibiotique clé du traitement standard de la tuberculose est la rifampicine, du fait de son activité bactéricide (c’est-à-dire sa capacité à détruire les bacilles extracellulaires de la caverne) mais surtout de son activité stérilisante (capacité à détruire les bacilles situés dans le caséum et ayant développé des phénomènes de tolérance au traitement antibiotique).1 C’est donc naturellement que de nouveaux traitements visent à optimiser l’utilisation de la rifampicine (fig. 1 ).
Activité bactéricide de la rifampicine améliorée par une dose augmentée
La posologie usuelle de 10 mg/kg a été récemment rediscutée. En effet, une étude d’escalade posologique a montré qu’une dose majorée jusqu’à 40 mg/kg améliorait graduellement l’activité bactéricide précoce, à savoir la capacité à réduire la charge bacillaire durant les deux premières semaines du traitement antituberculeux, sans majoration nette de la toxicité.2 Une première étude a échoué à prouver la non-infériorité de traitements de quatre mois avec une posologie majorée de rifampicine par rapport à un traitement standard de six mois.3 Dans la méningite tuberculeuse, une modélisation suggère que chaque palier de majoration de la posologie de la rifampicine s’accompagne d’une réduction de la mortalité.4
Ajout de la rifapentine pour diminuer la durée du traitement
La rifapentine, autre antibiotique de la famille des rifamycines, partage la même activité in vitro que la rifampicine mais a une demi-vie plus longue. De ce fait, à posologie équivalente, elle génère, chez le patient, une exposition (aire sous la courbe) plus importante que celle de la rifampicine. Une étude interventionnelle a montré qu’un traitement combinant la rifapentine à 20 mg/kg à une fluoroquinolone, la moxifloxacine, l’isoniazide et le pyrazinamide, est aussi efficace en quatre mois que le traitement standard de six mois.5 C’est la première fois qu’une réduction de la durée totale du traitement est obtenue dans la TB pulmonaire, justifiant la recommandation de ce protocole comme nouveau standard par l’OMS. Il faut toutefois noter que, pour que ce traitement puisse être mis en place de façon raisonnée, il faut que les tests de sensibilité aux fluoroquinolones soient réalisés en routine dans les laboratoires, ce qui n’est pas encore le cas. Par ailleurs, la question de la toxicité d’un protocole à base de fluoroquinolones nécessite des études dans plusieurs sous-populations (pédiatrique, gériatrique, etc.).
La longue demi-vie de la rifapentine a aussi été mise à profit pour simplifier le traitement de l’infection tuberculeuse latente. Une association d’isoniazide et de rifapentine administrée une fois par semaine pendant trois mois (soit 12 prises) s’est avérée aussi efficace qu’un traitement de neuf mois par isoniazide seul.6 Cette association a également été validée pour la chimioprophylaxie de la TB chez le sujet infecté par le VIH, mais avec une prise quotidienne pendant un mois.7
Malheureusement, la rifapentine n’a pas, à ce jour, d’autorisation de mise sur le marché (AMM) dans la plupart des pays européens dont la France, et le laboratoire qui la commercialise déclare ne pas souhaiter en faire une priorité pour le moment.
La longue demi-vie de la rifapentine a aussi été mise à profit pour simplifier le traitement de l’infection tuberculeuse latente. Une association d’isoniazide et de rifapentine administrée une fois par semaine pendant trois mois (soit 12 prises) s’est avérée aussi efficace qu’un traitement de neuf mois par isoniazide seul.6 Cette association a également été validée pour la chimioprophylaxie de la TB chez le sujet infecté par le VIH, mais avec une prise quotidienne pendant un mois.7
Malheureusement, la rifapentine n’a pas, à ce jour, d’autorisation de mise sur le marché (AMM) dans la plupart des pays européens dont la France, et le laboratoire qui la commercialise déclare ne pas souhaiter en faire une priorité pour le moment.
Tuberculose à bacilles résistants
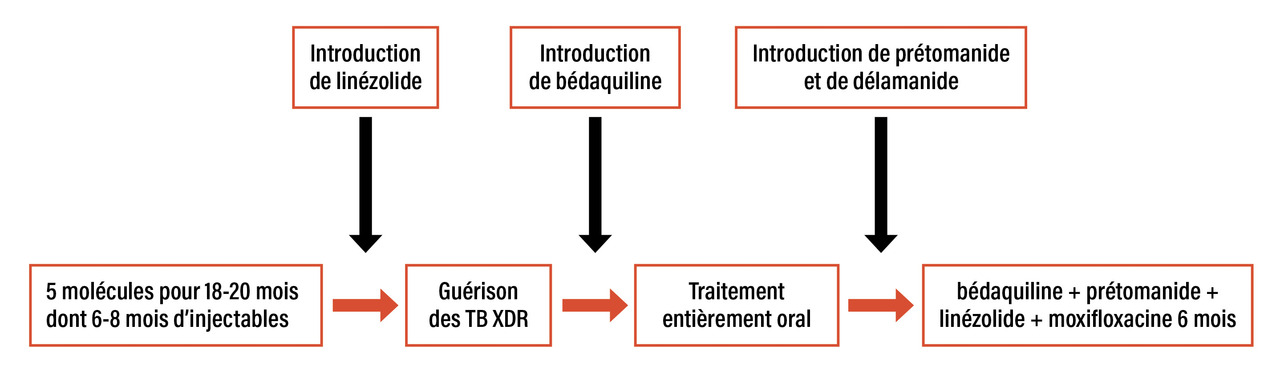
Les recommandations de l’OMS pour le traitement des TB MDR ont longtemps reposé sur une méta-analyse de données individuelles de prise en charge fournies rétrospectivement par plusieurs pays. Les résultats grevés de biais inhérents à la méthodologie ont soutenu la recommandation d’une longue durée de traitement et d’un régime unique pour tous les types de TB MDR (cinq molécules pour 18 à 20 mois dont 6 à 8 mois d’aminosides). La prise en charge très individualisée telle qu’elle est pratiquée en France avec l’aide de la réunion de concertation pluridisciplinaire (RCP) du Centre national de référence (CNR) des mycobactéries permettait de s’affranchir partiellement de ces recommandations. Néanmoins, il restait difficile de s’en éloigner en l’absence de données solides. L’arrivée de nouveaux antituberculeux a complètement changé la donne, offrant non seulement la perspective de protocoles plus efficaces et mieux tolérés mais aussi de niveaux de preuve bien meilleurs apportés par des études prospectives randomisées (fig. 2 ).
Apport du linézolide
Le linézolide est un inhibiteur de la synthèse protéique approuvé pour le traitement des infections à bactéries à Gram positif de la peau et des tissus mous. Son activité in vitro contre M. tuberculosis est équivalente à celle contre Streptococcus aureus. La démonstration claire de son activité a été faite dans une étude qui a inclus des cas de tuberculose à bacilles ultrarésistants (TB XDR) ou MDR en échec de traitement. Le traitement de ces patients, considérés en impasse thérapeutique, par une combinaison d’antibiotiques contenant le linézolide a permis de négativer la culture de leur expectoration dans 79 % des cas. Toutefois, le linézolide pâtit d’une toxicité importante (82 % d’effets indésirables sévères dans l’étude sus-citée) avec, en particulier, des neuropathies périphériques et optiques et une toxicité hématologique.8
Mécanisme d’action original pour la bédaquiline
La bédaquiline est véritablement le premier nouvel antituberculeux. Elle a un mécanisme d’action original : inhibition de l’ATP synthase impliquée dans la chaîne respiratoire bactérienne. Dans un essai randomisé contre placebo, la bédaquiline ajoutée à un traitement « classique » de TB MDR a permis d’augmenter les issues de traitement favorables de 32 à 58 %.9 Sa forte activité antituberculeuse combinée à sa tolérance ont permis de se passer des antibiotiques injectables et toxiques et d’entrer dans l’ère des traitements entièrement oraux de la TB MDR.10,11
Prétomanide ou délamanide en association
Le prétomanide et le délamanide sont deux molécules « cousines » dont les mécanismes d’action sont présumés identiques : inhibition de la synthèse de la paroi et intoxication à l’oxyde nitrique de la bactérie.
L’activité du délamanide a été démontrée dans un essai contre placebo de phase II pour le traitement des TB MDR de design similaire à celui de la bédaquiline, mais évaluant la négativation des cultures après deux mois de traitement.12 Toutefois, dans l’essai de phase III qui a suivi, le délamanide n’est pas apparu plus actif que le placebo quand il était ajouté à un traitement classique de TB MDR.13 Cette absence d’effet a été mise sur le compte d’un effectif trop limité pour atteindre la puissance statistique nécessaire du fait d’une hypothèse d’efficacité trop pessimiste pour le bras contrôle. Pour aller dans ce sens, il faut noter qu’une comparaison rétrospective de cohortes n’a pas montré de différences entre les patients ayant reçu un protocole à base de bédaquiline ou de délamanide, ce qui suggère que ces deux molécules ont un apport similaire.14
Jusqu’alors, les nouveaux antituberculeux étaient évalués un par un contre placebo. Ce type d’études a le mérite d’apporter une réponse claire sur l’intérêt de la nouvelle molécule mais l’inconvénient de prendre beaucoup de temps pour le développement de nouveaux protocoles thérapeutiques. L’étude Nix-TB a constitué une rupture avec ce dogme.15 Les auteurs ont fait le choix d’évaluer un protocole complètement nouveau : bédaquiline, prétomanide et linézolide pour traiter les TB XDR ou MDR en échec de traitement classique. L’absence de bras contrôle a été éthiquement justifiée par l’absence de protocole considéré comme efficace dans le traitement des TB MDR à l’époque. Cette étude a montré une issue de traitement favorable pour 90 % des patients inclus en seulement six à neuf mois de traitement (contre 18 à 20 mois pour le classique des TB MDR de l’époque). Depuis, plusieurs études ont développé, sur la base de ce protocole, de nouvelles combinaisons (tableau 1 ). La plus efficace semble être celle de l’essai prospectif randomisé comparatif conduit par Médecins sans frontières (MSF), TB-Practecal, associant moxifloxacine, bédaquiline, linézolide et prétomanide (89 % de succès, contre 77 % sans moxifloxacine).16 D’autres études ont confirmé que les protocoles de six mois à base de moxifloxacine, bédaquiline, linézolide et prétomanide ou délamanide permettent d’atteindre 90 % de succès en six mois. Dans l’ensemble, la tolérance de ces protocoles est correcte mais nécessite toujours une surveillance du risque de neuropathie liée au linézolide (tableau 2 ).
L’activité du délamanide a été démontrée dans un essai contre placebo de phase II pour le traitement des TB MDR de design similaire à celui de la bédaquiline, mais évaluant la négativation des cultures après deux mois de traitement.12 Toutefois, dans l’essai de phase III qui a suivi, le délamanide n’est pas apparu plus actif que le placebo quand il était ajouté à un traitement classique de TB MDR.13 Cette absence d’effet a été mise sur le compte d’un effectif trop limité pour atteindre la puissance statistique nécessaire du fait d’une hypothèse d’efficacité trop pessimiste pour le bras contrôle. Pour aller dans ce sens, il faut noter qu’une comparaison rétrospective de cohortes n’a pas montré de différences entre les patients ayant reçu un protocole à base de bédaquiline ou de délamanide, ce qui suggère que ces deux molécules ont un apport similaire.14
Jusqu’alors, les nouveaux antituberculeux étaient évalués un par un contre placebo. Ce type d’études a le mérite d’apporter une réponse claire sur l’intérêt de la nouvelle molécule mais l’inconvénient de prendre beaucoup de temps pour le développement de nouveaux protocoles thérapeutiques. L’étude Nix-TB a constitué une rupture avec ce dogme.15 Les auteurs ont fait le choix d’évaluer un protocole complètement nouveau : bédaquiline, prétomanide et linézolide pour traiter les TB XDR ou MDR en échec de traitement classique. L’absence de bras contrôle a été éthiquement justifiée par l’absence de protocole considéré comme efficace dans le traitement des TB MDR à l’époque. Cette étude a montré une issue de traitement favorable pour 90 % des patients inclus en seulement six à neuf mois de traitement (contre 18 à 20 mois pour le classique des TB MDR de l’époque). Depuis, plusieurs études ont développé, sur la base de ce protocole, de nouvelles combinaisons (
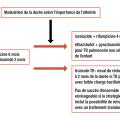
Prise en compte de l’importance de l’atteinte
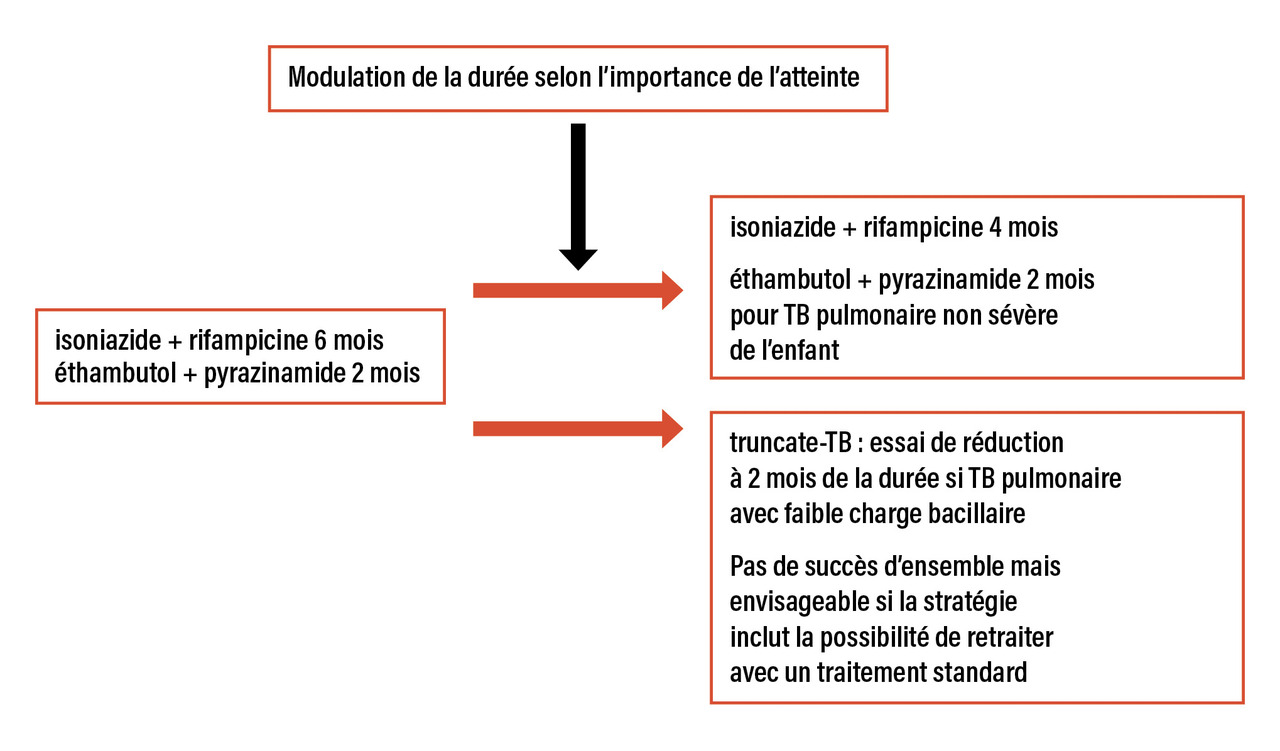
Le renouveau des antituberculeux avait débuté avec les fluoroquinolones pour lesquelles trois essais de raccourcissement de la durée de traitement ont montré qu’elles ne permettaient pas de la réduire à quatre mois dans la tuberculose pulmonaire. Dans ces études, la faible différence entre les bras interventionnels et les bras contrôles a conduit à faire des sous-analyses afin d’identifier les patients ayant des formes de tuberculose à risque d’évolution défavorable nécessitant une durée longue de traitement et ceux ayant une forme de bon pronostic qui pourraient être traitées pendant une durée plus courte. Il est apparu que les patients à risque d’évolution défavorable étaient ceux ayant une forte charge bacillaire dans les expectorations, ceux infectés par le virus de l’immunodéficience humaine (VIH) et ceux ayant une observance inférieure à 90 % des prises médicamenteuses. De façon intéressante, dans cette étude rétrospective, quatre mois de traitement étaient équivalents à six mois de traitement pour les cas à faible charge bacillaire caractérisés par l’absence de cavité ou une expectoration inférieure à 2+ bacilles acido-alcoolo-résistants (BAAR).17
La TB pulmonaire de l’enfant est justement caractérisée par sa faible charge bacillaire, à tel point qu’il est souvent difficile d’apporter la preuve diagnostique bactériologique. Cette population paraissait donc être bonne candidate à une stratégie de raccourcissement de la durée du traitement. C’est ce qui a été évalué dans l’essai SHINE : quatre mois de traitement pour les cas pédiatriques non compliqués (BAAR négatifs, un seul lobe atteint, pas de miliaire, pas de pleurésie compliquée, pas d’obstruction des voies aériennes). L’issue du traitement était favorable dans 97 % des cas dans le bras interventionnel contre 97 % dans le bras contrôle de six mois.18
Ces tentatives de réduction de la durée du traitement ont été poursuivies dans l’essai Truncate-TB chez les patients ayant une tuberculose à faible charge bacillaire.19 S’il ne permet pas de réduire à deux mois la durée pour tous les patients, cet essai de stratégie a néanmoins le mérite de montrer qu’avec les antibiotiques aujourd’hui disponibles un raccourcissement de durée de traitement est possible chez certains.
Le traitement de la tuberculose pulmonaire entre donc dans l’ère de la médecine personnalisée avec des durées de traitement qui dépendent non seulement des antibiotiques utilisés mais aussi du degré d’atteinte anatomique et de l’importance de la charge bacillaire.
La TB pulmonaire de l’enfant est justement caractérisée par sa faible charge bacillaire, à tel point qu’il est souvent difficile d’apporter la preuve diagnostique bactériologique. Cette population paraissait donc être bonne candidate à une stratégie de raccourcissement de la durée du traitement. C’est ce qui a été évalué dans l’essai SHINE : quatre mois de traitement pour les cas pédiatriques non compliqués (BAAR négatifs, un seul lobe atteint, pas de miliaire, pas de pleurésie compliquée, pas d’obstruction des voies aériennes). L’issue du traitement était favorable dans 97 % des cas dans le bras interventionnel contre 97 % dans le bras contrôle de six mois.18
Ces tentatives de réduction de la durée du traitement ont été poursuivies dans l’essai Truncate-TB chez les patients ayant une tuberculose à faible charge bacillaire.19 S’il ne permet pas de réduire à deux mois la durée pour tous les patients, cet essai de stratégie a néanmoins le mérite de montrer qu’avec les antibiotiques aujourd’hui disponibles un raccourcissement de durée de traitement est possible chez certains.
Le traitement de la tuberculose pulmonaire entre donc dans l’ère de la médecine personnalisée avec des durées de traitement qui dépendent non seulement des antibiotiques utilisés mais aussi du degré d’atteinte anatomique et de l’importance de la charge bacillaire.
Protocoles à venir
De nombreux nouveaux antibiotiques et combinaisons sont en développement actuellement (https://www.newtbdrugs.org/pipeline/clinical). Cela permettra peut-être d’effacer la distinction actuelle entre tuberculoses à bacilles sensibles et TB MDR ou XDR pour obtenir un protocole « universel ».
D’ores et déjà, la combinaison BPaLM (bédaquiline, prétomanide, linézolide, moxifloxacine), qui paraît très active en six mois, pourrait prétendre à cette appellation. Certes, elle est grevée par la toxicité du linézolide, mais le traitement standard actuel pose aussi des problèmes de tolérance, en particulier hépatique.
D’ores et déjà, la combinaison BPaLM (bédaquiline, prétomanide, linézolide, moxifloxacine), qui paraît très active en six mois, pourrait prétendre à cette appellation. Certes, elle est grevée par la toxicité du linézolide, mais le traitement standard actuel pose aussi des problèmes de tolérance, en particulier hépatique.
Références
1. Sarathy JP, Xie M, Jones RM, Chang A, Osiecki P, Weiner D, et al. A novel tool to identify bactericidal compounds against vulnerable targets in drug-tolerant M. tuberculosis found in caseum. mBio 2023;14(2):e0059823.
2. Te Brake LHM, de Jager V, Narunsky K, Vanker N, Svensson EM, Phillips PPJ, et al. Increased bactericidal activity but dose-limiting intolerability at 50 mg·kg-1 rifampicin. Eur Respir J 2021;58(1):2000955.
3. Jindani A, Atwine D, Grint D, Bah B, Adams J, Ticona ER, et al. Four-month high-dose rifampicin regimens for pulmonary tuberculosis. NEJM Evidence 2023;2(9):EVIDoa2300054.
4. Svensson EM, Dian S, Te Brake L, Ganiem AR, Yunivita V, van Laarhoven A, et al. Model-based meta-analysis of rifampicin exposure and mortality in Indonesian tuberculous meningitis trials. Clin Infect Dis 2020;71(8):1817‑23.
5. Dorman SE, Nahid P, Kurbatova EV, Phillips PPJ, Bryant K, Dooley KE, et al. Four-month rifapentine regimens with or without moxifloxacin for tuberculosis. N Engl J Med 2021;384(18):1705‑18.
6. Sterling TR, Villarino ME, Borisov AS, Shang N, Gordin F, Bliven-Sizemore E, et al. Three months of rifapentine and isoniazid for latent tuberculosis infection. N Engl J Med 2011;365(23):2155‑66.
7. Swindells S, Ramchandani R, Gupta A, Benson CA, Leon-Cruz J, Mwelase N, et al. One month of rifapentine plus isoniazid to prevent HIV-related tuberculosis. N Engl J Med 2019;380(11):1001‑11.
8. Lee M, Lee J, Carroll MW, Choi H, Min S, Song T, et al. Linezolid for treatment of chronic extensively drug-resistant tuberculosis. N Engl J Med 2012;367(16):1508‑18.
9. Diacon AH, Pym A, Grobusch MP, de los Rios JM, Gotuzzo E, Vasilyeva I, et al. Multidrug-resistant tuberculosis and culture conversion with bedaquiline. N Engl J Med 2014;371(8):723‑32.
10. Ndjeka N, Campbell JR, Meintjes G, Maartens G, Schaaf HS, Hughes J, et al. Treatment outcomes 24 months after initiating short, all-oral bedaquiline-containing or injectable-containing rifampicin-resistant tuberculosis treatment regimens in South Africa: A retrospective cohort study. Lancet Infect Dis 2022;S1473-3099(21)00811-2.
11. Goodall RL, Meredith SK, Nunn AJ, Bayissa A, Bhatnagar AK, Bronson G, et al. Evaluation of two short standardised regimens for the treatment of rifampicin-resistant tuberculosis (STREAM stage 2): An open-label, multicentre, randomised, non-inferiority trial. Lancet 2022;400(10366):1858‑68.
12. Gler MT, Skripconoka V, Sanchez-Garavito E, Xiao H, Cabrera-Rivero JL, Vargas-Vasquez DE, et al. Delamanid for multidrug-resistant pulmonary tuberculosis. N Engl J Med 2012;366(23):2151‑60.
13. von Groote-Bidlingmaier F, Patientia R, Sanchez E, Balanag V, Ticona E, Segura P, et al. Efficacy and safety of delamanid in combination with an optimised background regimen for treatment of multidrug-resistant tuberculosis: A multicentre, randomised, double-blind, placebo-controlled, parallel group phase 3 trial. Lancet Respir Med 2019;7(3):249‑59.
14. Hwang H, Kang H, Kwon YS, Jeon D, Shim TS, Yim JJ. Outcomes of multidrug-resistant tuberculosis treated with bedaquiline or delamanid. Clin Infect Dis 2021;73(8):1362‑9.
15. Conradie F, Diacon AH, Ngubane N, Howell P, Everitt D, Crook AM, et al. Treatment of highly drug-resistant pulmonary tuberculosis. New England Journal of Medicine 2020;382(10):893‑902.
16. Nyang’wa BT, Berry C, Kazounis E, Motta I, Parpieva N, Tigay Z, et al. A 24-week, all-oral regimen for rifampin-resistant tuberculosis. N Engl J Med 2022;387(25):2331‑43.
17. Imperial MZ, Nahid P, Phillips PPJ, Davies GR, Fielding K, Hanna D, et al. A patient-level pooled analysis of treatment-shortening regimens for drug-susceptible pulmonary tuberculosis. Nat Med 2018;24(11):1708‑15.
18. Turkova A, Wills GH, Wobudeya E, Chabala C, Palmer M, Kinikar A, et al. Shorter treatment for nonsevere tuberculosis in African and Indian children. N Engl J Med 2022;386(10):911‑22.
19. Paton NI, Cousins C, Suresh C, Burhan E, Chew KL, Dalay VB, et al. Treatment strategy for rifampin-susceptible tuberculosis. N Engl J Med 2023;388(10):873-87.
2. Te Brake LHM, de Jager V, Narunsky K, Vanker N, Svensson EM, Phillips PPJ, et al. Increased bactericidal activity but dose-limiting intolerability at 50 mg·kg-1 rifampicin. Eur Respir J 2021;58(1):2000955.
3. Jindani A, Atwine D, Grint D, Bah B, Adams J, Ticona ER, et al. Four-month high-dose rifampicin regimens for pulmonary tuberculosis. NEJM Evidence 2023;2(9):EVIDoa2300054.
4. Svensson EM, Dian S, Te Brake L, Ganiem AR, Yunivita V, van Laarhoven A, et al. Model-based meta-analysis of rifampicin exposure and mortality in Indonesian tuberculous meningitis trials. Clin Infect Dis 2020;71(8):1817‑23.
5. Dorman SE, Nahid P, Kurbatova EV, Phillips PPJ, Bryant K, Dooley KE, et al. Four-month rifapentine regimens with or without moxifloxacin for tuberculosis. N Engl J Med 2021;384(18):1705‑18.
6. Sterling TR, Villarino ME, Borisov AS, Shang N, Gordin F, Bliven-Sizemore E, et al. Three months of rifapentine and isoniazid for latent tuberculosis infection. N Engl J Med 2011;365(23):2155‑66.
7. Swindells S, Ramchandani R, Gupta A, Benson CA, Leon-Cruz J, Mwelase N, et al. One month of rifapentine plus isoniazid to prevent HIV-related tuberculosis. N Engl J Med 2019;380(11):1001‑11.
8. Lee M, Lee J, Carroll MW, Choi H, Min S, Song T, et al. Linezolid for treatment of chronic extensively drug-resistant tuberculosis. N Engl J Med 2012;367(16):1508‑18.
9. Diacon AH, Pym A, Grobusch MP, de los Rios JM, Gotuzzo E, Vasilyeva I, et al. Multidrug-resistant tuberculosis and culture conversion with bedaquiline. N Engl J Med 2014;371(8):723‑32.
10. Ndjeka N, Campbell JR, Meintjes G, Maartens G, Schaaf HS, Hughes J, et al. Treatment outcomes 24 months after initiating short, all-oral bedaquiline-containing or injectable-containing rifampicin-resistant tuberculosis treatment regimens in South Africa: A retrospective cohort study. Lancet Infect Dis 2022;S1473-3099(21)00811-2.
11. Goodall RL, Meredith SK, Nunn AJ, Bayissa A, Bhatnagar AK, Bronson G, et al. Evaluation of two short standardised regimens for the treatment of rifampicin-resistant tuberculosis (STREAM stage 2): An open-label, multicentre, randomised, non-inferiority trial. Lancet 2022;400(10366):1858‑68.
12. Gler MT, Skripconoka V, Sanchez-Garavito E, Xiao H, Cabrera-Rivero JL, Vargas-Vasquez DE, et al. Delamanid for multidrug-resistant pulmonary tuberculosis. N Engl J Med 2012;366(23):2151‑60.
13. von Groote-Bidlingmaier F, Patientia R, Sanchez E, Balanag V, Ticona E, Segura P, et al. Efficacy and safety of delamanid in combination with an optimised background regimen for treatment of multidrug-resistant tuberculosis: A multicentre, randomised, double-blind, placebo-controlled, parallel group phase 3 trial. Lancet Respir Med 2019;7(3):249‑59.
14. Hwang H, Kang H, Kwon YS, Jeon D, Shim TS, Yim JJ. Outcomes of multidrug-resistant tuberculosis treated with bedaquiline or delamanid. Clin Infect Dis 2021;73(8):1362‑9.
15. Conradie F, Diacon AH, Ngubane N, Howell P, Everitt D, Crook AM, et al. Treatment of highly drug-resistant pulmonary tuberculosis. New England Journal of Medicine 2020;382(10):893‑902.
16. Nyang’wa BT, Berry C, Kazounis E, Motta I, Parpieva N, Tigay Z, et al. A 24-week, all-oral regimen for rifampin-resistant tuberculosis. N Engl J Med 2022;387(25):2331‑43.
17. Imperial MZ, Nahid P, Phillips PPJ, Davies GR, Fielding K, Hanna D, et al. A patient-level pooled analysis of treatment-shortening regimens for drug-susceptible pulmonary tuberculosis. Nat Med 2018;24(11):1708‑15.
18. Turkova A, Wills GH, Wobudeya E, Chabala C, Palmer M, Kinikar A, et al. Shorter treatment for nonsevere tuberculosis in African and Indian children. N Engl J Med 2022;386(10):911‑22.
19. Paton NI, Cousins C, Suresh C, Burhan E, Chew KL, Dalay VB, et al. Treatment strategy for rifampin-susceptible tuberculosis. N Engl J Med 2023;388(10):873-87.