Près de 20 % des cancers du sein ont une surexpression de la protéine HER2. L’identification du statut HER2 conditionne la prise en charge, au stade localisé comme au stade métastatique. L’arrivée des thérapies ciblées a nettement amélioré le pronostic des cancers du sein métastatiques.
En France, le cancer du sein reste le premier cancer chez la femme en matière d’incidence et de mortalité avec 58 500 nouveaux cas en 2018, dont 15 à 20 % ont une surexpression de la protéine HER2.
Historiquement, la surexpression de HER2 était un facteur de mauvais pronostic du cancer du sein, avec un risque de récidive plus élevé au stade localisé et une survie globale plus courte au stade métastatique. Avec l’arrivée des traitements ciblant HER2, et notamment du trastuzumab en 1998, le pronostic s’est considérablement amélioré, devenant même meilleur que celui des cancers du sein ne surexprimant pas HER2.1
Depuis lors, le développement de nouvelles molécules ciblant HER2, notamment des anticorps conjugués (associant un anticorps monoclonal et des molécules de chimiothérapie via une molécule de liaison), a de nouveau modifié la prise en charge de cette maladie.
Historiquement, la surexpression de HER2 était un facteur de mauvais pronostic du cancer du sein, avec un risque de récidive plus élevé au stade localisé et une survie globale plus courte au stade métastatique. Avec l’arrivée des traitements ciblant HER2, et notamment du trastuzumab en 1998, le pronostic s’est considérablement amélioré, devenant même meilleur que celui des cancers du sein ne surexprimant pas HER2.1
Depuis lors, le développement de nouvelles molécules ciblant HER2, notamment des anticorps conjugués (associant un anticorps monoclonal et des molécules de chimiothérapie via une molécule de liaison), a de nouveau modifié la prise en charge de cette maladie.
Détermination du statut HER2 indispensable
Le gène HER2 est situé sur le chromosome 17 et encode un récepteur transmembranaire de la famille de l’EGFR (epidermal growth factor receptor [récepteur de facteur de croissance épidermique]). Ce dernier forme des hétérodimères avec les autres récepteurs de la même famille et active de multiples voies de signalisation intracellulaire, favorisant la croissance et la prolifération des cellules tumorales, ainsi que leur résistance aux chimiothérapies et hormonothérapies anticancéreuses.
La détermination du statut HER2 doit être systématique pour tous les cancers du sein ; elle conditionne la prise en charge, au stade localisé comme au stade métastatique.
La première détermination est réalisée en immunohistochimie, évaluant la densité des récepteurs au niveau de la membrane cellulaire, définissant un statut HER2 0, 1, 2 ou 3+. Les résultats 0 et 1 sont considérés « HER2 non surexprimé », les résultats 3+ « HER2 surexprimé » (HER2+). Pour les HER2 2+, une recherche de l’amplification du gène par hybridation in situ (FISH ou DISH) doit être réalisée.2
La détermination du statut HER2 doit être systématique pour tous les cancers du sein ; elle conditionne la prise en charge, au stade localisé comme au stade métastatique.
La première détermination est réalisée en immunohistochimie, évaluant la densité des récepteurs au niveau de la membrane cellulaire, définissant un statut HER2 0, 1, 2 ou 3+. Les résultats 0 et 1 sont considérés « HER2 non surexprimé », les résultats 3+ « HER2 surexprimé » (HER2+). Pour les HER2 2+, une recherche de l’amplification du gène par hybridation in situ (FISH ou DISH) doit être réalisée.2
Amélioration du pronostic du cancer du sein métastatique
Première ligne métastatique
En première ligne métastatique de cancer du sein HER2+, l’ajout du trastuzumab (anticorps monoclonal ciblant HER2) à une chimiothérapie conventionnelle par taxanes augmente la survie sans progression (médiane 6,9 vs 3 mois ; p < 0,001), le taux de réponse objective (38 % vs 16 %, p < 0,001) et la survie globale (médiane 22,1 vs 18,4 mois ; p = 0,17).3 La principale toxicité est le risque de dysfonction cardiaque ventriculaire gauche, nécessitant une surveillance régulière, plus importante en cas d’association aux anthracyclines (27 % dans ce cas) ; cette association étant, de fait, contre-indiquée. Depuis 2000, il est utilisé en première ligne en association aux taxanes (docétaxel ou paclitaxel).
En 2012, l’ajout au trastuzumab et au docétaxel d’un second anticorps monoclonal, le pertuzumab, lui aussi anti-HER2, a démontré une amélioration de la survie sans progression (18,5 vs 12,4 mois (hazard ratio [HR] : 0,62 ; intervalle de confiance à 95 % [IC à 95 %] : 0,51-0,75 ; p < 0,001) et en survie globale (médiane de 56,5 vs 40,8 mois, HR : 0,68 ; IC à 95 % : 0,56-0,84 ; p < 0,001).4 Sur le plan de la tolérance, il est retrouvé une augmentation des diarrhées et des neutropénies fébriles sans modification du taux de dysfonction ventriculaire gauche. Cette association est actuellement le traitement de référence, le paclitaxel étant régulièrement substitué au docétaxel pour améliorer la tolérance à la chimiothérapie.
En 2012, l’ajout au trastuzumab et au docétaxel d’un second anticorps monoclonal, le pertuzumab, lui aussi anti-HER2, a démontré une amélioration de la survie sans progression (18,5 vs 12,4 mois (hazard ratio [HR] : 0,62 ; intervalle de confiance à 95 % [IC à 95 %] : 0,51-0,75 ; p < 0,001) et en survie globale (médiane de 56,5 vs 40,8 mois, HR : 0,68 ; IC à 95 % : 0,56-0,84 ; p < 0,001).4 Sur le plan de la tolérance, il est retrouvé une augmentation des diarrhées et des neutropénies fébriles sans modification du taux de dysfonction ventriculaire gauche. Cette association est actuellement le traitement de référence, le paclitaxel étant régulièrement substitué au docétaxel pour améliorer la tolérance à la chimiothérapie.
Deuxième ligne métastatique
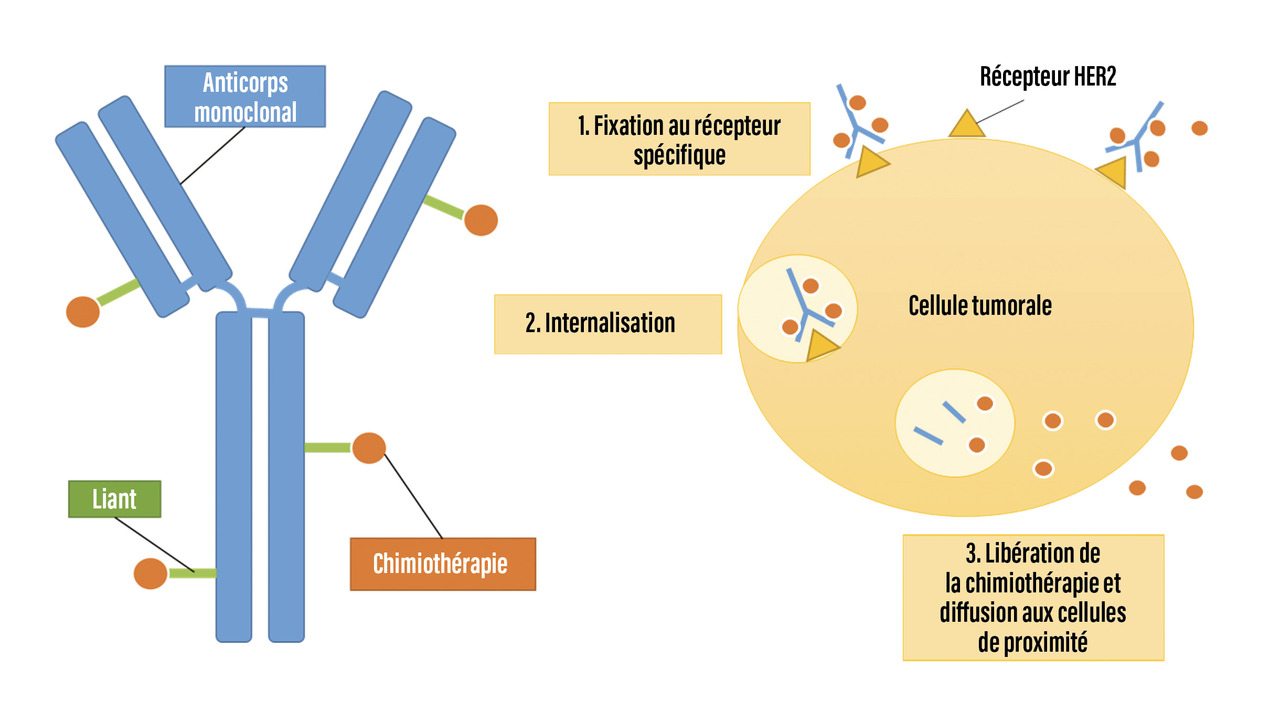
En deuxième ligne se positionnent des conjugués anticorps-médicaments (antibody drug conjugate [ADC]). Cette nouvelle classe de médicaments associe un anticorps à de la chimiothérapie fixée via un liant (fig. 1 ). Leurs différences reposent sur le type de chimiothérapie associée, le ratio molécule de chimiothérapie/anticorps, le type de liant. Dans le cas du cancer HER2+, l’anticorps utilisé est le trastuzumab. L’effet se situe à la fois au niveau de la cellule tumorale présentant la cible de l’anticorps et, pour les dernières générations, au niveau des cellules environnantes, lorsque la chimiothérapie a une capacité de diffusion transmembranaire (effet « bystander ») [fig. 1 ].
Le premier ADC utilisé en deuxième ligne métastatique, le trastuzumab emtansine (T-DM1), a montré un bénéfice en survie sans progression et en survie globale en comparaison à une chimiothérapie classique par capécitabine associée au lapatinib (inhibiteur de tyrosine kinase ciblant HER2 et EGFR).5 En 2022, un nouvel ADC, le trastuzumab déruxtécan, a démontré une amélioration majeure de la survie sans progression à 28,8 mois (IC à 95 % : 22,4-37,9) contre 6,8 mois (IC à 95 % : 5,6-8,2) avec le T-DM1 (HR = 0,33 ; IC à 95 % : 0,26-0,43 ; p < 0,0001) et du taux de réponse objective (79,7 % avec le trastuzumab déruxtécan et 34,2 % avec le T-DM1). Lors de la dernière actualisation disponible de cette étude, les médianes de survie globales ne sont pas encore atteintes, avec un taux de survie à 24 mois de 77,4 % (IC à 95 % : 71,7-82,1) dans le groupe trastuzumab déruxtécan et de 69,9 % (IC à 95 % : 63,7-75,2) dans le groupe T-DM1.6
La toxicité du trastuzumab déruxtécan est proche de celle d’une chimiothérapie systémique, avant tout digestive (nausées, vomissements), nécessitant une prémédication antiémétique renforcée, et hématologique. Une vigilance est de mise sur le risque de pneumopathie interstitielle médicamenteuse (10,5 %). L’impact sur la fonction ventriculaire gauche est rare.
Au vu de ces résultats, le trastuzumab déruxtécan est actuellement le traitement de deuxième ligne du cancer du sein métastatique HER2+. Des essais sont en cours en première ligne. La place actuelle du T-DM1 au stade métastatique reste à définir.
Au-delà, les chimiothérapies classiques validées dans le cancer du sein peuvent être utilisées, tout en maintenant un blocage de la voie HER2.
Le premier ADC utilisé en deuxième ligne métastatique, le trastuzumab emtansine (T-DM1), a montré un bénéfice en survie sans progression et en survie globale en comparaison à une chimiothérapie classique par capécitabine associée au lapatinib (inhibiteur de tyrosine kinase ciblant HER2 et EGFR).5 En 2022, un nouvel ADC, le trastuzumab déruxtécan, a démontré une amélioration majeure de la survie sans progression à 28,8 mois (IC à 95 % : 22,4-37,9) contre 6,8 mois (IC à 95 % : 5,6-8,2) avec le T-DM1 (HR = 0,33 ; IC à 95 % : 0,26-0,43 ; p < 0,0001) et du taux de réponse objective (79,7 % avec le trastuzumab déruxtécan et 34,2 % avec le T-DM1). Lors de la dernière actualisation disponible de cette étude, les médianes de survie globales ne sont pas encore atteintes, avec un taux de survie à 24 mois de 77,4 % (IC à 95 % : 71,7-82,1) dans le groupe trastuzumab déruxtécan et de 69,9 % (IC à 95 % : 63,7-75,2) dans le groupe T-DM1.6
La toxicité du trastuzumab déruxtécan est proche de celle d’une chimiothérapie systémique, avant tout digestive (nausées, vomissements), nécessitant une prémédication antiémétique renforcée, et hématologique. Une vigilance est de mise sur le risque de pneumopathie interstitielle médicamenteuse (10,5 %). L’impact sur la fonction ventriculaire gauche est rare.
Au vu de ces résultats, le trastuzumab déruxtécan est actuellement le traitement de deuxième ligne du cancer du sein métastatique HER2+. Des essais sont en cours en première ligne. La place actuelle du T-DM1 au stade métastatique reste à définir.
Au-delà, les chimiothérapies classiques validées dans le cancer du sein peuvent être utilisées, tout en maintenant un blocage de la voie HER2.
Cas particulier des métastases cérébrales
Les métastases cérébrales sont plus fréquentes en cas de cancer du sein métastatique HER2+ (21,8 % vs 11,1 % chez les HER2-) et associées à une survie plus longue : la survie médiane est de 18,9 mois pour les cancers HER2+ avec récepteurs hormonaux positifs et 13,1 mois pour les cancers HER2+ avec récepteurs hormonaux négatifs contre 7,9 mois dans la population globale de patientes avec un cancer du sein et des métastases cérébrales.7
Classiquement, les patientes avec métastases cérébrales évolutives sont exclues de nombreuses études. Cependant, au vu de leur fréquence, certains auteurs se sont penchés spécifiquement sur l’impact des traitements dans cette population.
Le tucatinib, un inhibiteur de la fonction tyrosine kinase ciblant HER2, associé au trastuzumab et à une chimiothérapie par capécitabine, a ainsi été évalué dans une étude de phase III. Les patientes devaient avoir reçu au préalable au minimum deux lignes de traitement du cancer du sein HER2+ métastatique, et pouvaient avoir des métastases cérébrales (y compris évolutives ; environ 50 % de la population incluse). Ce traitement était comparé à une association capécitabine-trastuzumab. Chez ces patientes déjà prétraitées (médiane de trois lignes de traitement au stade métastatique), l’ajout du tucatinib a permis un bénéfice en survie globale (21,9 mois contre 17,4 mois). En présence de métastases cérébrales, à un an de traitement, 24,9 % des patientes du groupe tucatinib n’avaient pas progressé, contre 0 % dans le groupe sans tucatinib, en faisant une proposition de choix pour ces patientes.
Un plus haut taux de diarrhées et de perturbation du bilan hépatique était retrouvé à la suite de l’adjonction du tucatinib.8
Classiquement, les patientes avec métastases cérébrales évolutives sont exclues de nombreuses études. Cependant, au vu de leur fréquence, certains auteurs se sont penchés spécifiquement sur l’impact des traitements dans cette population.
Le tucatinib, un inhibiteur de la fonction tyrosine kinase ciblant HER2, associé au trastuzumab et à une chimiothérapie par capécitabine, a ainsi été évalué dans une étude de phase III. Les patientes devaient avoir reçu au préalable au minimum deux lignes de traitement du cancer du sein HER2+ métastatique, et pouvaient avoir des métastases cérébrales (y compris évolutives ; environ 50 % de la population incluse). Ce traitement était comparé à une association capécitabine-trastuzumab. Chez ces patientes déjà prétraitées (médiane de trois lignes de traitement au stade métastatique), l’ajout du tucatinib a permis un bénéfice en survie globale (21,9 mois contre 17,4 mois). En présence de métastases cérébrales, à un an de traitement, 24,9 % des patientes du groupe tucatinib n’avaient pas progressé, contre 0 % dans le groupe sans tucatinib, en faisant une proposition de choix pour ces patientes.
Un plus haut taux de diarrhées et de perturbation du bilan hépatique était retrouvé à la suite de l’adjonction du tucatinib.8
Amélioration globale du pronostic
Ces différentes innovations ont permis une amélioration globale du pronostic des patientes porteuses d’un cancer du sein HER2+. Dans une base de données française incluant 22 000 patientes prises en charge pour un cancer du sein métastatique entre 2008 et 2016, la survie globale médiane était de 50,1 mois (IC à 95 % : 47,6-53,1), cohérente avec la médiane de survie de l’étude évaluant le pertuzumab en première ligne, contre 39,5 mois (IC à 95 % : 38,7-40,3) dans la population globale de patientes avec un cancer du sein métastatique,9 à mettre en perspective avec une survie médiane inférieure à deux ans avant l’utilisation du trastuzumab.1 De plus, ces données ne prennent pas en compte l’impact des dernières molécules mises sur le marché (trastuzumab, déruxtécan, tucaninib), permettant d’espérer une nouvelle amélioration du pronostic de ces patientes dans les années à venir.
Cancer du sein localisé : traitement séquentiel néoadjuvant
Apport du trastuzumab en situation adjuvante
Trois études publiées en 2005 ont démontré un net bénéfice de l’ajout du trastuzumab à la chimiothérapie adjuvante en cas de surexpression de HER2.10,11 L’ajout d’un an de traitement par trastuzumab au paclitaxel après un protocole fondé sur des anthracyclines permettait d’améliorer la survie sans récidive à quatre ans de 67,1 à 85,3 %, soit une différence absolue de 18,2 %, ainsi que la survie globale (91,4 % contre 86,6 % à quatre ans), avec cependant une augmentation des cas d’insuffisance cardiaque congestive (de 4,1 à 2,9 % selon les études), habituellement réversible à l’arrêt du traitement.11
Intérêt de la chimiothérapie néoadjuvante
Dans le cancer du sein localisé, en cas d’indication de chimiothérapie, celle-ci peut être réalisée en adjuvant ou néoadjuvant avant chirurgie.
La chimiothérapie néoadjuvante présente plusieurs avantages : augmenter les chances de chirurgie conservatrice en cas de tumeur localement avancée, traiter précocement la maladie micrométastatique et évaluer la sensibilité de la tumeur au traitement de chimiothérapie et au trastuzumab.
Concernant ce dernier point, il est établi que le pronostic est meilleur en cas de réponse histologique complète après chimiothérapie néoadjuvante qu’en cas de résidu tumoral. Pour améliorer le pronostic des patientes ayant un résidu tumoral, avec un risque de récidive plus élevé, une adaptation du traitement en postopératoire est donc une piste.
Pour des patientes avec un cancer du sein HER2+ localisé, traitées par chimiothérapie néoadjuvante associée au trastuzumab, et avec résidu tumoral sur pièce opératoire, une étude a évalué soit une poursuite classique du trastuzumab pour une durée totale d’un an (traitement de référence à l’époque), soit une modification pour du T-DM1. La survie sans maladie invasive à trois ans était significativement meilleure dans le groupe T-DM1 (HR = 0,50 ; IC à 95 % : 0,39-0,64 ; p < 0,001), avec 88,3 % de patientes sans maladie dans le groupe T-DM1 contre 77 % dans le groupe trastuzumab.12 Les résultats en matière de survie globale ne sont pas encore matures.
À la suite de ces résultats, la chimiothérapie des cancers du sein HER2+ est actuellement réalisée majoritairement de façon néoadjuvante, en association au trastuzumab, avec adaptation du traitement postopératoire en fonction de la réponse tumorale.
La chimiothérapie néoadjuvante présente plusieurs avantages : augmenter les chances de chirurgie conservatrice en cas de tumeur localement avancée, traiter précocement la maladie micrométastatique et évaluer la sensibilité de la tumeur au traitement de chimiothérapie et au trastuzumab.
Concernant ce dernier point, il est établi que le pronostic est meilleur en cas de réponse histologique complète après chimiothérapie néoadjuvante qu’en cas de résidu tumoral. Pour améliorer le pronostic des patientes ayant un résidu tumoral, avec un risque de récidive plus élevé, une adaptation du traitement en postopératoire est donc une piste.
Pour des patientes avec un cancer du sein HER2+ localisé, traitées par chimiothérapie néoadjuvante associée au trastuzumab, et avec résidu tumoral sur pièce opératoire, une étude a évalué soit une poursuite classique du trastuzumab pour une durée totale d’un an (traitement de référence à l’époque), soit une modification pour du T-DM1. La survie sans maladie invasive à trois ans était significativement meilleure dans le groupe T-DM1 (HR = 0,50 ; IC à 95 % : 0,39-0,64 ; p < 0,001), avec 88,3 % de patientes sans maladie dans le groupe T-DM1 contre 77 % dans le groupe trastuzumab.12 Les résultats en matière de survie globale ne sont pas encore matures.
À la suite de ces résultats, la chimiothérapie des cancers du sein HER2+ est actuellement réalisée majoritairement de façon néoadjuvante, en association au trastuzumab, avec adaptation du traitement postopératoire en fonction de la réponse tumorale.
Cas des tumeurs de petite taille
En cas de surexpression de HER2, le risque métastatique est plus élevé, et ce même pour des petites tailles tumorales. La question se pose cependant d’appliquer ce traitement séquentiel néoadjuvant à toutes les patientes. Pour des petites tumeurs de moins de 3 cm, sans atteinte ganglionnaire, une étude de phase II a retrouvé des taux de survie sans maladie invasive de 98,7 % à trois ans avec une chimiothérapie associant paclitaxel et trastuzumab et sans anthracyclines,13 en faisant une option raisonnable pour ces tumeurs de stade 1. La chimiothérapie n’est, de même, pas retenue pour les tumeurs de moins de 5 mm sans atteinte ganglionnaire.
Les traitements ciblés constituent une avancée majeure
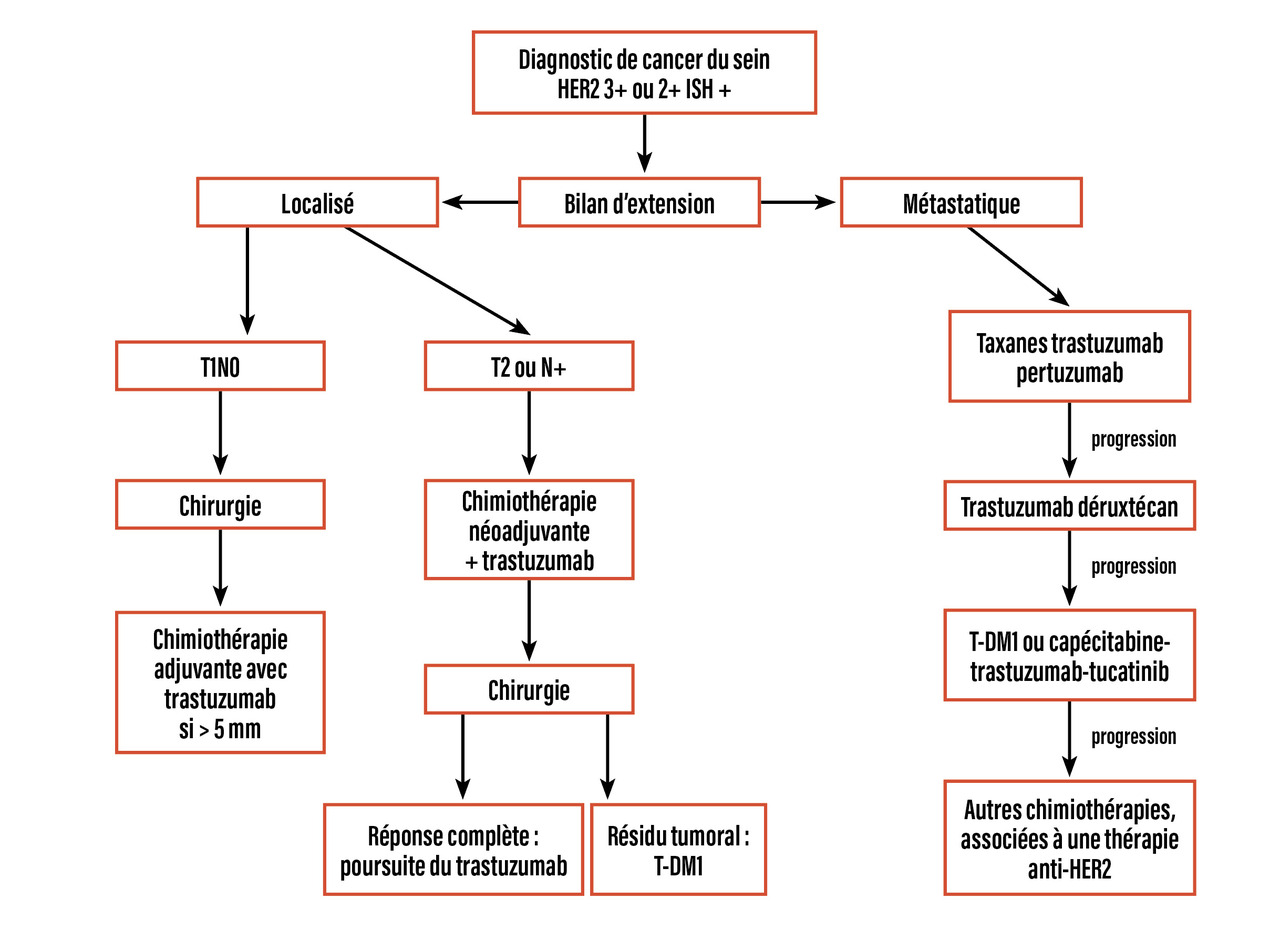
La prise en charge des patientes avec un cancer du sein HER2+ a considérablement évolué depuis l’utilisation des traitements ciblés, que ce soit au stade localisé ou métastatique (fig. 2 ), avec, en corollaire, l’amélioration la plus importante dans les différents sous-groupes de cancers du sein. Les ADC constituent une avancée majeure de ces dernières années et leur utilisation s’étend progressivement.
Le trastuzumab déruxtécan a montré une nette efficacité dans le cancer HER2+ mais son usage est également supérieur à plusieurs chimiothérapies classiques dans le cancer du sein métastatique avec une faible expression de HER2 (score 1+ ou 2+ et négatif en FISH).14 Pour le cancer du sein HER2+, des essais sont également en cours en première ligne métastatique ou au stade localisé en comparaison au T-DM1, en l’absence de réponse histologique complète.
Le trastuzumab déruxtécan a montré une nette efficacité dans le cancer HER2+ mais son usage est également supérieur à plusieurs chimiothérapies classiques dans le cancer du sein métastatique avec une faible expression de HER2 (score 1+ ou 2+ et négatif en FISH).14 Pour le cancer du sein HER2+, des essais sont également en cours en première ligne métastatique ou au stade localisé en comparaison au T-DM1, en l’absence de réponse histologique complète.
Références
1. Dawood S, Broglio K, Buzdar AU, Hortobagyi GN, Giordano SH. Prognosis of women with metastatic breast cancer by HER2 status and trastuzumab treatment: An institutional-based review. J Clin Oncol Off J Am Soc Clin Oncol 2010;28(1):92-8.
2. Wolff AC, Hammond MEH, Allison KH, Harvey BE, Mangu PB, Bartlett JMS, et al. Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Arch Pathol Lab Med 2018;142(11):1364-82.
3. Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001;344(11):783-92.
4. Swain SM, Baselga J, Kim SB, Ro J, Semiglazov V, Campone M, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015;372(8):724-34.
5. Verma S, Miles D, Gianni L, Krop IE, Welslau M, Baselga J, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012;367(19):1783-91.
6. Cortés J, Kim SB, Chung WP, Im SA, Park YH, Hegg R, et al. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Engl J Med 2022;386(12):1143-54.
7. Darlix A, Louvel G, Fraisse J, Jacot W, Brain E, Debled M, et al. Impact of breast cancer molecular subtypes on the incidence, kinetics and prognosis of central nervous system metastases in a large multicentre real-life cohort. Br J Cancer 2019;121(12):991-1000.
8. Murthy RK, Loi S, Okines A, Paplomata E, Hamilton E, Hurvitz SA, et al. Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. N Engl J Med 2020;382(7):597-609.
9. Deluche E, Antoine A, Bachelot T, Lardy-Cleaud A, Dieras V, Brain E, et al. Contemporary outcomes of metastatic breast cancer among 22,000 women from the multicentre ESME cohort 2008-2016. Eur J Cancer 2020;129:60-70.
10. Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005;353(16):1659-72.
11. Romond EH, Perez EA, Bryant J, Suman VJ, Geyer CE, Davidson NE, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005;353(16):1673-84.
12. von Minckwitz G, Huang CS, Mano MS, Loibl S, Mamounas EP, Untch M, et al. Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019;380(7):617-28.
13. Tolaney SM, Barry WT, Dang CT, Yardley DA, Moy B, Marcom PK, et al. Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer. N Engl J Med 2015;372(2):134-41.
14. Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022;387(1):9-20.
2. Wolff AC, Hammond MEH, Allison KH, Harvey BE, Mangu PB, Bartlett JMS, et al. Human epidermal growth factor receptor 2 testing in breast cancer: American Society of Clinical Oncology/College of American Pathologists Clinical Practice Guideline Focused Update. Arch Pathol Lab Med 2018;142(11):1364-82.
3. Slamon DJ, Leyland-Jones B, Shak S, Fuchs H, Paton V, Bajamonde A, et al. Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001;344(11):783-92.
4. Swain SM, Baselga J, Kim SB, Ro J, Semiglazov V, Campone M, et al. Pertuzumab, trastuzumab, and docetaxel in HER2-positive metastatic breast cancer. N Engl J Med 2015;372(8):724-34.
5. Verma S, Miles D, Gianni L, Krop IE, Welslau M, Baselga J, et al. Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012;367(19):1783-91.
6. Cortés J, Kim SB, Chung WP, Im SA, Park YH, Hegg R, et al. Trastuzumab deruxtecan versus trastuzumab emtansine for breast cancer. N Engl J Med 2022;386(12):1143-54.
7. Darlix A, Louvel G, Fraisse J, Jacot W, Brain E, Debled M, et al. Impact of breast cancer molecular subtypes on the incidence, kinetics and prognosis of central nervous system metastases in a large multicentre real-life cohort. Br J Cancer 2019;121(12):991-1000.
8. Murthy RK, Loi S, Okines A, Paplomata E, Hamilton E, Hurvitz SA, et al. Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer. N Engl J Med 2020;382(7):597-609.
9. Deluche E, Antoine A, Bachelot T, Lardy-Cleaud A, Dieras V, Brain E, et al. Contemporary outcomes of metastatic breast cancer among 22,000 women from the multicentre ESME cohort 2008-2016. Eur J Cancer 2020;129:60-70.
10. Piccart-Gebhart MJ, Procter M, Leyland-Jones B, Goldhirsch A, Untch M, Smith I, et al. Trastuzumab after adjuvant chemotherapy in HER2-positive breast cancer. N Engl J Med 2005;353(16):1659-72.
11. Romond EH, Perez EA, Bryant J, Suman VJ, Geyer CE, Davidson NE, et al. Trastuzumab plus adjuvant chemotherapy for operable HER2-positive breast cancer. N Engl J Med 2005;353(16):1673-84.
12. von Minckwitz G, Huang CS, Mano MS, Loibl S, Mamounas EP, Untch M, et al. Trastuzumab emtansine for residual invasive HER2-positive breast cancer. N Engl J Med 2019;380(7):617-28.
13. Tolaney SM, Barry WT, Dang CT, Yardley DA, Moy B, Marcom PK, et al. Adjuvant paclitaxel and trastuzumab for node-negative, HER2-positive breast cancer. N Engl J Med 2015;372(2):134-41.
14. Modi S, Jacot W, Yamashita T, Sohn J, Vidal M, Tokunaga E, et al. Trastuzumab deruxtecan in previously treated HER2-low advanced breast cancer. N Engl J Med 2022;387(1):9-20.