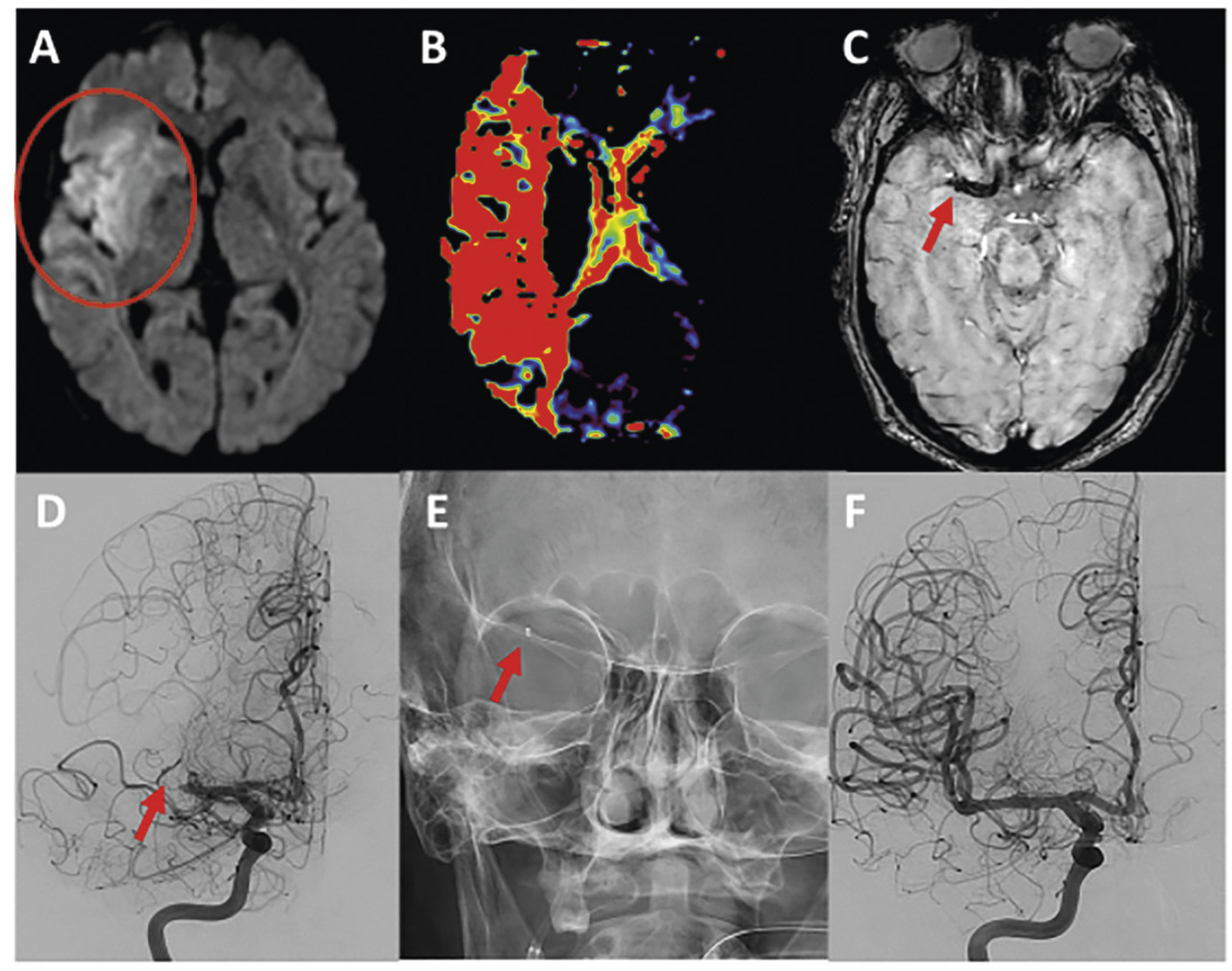
Les AVC sont les premiers pourvoyeurs de handicap, la deuxième cause de démence et la troisième de mortalité. Dans les accidents ischémiques cérébraux (AIC, 80 % des AVC), la recanalisation la plus précoce possible de l’artère occluse vise à restituer un débit sanguin suffisant pour limiter l’extension de la zone de nécrose et sauver la pénombre ischémique dans le territoire cérébral en aval de l’occlusion.
Thrombolyse : intérêt et limites
La thrombolyse intraveineuse (TIV) est efficace pour réduire le handicap neurologique. Elle est recommandée dans les AIC de moins de 4 h 301 ou constaté au réveil du patient si l’IRM cérébrale plaide pour un AIC très récent. Son effet sur le handicap à 3 mois est d’autant plus important qu’elle est pratiquée précocement par rapport à l’apparition des symptômes. Après TIV, la recanalisation artérielle est obtenue en moyenne dans 30 à 40 % des cas seulement, et ce de façon inversement proportionnelle au calibre de l’artère occluse. Son efficacité est donc limitée en cas d’occlusion proximale. Autre frein : l’augmentation du risque hémorragique responsable d’un surcroît de mortalité dans la semaine suivant l’AIC.
TM : nombreux atouts
En 2015, plusieurs études font état de résultats très positifs de la thrombectomie mécanique (TM). Avec des critères de sélection rigoureux (occlusion artérielle proximale de la circulation antérieure, intervention précoce, dispositifs de nouvelle génération type stent retriever), elle permet une recanalisation artérielle dans 60 à 90 % des cas. Soit un bénéfice net sur le handicap neurologique si effectuée dans les 6 heures.
Une méta-analyse de 8 essais randomisés confirme ce bénéfice comparé à la TIV seule sur le handicap neurologique évalué à 3 mois sans différence significative concernant la mortalité ou les complications hémorragiques cérébrales.2
Dans un sous-groupe de patients pour lesquels l’imagerie cérébrale multimodale révélait la persistance d’une zone de pénombre ischémique (IRM ou scanner), 2 études publiées en 2018 ont montré que la TM était supérieure au traitement médical seul jusqu’à 24 heures après le début des symptômes en termes de baisse du handicap neurologique à 3 mois.3, 4
Les bénéfices sont d’autant plus élevés que la TM est initiée rapidement après le début des symptômes ; en outre, elle a un intérêt quels que soient l’âge, le sexe et la sévérité de l’AIC.
Une méta-analyse de 8 essais randomisés confirme ce bénéfice comparé à la TIV seule sur le handicap neurologique évalué à 3 mois sans différence significative concernant la mortalité ou les complications hémorragiques cérébrales.2
Dans un sous-groupe de patients pour lesquels l’imagerie cérébrale multimodale révélait la persistance d’une zone de pénombre ischémique (IRM ou scanner), 2 études publiées en 2018 ont montré que la TM était supérieure au traitement médical seul jusqu’à 24 heures après le début des symptômes en termes de baisse du handicap neurologique à 3 mois.3, 4
Les bénéfices sont d’autant plus élevés que la TM est initiée rapidement après le début des symptômes ; en outre, elle a un intérêt quels que soient l’âge, le sexe et la sévérité de l’AIC.
Des indications précises
Dans les 6 heures, pour les AIC de la circulation antérieure avec occlusion proximale (carotide interne intracrânienne ; sylvienne proximale, segment M1 et M2), les Sociétés de neurologie vasculaire françaises (SFNV) et européennes (ESO) la recommandent en complément de la TIV.5
Elle doit être réalisée dans les 6 heures suivant le début des symptômes et aussi vite que possible une fois l’indication posée (conjointement par le neurologue et le neuroradiologue interventionnel), dans un centre disposant d’une unité de soins intensifs neurovasculaires (USINV) et d’un service de neuroradiologie interventionnelle (NRI).
La TM seule est également indiquée dans les 6 heures en première ligne si la thrombolyse est contre-indiquée.
Jusqu’à 24 heures pour certains. Selon les recommandations américaines et européennes, pour des patients sélectionnés avec mismatch radioclinique persistant (discordance entre la sévérité clinique – évaluée par le score NIHSS élevé – et un petit volume de l’infarctus cérébral en imagerie de diffusion ou en scanner de perfusion), la TM peut être réalisée jusqu’à 16 à 24 heures de la dernière fois où le patient a été vu sans symptômes.
Les AIC sur occlusion du tronc basilaire (TB) sont de plus mauvais pronostic et n’ont pas été évalués dans les essais randomisés récents, si bien que l’indication d’une TM ne repose pas sur des preuves scientifiques fortes. Cependant, les méta-analyses d’études non randomisées retrouvent un meilleur pronostic fonctionnel chez les malades thrombectomisés avec recanalisation satisfaisante. Ainsi la TM est considérée par les experts européens comme faisable chez ces patients. Une étude randomisée la comparant au traitement médical maximal (incluant la TIV) est en cours. Il n’existe pas de contre-indication formelle à la TM, si les critères de sélection des patients sont bien respectés et l’indication posée de façon collégiale entre neurologue et neuroradiologue interventionnel.
Elle doit être réalisée dans les 6 heures suivant le début des symptômes et aussi vite que possible une fois l’indication posée (conjointement par le neurologue et le neuroradiologue interventionnel), dans un centre disposant d’une unité de soins intensifs neurovasculaires (USINV) et d’un service de neuroradiologie interventionnelle (NRI).
La TM seule est également indiquée dans les 6 heures en première ligne si la thrombolyse est contre-indiquée.
Jusqu’à 24 heures pour certains. Selon les recommandations américaines et européennes, pour des patients sélectionnés avec mismatch radioclinique persistant (discordance entre la sévérité clinique – évaluée par le score NIHSS élevé – et un petit volume de l’infarctus cérébral en imagerie de diffusion ou en scanner de perfusion), la TM peut être réalisée jusqu’à 16 à 24 heures de la dernière fois où le patient a été vu sans symptômes.
Les AIC sur occlusion du tronc basilaire (TB) sont de plus mauvais pronostic et n’ont pas été évalués dans les essais randomisés récents, si bien que l’indication d’une TM ne repose pas sur des preuves scientifiques fortes. Cependant, les méta-analyses d’études non randomisées retrouvent un meilleur pronostic fonctionnel chez les malades thrombectomisés avec recanalisation satisfaisante. Ainsi la TM est considérée par les experts européens comme faisable chez ces patients. Une étude randomisée la comparant au traitement médical maximal (incluant la TIV) est en cours. Il n’existe pas de contre-indication formelle à la TM, si les critères de sélection des patients sont bien respectés et l’indication posée de façon collégiale entre neurologue et neuroradiologue interventionnel.
Capturer ou aspirer ?
L’objectif est de retirer le thrombus occluant l’artère irriguant le territoire cérébral ischémié, sans l’endommager ni fragmenter le caillot, pour éviter la survenue d’emboles en distalité ou dans d’autres territoires non préalablement atteints.
La TM peut être réalisée sous anesthésie locale, sédation consciente ou anesthésie générale (AG), le choix étant décidé de façon conjointe par l’anesthésiste et le neuroradiologue interventionnel.
La meilleure option reste encore débattue. En effet, l’AG évite la douleur, améliore le confort et limite les mouvements du patient, potentiellement dangereux pendant la procédure, mais elle peut faire baisser la pression artérielle et aggraver l’hypoperfusion cérébrale ou entraîner une intubation prolongée. Elle empêche également la surveillance de l’état clinique neurologique. Plusieurs travaux sont en cours afin de déterminer la meilleure modalité.
Après ponction de l’artère fémorale commune, un cathéter porteur de large calibre est monté jusque dans la carotide interne ou l’artère vertébrale, en amont de l’artère cérébrale occluse. Des clichés artériographiques, avec injection de produit de contraste iodé, confirment et précisent le niveau et le degré de l’occlusion. Un microcathéter est alors introduit à l’intérieur du cathéter porteur et navigué sur un microguide jusqu’au-delà de l’occlusion intracrânienne.
Actuellement, 2 techniques ont une efficacité équivalente : le stent retriever, stent auto-expansif non largable, déployé par le microcathéter en regard du niveau de l’occlusion. En ouvrant ses mailles, le stent capture le caillot. Autre technique : l’aspiration directe (figure ). Un cathéter spécifique connecté à une pompe dédiée est amené au contact du thrombus pour une aspiration de plusieurs minutes avant son retrait.
Au décours de la procédure, le patient transféré en USINV est surveillé de façon rapprochée. Une imagerie de contrôle dans les 24 h vise à éliminer toute complication (cérébrale [embole, perforation ou dissection artérielle, transformation hémorragique, infarctus dans un nouveau territoire], ou locale [hémorragie au point de ponction, faux anévrisme…]).
Réduire les délais de prise en charge est crucial. Ainsi, il est essentiel d’améliorer la reconnaissance des signes d’alerte d’AVC via des campagnes de prévention, de promouvoir l’appel systématique du 15 orientant le patient directement vers une USINV. Objectif : obtenir le plus rapidement possible une imagerie cérébrale (idéalement une IRM), qui aide à déterminer l’éligibilité du patient à un traitement de phase aiguë, et ce quels que soient son âge, ses antécédents ou ses traitements concomitants.
Il est essentiel de développer et d’organiser au mieux les structures d’USINV et les centres de thrombectomies sur l’ensemble du territoire (145 USINV et 41 centres de thrombectomie à ce jour ).
La TM peut être réalisée sous anesthésie locale, sédation consciente ou anesthésie générale (AG), le choix étant décidé de façon conjointe par l’anesthésiste et le neuroradiologue interventionnel.
La meilleure option reste encore débattue. En effet, l’AG évite la douleur, améliore le confort et limite les mouvements du patient, potentiellement dangereux pendant la procédure, mais elle peut faire baisser la pression artérielle et aggraver l’hypoperfusion cérébrale ou entraîner une intubation prolongée. Elle empêche également la surveillance de l’état clinique neurologique. Plusieurs travaux sont en cours afin de déterminer la meilleure modalité.
Après ponction de l’artère fémorale commune, un cathéter porteur de large calibre est monté jusque dans la carotide interne ou l’artère vertébrale, en amont de l’artère cérébrale occluse. Des clichés artériographiques, avec injection de produit de contraste iodé, confirment et précisent le niveau et le degré de l’occlusion. Un microcathéter est alors introduit à l’intérieur du cathéter porteur et navigué sur un microguide jusqu’au-delà de l’occlusion intracrânienne.
Actuellement, 2 techniques ont une efficacité équivalente : le stent retriever, stent auto-expansif non largable, déployé par le microcathéter en regard du niveau de l’occlusion. En ouvrant ses mailles, le stent capture le caillot. Autre technique : l’aspiration directe (
Au décours de la procédure, le patient transféré en USINV est surveillé de façon rapprochée. Une imagerie de contrôle dans les 24 h vise à éliminer toute complication (cérébrale [embole, perforation ou dissection artérielle, transformation hémorragique, infarctus dans un nouveau territoire], ou locale [hémorragie au point de ponction, faux anévrisme…]).
Réduire les délais de prise en charge est crucial. Ainsi, il est essentiel d’améliorer la reconnaissance des signes d’alerte d’AVC via des campagnes de prévention, de promouvoir l’appel systématique du 15 orientant le patient directement vers une USINV. Objectif : obtenir le plus rapidement possible une imagerie cérébrale (idéalement une IRM), qui aide à déterminer l’éligibilité du patient à un traitement de phase aiguë, et ce quels que soient son âge, ses antécédents ou ses traitements concomitants.
Il est essentiel de développer et d’organiser au mieux les structures d’USINV et les centres de thrombectomies sur l’ensemble du territoire (145 USINV et 41 centres de thrombectomie à ce jour ).
Références
1. Emberson J, Lees KR, Lyden P, et al. Effect of treatment delay, age, and stroke severity on the effects of intravenous thrombolysis with alteplase for acute ischaemic stroke: a meta-analysis of individual patient data from randomised trials. Lancet 2014;384:1929-35.
2. Ferrante G, Nuzzi NP, Stefanini GG, et al. Endovascular treatment vs. intravenous thrombolysis alone for ischaemic stroke: a meta-analysis of randomised controlled trials. EuroIntervention 2016;12:e271-e281.
3. Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018;378:11-21.
4. Albers GW, Marks MP, Kemp S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. N Engl J Med 2018;378:708-18.
5. Turc G, Bhogal P, Fischer U, et al. European Stroke Organisation-European Society for Minimally Invasive Neurological Therapy guidelines on mechanical thrombectomy in acute ischemic stroke. J Neurointerv Surg 2019;11:535-8.
2. Ferrante G, Nuzzi NP, Stefanini GG, et al. Endovascular treatment vs. intravenous thrombolysis alone for ischaemic stroke: a meta-analysis of randomised controlled trials. EuroIntervention 2016;12:e271-e281.
3. Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018;378:11-21.
4. Albers GW, Marks MP, Kemp S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. N Engl J Med 2018;378:708-18.
5. Turc G, Bhogal P, Fischer U, et al. European Stroke Organisation-European Society for Minimally Invasive Neurological Therapy guidelines on mechanical thrombectomy in acute ischemic stroke. J Neurointerv Surg 2019;11:535-8.