Épidémiologie et facteurs pronostiques
Il y a toutefois plusieurs moyens (
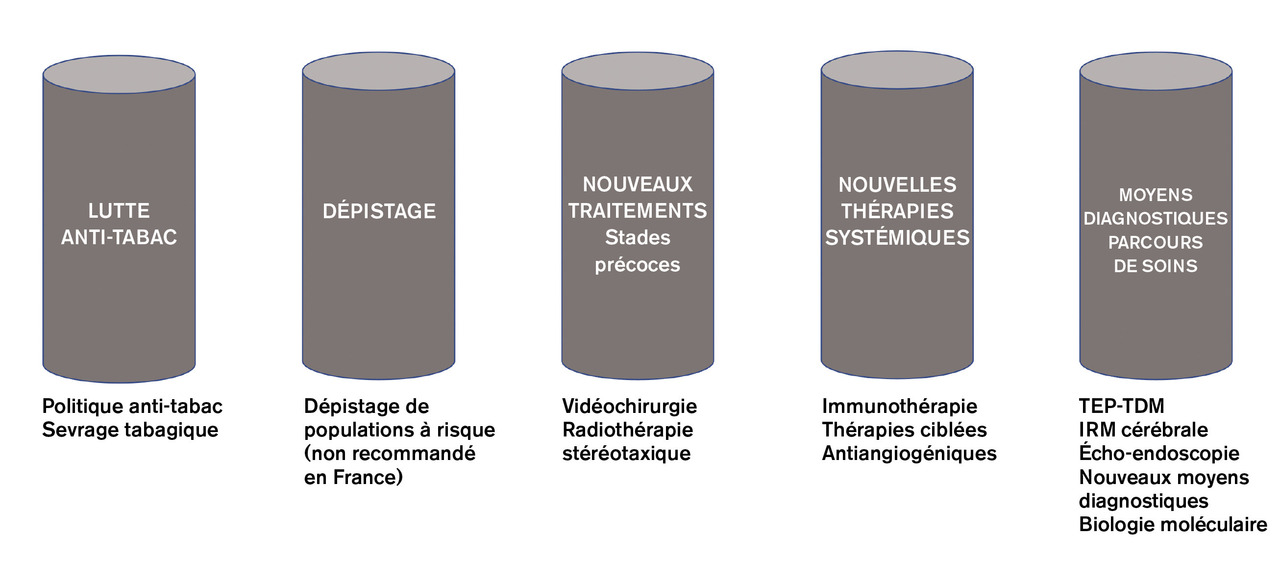
– le plus important est et restera la lutte drastique contre le tabagisme sous toutes ses formes par la mise en place de politiques de santé publique (augmentation des prix des produits de l’industrie du tabac, interdiction de fumer dans les lieux publics, publicité interdite, paquet neutre…), l’aide au sevrage tabagique et la prévention de l’initiation au tabac chez les jeunes ;
– le dépistage chez des populations sélectionnées définies à haut risque a montré son efficacité sur la réduction de la mortalité toutes causes de 6,7 % (intervalle de confiance [IC] à 95 % : 1,2-13,6) et sur la réduction spécifique de la mortalité par cancer du poumon de 20 % (IC à 95 % : 3,8-26,7) dans l’étude américaine NLST.2 Ces résultats ont été confirmés par l’étude européenne NELSON.3 Cependant, il n’y a actuellement pas de recommandation de dépistage de masse en France ;
– l’émergence de nouvelles modalités thérapeutiques moins invasives à des stades précoces : l’utilisation préférentielle de la vidéothoracoscopie à la place de la chirurgie à thorax ouvert diminue le risque de rechute à distance et améliore la survie à 5 ans.4 L’avènement des techniques de radiothérapie stéréotaxique comme alternative à la chirurgie chez les patients fonctionnellement inopérables ou ayant une contre-indication opératoire liée aux comorbidités.5
– l’arrivée de nouvelles thérapies systémiques pour les maladies avancées peut aussi expliquer l’amélioration du pronostic ; des traitements adaptés à l’histologie, comme les anti- angiogéniques et le pémétrexed doublent la survie à 2 ans pour les cancers non épidermoïdes avancés avec une meilleure tolérance, mais surtout la révolution apportée par l’immunothérapie (inhibiteurs des points de contrôle immunitaire), avec environ 15 % de patients vivants à 5 ans en deuxième ligne ;6
– enfin, la meilleure compréhension des voies de signalisation moléculaires oncogéniques a également permis le développement de thérapies ciblées. Ces traitements, administrés par voie orale, ciblent des anomalies moléculaires oncogéniques comme les mutations du récepteur de l’epidermal growth factor (EGFR) et les réarrangements de l’anaplastic lymphoma kinase (ALK) et ROS1 avec une efficacité antitumorale rapide et prolongée démontrée dès la première ligne et quel que soit l’état général du patient. D’autres altérations moléculaires sont également ciblables en deuxième ligne ou plus, avec une bonne efficacité. La recherche clinique est très active dans ce domaine, avec l’émergence régulière de nouvelles thérapies.
Finalement, l’amélioration des moyens diagnostiques pour une définition précise du stade, et la caractérisation précise histologique et moléculaire de la tumeur jouent un rôle essentiel dans l’amélioration du pronostic (v. infra).
Démarche diagnostique
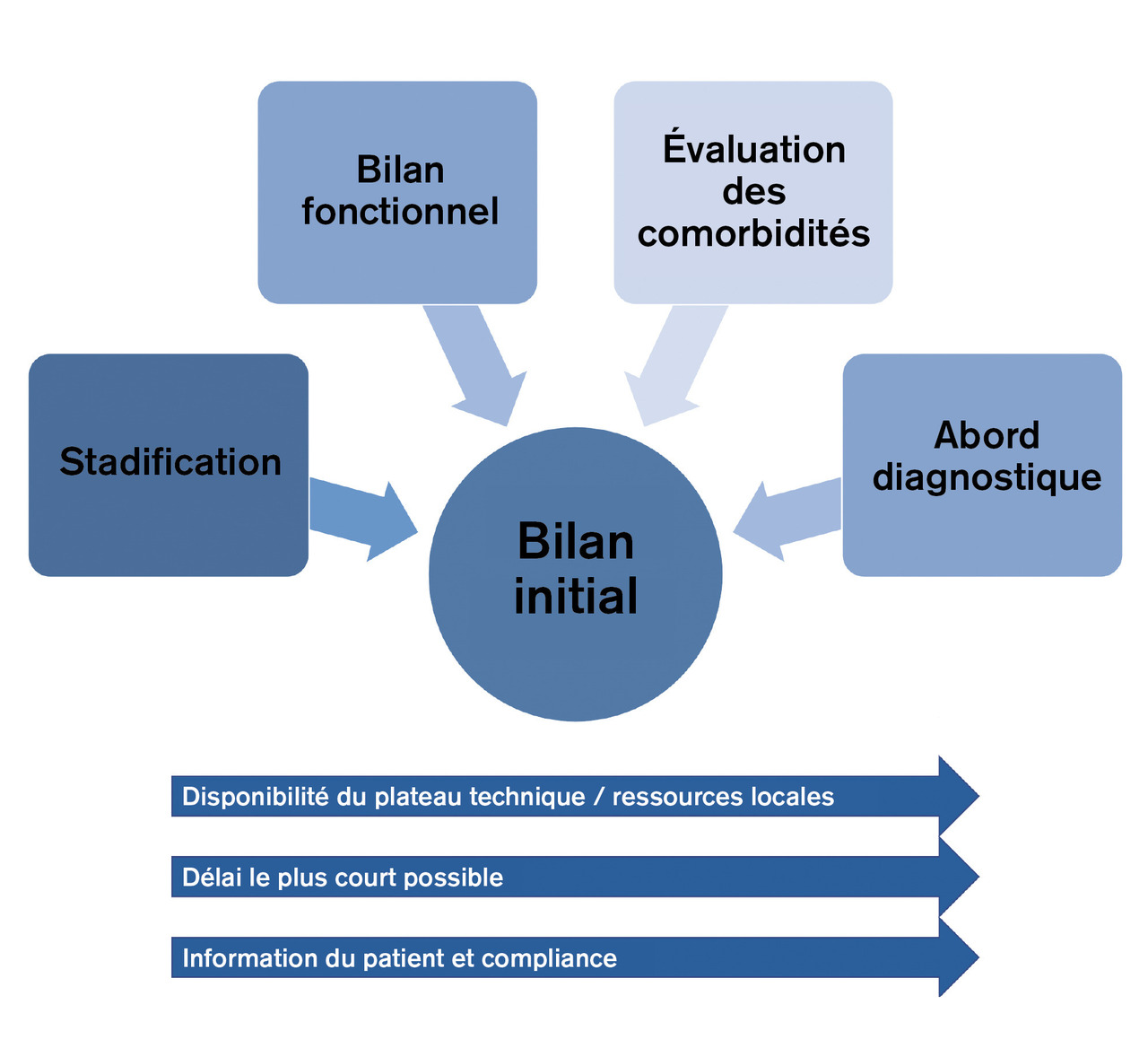
L’évaluation initiale du patient suspect de cancer du poumon est individualisée mais doit toutefois être standardisée afin de répondre à certains points clés pour une décision thérapeutique la plus adaptée dans un délai le plus court possible.
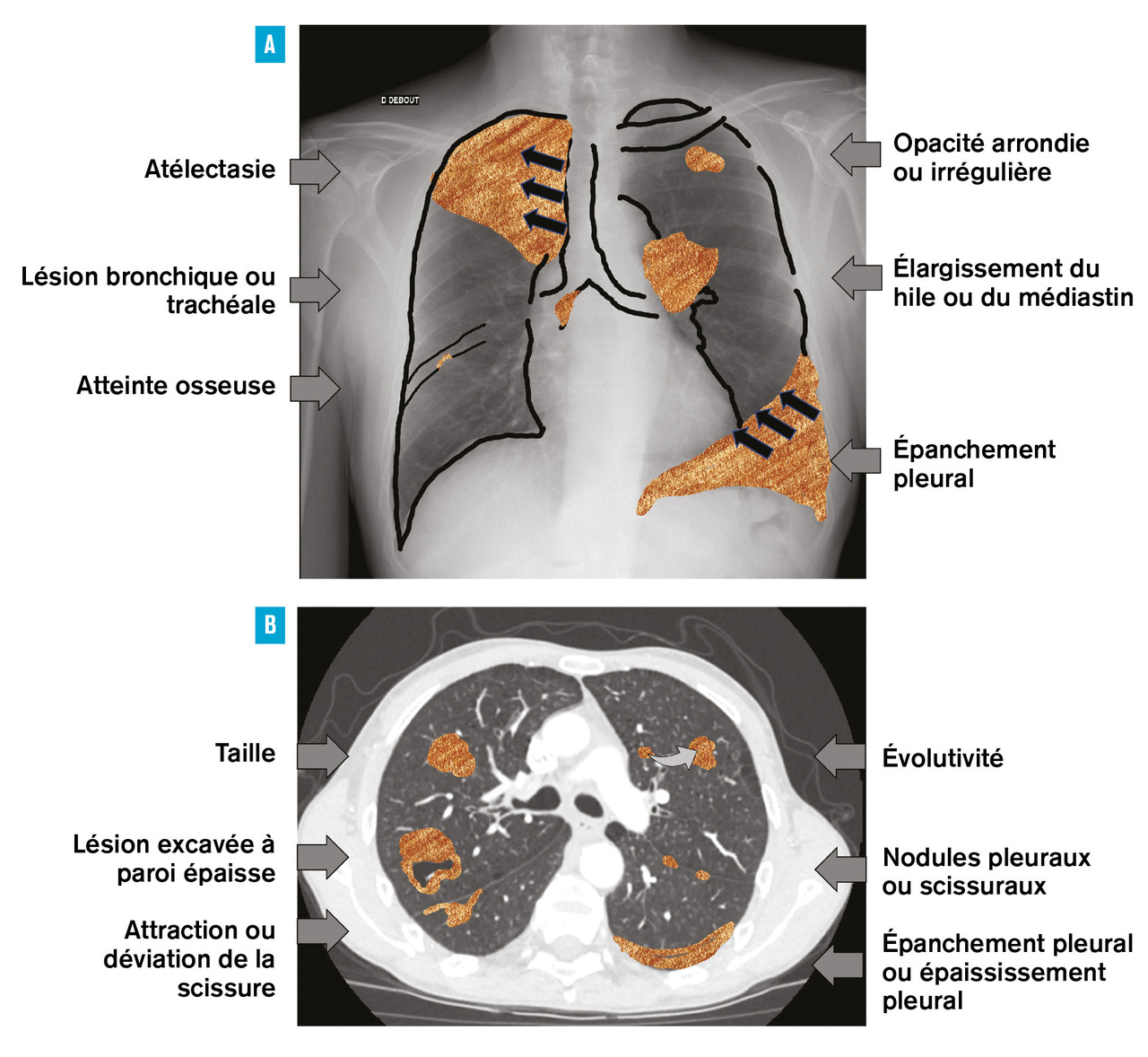
La première étape consiste pour le médecin de premier recours à réaliser des examens d’imagerie devant la survenue de symptômes respiratoires (apparition d’une douleur thoracique, toux, hémoptysie même de faible abondance ou aggravation d’une dyspnée) ou de symptômes plus généraux chez un patient fumeur ou ancien fumeur. La radiographie thoracique est un examen facilement accessible qui permet une première orientation. Les critères évocateurs de malignité à l’imagerie sont résumés dans la
Filières diagnostiques multidisciplinaires
Cette démarche a alors plusieurs objectifs, qui sont réalisés parallèlement (
Les patients récemment diagnostiqués peuvent ne pas avoir eu auparavant un suivi médical régulier, et la découverte du cancer fait déceler dans de nombreux cas d’autres comorbidités. Il semble important de rechercher les comorbidités qui peuvent avoir une incidence dans le choix thérapeutique (insuffisance rénale, insuffisance cardiaque ou respiratoire, infection par le virus de l’immunodéficience humaine...).
Enfin, face à une pathologie localisée ou localement avancée, lorsqu’un traitement local peut être envisagé, une évaluation fonctionnelle est réalisée afin de voir si ce geste est adapté aux conditions fonctionnelles du patient, c’est-à-dire s’il est opérable. La disponibilité des différentes techniques et l’expertise locale peuvent aussi conditionner ces choix de même que l’observance du patient aux examens proposés. L’objectif d’une telle filière est d’accélérer le processus, le cancer étant par définition évolutif, des délais trop longs entre les examens peuvent être préjudiciables pour les patients car une décision thérapeutique posée sur des examens datés peut ainsi être inadaptée. Il convient donc d’effectuer l’ensemble du bilan dans un délai maximal de 6 semaines. Toutefois, plus ce délai est court, moins le risque de préjudice pronostique pour le patient est important, en particulier face à des tumeurs ayant des caractéristiques agressives ou à la limite de la résécabilité .
Diagnostic anatomopathologique
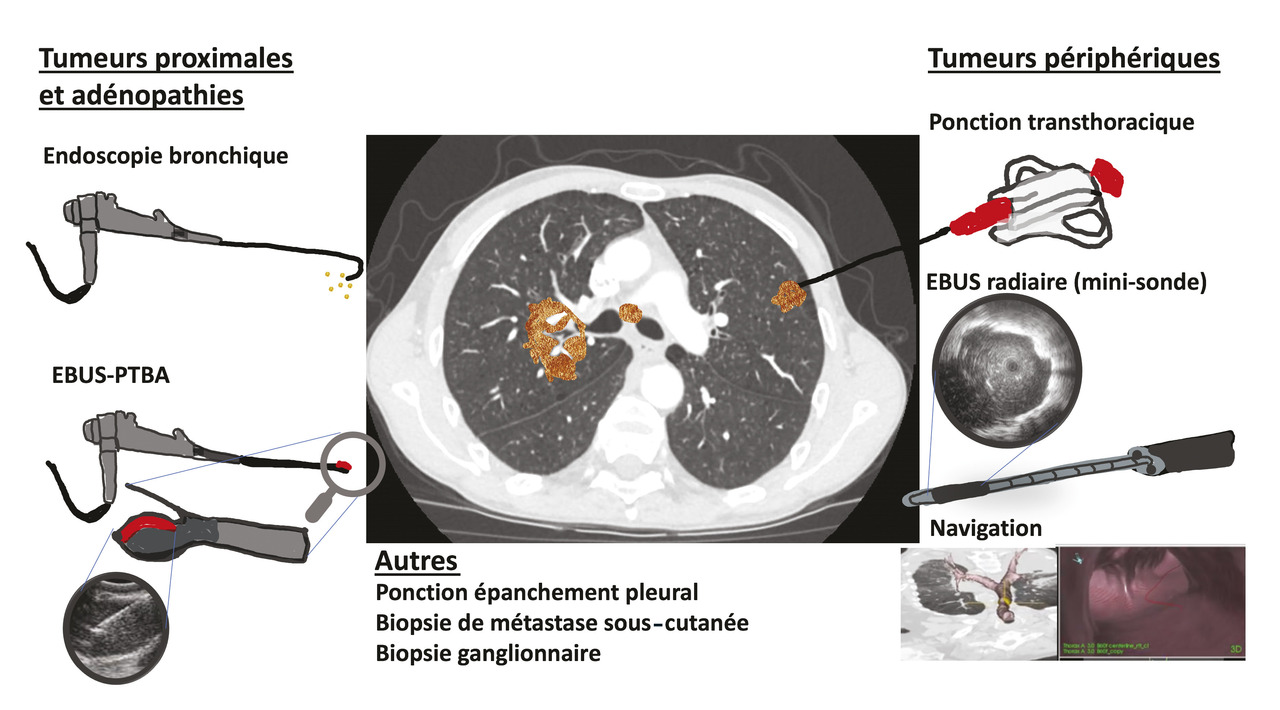
Le choix de la cible dépend de la localisation de la maladie (déterminée par l’examen clinique et l’imagerie), l’état général du patient et ses comorbidités (insuffisance respiratoire) et de l’extension. L’extension clinique (optimisée par l’imagerie) de la maladie joue également un rôle important dans le choix de la technique de prélèvement (
Par exemple, face à une tumeur localisée, il semble important de pouvoir s’assurer de sa résécabilité et, outre la preuve et le type histologique du cancer, l’évaluation de l’extension endobronchique par fibroscopie est primordiale. En cas de maladie métastatique, l’objectif est plutôt d’obtenir des biopsies avec du matériel tumoral riche pour réaliser toutes les analyses immunohistochimiques et moléculaires qui vont déterminer le choix thérapeutique. Enfin, face à une maladie oligométastatique, choisir cette métastase unique comme cible diagnostique permet à la fois de prouver le diagnostic et de confirmer le stade métastatique, et à l’inverse en cas de négativité de considérer la tumeur comme localisée.
L’idéal est pour le clinicien de choisir l’abord présentant les meilleures performances diagnostiques pour un risque le plus faible possible, le plus informatif quant au stade de la maladie tout en étant le moins invasif possible, et enfin permettant l’obtention de matériel suffisant pour le diag-nostic et la biologie moléculaire le cas échéant. Le rapport bénéfice-risque individuel doit être évalué systématiquement. Les patients sont informés des modalités de la procédure, des objectifs et des éventuelles complications potentielles et adhèrent ainsi aux décisions les concernant. Les sociétés savantes ont rédigé des formulaires d’information dédiés aux patients.
L’objectif est d’avoir suffisamment de matériel de bonne qualité afin de préciser le type histologique de la tumeur selon la classification 2015 de l’Organisation mondiale de la santé14 des tumeurs pulmonaires par une analyse morphologique associée à des techniques complémentaires : histochimique et/ou des techniques d’immunomarquage. Cela permet de différencier les carcinomes à petites cellules (CPC) des carcinomes non à petites cellules (CNPC), et de définir le sous-type histologique pour les CNPC chaque fois que possible : carcinome épidermoïde, adénocarcinome. En complément du type histologique et pour les tumeurs avancées qui ne peuvent bénéficier d’un traitement radical, une véritable « carte d’identité du cancer » est transmise au clinicien en routine avec le résultat de biomarqueurs immunohistochimiques auxquels des thérapeutiques potentielles sont conditionnées (par exemple l’utilisation de l’immunothérapie seule en première ligne lorsque l’expression d’une IHC PD-L1 sur les cellules tumorales est supérieure à 50 %15 ou l’immunohistochimie ALK qui, en cas de positivité, témoigne d’un réarrangement du gène ALK ciblable par un inhibiteur de tyrosine kinase anti-ALK). Du matériel est réservé pour la réalisation d’analyses complémentaires de biologie moléculaire : l’utilisation du séquençage haut débit (next-generation sequencing [NGS]) a permis d’augmenter considérablement le nombre de cibles recherchées car, en effet, de plus en plus de cibles ont actuellement un impact thérapeutique. Ainsi, il est recommandé de réaliser ces analyses moléculaires pour tout cancer non à petites cellules non épidermoïde avancé, ou de cancer épidermoïde avancé chez un patient non fumeur9 et d’obtenir le résultat dans un délai de moins de 3 semaines après la biopsie. Certaines altérations moléculaires permettent l’utilisation d’une thérapie ciblée orale dès la première ligne, avec une efficacité rapide et prolongée (mutations activatrices de l’EGFR, réarrangement d’ALK, réarrangement de ROS1). D’autre mutations ou réarrangements bien que plus rares sont également systématiquement recherchés pour les cibler pour des lignes ultérieures ou l’accès à des essais thérapeutiques (mutation de BRAF, mutation Exon 14 de MET, mutation de HER2, recherche de fusions RET, NTRK...). Chez les patients traités par une thérapie ciblée la rebiopsie fait aussi partie de la routine clinique face à une progression tumorale. Par exemple, chez un patient traité par un inhibiteur de tyrosine kinase de l’EGFR ou d’ALK, une population tumorale résistante (clone résistant) peut émerger sous la pression thérapeutique. Une biopsie liquide peut être alors réalisée, complétée, lorsque cela est nécessaire, par une nouvelle biopsie tissulaire pour l’étude histologique et moléculaire car cela peut avoir des conséquences thérapeutiques .
Pour optimiser ces analyses, le contexte clinique et le compte-rendu de la procédure doivent être transmis au pathologiste et au biologiste moléculaire. La coordination entre le prescripteur de l’acte, le préleveur et le laboratoire d’anatomopathologie est fondamentale pour optimiser les analyses, en particulier sur le statut tabagique, le caractère métastatique ou non. La quantité d’analyses demandées témoigne de l’importance d’optimiser le rendement et la richesse des prélèvements.
Bilan d’extension
Le bilan d’extension associe TDM thoraco-abdominale injectée, imagerie cérébrale par TDM injectée ou mieux imagerie par résonance magnétique (IRM), TDM couplée à la tomographie à émission de positons (TEP/TDM) et fibroscopie bronchique pour évaluer l’extension endobronchique, pour un cancer localisé ou localement avancé, c’est-à-dire qui pourrait bénéficier d’un traitement local.
La TEP/TDM, par l’évaluation du statut ganglionnaire et la recherche de localisation métastatique, permet de réduire la proportion de prises en charge chirurgicales futiles.17, 18 Elle permet de retrouver dans environ 10 % des cas des métastases, en particulier osseuses, qui n’étaient pas visualisées en TDM. Néanmoins, il faut garder en tête que la captation du 18-fluorodésoxyglucose (18FDG) ne signe pas l’envahissement tumoral et n’est pas spécifique du cancer. La plupart des lésions inflammatoires, tumorales ou bénignes, captent le 18FDG. En résumé, la TEP/TDM est systématique face à une maladie potentiellement opérable ou irradiable ou en cas de localisation métastatique potentiellement unique. En cas de maladie d’emblée multimétastatique sur la TDM, l’utilisation de la TEP/TDM reste débattue et n’est pas recommandée (
Au diagnostic de cancer bronchique, la présence de métastase(s) cérébrale(s) est fréquente, y compris asymptomatique(s). C’est pourquoi la réalisation d’une IRM cérébrale ou, à défaut, d’une TDM cérébrale injectée doit être systématique.
Bilan fonctionnel
Moyens du diagnostic positif
Bronchoscopie souple « conventionnelle »
Les tumeurs périphériques peuvent avoir diverses présentations radiologiques : nodule (≤ 3 cm), masse (> 3 cm), condensations alvéolaires. Dans ce cas, la sensibilité de la bronchoscopie « conventionnelle » est moins bonne. Par exemple, les biopsies transbronchiques ont une faible rentabilité, avec un risque de pneumothorax ou d’hémorragie non négligeable. C’est pourquoi de nouvelles techniques sont apparues afin d’augmenter la rentabilité de l’examen en cas de tumeur périphérique.
Endoscopie avec mini-sonde radiaire
Techniques de navigation
Ponction-biopsie guidée par l’imagerie
Écho-endoscopie bronchique ou œsophagienne pour l’exploration ganglionnaire médiastinale
La médiastinoscopie par voie cervicale (vidéomédiastinoscopie) est l’examen de référence. Mais des techniques mini-invasives (écho-endoscopie bronchique et écho-endoscopie œsophagienne) ont émergé, permettant, à l’aide d’une aiguille, d’obtenir un prélèvement cytologique et/ou histologique. Actuellement, elles sont recommandées en première intention, mais toutefois en cas de négativité, elles doivent être complétées d’une média-stinoscopie.
Les ponctions transbronchiques à l’aiguille fine non échoguidées consistent à traverser la paroi bronchique au niveau de repères anatomiques précis à l’aide d’une aiguille fine introduite dans le canal opérateur du fibroscope afin de ponctionner une cible précise et d’aspirer son contenu pour analyses. Cette technique reste utilisée pour les lésions médiastinales de grande taille. Ces ponctions peuvent être guidées par une écho-endoscopie bronchique ou œsophagienne et se réalisent sous sédation. L’écho-endoscopie bronchique associe à l’extrémité du bronchoscope une sonde d’échographie et un canal opérateur d’où émerge une aiguille lors de la ponction. L’opérateur visualise à la fois l’arbre trachéobronchique en lumière blanche et l’image échographique. Ce dispositif permet de visualiser en temps réel la progression de l’aiguille dans le champ déterminé par la sonde d’échographie. De nombreuses aires ganglionnaires sont ainsi accessibles ainsi que les lésions proximales en contact avec les bronches et la trachée. L’échoguidage permet d’augmenter le rendement et la sécurité du geste : spécificité poolée de 1 et sensibilité de 0,88.24 Depuis une dizaine d’années, de nombreux centres français se sont équipés.
Un bilan initial précis
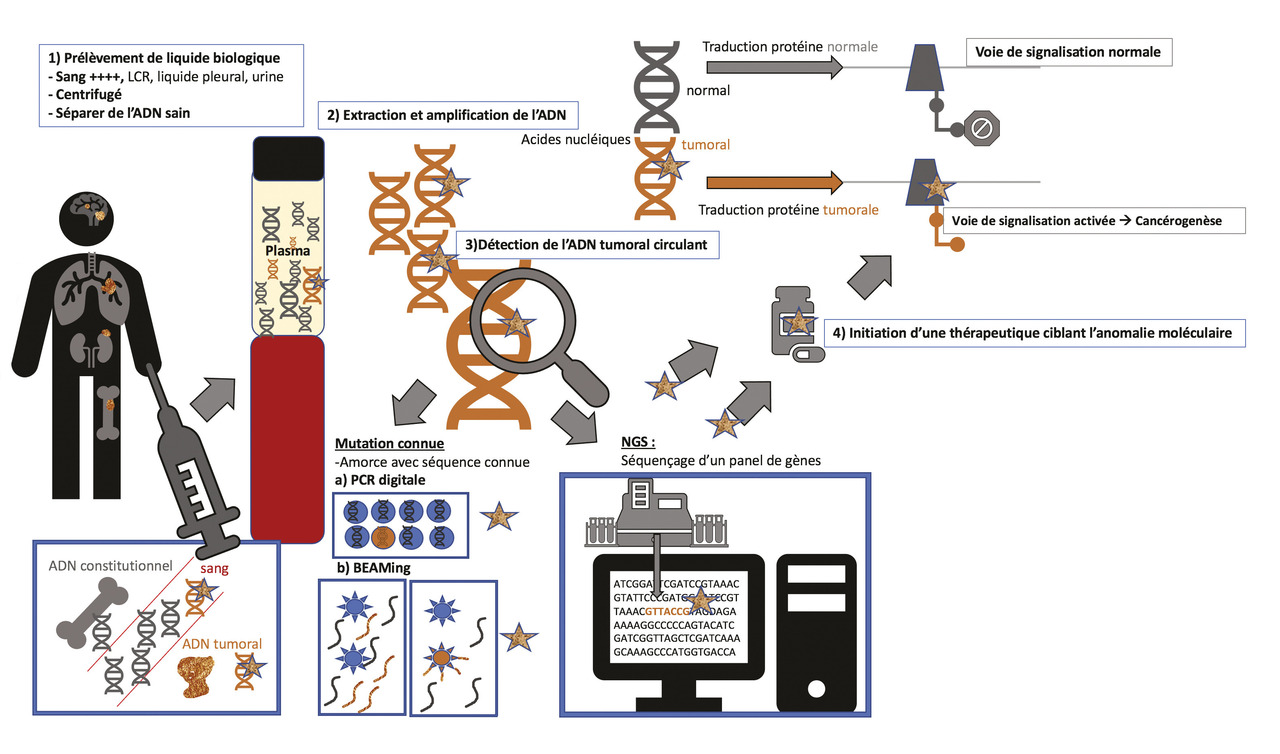
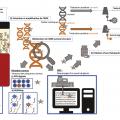
La biopsie liquide
Le diagnostic de cancer du poumon nécessite des biopsies tissulaires de la tumeur primitive ou d’une métastase. Ce diagnostic peut être aussi posé sur du matériel cytologique obtenu par ponction à l’aiguille (ponction pleurale, ganglionnaire…), s’il est suffisamment abondant. Des analyses moléculaires sont indiquées lors du diagnostic de tous les cancers non épidermoïdes métastatiques. Des biopsies itératives, au moment de la progression, en particulier sous traitement ciblé, sont aussi nécessaires afin d’analyser le ou les mécanismes de résistance pour adapter au mieux le traitement. Or le matériel tumoral obtenu sur les biopsies tissulaires est parfois insuffisant. De plus, lorsque les biopsies doivent être répétées, les techniques les moins invasives ont la préférence des patients. Les progrès techniques accomplis ces dernières années ont permis la révolution que représente la biopsie liquide.
La biopsie liquide est une analyse qui consiste à détecter du matériel tumoral sur un prélèvement non tissulaire, comme une prise de sang. Cette analyse peut également être réalisée sur d’autres liquides biologiques tels que les urines, le liquide céphalorachidien1 ou le liquide pleural.
Cellules tumorales circulantes
Les cellules cancéreuses peuvent passer dans la circulation sanguine et devenir des cellules tumorales circulantes pouvant potentiellement disséminer. Il est possible de détecter ces cellules par des techniques permettant de différencier les cellules tumorales des cellules sanguines (séparation des cellules par technique immunologique : détection d’antigènes de surface qui ne sont pas exprimés par les cellules sanguines mais par les cellules épithéliales, donc les cellules cancéreuses d’origine épithéliale, comme les cytokératines,2 ou par une technique de séparation physique sur la taille des cellules). Après isolement de ces cellules, une analyse morphologique au microscope est nécessaire pour affirmer la nature tumorale des cellules triées. La détection de cellules tumorales circulantes au-dessus d’un certain seuil dans le suivi de patients est prédictive d’une survie diminuée dans certains cancers (cancer du sein métastatique,3 cancer de la prostate métastatique résistant à la castration ou cancer colorectal métastatique). La recherche de cellules tumorales circulantes est moins utilisée en routine que la recherche d’ADN tumoral circulant car nettement moins sensible et nécessitant un appareillage dédié.
ADN tumoral circulant
L’ADN tumoral peut être détecté dans les liquides biologiques.4 La carcinogenèse est induite par des anomalies génomiques : amplifications, translocations ou délétions de séquences au sein de chromosomes ou des mutations au sein d’un gène aboutissant à la formation de protéines chimériques ou de récepteurs activés. Ces anomalies peuvent être identifiées dans les liquides biologiques et témoigner de la présence d’ADN tumoral circulant.
Lors d’une biopsie liquide, le sang est prélevé comme pour un bilan sanguin standard mais dans un tube spécifique qui est centrifugé pour procéder à une extraction d’ADN sur le plasma, qui est ensuite amplifié. Il est ainsi possible de détecter des mutations au sein d’acides nucléiques circulants par des techniques de polymerase chain reaction (PCR) ultra-sensibles : (PCR digitale, BEAMing) ou de next-generation sequencing (NGS). Ces techniques sont désormais réalisées en routine dans les centres prenant en charge le cancer du poumon. Plus récemment, les techniques visant à identifier l’ARN tumoral, molécule plus fragile, mais plus abondante, passant aussi dans le sang et autres liquides biologiques, ont été introduites, permettant de détecter des transcrits ARN de fusion (ARN messagers produits par des « néogènes » issus de translocations chromosomiques, et qui codent alors une protéine oncogénique). Ces transcrits de fusion impliquent la plupart des tyrosine kinases (comme ALK), activées par leur fusion avec un autre partenaire, et contre lesquelles existent désormais des inhibiteurs spécifiques.
Addiction oncogénique
Le phénomène d’addiction oncogénique ou de « driver oncogénique » correspond à la dépendance de la cellule tumorale à un mécanisme oncogénique prépondérant induisant un signal de prolifération et de survie. L’identification de « drivers oncogéniques » a permis le développement de petites molécules appelées thérapies ciblées, spécifiques du biomarqueur identifié, permettant un traitement personnalisé. Une analogie souvent parlante pour les patients est celle de l’interrupteur électrique. La cellule tumorale est parfois dépendante majoritairement d’un interrupteur qui reste allumé en permanence et entraîne la prolifération non régulée et permanente de la cellule. Le traitement ciblé a pour rôle « d’éteindre » cet interrupteur moléculaire, en l’inhibant par une interaction physique, pour stopper la multiplication des cellules tumorales.
La mutation du récepteur de l’EGF est une altération génétique qui peut être retrouvée dans environ 10 à 15 % des cancers du poumon en population caucasienne, mais avec une fréquence plus importante si la population étudiée concerne des femmes (21 %) ou des patients jamais sevrés ou très petits fumeurs sevrés (44 %).5
Indications
La biopsie liquide est utilisée dans le cancer du poumon métastatique pour la recherche d’une mutation de l’EGFR lorsque la biopsie tissulaire est épuisée et/ou si le patient n’est plus accessible à une biopsie tissulaire (réanimation, grand âge, comorbidités, risques d’une biopsie tissulaire car lésion tumorale avoisinant un organe à risque). L’identification dans le sang d’une mutation de l’EGFR permet d’initier un traitement par inhibiteur de tyrosine kinase de l’EGFR6 avec des taux de réponse élevés (80 %) et prolongés (74 % de taux de survie à 3 ans).7
Cependant, une tumeur cancéreuse est un processus dynamique qui va évoluer sous cette pression thérapeutique. Il existe une hétérogénéité tumorale avec différents sous-clones qui peuvent disparaître ou au contraire prendre le dessus sous l’action de thérapies ciblées. Ainsi, des mutations de résistance peuvent être identifiées, conférant au clone cellulaire qui les possède un avantage de survie. La biopsie liquide peut détecter des mutations de résistance comme la mutation T790M de l’EGFR.8
Les biopsies liquides contribuent donc à une approche théranostique (pour thérapie et diagnostique) du cancer bronchique.
Sous l’impulsion de l’Institut national du cancer (INCa), la France a été pionnière dans le domaine par la structuration de 28 plateformes régionales de génétique moléculaire des cancers réparties sur l’ensemble du territoire français, avec pour objectifs la centralisation des tests moléculaires au sein d’une région, leur réalisation dans le cadre de processus qualité, un rendu rapide des analyses afin d’optimiser l’accès aux traitements innovants (programme AcSé).
D’autres applications potentielles de la biopsie liquide font l’objet d’études, comme le diagnostic de récidive après traitement adjuvant, ou dans le cadre du dépistage en association avec l’imagerie, ou encore dans la surveillance sous traitement (mesure de la maladie résiduelle), à l’instar de ce qui existe depuis 20 ans en hématologie.
2. Allard WJ, Matera J, Miller MC, et al. Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases. Clin Cancer Res 2004;10:6897-904.
3. Cristofanilli M, Budd GT, Ellis MJ, et al. Circulating tumor cells, disease progression, and survival in metastatic breast cancer. N Engl J Med 2004;351:781-91.
4. Leon SA, Shapiro B, Sklaroff DM, Yaros MJ. Free DNA in the serum of cancer patients and the effect of therapy. Cancer Res 1977;37:646-50.
5. Barlesi F, Mazieres J, Merlio JP, et al. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT). Lancet 2016;387:1415-26.
6. Douillard JY, Ostoros G, Cobo M, et al. Gefitinib treatment in EGFR mutated caucasian NSCLC: circulating-free tumor DNA as a surrogate for determination of EGFR status. J Thorac Oncol 2014;9:1345-53.
7. Soria JC, Ohe Y, Vansteenkiste J, et al. Osimertinib in untreated EGFR-mutated advanced non-small-cell lung cancer. N Engl J Med 2018;378:113-25.
8. Murtaza M, Dawson SJ, Tsui DW, et al. Non-invasive analysis of acquired resistance to cancer therapy by sequencing of plasma DNA. Nature 2013;497:108-12.
2. National Lung Screening Trial Research Team, Aberle DR, Adams AM, et al. Reduced lung-cancer mortality with low-dose computed tomographic screening. N Engl J Med 2011;365:395-409.
3. de Koning HJ, van der Aalst CM, de Jong PA, et al. Reduced lung-cancer mortality with volume ct screening in a randomized trial. N Engl J Med 2020;382:503-13.
4. Yan TD, Black D, Bannon PG, McCaughan BC. Systematic review and meta-analysis of randomized and nonrandomized trials on safety and efficacy of video-assisted thoracic surgery lobectomy for early-stage non-small-cell lung cancer. J Clin Oncol 2009;27:2553-62.
5. Schneider BJ, Daly ME, Kennedy EB, et al. Stereotactic body radiotherapy for early-stage non-small-cell lung cancer: American Society of Clinical Oncology endorsement of the American Society for Radiation Oncology evidence-based guideline. J Clin Oncol 2018;36:710-9.
6. Gettinger S, Horn L, Jackman D, et al. Five-year follow-up of nivolumab in previously treated advanced non-small-cell lung cancer: results from the CA209-003 study. J Clin Oncol 2018;36:1675-84.
7. Institut national du cancer. Cancer du poumon, bilan initial. Recommandations et référentiels, INCa 2013.
8. Institut national du cancer. Cancers bronchopulmonaires – Du diagnostic au suivi. INCa, 2016.
9. Souquet PJ, Duruisseaux M, Tissot C, Falchero L; et le comité de rédaction des référentiels Auvergne Rhône-Alpes en oncologie thoracique. Référentiel Cancer bronchique à petites cellules : actualisation 2020. ARISTOT 2020. Accessible sur http://referentiels-aristot.com/
10. Rivera MP, Mehta AC, Wahidi MM. Establishing the diagnosis of lung cancer: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143(5 Suppl):e142S e165S.
11. Dietel M, Bubendorf L, Dingemans AM, et al. Diagnostic procedures for non-small-cell lung cancer (NSCLC): recommendations of the European Expert Group. Thorax 2016;71:177 84.
12. Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2017;28(suppl_4):iv1-iv21.
13. Ettinger DS, Wood DE, Aggarwal C, et al. NCCN guidelines insights: non-small cell lung cancer, Version 1.2020. J Natl Compr Canc Netw 2019;17:1464-72.
14. Travis WD, Brambilla E, Burke AP, Marx A, Nicholson AG. Introduction to the 2015 World Health Organization classification of tumors of the lung, pleura, thymus, and heart. J Thorac Oncol 2015;10:1240-2.
15. Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus chemotherapy for PD-L1-positive non-small-cell lung cancer. N Engl J Med 2016;375:1823-33.
16. Goldstraw P, Chansky K, Crowley J, et al. The IASLC lung cancer staging project: proposals for revision of the TNM stage groupings in the forthcoming (Eighth) edition of the TNM classification for lung cancer. J Thorac Oncol 2016;11:39-51.
17. Fischer B, Lassen U, Mortensen J, et al. Preoperative staging of lung cancer with combined PET-CT. N Engl J Med 2009;361:32-9.
18. Schmidt-Hansen M, Baldwin DR, Hasler E, Zamora J, Abraira V, Roqué I Figuls M. PET-CT for assessing mediastinal lymph node involvement in patients with suspected resectable non-small cell lung cancer. Cochrane Database Syst Rev 2014;2014(11):CD009519.
19. Brunelli A, Kim AW, Berger KI, Addrizzo-Harris DJ. Physiologic evaluation of the patient with lung cancer being considered for resectional surgery: Diagnosis and management of lung cancer, 3rd ed: American College of Chest Physicians evidence-based clinical practice guidelines. Chest 2013;143(5 Suppl):e166S–e190S.
20. Brunelli A, Charloux A, Bolliger CT, et al. ERS/ESTS clinical guidelines on fitness for radical therapy in lung cancer patients (surgery and chemo-radiotherapy). Eur Respir J 2009;34:17-41.
21. Dietel M, Bubendorf L, Dingemans AM, et al. Diagnostic procedures for non-small-cell lung cancer (NSCLC): recommendations of the European Expert Group. Thorax 2016;71:177-84.
22. Makris D, Scherpereel A, Leroy S, et al. Electromagnetic navigation diagnostic bronchoscopy for small peripheral lung lesions. Eur Respir J 2007;29:1187-92.
23. Loubeyre P, Copercini M, Dietrich PY. Percutaneous £CT-guided multisampling core needle biopsy of thoracic lesions. Am J Roentgenol 2005;185:1294-8.
24. Adams K, Shah PL, Edmonds L, Lim E. Test performance of endobronchial ultrasound and transbronchial needle aspiration biopsy for mediastinal staging in patients with lung cancer: systematic review and meta-analysis. Thorax 2009;64:757-62.

 Encadrés
Encadrés