Biosimilaires. À la différence d’un générique, un biosimilaire, copie d’un médicament biologique, doit démontrer sa similarité structurale, fonctionnelle, pré-clinique et clinique avec le médicament de référence.
Les médicaments biologiques, appelés biothérapies ou biomédicaments, sont issus des biotechnologies. Actuellement, les innovations thérapeutiques sont concentrées sur ces médicaments biologiques, 80 % des nouveaux médicaments mis sur le marché sont issus des biotechno- logies. Ils ont révolutionné la prise en charge de pathologies dans des domaines variés tels que la rhumatologie, la dermatologie, la gastro- entérologie ou encore l’onco-hématologie. Depuis 2006, les biosimilaires sont arrivés sur le marché français, copies des médicaments biologiques dont le brevet a expiré. Où en est-on actuellement ?
Médicament biologique et médicament biosimilaire
Un médicament biologique est défini comme « tout médicament dont la substance active est produite à partir d’une source biologique ou en est extraite et dont la caractérisation et la détermination de la qualité nécessitent une combinaison d’essais physiques, chimiques et biologiques ainsi que la connaissance de son procédé de fabrication et de son contrôle ».1 Autrement dit, on distingue les médicaments biologiques des médicaments dont le principe actif est issu de la synthèse chimique, qui restent les médicaments les plus représentés dans la pharmacopée actuelle. Il existe plusieurs catégories de médicaments biologiques : les vaccins, les protéines thérapeutiques (insulines, facteurs de croissance, interférons) et les anticorps monoclonaux. À titre d’illustration, un anticorps mono- clonal comporte plus de 650 acides aminés pour un poids moléculaire d’environ 150 000 daltons, alors qu’un médicament issu de la synthèse chimique comme le paracétamol a un poids moléculaire de 151 daltons.
Un médicament biosimilaire est défini par l’article L.5121-1 15° du code de la santé publique comme « un médicament biologique de même composition qualitative et quantitative en substance active et de même forme pharmaceutique qu’un médi- cament biologique de référence mais qui ne remplit pas les conditions pour être regardé comme une spécia- lité générique en raison de différences liées notamment à la variabilité de la matière première ou aux procédés de fabrication et nécessitant que soient produites des données précliniques et cliniques supplémentaires dans des conditions déterminées par voie réglementaire ».1 Un médicament biosimilaire est la copie d’un médicament biologique de référence qui est déjà autorisé en Europe et dont le brevet est tombé dans le domaine public. Il est utilisé dans les mêmes schémas thérapeutiques, aux mêmes posologies que le médicament biologique de référence. L’Agence nationale de sécurité des médicaments publie désormais un répertoire des biosimilaires (
Comment sont produits les médicaments biologiques ?
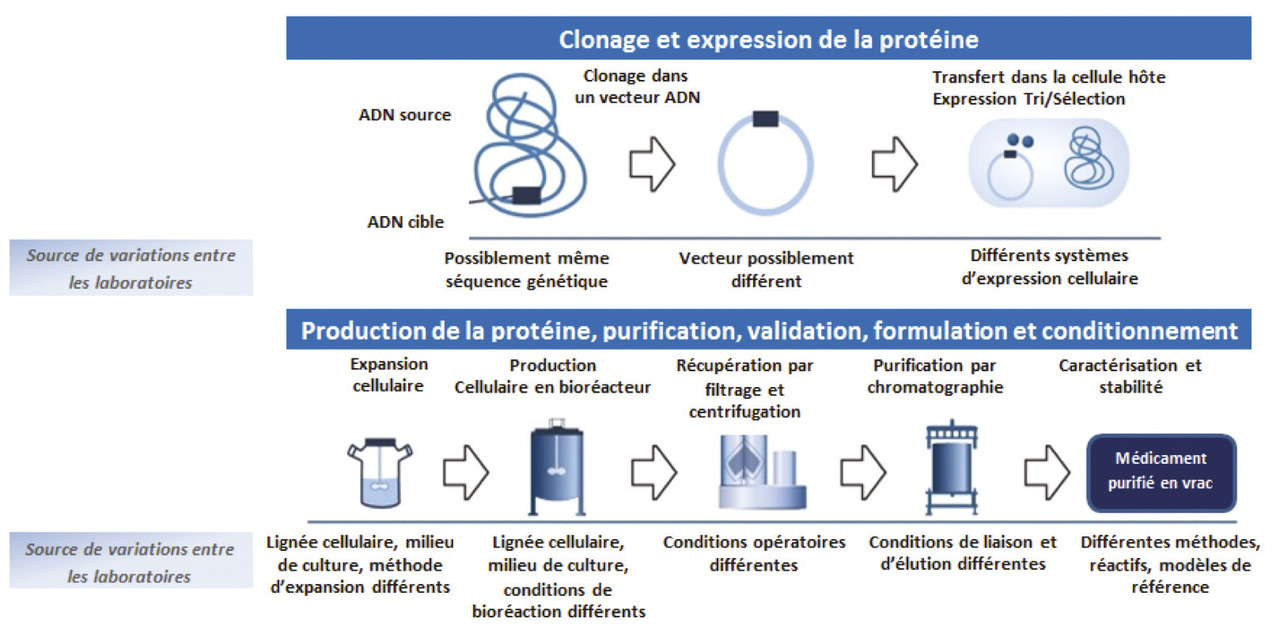
Les médicaments biologiques de référence ou les médicaments bio- similaires sont des médicaments pour lesquels le principe actif est fabriqué par un organisme vivant au moyen d’un ADN cible. Ce dernier est inséré dans un vecteur qui est ensuite transféré dans une cellule hôte. Les cellules hôtes sont alors mises en culture au sein d’un bioréacteur et produisent la biothérapie. De multiples étapes de purification se succèdent afin d’obtenir le médicament final (
Les médicaments biologiques (de référence ou biosimilaire) sont des molécules complexes et hétérogènes tant par leur taille que par leurs structures primaire (chaîne d’acides aminés), secondaire (repliement de la chaîne peptidique) et tertiaire (repliement tridimensionnel de la chaîne peptidique). À la différence des médicaments produits par synthèse chimique, la complexité de ces molécules peut engendrer une variabilité entre chaque molécule produite. En effet, la protéine, une fois synthétisée, subit des glycosylations diverses non identiques et non reproductibles d’une protéine à l’autre. Ces modifications dites « post-traductionnelles » peuvent conférer une structure tridimensionnelle légèrement différente entre chaque protéine. De nombreuses méthodes d’analyse physicochimiques et biologiques sont nécessaires pour évaluer et vérifier chaque lot du médicament produit qui doit répondre à des normes de qualité prédéfinies
Quelles différences avec les génériques ?
Le biosimilaire ne répond pas strictement à la définition du générique. En effet, le générique d’une spécialité de référence est défini comme ayant la même composition qualitative et quantitative en principe actif et la même forme pharmaceutique. Le développement du générique repose sur la démonstration, par des études de pharmacocinétique, de la bioéquivalence avec la spécialité de référence.1 Au vu des procédés de fabrication, le biosimilaire ne peut être strictement identique. L’enregistrement d’un biosimilaire est essentiellement fondé sur des études de comparabilité destinées à démontrer la similarité avec le médicament biologique de référence. Le biosimilaire doit démontrer une similarité structurale, fonctionnelle et préclinique (bioéquivalence pharmacocinétique et pharmacodynamique, toxicité). Enfin, cette similarité doit être confirmée par des études cliniques (efficacité, sécurité, immunogénicité) de non-infériorité vis-à-vis des médicaments biologiques de référence, non nécessaires pour les médicaments génériques. Ces études cliniques ne sont pas réalisées dans toutes les indications des médicaments biologiques de référence. Par exemple, pour obtenir l’autorisation de mise sur le marché, l’étude d’équivalence d’efficacité de Flixabi (infliximab, biosimilaire de Remicade) a été réalisée chez des patients atteints de polyarthrite rhumatoïde.
Les principales différences entre médicaments génériques et biosimilaires sont récapitulées dans le
Contexte réglementaire
En 2013, les autorités de santé recommandaient, après une première administration, de ne pas modifier la spécialité administrée au cours du traitement, afin de limiter les risques d’immunisation et d’assurer la traçabilité du suivi de pharmacovigilance.
En mai 2017 ont été publiés les résultats de l’étude NOR-SWITCH3 initiée par le gouvernement norvégien. Cette étude, randomisée et en double aveugle, est la première qui démontre la non-infériorité d’un biosimilaire (Inflectra) par rapport au médicament biologique de référence (Remicade) en cas de « switch », en termes d’efficacité et de tolérance.
La loi de financement de la Sécurité sociale pour 2017 puis l’instruction du 3 août 2017 relative aux médi- caments biologiques4 ont modifié les règles en vigueur relatives au recours aux médicaments biosi- milaires.
La première règle porte sur la prescription des biosimilaires : il est désormais possible de remplacer à tout moment du traitement un médicament biologique de référence par un biosimilaire : c’est l’interchangea- bilité. Elle induit la même obligation d’information du patient ou de tra- çabilité que pour les médicaments biologiques de référence mais aucune obligation supplémentaire.
En ce qui concerne la dispensation des biosimilaires, les conditions de traçabilité restent identiques à celle de l’ensemble des médicaments biologiques (enregistrement et conservation des informations relatives au prescripteur, au patient et au médicament délivré). Lors de la délivrance, la substitution par le pharmacien d’un médicament bio- logique par un biosimilaire n’est pas possible à ce jour, en l’absence de décret d’application.
Comment prescrire un biosimilaire ?
Seul le médecin autorisé à prescrire le médicament biologique de référence peut prescrire le médicament biosimilaire correspondant, tout au long du parcours patient. Par exemple, la prescription de Bemfola (biosimilaire de Gonal-F) reste réservée aux médecins gynécologues, endocrinologues et urologues. Comme pour toute prescription, cette prescription doit se faire dans le cadre d’une décision partagée entre le médecin et le patient.
La prescription d’un biosimilaire, à l’instar de tous les médicaments d’origine biologique, doit s’effectuer en dénomination commune et en nom de marque ou nom de fantaisie.5 Elle doit respecter les règles de bonne prescription que sont : l’information du patient (des observatoires du médicament, des dispositifs médicaux et de l’innovation thérapeutique [OMéDIT] ont mis à disposition des plaquettes d’information à destination des patients6) et la traçabilité du médicament prescrit dans le dossier médical du patient.
Les avantages
La mise à disposition des biosimilaires présente un double intérêt :7
– elle permet de diversifier l’offre en médicament biologique pour une pathologie donnée et donc de prévenir les ruptures de stocks et/ou les accidents de production ; cela permet de garantir aux patients le maintien de l’accès à leur traitement ;
– d’un point de vue économique, elle permet de stimuler la concurrence et d’induire une baisse des prix des médicaments biologiques tout en garantissant la sécurité et la qualité des traitements. En effet, un biosi- milaire arrive sur le marché avec un prix négocié par le Comité économique des produits de santé de la Haute Autorité de santé (CEPS) de 20 à 30 % plus bas que celui du médicament biologique de référence. Ce dernier a le droit de s’aligner sur le prix du biosimilaire, mais avec un délai, afin de ne pas empêcher la pénétration des biosimilaires sur le marché.
En raison de ce dernier élément, le plan Objectif national de dépenses d’Assurance maladie (ONDAM) 2018 prévoit une économie de 40 millions d’euros avec la promotion de l’utilisation des biosimilaires.8 À titre d’exemple, la prescription en ville du biosimilaire Benepali à la place du médicament biologique de référence Enbrel, pour traiter un psoriasis en plaques, permet une économie de 681 euros par patient. En France, parmi les 10 médicaments les plus vendus en ville (en valeur), 4 sont des médicaments biologiques9 (Lucentis, Humira, Enbrel, Lantus), 2 ont un biosimilaire disponible (Enbrel et Lantus) et un 3e (Humira) verra prochainement son biosimilaire arriver sur le marché.
La prescription de biosimilaires constitue un enjeu économique important pour notre système de santé, tout en garantissant un niveau d’efficacité et de sécurité comparable à celui des médicaments biologiques de référence déjà présents sur le marché.
1. Article L5121-1. Version en vigueur au 1er juillet 2017. Code de la santé publique L5121-1.
2. Agence nationale de sécurité du médicament et des produits de santé. État des lieux sur les médicaments biosimilaires. Rapport ANSM, mai 2016. www.ansm.sante.fr ou http://bit.ly/2InEWPs
3. Jørgensen KK, Olsen IC, Goll GL, et al. Switching from originator infliximab to biosimilar CT-P13 compared with maintained treatment with originator infliximab (NOR-SWITCH): a 52-week, randomised, double-blind, non-inferiority trial. Lancet 2017;389:2304-16.
4. Instruction n° DGOS/PF2/DSS/1C/DGS/PP2/2017/244 du 3 août 2017 relative aux médicaments biologiques, à leurs similaires ou « biosimilaires », et à l’interchangeabilité en cours des traitements. http://circulaire.legifrance.gouv.fr ou http://bit.ly/2FyQr8Q
5. Code de la santé publique. Article L5121-1-2. Version en vigueur au 28 janvier 2016.
6. OMéDIT Centre. Biosimilaires informations patients. Triptyque OMéDIT Centre. www.omedit-centre.fr ou http://bit.ly/2tIRcqo
7. Haute Autorité de santé. Les médicaments biosimilaires. www.has-sante.fr ou http://bit.ly/2zRny0N
8. Projet de loi de financement de la Sécurité sociale 2018. Annexe 7 ONDAM et dépenses de santé. www.securite-sociale.fr ou http://bit.ly/2p7Bq3x
9. Agence nationale de sécurité du médicament et des produits de santé. Ventes de médicaments en France : le rapport d’analyse de l’année 2013. Communiqué ANSM, 24 juin 2014. http://ansm.sante.fr ou http://bit.ly/2tM35f4
10. Camacho LH, Frost CP, Abella E, Morrow PK, Whittaker S. Biosimilars 101: considerations for U.S. oncologists in clinical practice. Cancer Med 2014;3:889-99.