Le traitement de la rectocolite hémorragique bénéficie de l’arrivée des biothérapies, qui occupent désormais une place majeure, avec trois classes thérapeutiques principales. Leur administration est réalisée majoritairement par voie sous-cutanée, à domicile, ce qui nécessite une coopération entre gastro-entérologues et médecins traitants.
Le traitement de la rectocolite hémorragique (RCH) a considérablement évolué durant ces dernières années. En effet, les objectifs thérapeutiques ont été révolutionnés par l’arrivée des biothérapies, qui occupent désormais une place majeure, avec trois classes thérapeutiques principales. Leur administration, initialement intraveineuse et hospitalière, est actuellement réalisée majoritairement en sous-cutanée et à domicile. Par ailleurs, leur coût diminue grâce aux biosimilaires. De plus en plus de patients atteints de RCH sont donc traités par biothérapie à domicile, ce qui implique une coopération importante entre gastroentérologues et médecins spécialistes en médecine générale.
Une maladie très invalidante
La RCH touche en Europe et en Amérique du Nord près de 1 personne sur 1 500, et son incidence est estimée entre 6 et 8 pour 100 000 individus.1
La RCH est responsable d’une inflammation chronique de la muqueuse du rectum, avec une extension dans le côlon d’amont, variable selon les individus. On définit trois niveaux d’extension des lésions : la rectite, l’atteinte étendue du rectum jusqu’à l’angle colique gauche, et la pancolite lorsque les lésions s’étendent en amont de l’angle colique gauche.
La sévérité de la RCH est classiquement définie selon trois stades : minime, modérée ou sévère, en fonction de la fréquence des selles liquides, des douleurs abdominales et des signes inflammatoires systémiques.
La RCH est une maladie très invalidante, avec une altération importante de la qualité de vie, parfois évaluée comme supérieure à celle de certaines pathologies cancéreuses. L’atteinte rectale est caractérisée par des impériosités, parfois des épisodes d’incontinence et des faux besoins avec des rectorragies présentes chez pratiquement tous les patients. Les formes distales peuvent s’accompagner d’une constipation ; à l’inverse, lorsque les lésions inflammatoires intéressent ou dépassent le côlon sigmoïde, la diarrhée chronique est fréquente.
Un syndrome inflammatoire systémique est rarement observé, et l’élévation de la protéine C-réactive (CRP), présente chez moins de 20 % des patients, est un signe de sévérité de la maladie.
Les complications de la RCH sont principalement marquées par les poussées sévères (colite aiguë grave), qui peuvent concerner jusqu’à 10 % des patients. Les autres complications sont surtout liées à un mauvais contrôle de la maladie à long terme, avec des risques d’altération chronique de la qualité de vie, d’anémie, de fibrose et de perte d’élasticité de la paroi colique (microcolie) conduisant à une diarrhée irréversible, et de lésions dysplasiques, puis de cancers colorectaux. Près de 10 % des patients nécessitent une coloproctectomie totale pour maladie réfractaire ou compliquée. Enfin, près de 30 % des patients ont des manifestations inflammatoires extra-intestinales associées : uvéites, épisclérites, arthrites périphériques et/ou axiales, érythème noueux, pyoderma gangrenosum, cholangite sclérosante primitive, etc.
La RCH est responsable d’une inflammation chronique de la muqueuse du rectum, avec une extension dans le côlon d’amont, variable selon les individus. On définit trois niveaux d’extension des lésions : la rectite, l’atteinte étendue du rectum jusqu’à l’angle colique gauche, et la pancolite lorsque les lésions s’étendent en amont de l’angle colique gauche.
La sévérité de la RCH est classiquement définie selon trois stades : minime, modérée ou sévère, en fonction de la fréquence des selles liquides, des douleurs abdominales et des signes inflammatoires systémiques.
La RCH est une maladie très invalidante, avec une altération importante de la qualité de vie, parfois évaluée comme supérieure à celle de certaines pathologies cancéreuses. L’atteinte rectale est caractérisée par des impériosités, parfois des épisodes d’incontinence et des faux besoins avec des rectorragies présentes chez pratiquement tous les patients. Les formes distales peuvent s’accompagner d’une constipation ; à l’inverse, lorsque les lésions inflammatoires intéressent ou dépassent le côlon sigmoïde, la diarrhée chronique est fréquente.
Un syndrome inflammatoire systémique est rarement observé, et l’élévation de la protéine C-réactive (CRP), présente chez moins de 20 % des patients, est un signe de sévérité de la maladie.
Les complications de la RCH sont principalement marquées par les poussées sévères (colite aiguë grave), qui peuvent concerner jusqu’à 10 % des patients. Les autres complications sont surtout liées à un mauvais contrôle de la maladie à long terme, avec des risques d’altération chronique de la qualité de vie, d’anémie, de fibrose et de perte d’élasticité de la paroi colique (microcolie) conduisant à une diarrhée irréversible, et de lésions dysplasiques, puis de cancers colorectaux. Près de 10 % des patients nécessitent une coloproctectomie totale pour maladie réfractaire ou compliquée. Enfin, près de 30 % des patients ont des manifestations inflammatoires extra-intestinales associées : uvéites, épisclérites, arthrites périphériques et/ou axiales, érythème noueux, pyoderma gangrenosum, cholangite sclérosante primitive, etc.
Évolution des objectifs thérapeutiques
Le concept classique caractérisant la RCH comme une maladie évoluant selon des phases de poussées inflammatoires entrecoupées de périodes de rémission clinique a considérablement évolué.
Plusieurs travaux ont démontré que des patients asymptomatiques sous traitement, mais qui gardaient des lésions inflammatoires muqueuses en coloscopie, avaient un risque de rechute clinique à un an significativement plus important que les patients chez lesquels une cicatrisation endoscopique parfaite était obtenue. Ainsi, plusieurs études et méta-analyses montrent que l’obtention d’une cicatrisation muqueuse endoscopique est associée à un meilleur pronostic évolutif à long terme de la maladie, avec une réduction importante du risque de complication.2 L’obtention d’une simple rémission clinique des symptômes caractérisée par la disparition des douleurs abdominales, des selles diarrhéiques et des rectorragies n’est donc plus un objectif thérapeutique suffisant à terme.
Un consensus d’experts internationaux, nommé STRIDE-II,3 a défini des objectifs thérapeutiques communs pour tous les traitements utilisés dans les maladies inflammatoires chroniques de l’intestin (que ce soit la RCH ou la maladie de Crohn) :
– à court terme (1 à 2 mois), le traitement doit permettre d’obtenir une réponse clinique généralement caractérisée par la diminution de 50 % des symptômes à type de douleurs abdominales et selles liquides ;
– à moyen terme (entre 3 et 6 mois), la rémission clinique doit être obtenue et être caractérisée par la disparition des symptômes digestifs précédemment cités ;
– à plus long terme (à 6 mois pour la RCH et entre 9 et 12 mois pour la maladie de Crohn), une cicatrisation des lésions endoscopiques doit être obtenue. Il est probable que, dans la RCH, l’obtention d’une cicatrisation également histologique soit associée à une diminution encore plus importante des risques évolutifs ultérieurs, mais cet objectif n’est pour l’instant pas requis en pratique clinique courante.
Bien évidemment, en pratique, ces objectifs sont à moduler au cas par cas selon la sévérité initiale de la maladie, les comorbidités et l’âge des patients, et à mettre en balance avec les caractéristiques des traitements choisis en matière de rapport risques-efficacité. Dans une forme sévère de la maladie et chez un sujet jeune sans comorbidité, il est important d’obtenir un contrôle rapide de la maladie et, pour ce faire, de privilégier le recours à un traitement ou à une association thérapeutique dont le profil d’efficacité sera peut-être supérieur à celui de sa sécurité.
Plusieurs travaux ont démontré que des patients asymptomatiques sous traitement, mais qui gardaient des lésions inflammatoires muqueuses en coloscopie, avaient un risque de rechute clinique à un an significativement plus important que les patients chez lesquels une cicatrisation endoscopique parfaite était obtenue. Ainsi, plusieurs études et méta-analyses montrent que l’obtention d’une cicatrisation muqueuse endoscopique est associée à un meilleur pronostic évolutif à long terme de la maladie, avec une réduction importante du risque de complication.2 L’obtention d’une simple rémission clinique des symptômes caractérisée par la disparition des douleurs abdominales, des selles diarrhéiques et des rectorragies n’est donc plus un objectif thérapeutique suffisant à terme.
Un consensus d’experts internationaux, nommé STRIDE-II,3 a défini des objectifs thérapeutiques communs pour tous les traitements utilisés dans les maladies inflammatoires chroniques de l’intestin (que ce soit la RCH ou la maladie de Crohn) :
– à court terme (1 à 2 mois), le traitement doit permettre d’obtenir une réponse clinique généralement caractérisée par la diminution de 50 % des symptômes à type de douleurs abdominales et selles liquides ;
– à moyen terme (entre 3 et 6 mois), la rémission clinique doit être obtenue et être caractérisée par la disparition des symptômes digestifs précédemment cités ;
– à plus long terme (à 6 mois pour la RCH et entre 9 et 12 mois pour la maladie de Crohn), une cicatrisation des lésions endoscopiques doit être obtenue. Il est probable que, dans la RCH, l’obtention d’une cicatrisation également histologique soit associée à une diminution encore plus importante des risques évolutifs ultérieurs, mais cet objectif n’est pour l’instant pas requis en pratique clinique courante.
Bien évidemment, en pratique, ces objectifs sont à moduler au cas par cas selon la sévérité initiale de la maladie, les comorbidités et l’âge des patients, et à mettre en balance avec les caractéristiques des traitements choisis en matière de rapport risques-efficacité. Dans une forme sévère de la maladie et chez un sujet jeune sans comorbidité, il est important d’obtenir un contrôle rapide de la maladie et, pour ce faire, de privilégier le recours à un traitement ou à une association thérapeutique dont le profil d’efficacité sera peut-être supérieur à celui de sa sécurité.
Démarche thérapeutique
Dans les formes minimes à modérées de RCH, il est recommandé de recourir en première ligne aux dérivés 5-aminosalicylés (5-ASA) par voie topique et/ou orale selon la topographie des lésions coliques. Près de 50 % des patients souffrant de RCH modérée à sévère seraient bien contrôlés à long terme par les 5-ASA. Cependant, ces données sont relativement anciennes et ne tenaient pas compte des objectifs thérapeutiques actuels.
Les corticoïdes par voie orale (40 mg/j), et pour une courte durée, peuvent être utilisés en cas de poussée ne répondant pas aux 5-ASA ou devant une poussée d’emblée plus sévère.
En cas d’échec ou d’intolérance aux 5-ASA, ou après recours aux corticoïdes (a fortiori s’il existe une corticodépendance), le traitement de fond repose sur les thiopurines (azathioprine ou 6-mercaptopurine), les biothérapies ou les petites molécules plus récentes (inhibiteurs de Janus kinases [JAK]).
Concernant les immunosuppresseurs, le méthotrexate n’a plus de place comme traitement de fond (en monothérapie) de la RCH en raison de deux essais contrôlés randomisés négatifs. L’usage des thiopurines reste possible et toujours recommandé par les consensus internationaux ; ils sont cependant de moins en moins utilisés au profit des biothérapies, en raison de leur plus mauvais profil de tolérance à long terme et chez les sujets âgés (risque de cancers cutanés, de cancers de la vessie, de lymphomes, d’infections opportunistes) que celui des biothérapies. Par ailleurs, les données de cicatrisation muqueuse obtenues avec les immunosuppresseurs, dans des études anciennes, semblent inférieures à celles des biothérapies et des nouvelles petites molécules. Leur profil est donc moins favorable pour répondre aux objectifs thérapeutiques actuels.
Les corticoïdes par voie orale (40 mg/j), et pour une courte durée, peuvent être utilisés en cas de poussée ne répondant pas aux 5-ASA ou devant une poussée d’emblée plus sévère.
En cas d’échec ou d’intolérance aux 5-ASA, ou après recours aux corticoïdes (a fortiori s’il existe une corticodépendance), le traitement de fond repose sur les thiopurines (azathioprine ou 6-mercaptopurine), les biothérapies ou les petites molécules plus récentes (inhibiteurs de Janus kinases [JAK]).
Concernant les immunosuppresseurs, le méthotrexate n’a plus de place comme traitement de fond (en monothérapie) de la RCH en raison de deux essais contrôlés randomisés négatifs. L’usage des thiopurines reste possible et toujours recommandé par les consensus internationaux ; ils sont cependant de moins en moins utilisés au profit des biothérapies, en raison de leur plus mauvais profil de tolérance à long terme et chez les sujets âgés (risque de cancers cutanés, de cancers de la vessie, de lymphomes, d’infections opportunistes) que celui des biothérapies. Par ailleurs, les données de cicatrisation muqueuse obtenues avec les immunosuppresseurs, dans des études anciennes, semblent inférieures à celles des biothérapies et des nouvelles petites molécules. Leur profil est donc moins favorable pour répondre aux objectifs thérapeutiques actuels.
Trois classes de biothérapies
Les biothérapies ou biomédicaments sont des anticorps monoclonaux dont le degré d’humanisation est variable selon les molécules et dont la production est assurée par culture cellulaire à grande échelle par des biogénérateurs. Dans la RCH, trois grandes classes de biothérapie sont actuellement utilisées : les anti-TNF, les anti-intégrines et les anti-interleukines 12-23.
Les anti-TNF ont révolutionné la prise en charge
Les premières biothérapies disponibles dans la RCH ont été les anti-TNF, qui ont permis une révolution dans la prise en charge des maladies inflammatoires chroniques de l’intestin en raison de leur rapidité d’action et leur capacité à induire une cicatrisation profonde des lésions muqueuses.
De plus, les anti-TNF, également utilisés dans d’autres pathologies inflammatoires, notamment dermatologiques et rhumatologiques, sont efficaces en cas de manifestations extradigestives de la RCH.
Cette famille regroupe trois molécules autorisées dans la RCH : l’infliximab, l’adalimumab et le golimumab. Tous ces anti-TNF ont une autorisation de mise sur le marché (AMM) en première ligne de traitement biologique et en cas d’échec des traitements conventionnels, qui comprennent les dérivés salicylés, les corticoïdes et les immunosuppresseurs.
En pratique clinique, il est désormais admis qu’une cure de corticoïdes ou une corticodépendance représente une étape thérapeutique suffisante pour le recours à un anti-TNF sans qu’il soit obligatoire d’utiliser un traitement par immunosuppresseur de façon préalable.
Il existe actuellement deux formes d’infliximab, la forme intraveineuse et, depuis 2021, une forme sous-cutanée.
L’infliximab est un anticorps monoclonal chimérique comportant une partie murine qui majore le risque d’immunisation, et d’échappement au traitement. Lorsqu’il est administré par voie veineuse, il est souvent associé à un immunosuppresseur (« combothérapie »), qui peut être une thiopurine ou du méthotrexate.
Le traitement d’induction de l’infliximab est une perfusion de 5 mg/kg administrée aux semaines 0, 2 et 6.
Le traitement d’entretien, chez les patients répondeurs au traitement d’induction, est généralement administré par une perfusion toutes les huit semaines. Cependant, en cas de réponse incomplète ou de perte de réponse, le traitement peut être optimisé en augmentant la posologie jusqu’à 10 mg/kg et/ou en réduisant la fréquence des perfusions jusqu’à quatre semaines.
En cas d’utilisation de la forme sous-cutanée, la posologie habituelle est de 120 mg tous les quatorze jours, que l’on débute après au moins deux perfusions d’induction intraveineuse.
L’immunogénicité de la forme sous-cutanée d’infliximab semble moins importante que celle de la forme intraveineuse. Il est donc suggéré que l’infliximab administré par voie sous-cutanée puisse être utilisé en monothérapie, sans l’adjonction d’un immunosuppresseur.5 Ces données nécessitent cependant une validation à plus large échelle.
Le golimumab est un anticorps monoclonal humanisé administré par voie sous-cutanée selon un schéma initial comprenant une injection initiale de 200 mg (2 injections de 100 mg) puis de 100 mg après deux semaines.7 Par la suite, le rythme d’administration est d’une injection toutes les quatre semaines. La dose d’entretien est variable en fonction du poids : 50 mg toutes les quatre semaines pour les sujets pesant moins de 80 kg ; 100 mg toutes les quatre semaines en cas de poids supérieur ou égal à 80 kg. Il s’utilise également généralement en monothérapie.
L’adalimumab et le golimumab ne sont pas adaptés pour traiter les formes sévères de RCH, contrairement à l’infliximab.
Des biosimilaires de l’infliximab et de l’adalimumab sont disponibles, avec une efficacité et une tolérance identiques aux molécules princeps.
De plus, les anti-TNF, également utilisés dans d’autres pathologies inflammatoires, notamment dermatologiques et rhumatologiques, sont efficaces en cas de manifestations extradigestives de la RCH.
Cette famille regroupe trois molécules autorisées dans la RCH : l’infliximab, l’adalimumab et le golimumab. Tous ces anti-TNF ont une autorisation de mise sur le marché (AMM) en première ligne de traitement biologique et en cas d’échec des traitements conventionnels, qui comprennent les dérivés salicylés, les corticoïdes et les immunosuppresseurs.
En pratique clinique, il est désormais admis qu’une cure de corticoïdes ou une corticodépendance représente une étape thérapeutique suffisante pour le recours à un anti-TNF sans qu’il soit obligatoire d’utiliser un traitement par immunosuppresseur de façon préalable.
Infliximab privilégié dans les formes graves
L’infliximab est considéré comme l’anti-TNF le plus puissant dans la RCH.4 Il est donc privilégié dans les formes sévères, les colites aiguës graves, dont la prise en charge est hospitalière.Il existe actuellement deux formes d’infliximab, la forme intraveineuse et, depuis 2021, une forme sous-cutanée.
L’infliximab est un anticorps monoclonal chimérique comportant une partie murine qui majore le risque d’immunisation, et d’échappement au traitement. Lorsqu’il est administré par voie veineuse, il est souvent associé à un immunosuppresseur (« combothérapie »), qui peut être une thiopurine ou du méthotrexate.
Le traitement d’induction de l’infliximab est une perfusion de 5 mg/kg administrée aux semaines 0, 2 et 6.
Le traitement d’entretien, chez les patients répondeurs au traitement d’induction, est généralement administré par une perfusion toutes les huit semaines. Cependant, en cas de réponse incomplète ou de perte de réponse, le traitement peut être optimisé en augmentant la posologie jusqu’à 10 mg/kg et/ou en réduisant la fréquence des perfusions jusqu’à quatre semaines.
En cas d’utilisation de la forme sous-cutanée, la posologie habituelle est de 120 mg tous les quatorze jours, que l’on débute après au moins deux perfusions d’induction intraveineuse.
L’immunogénicité de la forme sous-cutanée d’infliximab semble moins importante que celle de la forme intraveineuse. Il est donc suggéré que l’infliximab administré par voie sous-cutanée puisse être utilisé en monothérapie, sans l’adjonction d’un immunosuppresseur.5 Ces données nécessitent cependant une validation à plus large échelle.
Adalimumab et golimumab, plutôt en monothérapie
L’adalimumab est un anticorps monoclonal anti-TNF humanisé. Il s’administre uniquement par voie sous-cutanée, avec un schéma d’induction à 160 mg, puis 80 mg à la semaine 2, et ensuite 40 mg tous les quatorze jours.6 En cas d’échappement ou de perte de réponse, la posologie peut être augmentée jusqu’à généralement 80 mg tous les quatorze jours, ou les intervalles réduits à sept jours. Il n’est habituellement pas recommandé d’associer un immunosuppresseur à l’adalimumab, même si ce type d’association peut être légitimement bénéfique au cas par cas chez certains patients.Le golimumab est un anticorps monoclonal humanisé administré par voie sous-cutanée selon un schéma initial comprenant une injection initiale de 200 mg (2 injections de 100 mg) puis de 100 mg après deux semaines.7 Par la suite, le rythme d’administration est d’une injection toutes les quatre semaines. La dose d’entretien est variable en fonction du poids : 50 mg toutes les quatre semaines pour les sujets pesant moins de 80 kg ; 100 mg toutes les quatre semaines en cas de poids supérieur ou égal à 80 kg. Il s’utilise également généralement en monothérapie.
L’adalimumab et le golimumab ne sont pas adaptés pour traiter les formes sévères de RCH, contrairement à l’infliximab.
Des biosimilaires de l’infliximab et de l’adalimumab sont disponibles, avec une efficacité et une tolérance identiques aux molécules princeps.
Une seule anti-intégrine disponible mais une action ciblée et bien tolérée
Le védolizumab est la seule anti-intégrine actuellement disponible dans le traitement de la RCH.8 C’est un anticorps monoclonal de type IgG1 humanisé qui neutralise de façon spécifique l’intégrine α4β7 et bloque le recrutement des cellules immunes circulant dans les vaisseaux sanguins digestifs vers la muqueuse intestinale et colique. Son mode d’action est donc très spécifique de l’inflammation intestinale, avec un effet systémique minime, et donc une excellente tolérance. En corollaire, ce traitement n’a pas d’action sur les manifestations inflammatoires extra-intestinales.
Le védolizumab a obtenu une AMM et le remboursement en France comme biothérapie de première ligne après échec ou intolérance des traitements conventionnels (5-ASA, corticoïdes, thiopurines), au même titre que les anti-TNF, grâce à un essai « face/face » contre l’adalimumab.9 Cependant, il n’est pas recommandé en pratique dans les formes les plus sévères de RCH, où l’infliximab reste le traitement de choix en première ligne.
Le traitement d’induction est toujours effectué par voie intraveineuse en milieu hospitalier avec une perfusion de 300 mg réalisée aux semaines 0, 2 et 6. Par la suite, les perfusions sont généralement réalisées toutes les huit semaines mais peuvent être rapprochées jusqu’à quatre semaines si besoin. Il est désormais possible, après au moins deux perfusions, d’administrer le traitement par voie sous-cutanée à la dose de 108 mg toutes les deux semaines, à domicile.
Le védolizumab a obtenu une AMM et le remboursement en France comme biothérapie de première ligne après échec ou intolérance des traitements conventionnels (5-ASA, corticoïdes, thiopurines), au même titre que les anti-TNF, grâce à un essai « face/face » contre l’adalimumab.9 Cependant, il n’est pas recommandé en pratique dans les formes les plus sévères de RCH, où l’infliximab reste le traitement de choix en première ligne.
Le traitement d’induction est toujours effectué par voie intraveineuse en milieu hospitalier avec une perfusion de 300 mg réalisée aux semaines 0, 2 et 6. Par la suite, les perfusions sont généralement réalisées toutes les huit semaines mais peuvent être rapprochées jusqu’à quatre semaines si besoin. Il est désormais possible, après au moins deux perfusions, d’administrer le traitement par voie sous-cutanée à la dose de 108 mg toutes les deux semaines, à domicile.
Anti-interleukines 12 et 23 et anti-IL-23 en deuxième ligne
L’ustékinumab, anticorps monoclonal ciblant les interleukines 12 et 23, a un effet systémique démontré dans plusieurs maladies inflammatoires, avec une AMM obtenue pour le psoriasis, le rhumatisme psoriasique, la maladie de Crohn et, plus récemment, la RCH.
Il est autorisé et remboursé en deuxième ligne de biothérapie après échec ou contre-indication à un anti-TNF ou au védolizumab.10
Il est utilisé avec une première perfusion d’induction, en milieu hospitalier, dont la dose dépend du poids, puis en injection sous-cutanée de 90 mg à domicile avec une fréquence variant entre huit et douze semaines. Il est possible d’optimiser le traitement jusqu’à une injection toutes les quatre semaines si besoin.
L’allergie au latex contre-indique l’utilisation des seringues sous-cutanées.
De nouveaux anticorps monoclonaux ciblant spécifiquement l’interleukine 23 seront prochainement disponibles (mirikizumab, guselkumab, risankizumab).
Il est autorisé et remboursé en deuxième ligne de biothérapie après échec ou contre-indication à un anti-TNF ou au védolizumab.10
Il est utilisé avec une première perfusion d’induction, en milieu hospitalier, dont la dose dépend du poids, puis en injection sous-cutanée de 90 mg à domicile avec une fréquence variant entre huit et douze semaines. Il est possible d’optimiser le traitement jusqu’à une injection toutes les quatre semaines si besoin.
L’allergie au latex contre-indique l’utilisation des seringues sous-cutanées.
De nouveaux anticorps monoclonaux ciblant spécifiquement l’interleukine 23 seront prochainement disponibles (mirikizumab, guselkumab, risankizumab).
Inhibiteurs des JAK, de petites molécules immunorégulatrices
Il existe deux types de nouvelles molécules disponibles dans la RCH qui, même si elles n’appartiennent pas à la classe des biothérapies, ont un positionnement similaire dans l’arsenal thérapeutique.
Il s’agit principalement des inhibiteurs des JAK : le tofacitinib11 et le filgotinib12 sont actuellement disponibles et remboursés, et l’upadacitinib devrait l’être prochainement.13 Ces traitements oraux puissants, d’action rapide mais dont le profil de tolérance est plus défavorable que celui des biothérapies, sont donc utilisés après échec ou intolérance d’un anti-TNF et du védolizumab. Cette restriction ne figure pas encore dans l’AMM du tofacitinib, mais ceci pourrait évoluer. Par ailleurs, pour l’instant, dans l’attente de la validation de données rassurantes du filgotinib sur la spermatogenèse, ce traitement reste réservé spécifiquement aux femmes. Les inhibiteurs des JAK ont été associés à des sur-risques de cancers, principalement cutanés, de zona et d’infections ainsi qu’à des thromboses veineuses profondes. Ces effets indésirables sévères sont surtout observés chez les sujets âgés. Cette classe thérapeutique fait l’objet de préconisations d’usage par l’Agence européenne du médicament (EMA), qui les déconseille après 65 ans et chez les patients ayant un risque élevé de thrombose veineuse profonde et d’accident cardiovasculaire.
Une autre petite molécule orale, l’ozanimod, inhibiteur de la sphingosine 1-phosphate, qui bloque la mobilisation des cellules immunes depuis les structures ganglionnaires vers l’intestin, a reçu une AMM européenne dans la RCH14 mais n’a pas obtenu le remboursement en France.
Il s’agit principalement des inhibiteurs des JAK : le tofacitinib11 et le filgotinib12 sont actuellement disponibles et remboursés, et l’upadacitinib devrait l’être prochainement.13 Ces traitements oraux puissants, d’action rapide mais dont le profil de tolérance est plus défavorable que celui des biothérapies, sont donc utilisés après échec ou intolérance d’un anti-TNF et du védolizumab. Cette restriction ne figure pas encore dans l’AMM du tofacitinib, mais ceci pourrait évoluer. Par ailleurs, pour l’instant, dans l’attente de la validation de données rassurantes du filgotinib sur la spermatogenèse, ce traitement reste réservé spécifiquement aux femmes. Les inhibiteurs des JAK ont été associés à des sur-risques de cancers, principalement cutanés, de zona et d’infections ainsi qu’à des thromboses veineuses profondes. Ces effets indésirables sévères sont surtout observés chez les sujets âgés. Cette classe thérapeutique fait l’objet de préconisations d’usage par l’Agence européenne du médicament (EMA), qui les déconseille après 65 ans et chez les patients ayant un risque élevé de thrombose veineuse profonde et d’accident cardiovasculaire.
Une autre petite molécule orale, l’ozanimod, inhibiteur de la sphingosine 1-phosphate, qui bloque la mobilisation des cellules immunes depuis les structures ganglionnaires vers l’intestin, a reçu une AMM européenne dans la RCH14 mais n’a pas obtenu le remboursement en France.
Les contre-indications des biothérapies imposent un bilan préthérapeutique
De manière générale, un antécédent personnel de cancer avec une guérison datant de moins de cinq ans est une contre-indication à l’usage d’une biothérapie ou d’une petite molécule. Cependant, en fonction du type de cancer, du risque de récidive, et de l’activité de la maladie inflammatoire, le recours à une biothérapie peut être discuté au cas par cas dans le cadre d’une réunion de concertation pluridisciplinaire (RCP) spécialisée.
Une infection chronique latente bactérienne ou virale est également une contre-indication. Néanmoins, une infection par le virus de l’immunodéficience humaine (VIH) traitée et contrôlée ne contre-indique pas l’introduction d’une biothérapie. De même, le portage chronique de l’antigène HBs ne contre-indique pas l’introduction d’une biothérapie mais impose un traitement préemptif de l’hépatite B. Une tuberculose latente doit impérativement être recherchée par une intradermoréaction à la tuberculine ou un test QuantiFERON ou T-SPOT.TB, ainsi que par une radiographie pulmonaire. En cas de tuberculose latente, un traitement préalable de trois semaines doit être mis en œuvre avant l’introduction d’une biothérapie puis poursuivi pendant trois mois.
Concernant les anti-TNF, un antécédent personnel de sclérose en plaques, une suspicion de maladie démyélinisante ou une insuffisance cardiaque de grade IV contre-indique le traitement.
Le bilan préthérapeutique avant biothérapie est rappelé dans letableau 1 .
De plus, il est souvent sage, lors du diagnostic de RCH, de mettre à jour les vaccinations et d’effectuer celle contre le pneumocoque.
Il n’existe pas d’interactions médicamenteuses connues avec les biothérapies.
Des fiches sur les différents médicaments, également à destination des patients, sont disponibles sur le site du Groupe d’étude thérapeutique des affections inflammatoires du tube digestif (GETAID : https://www.getaid.org).
Une infection chronique latente bactérienne ou virale est également une contre-indication. Néanmoins, une infection par le virus de l’immunodéficience humaine (VIH) traitée et contrôlée ne contre-indique pas l’introduction d’une biothérapie. De même, le portage chronique de l’antigène HBs ne contre-indique pas l’introduction d’une biothérapie mais impose un traitement préemptif de l’hépatite B. Une tuberculose latente doit impérativement être recherchée par une intradermoréaction à la tuberculine ou un test QuantiFERON ou T-SPOT.TB, ainsi que par une radiographie pulmonaire. En cas de tuberculose latente, un traitement préalable de trois semaines doit être mis en œuvre avant l’introduction d’une biothérapie puis poursuivi pendant trois mois.
Concernant les anti-TNF, un antécédent personnel de sclérose en plaques, une suspicion de maladie démyélinisante ou une insuffisance cardiaque de grade IV contre-indique le traitement.
Le bilan préthérapeutique avant biothérapie est rappelé dans le
De plus, il est souvent sage, lors du diagnostic de RCH, de mettre à jour les vaccinations et d’effectuer celle contre le pneumocoque.
Il n’existe pas d’interactions médicamenteuses connues avec les biothérapies.
Des fiches sur les différents médicaments, également à destination des patients, sont disponibles sur le site du Groupe d’étude thérapeutique des affections inflammatoires du tube digestif (GETAID : https://www.getaid.org).
Suivi de l’efficacité par les gastroentérologues
Le suivi de l’efficacité du traitement revient aux gastroentérologues, qui veillent à vérifier que le traitement atteint les objectifs thérapeutiques définis avec le patient (voir STRIDE-II). Le recours aux dosages de calprotectine fécale (non remboursé) est utile pour vérifier l’efficacité du traitement au-delà des symptômes.
Surveillance de la tolérance
Parmi les biothérapies disponibles dans la RCH, la classe des anti-TNF est celle qui comporte le plus de risque d’événements indésirables, même si la tolérance reste excellente au regard de l’efficacité.
Les effets indésirables cutanés, qui peuvent intéresser jusqu’à 30 % des patients après dix ans de traitement, comprennent la sécheresse cutanée, l’eczéma et le psoriasis paradoxal, dont les formes palmoplantaires et/ou du cuir chevelu conduisent généralement à l’arrêt du traitement.15
Le risque d’infection opportuniste est faible, principalement observé après 65 ans et chez les malades porteurs de comorbidités. Les pneumopathies sont les infections sévères les plus fréquentes, raison pour laquelle la vaccination contre le pneumocoque est nécessaire avant l’introduction d’une biothérapie.
Très rarement, des vascularites, des lupus induits, des manifestations démyélinisantes, des neuropathies périphériques peuvent être observés sous anti-TNF.
La tolérance du védolizumab et des anti-interleukines 12 et 23 est excellente, y compris chez les sujets âgés. Des céphalées peuvent être observées de façon commune à toutes les biothérapies chez une faible proportion de patients. Il est recommandé, en cas de syndrome infectieux avec fièvre, de suspendre toute biothérapie jusqu’à résolution de l’infection. Un dépistage annuel de la dysplasie du col utérin et des cancers cutanés est conseillé sous biothérapie.
Les effets indésirables cutanés, qui peuvent intéresser jusqu’à 30 % des patients après dix ans de traitement, comprennent la sécheresse cutanée, l’eczéma et le psoriasis paradoxal, dont les formes palmoplantaires et/ou du cuir chevelu conduisent généralement à l’arrêt du traitement.15
Le risque d’infection opportuniste est faible, principalement observé après 65 ans et chez les malades porteurs de comorbidités. Les pneumopathies sont les infections sévères les plus fréquentes, raison pour laquelle la vaccination contre le pneumocoque est nécessaire avant l’introduction d’une biothérapie.
Très rarement, des vascularites, des lupus induits, des manifestations démyélinisantes, des neuropathies périphériques peuvent être observés sous anti-TNF.
La tolérance du védolizumab et des anti-interleukines 12 et 23 est excellente, y compris chez les sujets âgés. Des céphalées peuvent être observées de façon commune à toutes les biothérapies chez une faible proportion de patients. Il est recommandé, en cas de syndrome infectieux avec fièvre, de suspendre toute biothérapie jusqu’à résolution de l’infection. Un dépistage annuel de la dysplasie du col utérin et des cancers cutanés est conseillé sous biothérapie.
Formation des patients
Dans l’immense majorité des cas, les biothérapies sont administrées à domicile par les patients eux-mêmes. Il est donc important de leur fournir une formation à l’usage de leur traitement grâce à des séances d’éducation thérapeutique et de mettre en place un suivi leur permettant de pouvoir répondre rapidement à leurs questions (« J’ai une rhinite, puis-je faire mon injection ? », etc.). Le rôle des infirmières de coordination, et de pratique avancée, ayant des connaissances concernant les biothérapies et les maladies inflammatoires chroniques de l’intestin, est majeur comme relais dans la prise en charge coordonnée des patients en collaboration avec les gastroentérologues et les médecins traitants.
Données rassurantes pendant la grossesse
Concernant la grossesse, aucune des biothérapies disponibles dans la RCH n’a été associée à des risques pour le fœtus ou pour la mère. Le recul très important disponible pour la classe des anti-TNF permet actuellement d’autoriser cette famille de médicaments durant la grossesse sans sur-risque démontré.16 Le recul encore insuffisant concernant le védolizumab et la classe des anti-interleukines 12 et 23 les soumet encore à une réserve de principe quant à leur utilisation pendant la grossesse, même si les données disponibles sont tout à fait rassurantes.
Critères de choix des traitements
En première ligne de biothérapie, le choix se fait entre les anti-TNF et le védolizumab.
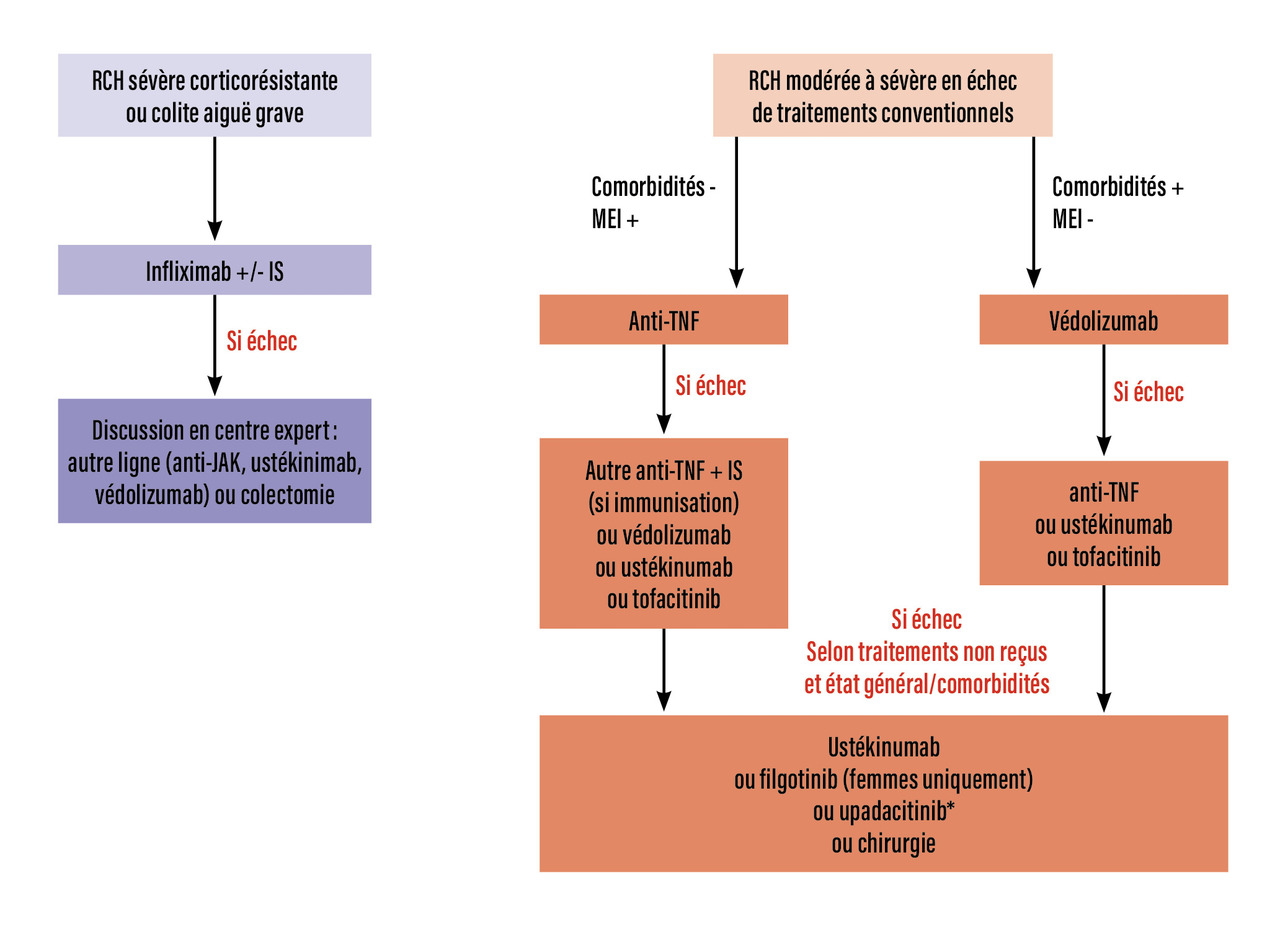
En cas de RCH compliquée d’une colite aiguë grave ou d’une forme sévère ne répondant pas à une corticothérapie systémique, l’infliximab reste le traitement de référence.
Pour des formes modérées à sévères de RCH, le choix du traitement prend en compte les critères de tolérance, de comorbidité et la présence ou non de manifestations extradigestives de la maladie.
Entre 20 et 30 % des patients sont non répondeurs primaires à une biothérapie, et il n’existe pour l’instant aucun biomarqueur prédisant l’efficacité d’une classe thérapeutique par rapport à une autre à l’échelle individuelle.
Après échec d’une première ligne de biothérapie par anti-TNF ou par védolizumab, le choix du traitement de deuxième ligne est complexe et relève d’un avis spécialisé qui prend en compte de multiples facteurs (sévérité de la maladie, âge et comorbidités, présence de manifestations extra-intestinales…). Les éléments décisionnels sont détaillés dans letableau 2 .
En cas de RCH compliquée d’une colite aiguë grave ou d’une forme sévère ne répondant pas à une corticothérapie systémique, l’infliximab reste le traitement de référence.
Pour des formes modérées à sévères de RCH, le choix du traitement prend en compte les critères de tolérance, de comorbidité et la présence ou non de manifestations extradigestives de la maladie.
Entre 20 et 30 % des patients sont non répondeurs primaires à une biothérapie, et il n’existe pour l’instant aucun biomarqueur prédisant l’efficacité d’une classe thérapeutique par rapport à une autre à l’échelle individuelle.
Après échec d’une première ligne de biothérapie par anti-TNF ou par védolizumab, le choix du traitement de deuxième ligne est complexe et relève d’un avis spécialisé qui prend en compte de multiples facteurs (sévérité de la maladie, âge et comorbidités, présence de manifestations extra-intestinales…). Les éléments décisionnels sont détaillés dans le
Durée du traitement prolongée
Il n’existe pas de durée recommandée de traitement par biothérapie lorsqu’elle est efficace et permet d’obtenir une rémission clinique et une cicatrisation muqueuse. La plupart des études disponibles testant des stratégies de désescalade et d’interruption du traitement rapportent des taux de rechute de la maladie avoisinant 50 % à un an.17
Par ailleurs, il existe un taux de perte de réponse secondaire dans le temps plus marqué pour la classe des anti-TNF (entre 10 et 15 % par an), qui impose des changements de classe thérapeutique au cours de la vie des patients.
Par ailleurs, il existe un taux de perte de réponse secondaire dans le temps plus marqué pour la classe des anti-TNF (entre 10 et 15 % par an), qui impose des changements de classe thérapeutique au cours de la vie des patients.
Des traitements efficaces et bien tolérés nécessitant expertise et coordination
L’arsenal thérapeutique de la RCH s’est considérablement diversifié au cours des dernières années, au bénéfice des patients. Ainsi, chez les patients non répondeurs ou intolérants aux 5-ASA, et ceux dont la maladie est d’emblée sévère, de nombreuses options thérapeutiques sont désormais disponibles. Les biothérapies sont efficaces et ont un bon profil de tolérance, avec des spécificités. Cependant, le choix de ces traitements, l’adaptation de leur profil aux caractéristiques de chaque patient, les stratégies utilisant différentes séquences thérapeutiques sont devenues complexes et nécessitent donc une expertise spécifique. Une fois instaurés, ces traitements sont administrés le plus souvent à domicile, ce qui implique que tous les acteurs de la prise en charge des patients souffrant de RCH aient une bonne connaissance de ces médicaments et de leur surveillance.
Références
1. Gower-Rousseau C, Leroyer A, Génin M, Savoye G, Sarter H, Pariente B, et al. Bull Epidemiol Hebd 2019;13:228-36.
2. Viscido A, Valvano M, Stefanelli G, Capannolo A, Castellini C, Onori E, et al. Systematic review and meta-analysis: The advantage of endoscopic Mayo score 0 over 1 in patients with ulcerative colitis. BMC Gastroenterol 2022;22(1):92.
3. Turner D, Ricciuto A, Lewis A. STRIDE-II: an update on the Selecting therapeutic targets in inflammatory bowel disease (STRIDE) initiative of the International Organization for the Study of IBD (IOIBD): Determining therapeutic goals for treat-to-target strategies in IBD. Gastroenterology 2021;160(5):1570-83.
4. Lasa JS, Olivera PA, Danese S, Peyrin-Biroulet L. Efficacy and safety of biologics and small molecule drugs for patients with moderate-to-severe ulcerative colitis: A systematic review and network meta-analysis. Lancet Gastroenterol Hepatol 2022;7(2):161-70.
5. Schreiber S, Ben-Horin S, Leszczyszyn J, Dudkowiak R, Lahat A, Gawdis-Wojnarska B, et al. Randomized controlled trial: Subcutaneous vs intravenous infliximab CT-P13 maintenance in inflammatory bowel disease. Gastroenterology 2021;160(7):2340-53.
6. J Sandborn WJ, van Assche G, Reinisch W, Colombel JF, D’Haens G, Wolf DC, et al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012;142(2):257-65.
7. Sandborn WJ, Feagan BG, Marano C, Zhang H, Strauss R, Johanns J, et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014;146(1):85-95.
8. Feagan BG, Rutgeerts P, Sands BA, Hanauer S, Colombel JF, Sandborn WJ, et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013;369(8):699-710.
9. Sands BE, Peyrin-Biroulet L, Loftus EV Jr, Danese S, Colombel JF, Törüner M, et al. Vedolizumab versus adalimumab for moderate-to-severe ulcerative colitis. N Engl J Med 2019;381(13):1215-26.
10. Sands BE, Sandborn WJ, Panaccione R, O’Brien CD, Zhang H, Johanns J, et al. Ustekinumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2019;381(13):1201-14.
11. Sandborn WJ, Su C, Sands BE, D’Haens GR, Vermeire S, Schreiber S, et al. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017;376(18):1723-36.
12. Feagan BG, Danese S, Loftus EV Jr, Vermeire S, Schreiber S, Ritter T, et al. Filgotinib as induction and maintenance therapy for ulcerative colitis (SELECTION): A phase 2b/3 double-blind, randomised, placebo-controlled trial. Lancet 2021;397(10292):2372-84.
13. Danese S, Vermeire S, Zhou W, Pangan A, Siffledeen J, Greenbloom, et al. Upadacitinib as induction and maintenance therapy for moderately to severely active ulcerative colitis: Results from three phase 3, multicentre, double-blind, randomised trials. Lancet 2022;399(10341):2113-21.
14. Sandborn WJ, Feagan BG, D’Haens G, Wolf DC, Jovanovic I, Hanauer SB, et al. Ozanimod as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2021;385(14):1280-91.
15. Fréling E, Baumann C, Cuny JF, Bigeard MA, Schmutz JL, Barbaud A, et al. Cumulative incidence of, risk factors for, and outcome of dermatological complications of anti-TNF therapy in inflammatory bowel disease: A 14-year experience. Am J Gastroenterol 2015;110(8):1186-96.
16. Meyer A, Drouin J, Weill A, Carbonnel F, Dray-Spira R. Comparative study of pregnancy outcomes in women with inflammatory bowel disease treated with thiopurines and/or anti-TNF: A French nationwide study 2010-2018. Aliment Pharmacol Ther 2021;54(3):302-11.
17. Casanova MJ, Chaparro M, García-Sánchez V, Nantes O, Leo E, Rojas-Feria M, et al. Evolution after anti-TNF discontinuation in patients with inflammatory bowel disease: A multicenter long-term follow-up study. Am J Gastroenterol 2017;112(1):120-31.
2. Viscido A, Valvano M, Stefanelli G, Capannolo A, Castellini C, Onori E, et al. Systematic review and meta-analysis: The advantage of endoscopic Mayo score 0 over 1 in patients with ulcerative colitis. BMC Gastroenterol 2022;22(1):92.
3. Turner D, Ricciuto A, Lewis A. STRIDE-II: an update on the Selecting therapeutic targets in inflammatory bowel disease (STRIDE) initiative of the International Organization for the Study of IBD (IOIBD): Determining therapeutic goals for treat-to-target strategies in IBD. Gastroenterology 2021;160(5):1570-83.
4. Lasa JS, Olivera PA, Danese S, Peyrin-Biroulet L. Efficacy and safety of biologics and small molecule drugs for patients with moderate-to-severe ulcerative colitis: A systematic review and network meta-analysis. Lancet Gastroenterol Hepatol 2022;7(2):161-70.
5. Schreiber S, Ben-Horin S, Leszczyszyn J, Dudkowiak R, Lahat A, Gawdis-Wojnarska B, et al. Randomized controlled trial: Subcutaneous vs intravenous infliximab CT-P13 maintenance in inflammatory bowel disease. Gastroenterology 2021;160(7):2340-53.
6. J Sandborn WJ, van Assche G, Reinisch W, Colombel JF, D’Haens G, Wolf DC, et al. Adalimumab induces and maintains clinical remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2012;142(2):257-65.
7. Sandborn WJ, Feagan BG, Marano C, Zhang H, Strauss R, Johanns J, et al. Subcutaneous golimumab induces clinical response and remission in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014;146(1):85-95.
8. Feagan BG, Rutgeerts P, Sands BA, Hanauer S, Colombel JF, Sandborn WJ, et al. Vedolizumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2013;369(8):699-710.
9. Sands BE, Peyrin-Biroulet L, Loftus EV Jr, Danese S, Colombel JF, Törüner M, et al. Vedolizumab versus adalimumab for moderate-to-severe ulcerative colitis. N Engl J Med 2019;381(13):1215-26.
10. Sands BE, Sandborn WJ, Panaccione R, O’Brien CD, Zhang H, Johanns J, et al. Ustekinumab as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2019;381(13):1201-14.
11. Sandborn WJ, Su C, Sands BE, D’Haens GR, Vermeire S, Schreiber S, et al. Tofacitinib as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2017;376(18):1723-36.
12. Feagan BG, Danese S, Loftus EV Jr, Vermeire S, Schreiber S, Ritter T, et al. Filgotinib as induction and maintenance therapy for ulcerative colitis (SELECTION): A phase 2b/3 double-blind, randomised, placebo-controlled trial. Lancet 2021;397(10292):2372-84.
13. Danese S, Vermeire S, Zhou W, Pangan A, Siffledeen J, Greenbloom, et al. Upadacitinib as induction and maintenance therapy for moderately to severely active ulcerative colitis: Results from three phase 3, multicentre, double-blind, randomised trials. Lancet 2022;399(10341):2113-21.
14. Sandborn WJ, Feagan BG, D’Haens G, Wolf DC, Jovanovic I, Hanauer SB, et al. Ozanimod as induction and maintenance therapy for ulcerative colitis. N Engl J Med 2021;385(14):1280-91.
15. Fréling E, Baumann C, Cuny JF, Bigeard MA, Schmutz JL, Barbaud A, et al. Cumulative incidence of, risk factors for, and outcome of dermatological complications of anti-TNF therapy in inflammatory bowel disease: A 14-year experience. Am J Gastroenterol 2015;110(8):1186-96.
16. Meyer A, Drouin J, Weill A, Carbonnel F, Dray-Spira R. Comparative study of pregnancy outcomes in women with inflammatory bowel disease treated with thiopurines and/or anti-TNF: A French nationwide study 2010-2018. Aliment Pharmacol Ther 2021;54(3):302-11.
17. Casanova MJ, Chaparro M, García-Sánchez V, Nantes O, Leo E, Rojas-Feria M, et al. Evolution after anti-TNF discontinuation in patients with inflammatory bowel disease: A multicenter long-term follow-up study. Am J Gastroenterol 2017;112(1):120-31.
Dans cet article
- Une maladie très invalidante
- Évolution des objectifs thérapeutiques
- Démarche thérapeutique
- Trois classes de biothérapies
- Inhibiteurs des JAK, de petites molécules immunorégulatrices
- Les contre-indications des biothérapies imposent un bilan préthérapeutique
- Suivi de l’efficacité par les gastroentérologues
- Surveillance de la tolérance
- Critères de choix des traitements
- Durée du traitement prolongée
- Des traitements efficaces et bien tolérés nécessitant expertise et coordination