Depuis plus de 20 ans, les biothérapies ont une place en pratique quotidienne en rhumatologie. Les principales cytokines concernées sont le TNF alpha, les interleukines 6 (IL-6), IL-1, IL-17, ou encore IL-12/23. D’autres molécules, comme l’anti-CTLA-4,inhibent les signaux de costimulation indispensables pour l’activation des lymphocytes T. Enfin, celles visant le CD20 – marqueur de surface des lymphocytes B – induisent leur apoptose.
Trois formes pharmacologiques :
– les anticorps monoclonaux : désignés par le suffixe « -mab » (« -ximab » si chimériques ; « -mumab » si humains ; « -zumab » si humanisés) ;
– les récepteurs des cytokines couplés au composant Fc d’immunoglobulines IgG humaines (suffixe « -cept ») ;
– les antagonistes recombinants (ils se fixent aux récepteurs mais ne délivrent pas de signal, comme anakinra, Kineret, anti-IL-1R).
Ces biothérapies sont prescrites dans la plupart des rhumatismes inflammatoires chroniques – polyarthrite rhumatoïde (PR) , spondyloarthrite, rhumatisme psoriasique, connectivites, maladie de Still – souvent en association aux « Disease Modifying Anti-Rheumatic Drugs » (DMARDs), traitements de fond conventionnels, en particulier le méthotrexate. Dans la PR et le rhumatisme psoriasique, elles sont indiquées en cas d’échec d’un DMARD. Dans la SPA, en 2e ligne après traitement par AINS.
Trois formes pharmacologiques :
– les anticorps monoclonaux : désignés par le suffixe « -mab » (« -ximab » si chimériques ; « -mumab » si humains ; « -zumab » si humanisés) ;
– les récepteurs des cytokines couplés au composant Fc d’immunoglobulines IgG humaines (suffixe « -cept ») ;
– les antagonistes recombinants (ils se fixent aux récepteurs mais ne délivrent pas de signal, comme anakinra, Kineret, anti-IL-1R).
Ces biothérapies sont prescrites dans la plupart des rhumatismes inflammatoires chroniques – polyarthrite rhumatoïde (PR) , spondyloarthrite, rhumatisme psoriasique, connectivites, maladie de Still – souvent en association aux « Disease Modifying Anti-Rheumatic Drugs » (DMARDs), traitements de fond conventionnels, en particulier le méthotrexate. Dans la PR et le rhumatisme psoriasique, elles sont indiquées en cas d’échec d’un DMARD. Dans la SPA, en 2e ligne après traitement par AINS.
Anti-TNF alpha
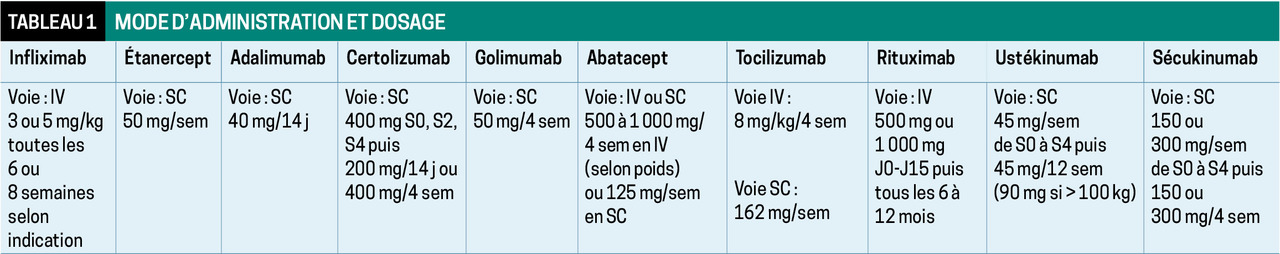
Cinq molécules sont commercialisées : infliximab (Remicade et biosimilaires : Inflectra, Flixabi, Remsima…), adalimumab (Humira et Hulio, Imraldi, Amgevita, Hyrimoz), étanercept (Enbrel, Benepali, Erelzi), certolizumab pégol (Cimzia) et golimumab (Simponi). Elles sont toutes administrées par voie SC, à l’exception de l’infliximab (voie IV, tableau 1 ). Pas de supériorité d’une molécule par rapport à une autre.
Ces médicaments exposent à un risque infectieux. Si l’incidence des événements semble faiblement augmentée, le risque d’épisodes sévères est accru (odds ratio : 1,1 à 1,8).1 Des récurrences de tuberculose maladie et de zona sont possibles. Ainsi, avant de débuter le traitement, il est recommandé de faire une IDR ou un test Quantiféron et de prescrire un traitement antituberculeux prophylactique en cas de positivité.
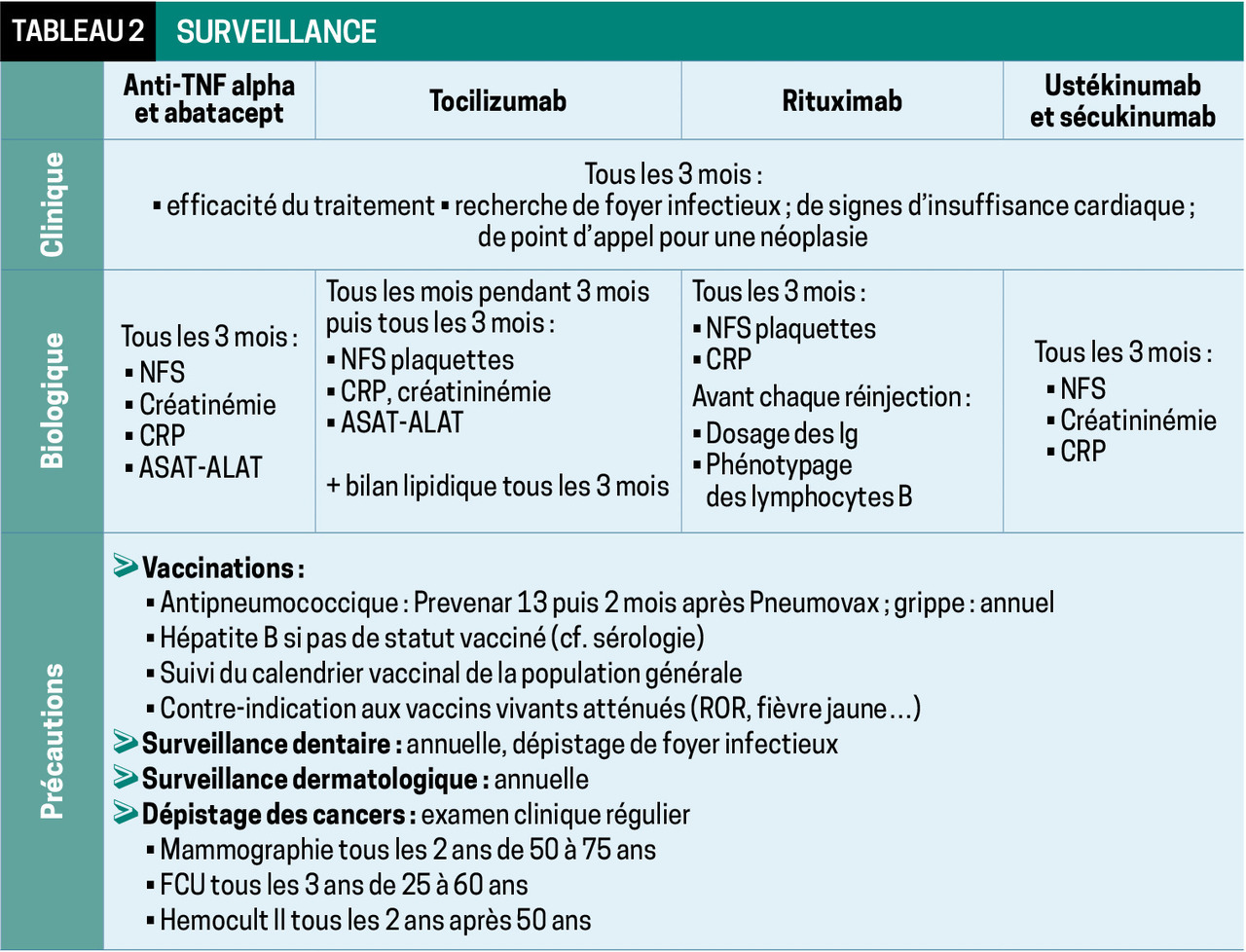
La surveillance clinique et biologique est cruciale (tableau 2 ). Toute fièvre doit faire rechercher une infection, et impose une antibiothérapie adaptée si besoin.
La prévention repose également sur la mise à jour des vaccinations. Selon le CRI (Club rhumatismes et inflammations) :2 suivi du calendrier vaccinal en vigueur, vaccin antigrippal et antipneumococcique (Prevenar 13, puis Pneumovax 2 mois après). Les vaccins vivants atténués (notamment fièvre jaune) sont contre-indiqués sous biothérapie. Par ailleurs, il est important de dépister et prendre en charge toutes les portes d’entrée (dentaires, cutanées…).
Il est maintenant bien démontré que les anti-TNF alpha n’augmentent pas le risque de cancer solide ou d’hémopathies.1 Il persiste encore un doute concernant les tumeurs cutanées non mélanodermiques (baso- et spinocellulaires), à surveiller (consultation dermatologique 1 fois par an). Il faut respecter les recommandations générales de dépistage (tableau 2 ).
Ces médicaments exposent à un risque infectieux. Si l’incidence des événements semble faiblement augmentée, le risque d’épisodes sévères est accru (odds ratio : 1,1 à 1,8).1 Des récurrences de tuberculose maladie et de zona sont possibles. Ainsi, avant de débuter le traitement, il est recommandé de faire une IDR ou un test Quantiféron et de prescrire un traitement antituberculeux prophylactique en cas de positivité.
La surveillance clinique et biologique est cruciale (
La prévention repose également sur la mise à jour des vaccinations. Selon le CRI (Club rhumatismes et inflammations) :2 suivi du calendrier vaccinal en vigueur, vaccin antigrippal et antipneumococcique (Prevenar 13, puis Pneumovax 2 mois après). Les vaccins vivants atténués (notamment fièvre jaune) sont contre-indiqués sous biothérapie. Par ailleurs, il est important de dépister et prendre en charge toutes les portes d’entrée (dentaires, cutanées…).
Il est maintenant bien démontré que les anti-TNF alpha n’augmentent pas le risque de cancer solide ou d’hémopathies.1 Il persiste encore un doute concernant les tumeurs cutanées non mélanodermiques (baso- et spinocellulaires), à surveiller (consultation dermatologique 1 fois par an). Il faut respecter les recommandations générales de dépistage (
Inhibiteurs des interleukines
L’inhibiteur du récepteur de l’IL-6 (IL-6R), le tocilizumab (Roactemra), est administré par voie intraveineuse, ou sous-cutanée à la dose habituelle de 4 mg/kg ou 8 mg/kg toutes les 4 semaines. Les principales indications sont la PR et, depuis peu, la maladie de Horton. Les risques infectieux et néoplasiques et les précautions sont les mêmes que pour les anti-TNF, avec 3 spécificités :
– risque de dyslipidémie, et en particulier augmentation des taux de LDL- et HDL-cholestérol : à surveiller de manière régulière pour adapter le traitement selon la HAS ;
– risque de neutropénie : contrôler le taux de polynucléaires neutrophiles ;
– poussées de diverticulite et perforation digestive plus fréquentes chez les patients atteints de diverticulose.
Le sécukinumab (Cosentyx), anti- IL-17, a une AMM dans le rhumatisme psoriasique et la spondyloarthrite axiale. Les précautions vis-à-vis d’éventuelles infections sont identiques à celles des anti-TNF alpha. On note cependant un risque accru de candidose, imposant une surveillance clinique, et de neutropénie, le plus souvent modérée.
Pour l’ustékinumab (Stelara), anti- IL-12/23 (voie SC), indiqué dans le rhumatisme psoriasique, pas de surveillance biologique ou immunologique spécifique (tableau 2 ).
– risque de dyslipidémie, et en particulier augmentation des taux de LDL- et HDL-cholestérol : à surveiller de manière régulière pour adapter le traitement selon la HAS ;
– risque de neutropénie : contrôler le taux de polynucléaires neutrophiles ;
– poussées de diverticulite et perforation digestive plus fréquentes chez les patients atteints de diverticulose.
Le sécukinumab (Cosentyx), anti- IL-17, a une AMM dans le rhumatisme psoriasique et la spondyloarthrite axiale. Les précautions vis-à-vis d’éventuelles infections sont identiques à celles des anti-TNF alpha. On note cependant un risque accru de candidose, imposant une surveillance clinique, et de neutropénie, le plus souvent modérée.
Pour l’ustékinumab (Stelara), anti- IL-12/23 (voie SC), indiqué dans le rhumatisme psoriasique, pas de surveillance biologique ou immunologique spécifique (
Autres molécules
La principale indication de l’inhibiteur du CTLA-4 (abatacept, Orencia ; voie IV ou SC) chez l’adulte est la PR. Les précautions à suivre sont identiques à celles des anti-TNF alpha, mais le risque infectieux est probablement un peu inférieur.
L’inhibiteur du CD20 (rituximab, Mabthera, Rixathon, Truxima) est utilisé dans la PR et les vascularites à ANCA (granulomatose avec polyangéite et polyangéite microscopique). Il est administré par voie IV uniquement, avec un schéma de 1 injection tous les 6 mois, voire 1 an en fonction du contrôle de la maladie.
Globalement, le risque infectieux semble faible (pas de dépistage de tuberculose latente avant la mise en route). Il faut cependant porter une attention particulière aux réactivations du virus de l’hépatite B, parfois fatales. Un dépistage du VHB est donc systématique avant traitement. Des réactions cutanées sévères telles que le syndrome de Lyell (nécrolyse épidermique toxique) et celui de Stevens-Johnson ont été rapportées, mais elles sont rares. Elles imposent l’arrêt définitif.
Il semble également important de surveiller les taux d’immunoglobulines, notamment des classes IgG et IgM, car une forte diminution expose à un sur-risque infectieux. Attention : les mises à jour vaccinales ne doivent pas être faites sous traitement (faible réponse) mais avant son introduction (ou la nouvelle perfusion).
L’inhibiteur du CD20 (rituximab, Mabthera, Rixathon, Truxima) est utilisé dans la PR et les vascularites à ANCA (granulomatose avec polyangéite et polyangéite microscopique). Il est administré par voie IV uniquement, avec un schéma de 1 injection tous les 6 mois, voire 1 an en fonction du contrôle de la maladie.
Globalement, le risque infectieux semble faible (pas de dépistage de tuberculose latente avant la mise en route). Il faut cependant porter une attention particulière aux réactivations du virus de l’hépatite B, parfois fatales. Un dépistage du VHB est donc systématique avant traitement. Des réactions cutanées sévères telles que le syndrome de Lyell (nécrolyse épidermique toxique) et celui de Stevens-Johnson ont été rapportées, mais elles sont rares. Elles imposent l’arrêt définitif.
Il semble également important de surveiller les taux d’immunoglobulines, notamment des classes IgG et IgM, car une forte diminution expose à un sur-risque infectieux. Attention : les mises à jour vaccinales ne doivent pas être faites sous traitement (faible réponse) mais avant son introduction (ou la nouvelle perfusion).
Biosimilaires
Disponibles depuis environ 2 ans, ces médicaments sont équivalents en termes d’efficacité, de tolérance, de pharmacocinétique et d’immunogénicité aux thérapies biologiques de référence ayant une AMM et dont le brevet est tombé dans le domaine public. Leur coût est nettement inférieur (15 à 30 %). Exemples : Inflectra, Flixabi, Remsima, pour l’infliximab (princeps : Remicade), Benepali, Erelzi pour l’étanercept (princeps : Enbrel).
Selon les dernières recommandations EULAR, il n’y a pas de différence d’efficacité et de tolérance entre les biothérapies initiales et les biosimilaires, et les premières données issues des études de « vraie vie » sont rassurantes.
La pratique aujourd’hui est de préférer un biosimilaire en prescription initiale. En revanche, chez les patients déjà traités, les molécules princeps ne sont pas changées de manière systématique.
Selon les dernières recommandations EULAR, il n’y a pas de différence d’efficacité et de tolérance entre les biothérapies initiales et les biosimilaires, et les premières données issues des études de « vraie vie » sont rassurantes.
La pratique aujourd’hui est de préférer un biosimilaire en prescription initiale. En revanche, chez les patients déjà traités, les molécules princeps ne sont pas changées de manière systématique.
Références
1. Ramiro S, Sepriano A, Chatzidionysiou K, et al. Safety of synthetic and biological DMARDs: a systematic literature review informing the 2016 update of the EULAR recommendations for management of rheumatoid arthritis. Ann Rheum Dis 2017;76:1101-36.
2. CRI. Prise en charge pratique des patients sous sécukinumab. Fiche pratique. https://bit.ly/2MnSFvQ
2. CRI. Prise en charge pratique des patients sous sécukinumab. Fiche pratique. https://bit.ly/2MnSFvQ