Due à une bactérie spirochète du genre Borrelia burgdorferi sensu lato, elle est transmise par une tique dure Ixodes ricinus (
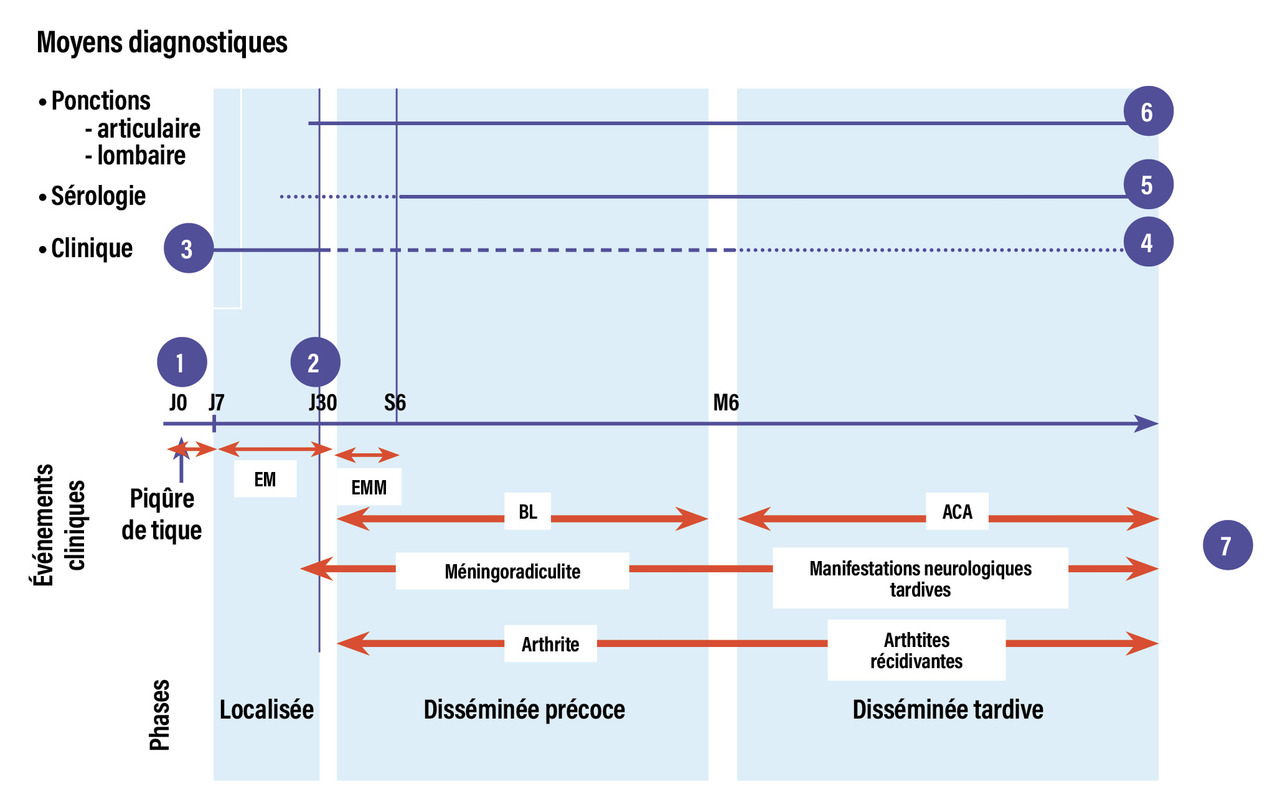
Il est essentiel d’en connaître les critères diagnostiques afin d’assurer une prise en charge efficace. Le diagnostic de BL repose sur un trépied, parfois incomplet : une exposition aux piqûres de tiques, une clinique compatible et une sérologie positive en deux temps, selon le stade de la maladie.
Son traitement consiste en une antibiothérapie par doxycycline ou ceftriaxone, pendant 14 à 28 jours, selon le stade et les atteintes cliniques. Si des symptômes aspécifiques peuvent persister plusieurs semaines après le traitement, les séquelles sont rares et l’évolution à moyen terme favorable.
Les principales difficultés sont diagnostiques. La présence fréquente de signes fonctionnels associés rend en effet le tableau clinique complexe et doit faire évoquer de nombreux diagnostics différentiels, ce d’autant que certains patients n’ont pas remarqué de piqûre de tique. L’absence de tests diagnostiques directs performants impose également une interprétation éclairée des résultats sérologiques. Cinq centres de référence des maladies vectorielles à tiques ont ainsi été créés en 2019 pour aider à la prise en charge des patients présentant des situations complexes dans le cadre d’une suspicion de BL.
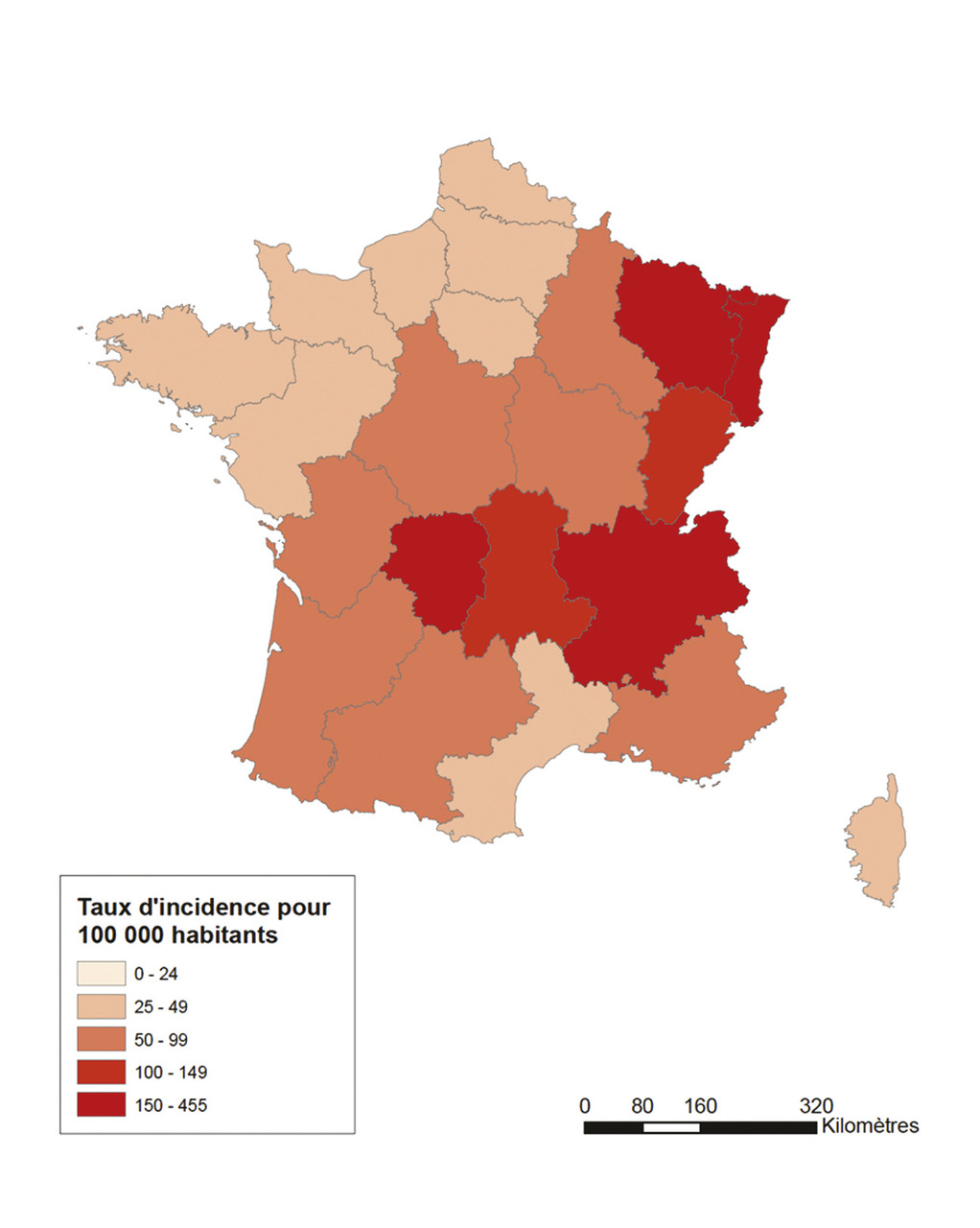
Augmentation du nombre de cas avec des disparités régionales
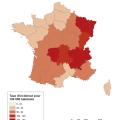
Son incidence oscille entre 41 et 104 cas pour 100 000 habitants en France, soit entre 25 000 et 68 530 cas par an. On constate une augmentation constante depuis 20113 probablement du fait d’une meilleure sensibilisation des médecins à son diagnostic et du réchauffement climatique augmentant la période annuelle d’exposition aux tiques. Il existe des disparités régionales avec des taux d’incidence plus élevés dans l’Est et le Centre du territoire métropolitain (
Le diagnostic repose en premier lieu sur la clinique
Certains tableaux cliniques sont clairement évocateurs
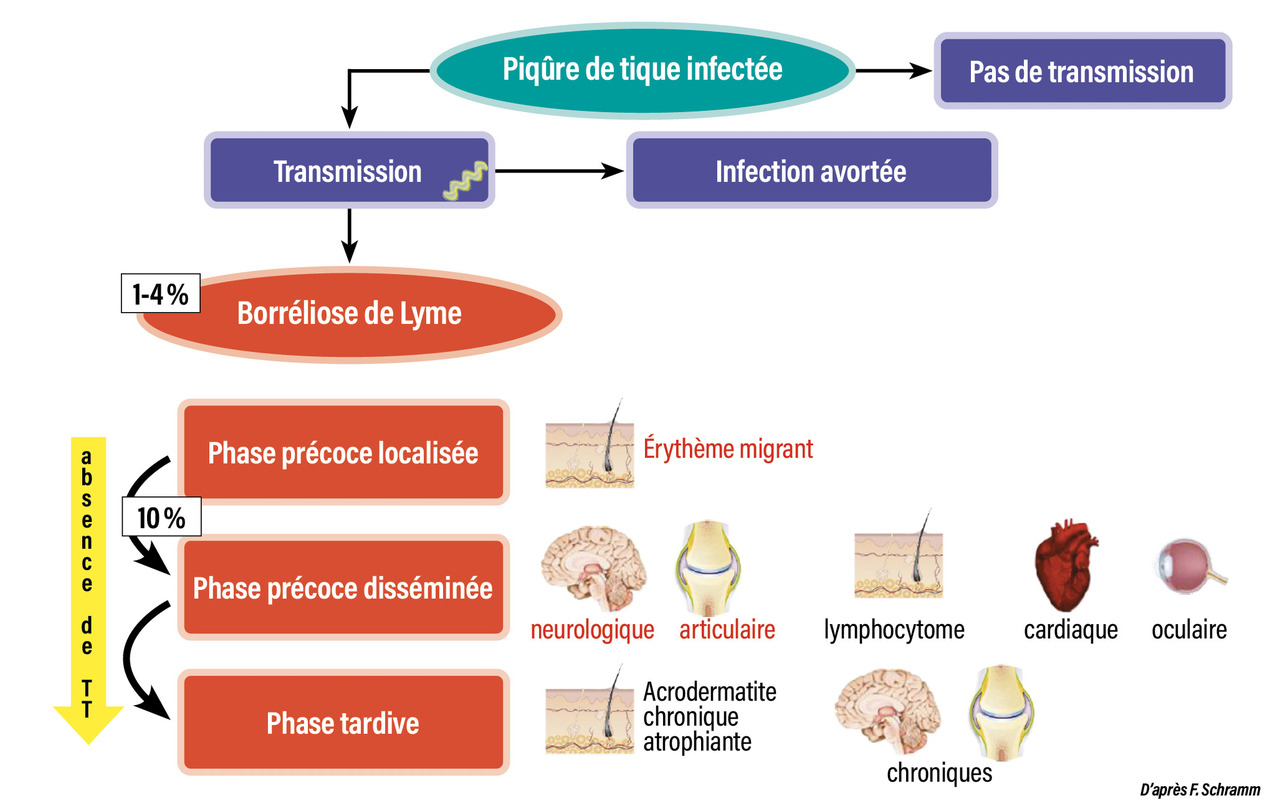
Évolution en trois phases
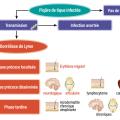
On distingue trois phases évolutives d’une BL :- la phase localisée précoce, ou érythème migrant (EM), dans les 30 jours suivant la piqûre de tique ;
- la phase disséminée précoce, dans les six premiers mois, avec comme signes principaux les arthrites, le lymphocytome cutané bénin et les méningo-radiculites dont la paralysie faciale ;
- puis la phase disséminée tardive au-delà de six mois, avec l’acrodermatite chronique atrophiante (ACA), les arthrites et l’encéphalomyélite chronique progressive (
Atteintes cutanées
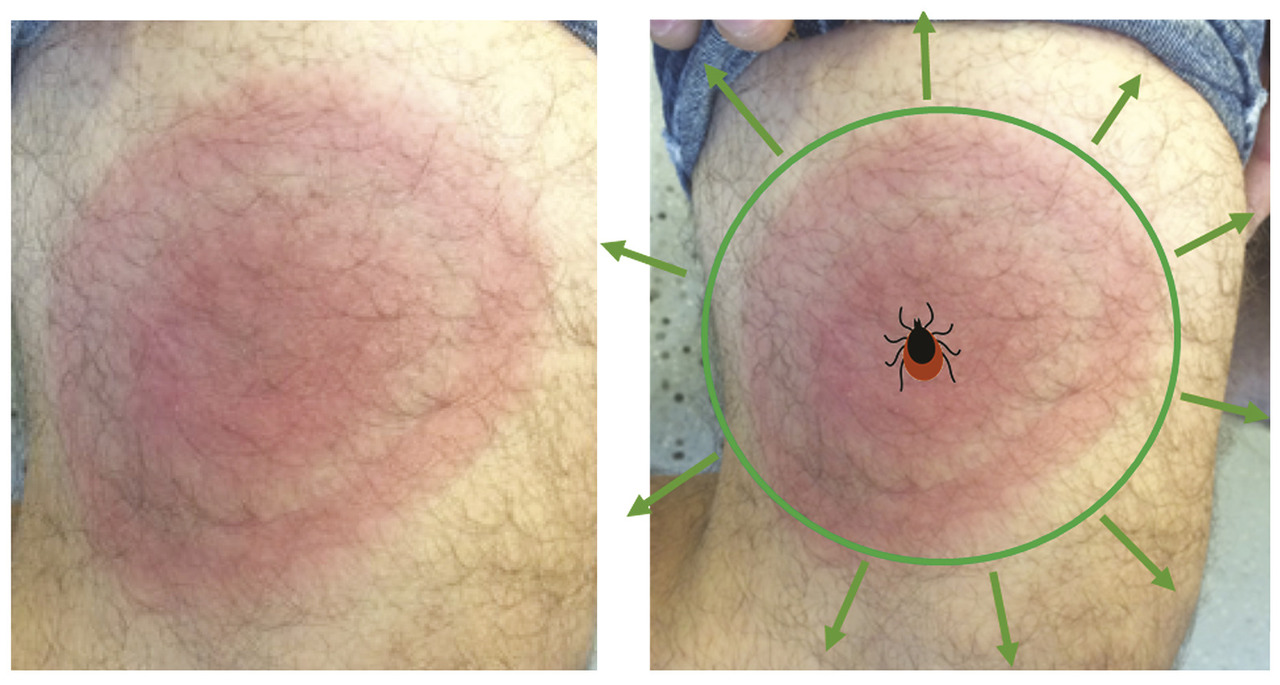
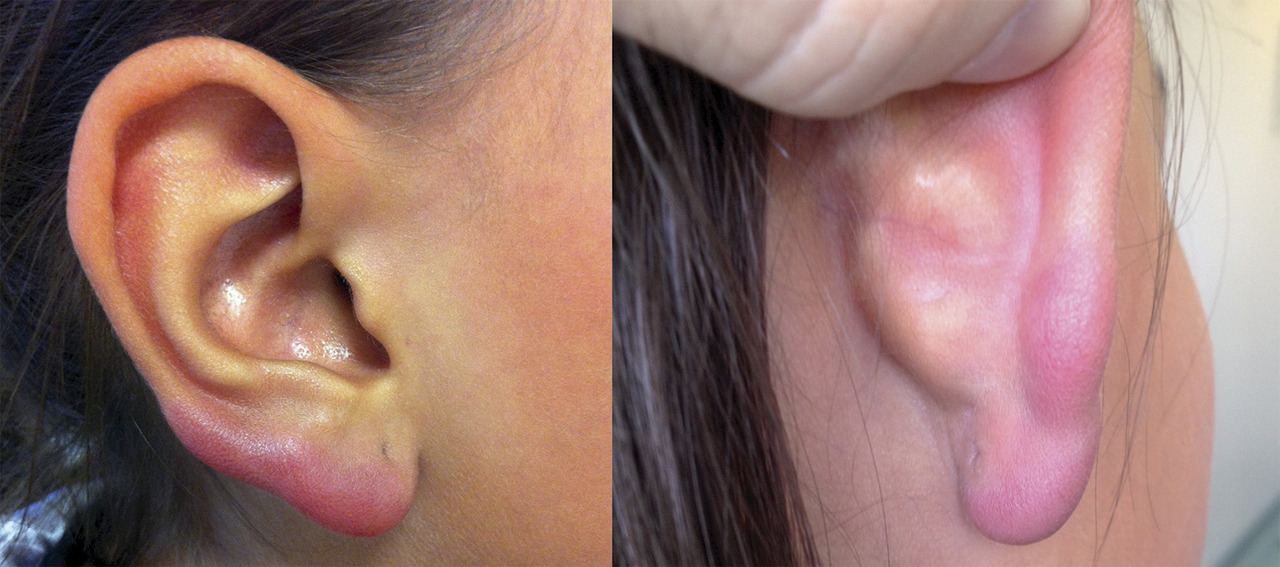
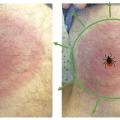
Erythème migrant inconstant
Un érythème apparaissant immédiatement après une piqûre de tique, sans intervalle libre de quelques jours, correspond à une inflammation locale post-piqûre et non à un EM, et ne nécessite donc pas d’antibiothérapie.
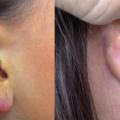
Lymphocytome cutané localisé
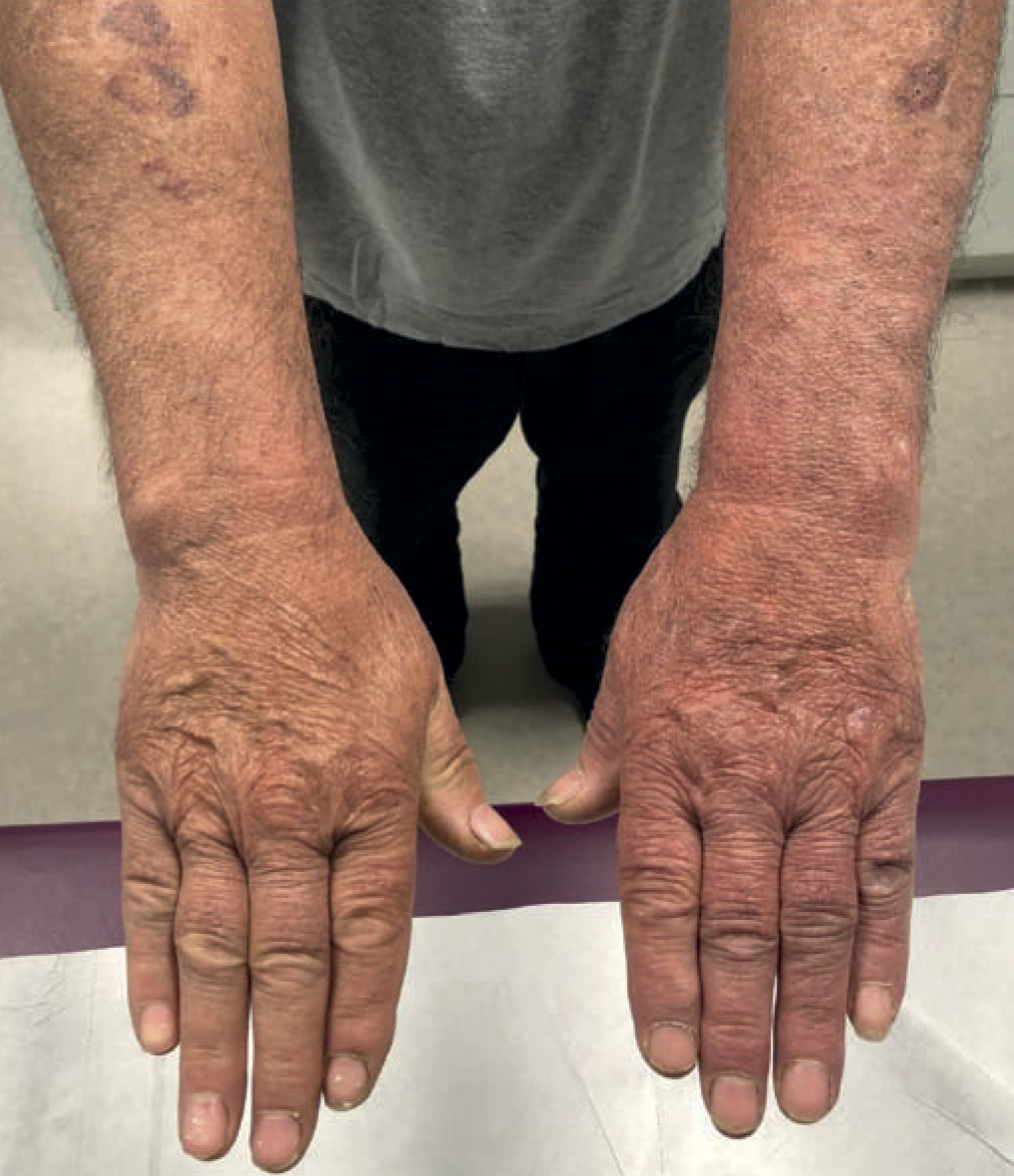
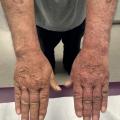
Acrodermatite chronique atrophiante d’apparition tardive
Elle évolue en deux phases :
- la phase œdémateuse, réversible, évoluant par poussées sur plusieurs mois, sous forme d’un érythème rouge à violacé, à la face d’extension des membres, souvent inférieurs (70 % des cas), et unilatéral (60 %) ;
- la phase atrophiante, irréversible, où la peau est amincie, en aspect de papier à cigarette, associée à des troubles sensitifs et des douleurs neuropathiques dans 20 % des cas.
Atteintes neurologiques
Les neuroborrélioses (NBL) sont fréquentes en Europe, et concernent la moitié des formes de patients hospitalisés en France.La méningoradiculite est la plus commune, dont la paralysie faciale. Elle survient environ quatre à six semaines après la piqûre (de 1 à 12 mois), dans le dermatome piqué, sous forme de radiculalgie avec douleurs neuropathiques insomniantes, non déficitaire et sans syndrome rachidien.
Chez l’enfant, la paralysie faciale est très classique, parfois bilatérale à bascule. Les autres paires crâniennes peuvent aussi être atteintes.6
Seulement 5 % des NBL sont tardives : il s’agit alors de l’encéphalomyélite chronique progressive regroupant des signes de myélite et d’encéphalite, et la polyneuropathie axonale sensitive, asymétrique, associée à l’ACA.
Le diagnostic de polyneuropathie doit faire réaliser un bilan exhaustif avant de conclure à une BL, surtout en cas de manifestations antérieures à la piqûre ou en l’absence d’ACA.
Atteintes articulaires
L’arthrite de Lyme est une monoarthrite souvent récidivante (90 %), touchant le genou dans 98 % des cas.Une oligoarthrite asymétrique intermittente est classique chez l’enfant. Contrairement à d’autres arthrites infectieuses, l’arthrite de Lyme est non destructrice et le syndrome inflammatoire associé est toujours modéré (CRP inférieure à 60 mg/L).7 Cette forme clinique est plus rare en Europe qu’aux États-Unis.
Rares atteintes cardiaques ou ophtalmiques
Les atteintes cardiaques (troubles de conduction aigus, sans cardiopathie sous-jacente en zone d’endémie) ou ophtalmologiques (uvéite) sont beaucoup plus rares.Des signes aspécifiques, d’analyse plus complexe
En cas de difficultés diagnostiques, un avis peut être sollicité auprès du centre de référence ou de compétence des maladies vectorielles à tiques le plus proche.
Diagnostics différentiels à évoquer
Diagnostic paraclinique : surtout la sérologie !
Un sérodiagnostic en deux temps
- une technique immuno-enzymatique sensible (ELISA), et
- en cas de positivité ou de doute, la confirmation par immuno-empreinte (western-blot) dont la spécificité est meilleure que celle de l’ELISA (responsable de faux positifs).9, 10
Les tests ELISA actuels comportent au moins les antigènes des trois principales espèces européennes pathogènes pour l’homme (Borrelia afzelii, B. garinii, et B. burgdorferi sensu stricto).
Le diagnostic de l’EM est uniquement clinique, car la séroconversion IgG se fait en six semaines environ (risque de faux négatif avant 6 semaines).11
La sérologie gagne en sensibilité au cours du temps, pour atteindre plus de 90 % à partir de 6 à 8 semaines d’évolution.11
La présence isolée d’IgM au-delà de 6 semaines doit être considérée comme un faux positif, les IgM croisant avec d’autres pathologies (autres infections, maladies auto-immunes, etc.).
Un western-blot est considéré comme positif en IgG si plus de trois bandes sont détectées, dont VlsE (variable protein-like sequence expressed).
Dans les formes tardives, la séropositivité en ELISA est proche de 100 % et le taux d’IgG détecté est élevé.11 Une sérologie de Lyme négative au stade tardif (évolution des symptômes supérieure à 6 mois) doit faire remettre en cause l’hypothèse de BL.
Concernant les formes neurologiques, la recherche d’anticorps anti-Borrelia dans le sang et le liquide cérébrospinal (LCS) est simultanément réalisée : la synthèse intrathécale d’IgG spécifiques anti B. burgdorferi s.l. confirme le diagnostic de NBL.10Après un traitement efficace, des taux élevés d’anticorps peuvent perdurer plusieurs années après la guérison : ils ne doivent pas conduire à reprendre le traitement. Les anticorps spécifiques ne protègent pas contre une nouvelle infection à B. burgdorferi s.l., car il existe plusieurs souches. Dans le cas d’une possible réinfection, une sérologie positive ne permet pas de différencier une infection active d’une cicatrice sérologique. Un contrôle de la sérologie à 4 semaines peut alors permettre d’objectiver une ascension du titre des IgG. Sinon, seules la clinique, la notion d’exposition, et la biologie moléculaire selon la localisation permettent d’orienter le diagnostic.
En cas de sérologie positive en l’absence de signe clinique, il s’agit d’une cicatrice sérologique ou d’une séroconversion asymptomatique, ne devant pas conduire à une antibiothérapie.
Diagnostic par PCR de sensibilité variable
Culture spécifique mais peu sensible
Peu de place pour les autres tests biologiques
De nombreux autres tests (interféron-gamma dit ELISPOT, tests de transformation lymphocytaire, phage-tests, microscopie à fond noir etc.) ont été évalués sans montrer de performances suffisantes pour améliorer le diagnostic des BL.12
Le syndrome inflammatoire biologique dans les BL est toujours modéré (CRP normale ou peu élevée).
L’imagerie élimine les diagnostics différentiels
Traitement : pas plus de quatre semaines d’antibiothérapie
Molécule et durée de l’antibiothérapie variables selon les formes
Compte tenu de la continuité des formes localisées et disséminées précoces, et de l’efficacité de la doxycycline sur toutes les localisations de la maladie, cette molécule est privilégiée en première intention en l’absence de contre-indication. Elle présente par ailleurs l’intérêt d’être active sur d’autres maladies à tiques. Pour les NBL, la doxycycline per os est aussi efficace que la ceftriaxone13 dont les effets indésirables, en lien avec son administration parentérale et son large spectre, doivent faire peser la balance bénéfice-risque avant toute utilisation. Seule l’atteinte du système nerveux central fait discuter l’utilisation de la ceftriaxone en intraveineuse, ou le doublement de posologie de la doxycycline afin d’obtenir une concentration suffisante dans les tissus lésés, en tenant compte de la barrière hémato-encéphalique. De plus, en cas de poids supérieur à 70 kg, les doses doivent être adaptées en mg/kg afin d’éviter un sous-dosage potentiel.
Au-delà de 4 semaines de traitement, il n’y a pas d’argument pour continuer l’antibiothérapie quel que soit le résultat clinique, sauf dans les formes articulaires. Comme de rares échecs microbiologiques ont été identifiés (persistance de Borrelia dans le tissu synovial après une antibiothérapie adaptée), une seconde cure est recommandée en l’absence de guérison, avec l’antibiotique non utilisé précédemment (ceftriaxone ou doxycycline selon le schéma initial).7 Après cette seconde cure, les études suggèrent une éradication de la bactérie, se traduisant par une évolution clinique parfois longue mais favorable.
Tenir compte de la dimension psychologique
Aucune autre thérapeutique n’a fait la preuve de son efficacité. L’efficacité des corticoïdes est discutée dans les paralysies faciales de Lyme et dans les arthrites.14 La bonne compréhension par les patients de l’efficacité attendue du traitement et du temps de récupération parfois long est un facteur de bon pronostic.
Il est utile d’associer des prises en charge spécifiques de la douleur ou de réadaptation physique.
La dimension psychologique (contexte de douleurs, de difficultés diagnostiques, etc.) ne doit pas être négligée, et doit être explicitée avec attention au patient, ce d’autant que l’anxiété ou le stress induit interviennent souvent comme facteur d’entretien de symptômes persistants, sans en être la cause.
Après traitement, l’évolution est généralement favorable
Cependant, dans les formes traitées tardivement, les lésions tissulaires provoquées par la bactérie peuvent être à l’origine de manifestations cliniques persistantes, souvent douloureuses. On parle de manifestations post-BL séquellaires dont les mécanismes physiopathologiques ne sont pas totalement élucidés. Ces situations restent minoritaires, mais peuvent occasionner des handicaps (neuropathie, déficits moteurs persistants). L’intérêt des antibiothérapies prolongées pour des patients ayant des symptômes subjectifs après une BL traitée a été évalué dans plusieurs essais randomisés contre placebo sans montrer d’efficacité, que ce soit sur la qualité de vie, les douleurs ou la fatigue.15, 16
La prise en charge globale de ces symptômes persistants, avec une équipe pluridisciplinaire, est un facteur de bon pronostic. Les centres de compétence et des centres de référence des maladies vectorielles à tiques sont disponibles pour ces patients. Il en existe cinq en France (liste sur https://crmvt.fr/)
Plusieurs niveaux de prévention
Information du grand public
Prévention primaire individuelle
La prévention primaire mécanique s’appuie sur le port de vêtements couvrants (pantalons, manches longues, et chapeaux pour les enfants) et clairs, pour repérer les tiques plus facilement.17
Les méthodes chimiques sont des acaricides ou des répulsifs cutanés, perturbant le système olfactif des tiques de façon à les tenir éloignées (
Prévention secondaire : inspection, extraction et surveillance
L’extraction est mécanique et se fait grâce à un tire-tique, avec un mouvement de rotation. L’utilisation de substances chimiques est à proscrire car elle favorise la régurgitation et la transmission de pathogènes. Une désinfection locale est réalisée après l’extraction.
Une surveillance du point de piqûre pendant quatre semaines est nécessaire, à la recherche de l’apparition d’un EM. Pendant cette période, la survenue d’autres symptômes, locaux ou systémiques, doit conduire à une consultation médicale, dans l’hypothèse d’autres maladies transmises par les tiques.
En cas de doute diagnostique, le patient peut être adressé en centre de compétence.
Pas de place pour l’antibioprophylaxie !
Par ailleurs, aucun vaccin n’est actuellement disponible mais des études sont en cours.
L’exposition aux piqûres de tiques est un élément capital pour le diagnostic de borréliose de Lyme
La sérologie de Lyme a de bonnes performances diagnostiques (en dehors de l’EM où elle n’est pas indiquée), à condition d’en respecter les indications et de savoir l’interpréter.
La borréliose de Lyme est traitée par antibiothérapie, pendant deux à quatre semaines selon le stade clinique et le type d’atteinte. La prise en charge de symptômes persistants est primordiale car ils sont souvent à l’origine d’une errance thérapeutique. En cas de difficultés dans la prise en charge diagnostique ou thérapeutique, les centres de compétence et de référence des maladies vectorielles à tiques ont des missions de recours et doivent être sollicités afin de faciliter la prise en charge des patients suspects de borréliose de Lyme.
Idées reçues : vrai ou faux ?
Les tiques tombent des arbres
FAUX, les tiques vivent à moins d’un mètre du sol, dans un milieu tempéré et humide.
Les tiques mangent une fois par an
VRAI, une tique fait un repas sanguin par an. Donc une tique repue ne repiquera pas tout de suite.
Si l’on se fait piquer par une tique, le risque de développer une maladie est important
FAUX, le risque est inférieur à 5 %. C’est pour cela qu’une antibioprophylaxie est inutile, ce d’autant que le risque de développer quand même une borréliose de Lyme après une antibioprophylaxie n’est pas nul non plus. Inspecter régulièrement l’apparition d’un érythème migrant et consulter au moindre signe clinique sont donc des réflexes importants afin de traiter le plus précocement possible et obtenir ainsi une guérison plus rapide.
La borréliose de Lyme est une maladie à déclaration obligatoire.
FAUX, cette maladie ne répond pas aux critères de la déclaration obligatoire car c’est une maladie fréquente, sans contamination interhumaine, avec une définition trop ou pas assez stricte, et sans menace de santé publique imminente et grave.
La borréliose de Lyme se transmet de la mère à l’enfant
FAUX, s’il existe une transmission avérée des anticorps anti-Borrelia de la mère à l’enfant, il n’existe pas à ce jour de cas décrits de borréliose de Lyme néonatale. Néanmoins, il existe un unique cas de mort fœtale in utero où Borrelia aurait été retrouvée en post-mortem dans les tissus fœtaux. Aucun risque malformatif n’a été mis en évidence à ce jour. En revanche, une femme enceinte atteinte de borréliose de Lyme sera plus à risque de fausses couches spontanées, justifiant donc un traitement antibiotique sans attendre.
La borréliose de Lyme est une maladie sexuellement transmissible
FAUX, à ce jour, la transmission sexuelle n’est pas démontrée. Il est difficile de mener des études pour étudier cette transmission car un couple vit dans les mêmes conditions, avec le même risque d’exposition le plus souvent.
On ne guérit jamais complètement de la borréliose de Lyme.
FAUX, après une antibiothérapie avec la bonne molécule, à la bonne dose et la bonne durée, l’évolution d’une borréliose de Lyme est favorable, même si la guérison complète peut prendre plusieurs mois, voire années concernant les neuroborrélioses. Une borréliose qui n’évolue pas favorablement doit faire rechercher un diagnostic différentiel associé. En cas de doute concernant le diagnostic ou sur l’éradication de Borrelia, le patient doit être adressé à un centre de référence des maladies vectorielles à tiques.
Borrelia peut s’enkyster et devenir insensible aux antibiotiques
FAUX, Borrelia, comme toutes les bactéries ne peut pas s’enkyster (forme présente chez certains parasites uniquement). Ce qui est pris pour des kystes sont en fait des formes déficientes, arrondies. Ces formes arrondies n’ont été produites qu’in vitro dans des conditions extrêmes de pH ou d’osmolarité qui sont incompatibles avec la vie humaine. Ces formes n’ont jamais été mises en évidence chez l’homme ou chez des animaux infectés naturellement.
Borrelia en phase de croissance stationnaire est moins sensible aux antibiotiques.
VRAI, cela a été démontré. C’est en partie pour cela que les doses antibiotiques recommandées sont élevées. Le respect des posologies est primordial car elles permettent de détruire Borrelia dans ces conditions. L’adaptation des posologies au poids du patient permet d’éviter un éventuel sous-dosage.
Les symptômes persistants post-Lyme prouvés et traités selon les recommandations sont dus à la persistance de Borrelia
FAUX, à ce jour, aucune étude n’a démontré la persistance de Borrelia sous une forme vivante et capable de se multiplier dans les tissus après une antibiothérapie telle que préconisée dans les recommandations. La physiopathologie de ces symptômes persistants souvent invalidants pour les patients et dont la prise en charge précoce est fondamentale est encore mal connue. Les principales hypothèses sont : la dysrégulation des réponses inflammatoires, des processus auto-immuns, le rôle du microbiote intestinal, une neuro-inflammation cérébrale chronique et une sensibilité accrue du système nerveux central, et des mécanismes psychologiques.
2. Sykes RA, Makiello P. An estimate of Lyme borreliosis incidence in Western Europe. J Public Health 2017; 39(1):74-81.
3. Borréliose de Lyme : données épidémiologiques 2020. Santé Publique France. 4 novembre 2021. https://vu.fr/Dwqv
4. Rebman AW, Yang T, Mihm EA, Novak CB, Yoon I, Powell D, et al.The presenting characteristics of erythema migrans vary by age, sex, duration, and body location. Infection 2021;49(4):685-92.
5. Ogrinc K, Maraspin V, Lusa L, Cerar Kisek T, Rusik-Sabljic E, Strle F. Acrodermatitis chronica atrophicans: Clinical and microbiological characteristics of a cohort of 693 Slovenian patients. J Intern Med 2021;290(2):335-48.
6. Knudtzen FC, Andersen NS, Jensen TG, Skarphédinsson S. Characteristics and clinical outcome of Lyme neuroborreliosis in a high endemic area, 1995-2014: A retrospective cohort study in Denmark. Clin Infect Dis 2017;65(9):1489-95.
7. Steere AC, Levin RE, Molloy PJ, Kalish RA, Abraham JH, Liu NY, et al. Treatment of Lyme arthritis. Arthritis Rheum 1994;37(6):878-88.
8. Jacquet C, Goehringer F, Baux E, Conrad JA, Ganne Devonec MO, Schmutz JL, et al. Multidisciplinary management of patients presenting with Lyme disease suspicion. Med Mal Infect 2019;49(2):112-20.
9. Jaulhac B, Saunier A, Caumes E, Bouiller K, Gehanno JF, Rabaud C, et al. Lyme borreliosis and other tick-borne diseases. Guidelines from the French scientific societies (II). Biological diagnosis, treatment, persistent symptoms after documented or suspected Lyme borreliosis. Med Mal Infect 2019;49(5):335-46.
10. Eldin C, Raffetin A, Bouillet K, Hansmann Y, Roblot F, Raoult D, et al. Review of European and American guidelines for the diagnosis of Lyme borreliosis. Med Mal Infect 2018;49(2):121-32.
11. Leeflang MMG, Ang CW, Berkhout J, Bijlmer HA, Van Bortel W, Brandenburg AH, et al. The diagnostic accuracy of serological tests for Lyme borreliosis in Europe: A systematic review and meta-analysis. BMC Infect Dis 2016;16:140.
12. Raffetin A, Saunier A, Bouiller K, Cataux-Paz, Eldin C, Gallien S, et al. Unconventional diagnostic tests for Lyme borreliosis: A systematic review. Clin Microbiol Infect 2020;26(1):51-9.
13. Kortela E, Kanerva MJ, Puustinen J, Hurme S, Airas L, Lauhio A, et al. Oral doxycycline compared to intravenous ceftriaxone in the treatment of Lyme neuroborreliosis: A multicenter, equivalence,randomized, open-label trial. Clin Infect Dis 2021;72(8):1323-31.
14. Corre C, Coiffier G, Le Goff B, Ferreyra M, Guennic X, Patrat-Delon S, et al. Lyme arthritis in Western Europe: A multicentre retrospective study. Eur J Clin Microbiol Infect Dis 2022;41(1):21-7.
15. Berende A, Hofstede HJM, Vos FJ, van Middendorp H, Vogelaar ML, Tromp M, et al. Randomized trial of longer-term therapy for symptoms attributed to Lyme disease. N Engl J Med 2016;374(13):1209-20.
16. Fallon BA, Keilp JG, Corbera KM, Petkova E, Britton CB, Dwyer E, et al. A randomized, placebo-controlled trial of repeated IV antibiotic therapy for Lyme encephalopathy. Neurology 2008;70(13):992-1003.
17. Figoni J, Chirouze C, Hansmann Y, Lemogne C, Hentgen V, Saunier A, et al.Lyme borreliosis and other tick-borne diseases. Guidelines from the French Scientific Societies (I): Prevention, epidemiology, diagnosis. Med Mal Infect 2019;49(5):318-34.
18. Recommandations sanitaires pour les voyageurs, 2022 (à l’attention de professionnels de santé). Bulletin Epidémiologique Hebdomadaire, Hors-série, 2 juin 2022.
19. Nadelman RB, Nowakowski J, Fish D, Falco RC, Freeman K, McKenna D, et al. Prophylaxis with single-dose doxycycline for the prevention of Lyme disease after an Ixodes scapularis tick bite. N Engl J Med 2001;345(2):79-84.
Dans cet article
- Augmentation du nombre de cas avec des disparités régionales
- Le diagnostic repose en premier lieu sur la clinique
- Diagnostic paraclinique : surtout la sérologie !
- Traitement : pas plus de quatre semaines d’antibiothérapie
- Plusieurs niveaux de prévention
- L’exposition aux piqûres de tiques est un élément capital pour le diagnostic de borréliose de Lyme

 Encadrés
Encadrés