Moins connues que la maladie de Lyme, les borrélioses récurrentes sont transmises par des tiques ou des poux. Elles sont à l’origine de tableaux cliniques parfois sévères.
Au sein du genre bactérien des Borrelia, on distingue plusieurs espèces. Certaines sont responsables d’un tableau clinique désigné sous le nom de maladie de Lyme, ou borréliose de Lyme, très médiatisée ces dernières années, mais qui ne sera pas développée ici. D’autres espèces au sein du genre Borrelia sont à l’origine d’un tableau clinique bien différent, souvent moins connu des cliniciens, désigné sous le nom de borréliose récurrente (BR), ou fièvre récurrente. Des connaissances de base, concernant les différents types de BR que l’on peut rencontrer, sont nécessaires aux praticiens.
Épidémiologie : tiques ou poux ?
Au sein des borrélioses récurrentes, on distingue celles qui sont transmises par les poux de corps (Pediculus humanus corporis) (fig. 1 ) et celles qui sont transmises par des tiques (tiques molles du genre Ornithodoros et tiques dures du genre Ixodes pour l’une d’entre elles) [fig. 2 ]. De ces modes de transmission découlent les principales caractéristiques épidémiologiques de ces infections (tableaux 1 et 2 ).
Borréliose récurrente à poux due à B. recurrentis
Cette maladie épidémique survient principalement lorsque les conditions sanitaires sont défavorables et propices à l’infestation par les poux de corps (guerre, famine, promiscuité, surpeuplement, manque d’hygiène…). Le pou vit dans les vêtements au contact du corps, et change d’hôte lorsque la température corporelle n’est plus adéquate (changement de vêtements, fièvrede l’hôte, décès). Le pou est hématophage et ingère Borrelia lors de son repas sanguin. Lors de l’écrasement du pou, le liquide cœlomique et les fèces contaminés sont libérés sur la peau, et la transmission se fait alors à travers la peau lésée par le grattage, ou les muqueuses (conjonctives notamment). Des transmissions nosocomiales sont possibles (transfusion sanguine, accident d’exposition au sang).1
Actuellement, la maladie s’observe principalement dans des foyers endémiques limités à la corne de l’Afrique (Éthiopie, Somalie, Soudan, Érythrée). Elle se manifeste par des bouffées épidémiques lors de la saison des pluies, chez les personnes les plus défavorisées. En Europe, des épidémies ont été décrites depuis 2015, chez des migrants africains originaires d’Afrique de l’Est vivant dans de mauvaises conditions d’hygiène.2 Une étude sérologique a également montré la présence d’anticorps contre Borrelia recurrentis chez les sans-abri de la région de Marseille, suggérant une circulation méconnue au sein de cette population qui vit dans la précarité.3
Actuellement, la maladie s’observe principalement dans des foyers endémiques limités à la corne de l’Afrique (Éthiopie, Somalie, Soudan, Érythrée). Elle se manifeste par des bouffées épidémiques lors de la saison des pluies, chez les personnes les plus défavorisées. En Europe, des épidémies ont été décrites depuis 2015, chez des migrants africains originaires d’Afrique de l’Est vivant dans de mauvaises conditions d’hygiène.2 Une étude sérologique a également montré la présence d’anticorps contre Borrelia recurrentis chez les sans-abri de la région de Marseille, suggérant une circulation méconnue au sein de cette population qui vit dans la précarité.3
Borrélioses récurrentes à tiques : un ensemble de maladies cliniquement similaires
Leur répartition géographique dépend de celle de la tique vectrice. Les tiques molles du genre Ornithodoros sont endémiques en Afrique, Amérique, Asie, Moyen-Orient et dans la péninsule ibérique. Elles résistent à la chaleur et à la sécheresse et on les trouve dans des terriers ou dans les murs en terre des habitations, principalement en zone rurale. Une espèce fait exception, il s’agit de Borrelia miyamotoi, qui est transmise par des tiques dures du genre Ixodes, plus répandues dans les zones tempérées d’Europe du Nord et d’Asie. En Europe, l’Espagne est une zone d’endémie de la fièvre récurrente à tiques à Borrelia hispanica, notamment l’Andalousie. Son incidence varie d’une année à l’autre (jusqu’à 8,69/100 000 personnes en 2015) et son pic se situe entre juin et novembre, principalement dans les zones rurales.4
En Afrique, l’incidence est mal documentée du fait d’un manque de moyens diagnostiques. On sait néanmoins, grâce à des études épidémiologiques, que la fièvre récurrente à Borrelia crocidurae est présente en Afrique de l’Ouest mais aussi au Maroc, au Kenya, en Libye et en Égypte. Au Sénégal, cette maladie représenterait 13 % des causes de fièvres dans les dispensaires, soit 11 à 25 cas pour 100 personne-années. Au Maroc, 20,5 % des fièvres pourraient être en lien avec une BR à tiques.5 D’autres borrélioses récurrentes à tiques sont présentes en Afrique (Borrelia duttonii, Borrelia microti…). Il faut y penser en cas de fièvre chez le voyageur de retour d’Afrique, une fois le diagnostic de paludisme éliminé, surtout si le patient a séjourné en zone rurale. Aux États-Unis, les BR à tiques sont présentes principalement dans l’ouest du pays.6
L’épidémiologie de B. miyamotoi est très différente de celle des autres BR à tiques, puisqu’elle est transmise par une tique dure du genre Ixodes, plus souvent présente dans les régions tempérées d’Europe et d’Asie. Les premiers cas ont été rapportés en Russie en 2011, et il s’agit d’un pathogène émergent en Europe.7
En Afrique, l’incidence est mal documentée du fait d’un manque de moyens diagnostiques. On sait néanmoins, grâce à des études épidémiologiques, que la fièvre récurrente à Borrelia crocidurae est présente en Afrique de l’Ouest mais aussi au Maroc, au Kenya, en Libye et en Égypte. Au Sénégal, cette maladie représenterait 13 % des causes de fièvres dans les dispensaires, soit 11 à 25 cas pour 100 personne-années. Au Maroc, 20,5 % des fièvres pourraient être en lien avec une BR à tiques.5 D’autres borrélioses récurrentes à tiques sont présentes en Afrique (Borrelia duttonii, Borrelia microti…). Il faut y penser en cas de fièvre chez le voyageur de retour d’Afrique, une fois le diagnostic de paludisme éliminé, surtout si le patient a séjourné en zone rurale. Aux États-Unis, les BR à tiques sont présentes principalement dans l’ouest du pays.6
L’épidémiologie de B. miyamotoi est très différente de celle des autres BR à tiques, puisqu’elle est transmise par une tique dure du genre Ixodes, plus souvent présente dans les régions tempérées d’Europe et d’Asie. Les premiers cas ont été rapportés en Russie en 2011, et il s’agit d’un pathogène émergent en Europe.7
Des signes cliniques peu spécifiques et d’apparition brutale
L’incubation dure 7 jours en moyenne (de 3 à 20 jours), puis la maladie se déclare par l’apparition d’une fièvre élevée (supérieure à 40 °C) accompagnée de signes aspécifiques, avec au premier plan des céphalées intenses, des arthromyalgies, des douleurs abdominales, des nausées et vomissements, une langue saburrale, un ictère conjonctival, et une hépatosplénomégalie sensible. Des signes neurologiques sont possibles, tels qu’une agitation ou un ralentissement psychomoteur. Un rash maculo-papuleux et des pétéchies sont aussi fréquents. La fièvre décroît sur 3 jours en moyenne (de 1 à 14 jours), décroissance souvent accompagnée d’une hypotension et de sueurs intenses. La phase apyrétique qui suit dure 5 à 14 jours, alors que les autres signes cliniques persistent habituellement. En l’absence de traitement, plusieurs récurrences se succèdent (de une à 8 en général). L’intensité des manifestations cliniques et de la fièvre diminue à chaque récurrence.
La présentation clinique de la BR à B. miyamotoi est un peu différente de celle des autres BR : en effet, les thrombopénies et les tableaux neurologiques avec des signes méningés sont plus fréquents.7
La présentation clinique de la BR à B. miyamotoi est un peu différente de celle des autres BR : en effet, les thrombopénies et les tableaux neurologiques avec des signes méningés sont plus fréquents.7
De multiples complications et 2 à 5 % de décès
Les principales complications sont hémorragiques (épistaxis, hémorragies internes), hépatiques (ictère, cytolyse et cholestase), neurologiques (méningite lymphocytaire aiguë, méningo-encéphalite, myélite, paralysie des nerfs crâniens, avec des paralysies faciales fréquentes chez l’enfant), psychiatriques (agitation, prostration, hallucinations), pulmonaires (toux, pneumopathie, œdème pulmonaire), cardiovasculaires (anomalies de l’électrocardiogramme avec allongement du QT ou extrasystoles ventriculaires, collapsus lors de la chute thermique, myocardite), et oculaires (uvéite, hémorragies rétiniennes, neuropathie optique).
Le taux de mortalité varie de 2 à 5 %. Il est plus élevé chez les enfants et les femmes enceintes. Les complications obstétricales sont fréquentes (risque élevé de fausses couches et d’accouchements prématurés, complications maternelles, infection congénitale avec pronostic réservé pour le nouveau-né). Le pronostic dépend de l’espèce de Borrelia incriminée, les tableaux de la BR à poux étant généralement plus sévères (B. recurrentis).
Le taux de mortalité varie de 2 à 5 %. Il est plus élevé chez les enfants et les femmes enceintes. Les complications obstétricales sont fréquentes (risque élevé de fausses couches et d’accouchements prématurés, complications maternelles, infection congénitale avec pronostic réservé pour le nouveau-né). Le pronostic dépend de l’espèce de Borrelia incriminée, les tableaux de la BR à poux étant généralement plus sévères (B. recurrentis).
Thyphoïde, paludisme, leptospirose… quels diagnostics différentiels ?
La typhoïde, le paludisme et la leptospirose sont les principaux diagnostics différentiels à évoquer devant une fièvre au retour ou en zone tropicale et peuvent aussi être des co-infections. Parmi les autres diagnostics possibles figurent les rickettsioses, la dengue, la fièvre jaune, les infections bactériennes communautaires (notamment les méningites).
Diagnostic paraclinique : la PCR, technique de référence
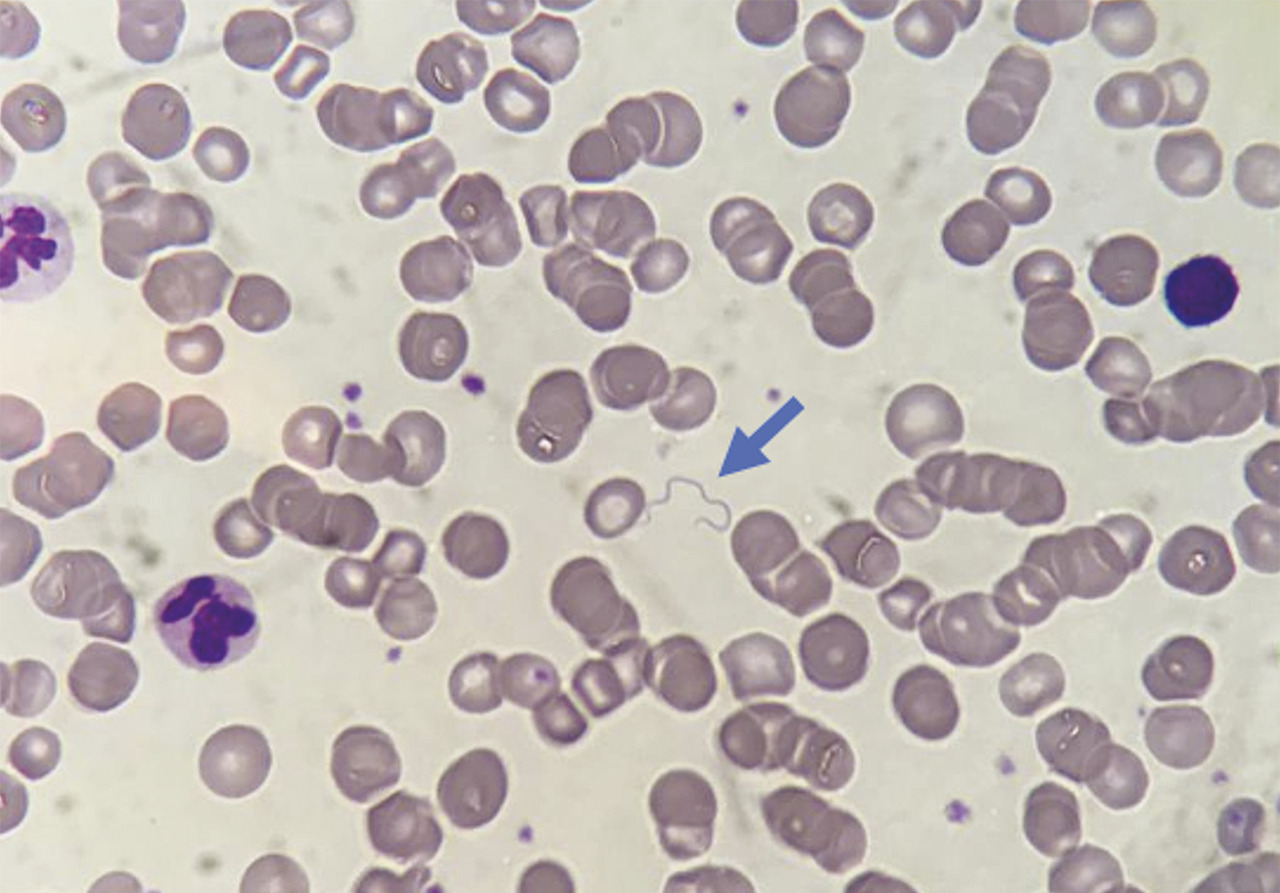
Durant les accès fébriles des BR, la bactériémie (ou spirochétémie) est élevée, mais la bactérie ne pousse pas sur des hémocultures standard. Afin de la mettre en évidence, il existe plusieurs méthodes. La plus ancienne est la détection par microscopie optique sur frottis sanguin après coloration de May-Grünwald-Giemsa (fig. 3 ). Néanmoins, elle expose à un risque de faux négatif en cas de faible concentration bactérienne.8
À l’heure actuelle, la technique de référence, la plus sensible et la plus facile à effectuer, est la PCR quantitative spécifique détectant Borrelia sp. dans le sang.8, 9
La culture requiert une expertise particulière, notamment un milieu spécial (BSK-H) dans des laboratoires qui maîtrisent cette technique.
La sérologie n’a que peu d’intérêt pour le diagnostic de borréliose récurrente car elle manque actuellement de standardisation entre laboratoires et se positive à un stade tardif, bien souvent à distance des accès fébriles.8
À l’heure actuelle, la technique de référence, la plus sensible et la plus facile à effectuer, est la PCR quantitative spécifique détectant Borrelia sp. dans le sang.8, 9
La culture requiert une expertise particulière, notamment un milieu spécial (BSK-H) dans des laboratoires qui maîtrisent cette technique.
La sérologie n’a que peu d’intérêt pour le diagnostic de borréliose récurrente car elle manque actuellement de standardisation entre laboratoires et se positive à un stade tardif, bien souvent à distance des accès fébriles.8
Le traitement repose sur une antibiothérapie
Le traitement de référence de la BR à poux est la tétracycline en dose unique en une prise (500 mg per os).
Le traitement de première intention des BR à tiques est la doxycycline : 200 mg/j per os en deux prises pendant 10 jours. En présence d’une atteinte méningée ou encéphalitique, la ceftriaxone est privilégiée, à la dose de 2 g/j en intraveineuse pendant 14 jours.
Le traitement de première intention des BR à tiques est la doxycycline : 200 mg/j per os en deux prises pendant 10 jours. En présence d’une atteinte méningée ou encéphalitique, la ceftriaxone est privilégiée, à la dose de 2 g/j en intraveineuse pendant 14 jours.
Guetter la réaction de Jarisch-Herxheimer
Le principal effet secondaire grave est la réaction de Jarisch-Herxheimer. Provoquée par la lyse simultanée d’un grand nombre de spirochètes, elle survient classiquement dans les 2 à 4 heures qui suivent le début du traitement. Elle est très fréquente dans la BR à poux et plus variable dans les BR à tiques, car elle est corrélée à la gravité initiale de l’infection. Elle se manifeste par une exacerbation des signes cliniques, avec des frissons, une fièvre, une tachycardie, une hypotension. Il est donc recommandé de surveiller les patients en milieu hospitalier dans les heures qui suivent la première administration d’antibiotiques. Le traitement de cette réaction est symptomatique.
En prévention, hygiène et salubrité au premier plan
Les fièvres récurrentes à B. recurrentis sont transmises par les poux de corps, dans des conditions d’hygiène très dégradées, dans des environnements surpeuplés et de grande précarité. La lutte contre ces parasites est la pierre angulaire de la prévention de la BR à poux. Dès qu’un patient est porteur de poux de corps, ses vêtements et tous les tissus en contact (draps, serviettes de toilette) doivent être lavés à 60 °C. Les mêmes mesures doivent être appliquées pour les sujets en contact direct avec le patient.
Concernant les BR à tiques, la prévention repose sur une amélioration des habitats en zone rurale lorsqu’ils qui sont infestés par les tiques molles. La prévention des morsures de tiques dures (B. miyamotoi) repose sur un ensemble de mesures, détaillées dans une fiche de la Haute Autorité de santé (Prévention des maladies vectorielles à tiques, HAS 2018) : port de vêtements longs, clairs, chaussettes recouvrant le pantalon, application de répulsifs cutanés ou sur les vêtements. Dans certaines zones géographiques particulièrement infestées, une prophylaxie post-exposition, sous forme de doxycycline, peut être proposée en dose unique dans les 72 heures qui suivent l’exposition.10
Concernant les BR à tiques, la prévention repose sur une amélioration des habitats en zone rurale lorsqu’ils qui sont infestés par les tiques molles. La prévention des morsures de tiques dures (B. miyamotoi) repose sur un ensemble de mesures, détaillées dans une fiche de la Haute Autorité de santé (Prévention des maladies vectorielles à tiques, HAS 2018) : port de vêtements longs, clairs, chaussettes recouvrant le pantalon, application de répulsifs cutanés ou sur les vêtements. Dans certaines zones géographiques particulièrement infestées, une prophylaxie post-exposition, sous forme de doxycycline, peut être proposée en dose unique dans les 72 heures qui suivent l’exposition.10
Précarité et voyage
On distingue les borrélioses récurrentes dues à B. recurrentis, transmises par les poux de corps, et les borrélioses récurrentes transmises par des tiques (tiques molles pour la majorité d’entre elles et tiques dures pour B. miyamotoi).
Il faut savoir évoquer les borrélioses récurrentes à poux dans des contextes de grande précarité (immigrés en provenance d’Afrique, personnes sans-abri). Les borrélioses récurrentes à tiques molles peuvent concerner des voyageurs au retour d’Afrique ou d’Espagne : épisodes fébriles récurrents sans cause identifiée.
La borréliose récurrente à tiques dures due à B. miyamotoi est encore rare mais doit être évoquée devant un tel tableau chez un patient qui a été exposé à des piqûres de tiques en zone tempérée d’Europe ou d’Asie. Les signes cliniques sont aspécifiques et l’infection peut être grave, en particulier chez les femmes enceintes ou les enfants, avec un taux de mortalité de 2 à 5 %.
Le traitement repose sur les cyclines, ou la ceftriaxone en cas d’atteinte neurologique.
Il faut savoir évoquer les borrélioses récurrentes à poux dans des contextes de grande précarité (immigrés en provenance d’Afrique, personnes sans-abri). Les borrélioses récurrentes à tiques molles peuvent concerner des voyageurs au retour d’Afrique ou d’Espagne : épisodes fébriles récurrents sans cause identifiée.
La borréliose récurrente à tiques dures due à B. miyamotoi est encore rare mais doit être évoquée devant un tel tableau chez un patient qui a été exposé à des piqûres de tiques en zone tempérée d’Europe ou d’Asie. Les signes cliniques sont aspécifiques et l’infection peut être grave, en particulier chez les femmes enceintes ou les enfants, avec un taux de mortalité de 2 à 5 %.
Le traitement repose sur les cyclines, ou la ceftriaxone en cas d’atteinte neurologique.
Références
1. Warrell DA. Louse-borne relapsing fever (Borrelia recurrentis infection). Epidemiol Infect 2019;147:e106.
2. Wilting KR, Stienstra Y, Sinha B, Braks M, Cornish D, Grundmann H. Louse-borne relapsing fever (Borrelia recurrentis) in asylum seekers from Eritrea, the Netherlands, July 2015. Euro Surveill 2015;20:21196.
3. Ly TDA, Louni M, Hoang VT, Dao TL, Badiaga S, Brouqui P, et al. Epidemiological serosurvey of vector-borne and zoonotic pathogens among homeless people living in shelters in Marseille: cross-sectional one-day surveys (2005-2015). Eur J Clin Microbiol Infect Dis 2020;39:1663-72.
4. Domínguez MC, Vergara S, Gómez MC, Roldán ME. Epidemiology of tick-borne Relapsing fever in endemic area, Spain. Emerg Infect Dis 2020;26:849‑56.
5. Cutler SJ. Relapsing Fever Borreliae: A global review. Clin Lab Med 2015;35:847‑65.
6. Rodino KG, Theel ES, Pritt BS. Tick-borne diseases in the United States. Clin Chem 2020;66:537‑48.
7. Kubiak K, Szczotko M, Dmitryjuk M. Borrelia miyamotoi. An emerging human tick-borne pathogen in Europe. Microorganisms 2021;9:154.
8. Eldin C, Jaulhac B, Mediannikov O, Arzouni JP, Raoult D. Values of diagnostic tests for the various species of spirochetes. Med Mal Infect 2019;49:102‑11.
9. Patrat-Delon S, Drogoul AS, Le Ho H, Biziraguzenyuka J, Rabier V, Arvieux C et al. Recurrent tick-borne fever: A possible diagnosis in patients returning from Senegal. Med Mal Infect 2008;38:396-9.
10. Binenbaum Y, Ben-Ami R, Baneth G, Langford B, Negev Y, Friedlander E, et al. Single dose of doxycycline for the prevention of tick-borne relapsing fever. Clin Infect Dis 2020;71:1768‑71.
2. Wilting KR, Stienstra Y, Sinha B, Braks M, Cornish D, Grundmann H. Louse-borne relapsing fever (Borrelia recurrentis) in asylum seekers from Eritrea, the Netherlands, July 2015. Euro Surveill 2015;20:21196.
3. Ly TDA, Louni M, Hoang VT, Dao TL, Badiaga S, Brouqui P, et al. Epidemiological serosurvey of vector-borne and zoonotic pathogens among homeless people living in shelters in Marseille: cross-sectional one-day surveys (2005-2015). Eur J Clin Microbiol Infect Dis 2020;39:1663-72.
4. Domínguez MC, Vergara S, Gómez MC, Roldán ME. Epidemiology of tick-borne Relapsing fever in endemic area, Spain. Emerg Infect Dis 2020;26:849‑56.
5. Cutler SJ. Relapsing Fever Borreliae: A global review. Clin Lab Med 2015;35:847‑65.
6. Rodino KG, Theel ES, Pritt BS. Tick-borne diseases in the United States. Clin Chem 2020;66:537‑48.
7. Kubiak K, Szczotko M, Dmitryjuk M. Borrelia miyamotoi. An emerging human tick-borne pathogen in Europe. Microorganisms 2021;9:154.
8. Eldin C, Jaulhac B, Mediannikov O, Arzouni JP, Raoult D. Values of diagnostic tests for the various species of spirochetes. Med Mal Infect 2019;49:102‑11.
9. Patrat-Delon S, Drogoul AS, Le Ho H, Biziraguzenyuka J, Rabier V, Arvieux C et al. Recurrent tick-borne fever: A possible diagnosis in patients returning from Senegal. Med Mal Infect 2008;38:396-9.
10. Binenbaum Y, Ben-Ami R, Baneth G, Langford B, Negev Y, Friedlander E, et al. Single dose of doxycycline for the prevention of tick-borne relapsing fever. Clin Infect Dis 2020;71:1768‑71.