D’après l’intervention aux JNMG du Dr Gilles Jébrak, service de pneumologie B et de transplantations pulmonaires, hôpital Bichat, Paris.
BPCO : une maladie complexe
La BPCO souffre de l’image d’une maladie désespérante et autoentretenue – le patient « classique » étant un vieux monsieur tabagique qui ne peut/veut pas arrêter de fumer – ce qui amène à une vision fataliste. Il en résulte une pathologie délaissée, avec peu de financements alloués pour la recherche, alors qu’il s’agit d’une affection très fréquente et mortelle (3e cause de décès dans le monde avant la pandémie de Covid).
Aujourd’hui, on s’aperçoit que la BCPO peut toucher des patients plus jeunes, de plus en plus de femmes, ainsi que des non-fumeurs ayant d’autres facteurs de risque environnementaux mais aussi génétiques (cf. ci-dessous).
Ainsi, dans les recos du GINA 2023, la BPCO est considérée comme une pathologie hétérogène des poumons, un syndrome qui relève de plusieurs causes – différents toxiques inhalés – sur un terrain prédisposé. De plus, les définitions de 2023 intègrent de nouvelles formes avec un rapport de Tiffeneau (VEMS/CVF) conservé : les « BPCO des jeunes » de < 50 ans et les « pré-BPCO » avec anomalies fonctionnelles (VEMS ou CVF diminué), des anomalies radiographiques et/ou de l’emphysème.
Quels facteurs de risque ?
Les principaux facteurs environnementaux sont le tabagisme (trois quarts des BPCO en France) ou l’inhalation de toxiques liés à la pollution (surtout dans d’autres pays), mais d’autres éléments de l’environnement ou liés à l’hôte peuvent contribuer à la maladie. En effet, parmi le 1,3 milliard de fumeurs dans le monde, « seulement » 384 millions ont une BPCO : il existe donc des facteurs individuels (génétiques, environnementaux…).
Inversement, plus de 20 % des BPCO sont diagnostiquées chez des non-fumeurs. Les facteurs de risque sont de plus en plus connus : cannabis, vapotage (mode d’entrée dans le tabagisme), petit poids de naissance, exposition involontaire à la pollution intérieure ou extérieure, expositions professionnelles (mines, tunneliers, laiterie…).
Le principal facteur génétique connu à ce jour est une mutation du gène SERPINA1 (région chromosomique 14q32.13) entraînant un déficit en alpha- 1 -antitrypsine : il concerne jusqu’à 1 cas sur 2 000.
Tous ces facteurs individuels ont amené à une nouvelle classification des différents « étiotypes » de BPCO (d’origine génétique, environnementale, développement pulmonaire anormale, infections…).
Quoi de neuf dans le diagnostic ?
La définition retenue de l’obstruction bronchique reste un rapport VEMS/CVF après test bronchodilatateur < 70 %. Pour mesurer l’obstruction, il faut donc mesurer le souffle par spirométrie. Or les deux tiers des BPCO (environ 3 millions de patients en France) ne sont pas diagnostiqués car ces examens ne sont pas réalisés, à cause de l’incapacité du patient à faire le test ou du manque d’accès au matériel. D’autres techniques diagnostiques sont en cours d’évaluation, comme la détection de certaines anomalies au scanner (qui requièrent moins la coopération des patients) et pourraient être disponibles prochainement.
Faut-il faire d’autres examens outre la spirométrie et la radio ?
Le scanner n’est pas systématique mais il est souvent prescrit pour écarter les diagnostics différentiels, en cas d’indication chirurgicale, pour détecter un emphysème ou dépister un cancer bronchique chez les gros fumeurs.
Quelles nouveautés dans les traitements ?
Les cibles thérapeutiques au cours des BPCO sont multiples. Il faut lutter contre :
- l’inflammation : éviter les facteurs aggravants (expositions toxiques, exacerbations) ; utilisation des inflammatoires : corticoïdes, macrolides…
- l’encombrement : kinésithérapie, mucomodificateurs (de nouvelles spécialités seront bientôt disponibles) ;
- la bronchoconstriction (bronchodilatateurs, anticholinergiques et sympathomimétiques) ;
- l’emphysème : bronchodilatateurs (impact sur le piégeage gazeux) et dans des indications très ciblées : réduction de volume pulmonaire, transplantations ;
- le retentissement général : réadaptation, traitements préventif et curatif des comorbidités qui participent au handicap.
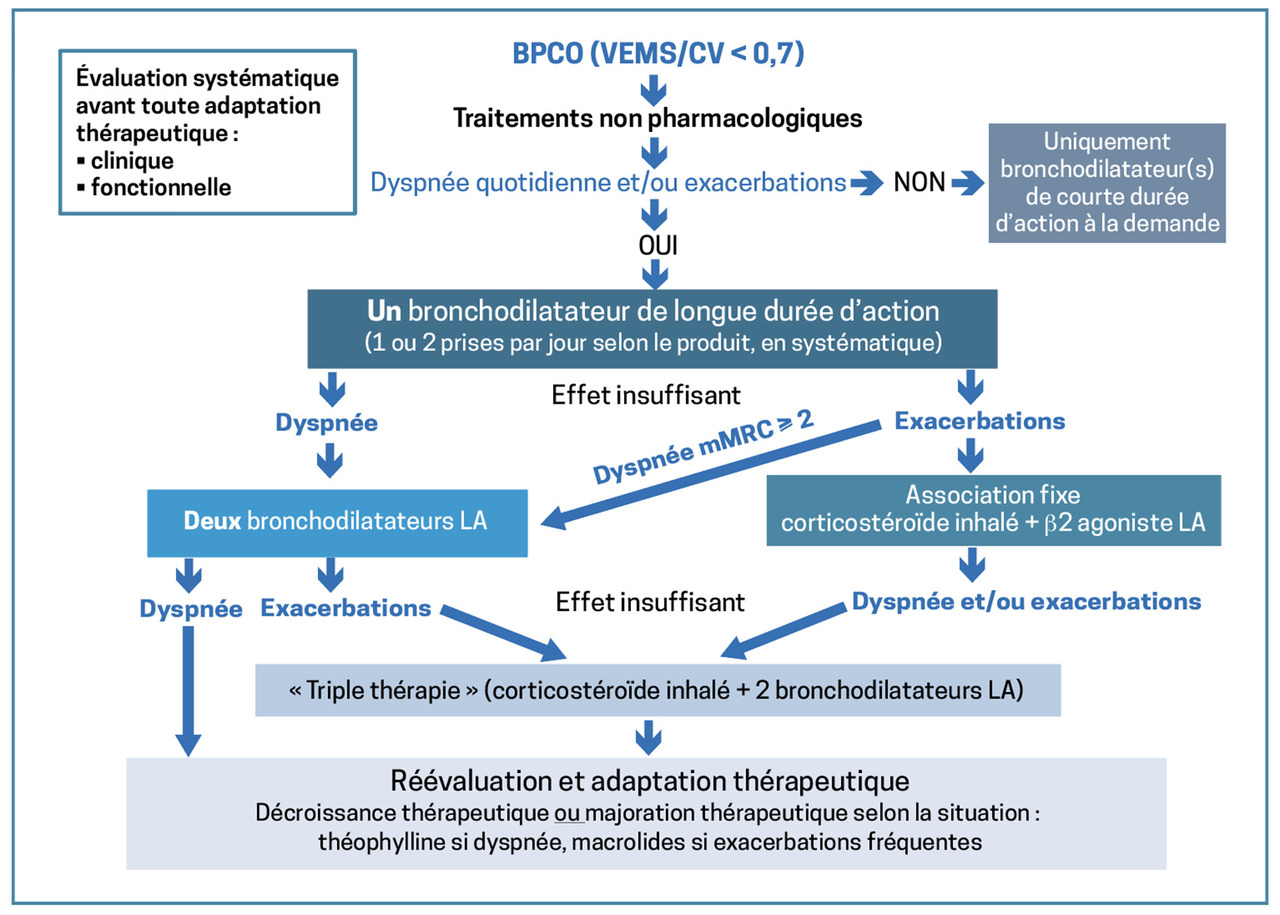
Selon les dernières recos de la SPLF (fig. 1) on dispose de 2 grands volets de traitements : pharmacologiques et non.
Traitements non pharmacologiques : sevrage du tabac et des toxiques inhalés +++, activité physique régulière, réadaptation respiratoire, perte de poids en cas de surpoids. Notons que l’activité physique régulière (4 h par semaine) et la réadaptation respiratoire faite assidument ont montré une efficacité significative sur la diminution de la mortalité. La vaccination est cruciale pour la prévention des exacerbations : on recommande celle contre la grippe, le Covid, le pneumocoque ; la vaccination anti-VRS chez les seniors est intéressante mais elle n’est pas remboursée pour le moment.
Concernant les traitements médicamenteux (fig. 1), le premier palier doit contenir des bronchodilatateurs de courte durée d’action. En cas de dyspnée quotidienne et/ou de profil dit « exacerbateur » – patient ayant fait au moins 2 exacerbations dans l’année ou un épisode requérant une hospitalisation –, on propose un bronchodilatateur de longue durée d’action : antimuscarinique (LAMA) ou β2 -agoniste (LABA). Si dyspnée d’exacerbation fréquente : une bithérapie est indiquée : LABA + LAMA ou LABA + corticostéroïdes inhalés (CSI).
Depuis peu, la trithérapie (CSI + deux bronchodilatateurs de longue durée d’action) peut être prescrite par les médecins généralistes (4 dispositifs commercialisés actuellement). Elle a l’avantage d’améliorer l’observance (même dispositif), mais avec l’inconvénient de ne pas pouvoir moduler les doses.
Quand ajouter un CSI au traitement bronchodilatateur ?
Compte tenu des effets secondaires des CSI (candidose, pneumopathies +++), la balance bénéfices/risques doit être évaluée à chaque prescription.
En faveur de l’ajout d’un CSI : notion d’hospitalisation(s) pour exacerbations, asthme associé, polynucléaires éosinophiles (PNE) ≥ 300/mm3. En défaveur : pneumonie à répétition, PNE < 100, notion d'infection à mycobactérie.
Ainsi, les indications de la trithérapie doivent rester limitées : échec de la bithérapie (exacerbations graves ou fréquentes) chez les patients ayant un profil proche de l’asthme et des PNE > 300.
Par ailleurs, un enjeu majeur est la désescalade : il faut envisager la décroissance/permutation thérapeutique en cas d’effets indésirables des corticostéroïdes, d’éosinophiles < 300 ou en l’absence d’exacerbation dans l’année.
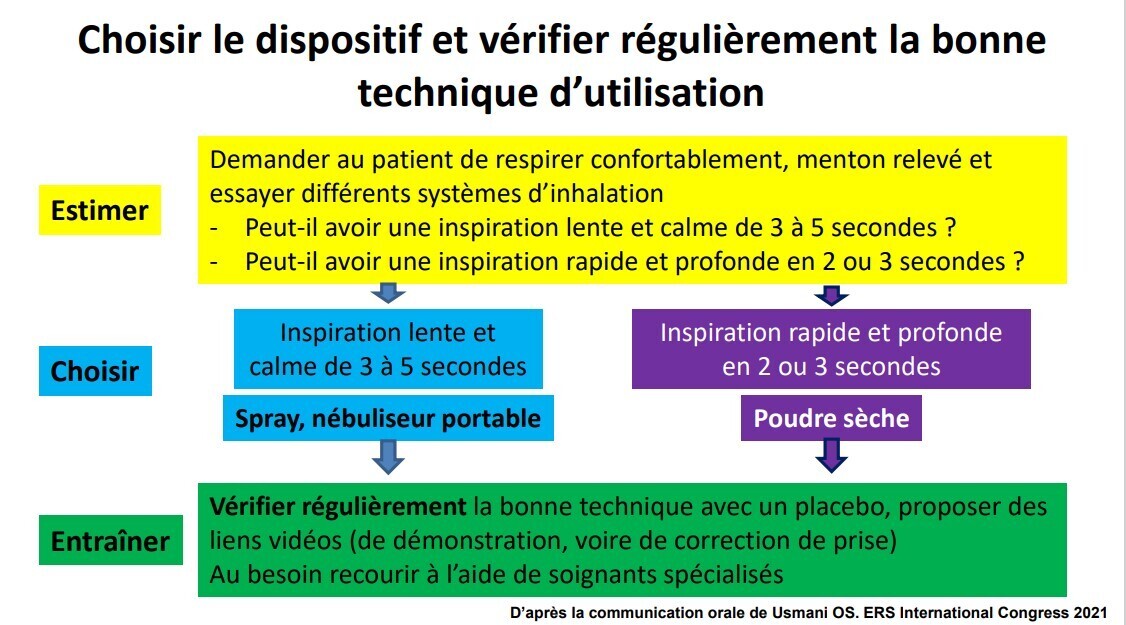
Dispositifs inhalés : comment s’y retrouver ?
On dispose de 3 grands types de dispositifs : aérosol-doseurs, poudres sèches, brumisateurs.
Le choix de l’inhalateur dépend surtout des capacités et de la préférence du patient (fig. 2). Il est essentiel de lui fournir les instructions et de démontrer comment réaliser correctement une inhalation, ainsi que de contrôler à chaque visite que le patient conserve une bonne technique de prise (oubli +++). On peut s’appuyer sur des vidéos sur internet (des systèmes d’IA pour suivre la bonne utilisation sont en développement). Les erreurs techniques sont très fréquentes : expiration incomplète après inhalation, pas d’apnée avant expiration post-inhalation…
Exacerbations : attention aux diagnostics différentiels
Il s’agit d’épisodes caractérisés par une aggravation de la dyspnée et/ou de la toux et de l’expectoration pendant moins de 14 jours, parfois accompagnés de polypnée et/ou de tachycardie, souvent associés à une augmentation des phénomènes inflammatoires locaux ou généraux, causés par une infection, la pollution ou d’autres agressions des voies aériennes.
Les recos GOLD 2023 considèrent que d’autres diagnostics (embolie pulmonaire, décompensation cardiaque, pneumonie, pneumothorax, etc.) parfois responsables d’aggravation des symptômes respiratoires sont des diagnostics différentiels.
La prise en charge des exacerbations repose sur les bronchodilatateurs, les corticoïdes per os (40 mg/j x 5 j), les antibiotiques en cas exportation purulente. La CRP pourrait être un marqueur pour limiter la prescription inutile d’antibiotiques, mais son utilisation n’est pas encore validée.
Grosbois JM. Réadaptation respiratoire des patients atteints de bronchopneumopathie chronique obstructive. Rev Prat 2023;73(10);1109-12.
D’Alessandro E. Prescription l'activité physique : indications spécifiques en fonction des pathologies. Rev Prat 2023;73(9);1006.
Le Guillou F. Vivre avec…une BPCO. Rev Prat 2018;68(5);529-30.
Dans cet article
- BPCO : une maladie complexe
- Quels facteurs de risque ?
- Quoi de neuf dans le diagnostic ?
- Faut-il faire d’autres examens outre la spirométrie et la radio ?
- Quelles nouveautés dans les traitements ?
- Quand ajouter un CSI au traitement bronchodilatateur ?
- Dispositifs inhalés : comment s’y retrouver ?
- Exacerbations : attention aux diagnostics différentiels