Cette maladie chronique caractérisée par une obstruction permanente des voies aériennes est responsable d’une morbi-mortalité signi- ficative dans notre pays et dans le monde. Malgré cela, elle est méconnue et/ou négligée, comme en témoigne une enquête récente.1
Très fréquente mais sous-estimée
La prévalence en France est évaluée entre 5 et 10 % de la population adulte de plus de 45 ans. Cette imprécision relative est la conséquence d’un sous-diagnostic, puisqu’on estime que jusqu’à 80 % des sujets atteints ignorent leur maladie. En effet, les symptômes étant aspécifiques, ils sont souvent négligés ou minimisés par les patients. Notons qu’il a été montré que ces individus non diagnostiqués ont un sur-risque d’exacerbation et de mortalité.
En 2014, selon l’InVS, cette pathologie était impliquée dans plus de 18 000 décès. Le taux de mortalité par BPCO (cause initiale) est de 13 pour 100 000 habitants et celui lié à cette affection (cause associée) est de 27,7 pour 100 000 habitants. Il existe une disparité selon les sexes : pour les hommes, ce dernier chiffre s’élève à 38,1 pour 100 000 habitants, en diminution depuis 2000 ; pour les femmes, à 18 pour 100 000 habitants (stable).
Toujours d’après l’InVS, en 2015, le nombre de séjours hospitaliers pour exacerbation de BPCO se situait entre 100 000 et 150 000 selon l’indicateur utilisé, soit un taux variant entre 15,9 et 24,9 pour 100 000 habitants, en augmentation constante depuis 2000 pour les 2 sexes (20,8 à 33,3 chez les hommes et 11,3 à 16,9 chez les femmes). Ces épisodes sont des événements majeurs dans l’histoire de la maladie et doivent donc systématiquement alerter. En effet, une étude québécoise a mis en évidence que la médiane de survie après une première exacerbation sévère, c’est-à-dire ayant nécessité une hospitalisation, était de 3,6 ans.
Par ailleurs, une disparité géographique est décrite : les régions les plus touchées sont les Hauts-de-France, le Grand-Est et la Réunion, où les taux moyens de mortalité et d’hospitalisation liés à la BPCO sont plus de 20 % supérieurs aux valeurs nationales (données 2013-2014).
Facteurs de risque
La BPCO est la conséquence de l’interaction entre une prédisposition génétique et l’exposition à des facteurs environnementaux. La seule maladie monogénique identifiée est le déficit en alpha-1 antitrypsine, en cause chez 1 % des malades seulement. Cependant, elle doit être évoquée et recherchée devant une forme précoce (avant 45 ans), notamment lorsque l’emphysème est prédominant et/ou les expositions environnementales (tabagisme en particulier) minimes, voire absentes. En effet, le patient doit bénéficier d’un conseil génétique et si besoin d’un traitement substitutif.
Le tabagisme (actif ou passif) est le facteur de risque principal, impliqué dans la survenue de 90 % des BCPO ; son impact est d’autant plus important qu’il débute tôt dans la vie et qu’il est prolongé dans le temps.
L’association à des expositions professionnelles, notamment industrielles et agricoles, est retrouvée dans environ 20 % des cas, mais leur identification ne donne que rarement droit à une reconnaissance en maladie professionnelle (tableaux du Régime général n° 90 en rapport avec l’inhalation de poussières textiles végétales, n° 91 du mineur de charbon et n° 94 du mineur de fer).
Le niveau de preuve de l’implication de la pollution atmosphérique (particules fines, NO2, SO2…) est faible en raison de nombreux facteurs confondants dans les études, rendant difficile la démonstration d’un lien de causalité direct. Cependant, la corrélation entre les pics de pollution et, d’une part, les hospitalisations pour exacerbations ; d’autre part, la mortalité des patients atteints de BPCO, suggère un impact significatif sur la physiopathologie de la maladie.
Diagnostics différentiels
Une toux ou des expectorations et/ou une dyspnée d’effort ou paroxystique, ne sont pas obligatoirement synonymes de BPCO et imposent un bilan étiologique précis.
La bronchite chronique, définie par une toux productive quotidienne durant au moins 3 mois par an, pendant au moins 2 années consécutives, concerne la moitié des fumeurs et peut être associée à une BPCO. Si aucun trouble ventilatoire obstructif (TVO) n’est détecté à la spirométrie (forme simple), cela exclut la BPCO. À ce jour, aucun traitement n’est efficace en dehors du sevrage tabagique et d’une activité physique régulière associée à un régime alimentaire équilibré.
À l’inverse, la BPCO n’est pas toujours accompagnée d’une bronchite chronique ; il faut rester attentif à d’autres symptômes comme la dyspnée d’effort ou la survenue de bronchites répétées chez un patient exposé à des toxiques.
L’asthme est une autre bronchopathie chronique très fréquente. Même s’il est classiquement considéré comme une maladie du sujet jeune, sa prévalence est de 6 % chez l’adulte ; il faut donc y penser systématiquement.
La variabilité des symptômes respiratoires au cours du temps et le caractère paroxystique des crises sont évocateurs, notamment s’il y a aussi des signes de rhinite allergique.
La distinction entre asthme et BPCO est indispensable et essentielle, la balance bénéfices-risques des classes de traitements inhalés étant très différente dans ces 2 pathologies.
Les dilatations des bronches, dont les étiologies sont multiples (mucoviscidose notamment) sont plus rares. Définies par un élargissement anormal du diamètre bronchique consécutif à la destruction des parois, elles s’accompagnent également d’un TVO non complètement réversible rendant la distinction avec une BPCO parfois difficile. Compte tenu de la colonisation fréquente par des pathogènes particuliers comme Pseudomonas aeruginosa, du risque accru d’hémoptysie, des spécificités de la prise en charge et des conséquences pour la famille de certaines maladies héréditaires, il est important de ne pas les méconnaître. En pratique, elles doivent être suspectées devant une bronchorrhée chronique (expectoration abondante de mucus > 50 mL/j, inconstante) et peuvent être mises en évidence sur une imagerie thoracique. Enfin, le diagnostic initial de BPCO peut être corrigé secondairement devant des atypies évolutives ou symptomatiques (exacerbations fréquentes, absence d’exposition significative à des toxiques inhalés, troubles de la fertilité…) justifiant d’adresser tout patient atypique ou non contrôlé par la prise en charge habituelle à un pneumologue pour réévaluation.
L’emphysème caractérisé par un élargissement anormal et permanent des espaces aériens distaux, avec destruction des parois alvéolaires, sans fibrose associée, se traduit radiologiquement par des hypodensités dans les parenchymes pulmonaires, voire des bulles… Fréquent dans la BPCO (mais inconstant), il peut toutefois exister en l’absence de toute obstruction bronchique objectivée à la spirométrie.
Ainsi, malgré la prévalence élevée de la BPCO, une démarche rigoureuse est indispensable afin d’éviter les diagnostics en excès ou erronés.
Quand y penser ?
Dans 3 circonstances particulièrement évocatrices :
– symptômes respiratoires tels qu’une toux, des expectorations chroniques ou une dyspnée ;
– facteurs de risque, notamment un tabagisme chronique et/ou des expositions professionnelles ou environnementales à des toxiques ;
– infections respiratoires basses à type de bronchites aiguës, surtout si répétées, traînantes, associées à un frein expiratoire ou des sibilants, ou sévères nécessitant une hospitalisation.
Ces patients doivent être adressés à un pneumologue pour évaluation et réalisation d’EFR.
Les études et la pratique montrent que la première consultation avec le spécialiste est souvent tardive, au stade déjà évolué, classiquement à la suite d’une hospitalisation pour exacerbation aiguë. Pourtant, l’interrogatoire révèle dans la majorité des cas des symptômes respiratoires préexistants et négligés depuis plusieurs années, la plupart des sujets considérant qu’il est normal de tousser et expectorer lorsque l’on fume.
Il est donc essentiel de les rechercher de façon systématique d’autant plus si le motif de la consultation est respiratoire. Une dyspnée d’effort doit aussi être identifiée, celle-ci étant souvent méconnue des patients qui modifient leurs habitudes sans s’en rendre compte. Ainsi, des adaptations comportementales comme le fait de ne plus prendre les escaliers mais l’ascenseur ou les escalators, ou encore de ne plus faire ses courses à pied mais en voiture doivent alerter.
Diagnostic : en 2 étapes
Par définition, il requiert une spirométrie mettant en évidence un TVO non complètement réversible après bronchodilatation.
La clinique est prise à défaut, surtout dans les stades légers et modérés. Inversement, les signes physiques de distension thoracique, d’expiration à lèvres pincées ou encore d’hypertrophie des muscles sterno-cléido-mastoïdiens sont tardifs.
La dyspnée est un très mauvais indicateur au niveau individuel : des patients ayant des obstructions légères à modérées peuvent souffrir de symptômes parfois graves (si déconditionnement et/ou comorbidités associées) ; d’autres, ayant une obstruction sévère, voire très sévère, sont dyspnéiques uniquement lors d’efforts importants (monter plusieurs étages), grâce à une adaptation cardiovasculaire et musculaire encore efficace.
Toutefois, la confirmation d’un TVO, c’est-à-dire d’un rapport volume maximal expiré la première seconde (VEMS) sur capacité vitale (CV) < 0,7 au cours d’une manœuvre d’expiration forcée, est compliquée à obtenir en pratique courante (formation à la technique ; réalisation de plusieurs mesures…).
Le diagnostic au cabinet de médecine générale est donc essentiellement probabiliste. L’identification de la meilleure façon de procéder en soins primaires a fait l’objet de nombreux travaux : les résultats sont mitigés, suggérant que la modalité optimale dépend du mode d’exercice et de ses contraintes d’une part, et de la population concernée d’autre part. Si la première étape est naturellement d’y penser (cf. les 3 situations ci-dessus), le praticien peut s’aider de l’autoquestionnaire court proposé par la HAS, disponible en ligne (encadré 1).2 Trois, voire 2, réponses positives doivent alerter et motiver une spirométrie.
L’emploi de mini-spiromètres (VEMS/VEM6 [= volume expiré au bout de 6 s] ; Piko-6) et de spiromètres est également en cours d’évaluation ; l’intérêt est d’authentifier plus précocement un TVO. Cependant, la proportion de généralistes formés qui les utilisent réellement au quotidien est très faible, ce qui témoigne de la difficulté d’intégrer ces outils dans la pratique. De plus, l’identification d’un TVO n’est pas toujours suivie d’une consultation avec un pneumologue, probablement en raison de difficultés d’accès.
La mise en place d’un dépistage organisé nécessite donc d’identifier une méthode compatible avec la médecine générale et de lever les freins à la prise en charge par le spécialiste.
En pratique, le diagnostic n’est donc certain qu’après 2 étapes : détection systématique des sujets à risque et confirmation par le pneumologue (par spirométrie et élimination des diagnostics différentiels).
Évaluer la sévérité
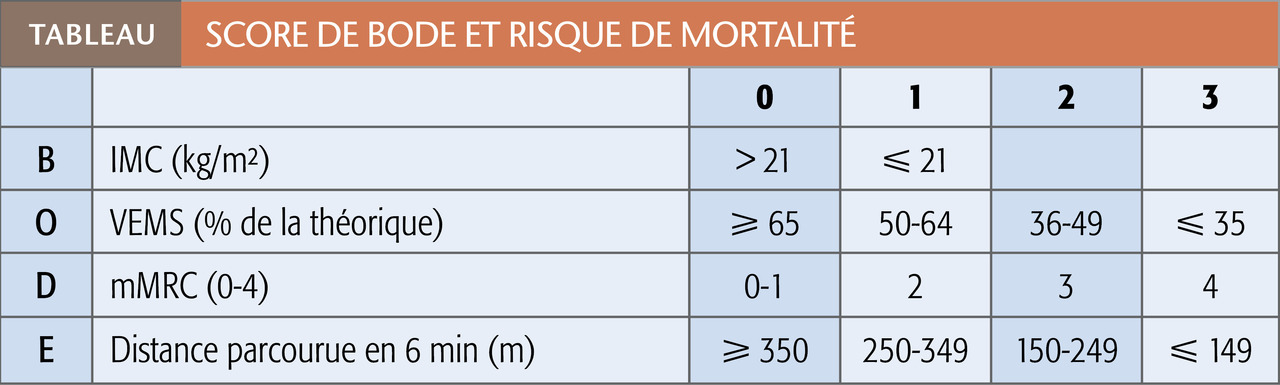
Longtemps, on l’a assimilée à la gravité de l’obstruction bronchique, quantifiée par la mesure du VEMS au cours d’une spirométrie. Si celle-ci a incontestablement une valeur pronostique, d’autres facteurs sont essentiels :
– l’état nutritionnel (indice de masse corporelle) ;
– la dyspnée (quantifiée par l’échelle mMRC) ;
– la tolérance à l’exercice évaluée par la distance parcourue lors d’un test de marche de 6 minutes
Ces éléments sont pris en compte dans le score composite de BODE (tableau).
L’évaluation du retentissement sur la qualité de vie par un questionnaire comme le CAT (COPDAssessment Test) fait également partie des recommandations de bonne pratique.
Rechercher et traiter les comorbidités (très fréquentes) est crucial et devrait être systématique au cours du suivi.
Sur le plan cardiovasculaire : HTA, cardiopathies ischémiques mais aussi artériopathie périphérique (se manifestant par une claudication intermittente) et troubles de l’érection, souvent non évoqués par les patients si non abordés par le praticien. La fréquence et la gravité potentielle de ces atteintes justifient de réaliser un bilan cardiovasculaire au diagnostic à répéter ensuite.
Les cancers bronchopulmonaires sont également plus fréquents chez ces malades. Les règles de dépistage sont les mêmes que celles en population générale. Si certaines études suggèrent un bénéfice du repérage systématique par un scanner thoracique faible dose dans une population très ciblée, la HAS ne le recommande pas pour le moment en raison des nombreux faux positifs et en l’attente d’autres données, .
D’autres comorbidités, tout aussi fréquentes, ont un impact significatif : dénutrition, amyotrophie, ostéoporose, troubles respiratoires du sommeil ou métaboliques, anxiété et dépression.
Les exacerbations sont des événements déterminants dans l’évolution de la maladie, la morbi- mortalité augmentant avec leur nombre et/ou leur sévérité. Il s’agit d’épisodes aigus caractérisés par une majoration des symptômes respiratoires (dyspnée, toux, expectoration) au-delà des variations quotidiennes et conduisant à une modification thérapeutique. Elles sont classées comme légères ou modérées si la prise en charge est ambulatoire, sévères si elles imposent une hospitalisation. En raison du caractère aspécifique des symptômes, le diagnostic implique d’avoir éliminé une pneumopathie aiguë, une insuffisance cardiaque, une embolie pulmonaire ou un pneumothorax. Leur prise en charge a fait l’objet de recommandations récentes de la Société de pneumologie de langue française (SPLF), non abordées dans ce dossier.
Prise en charge
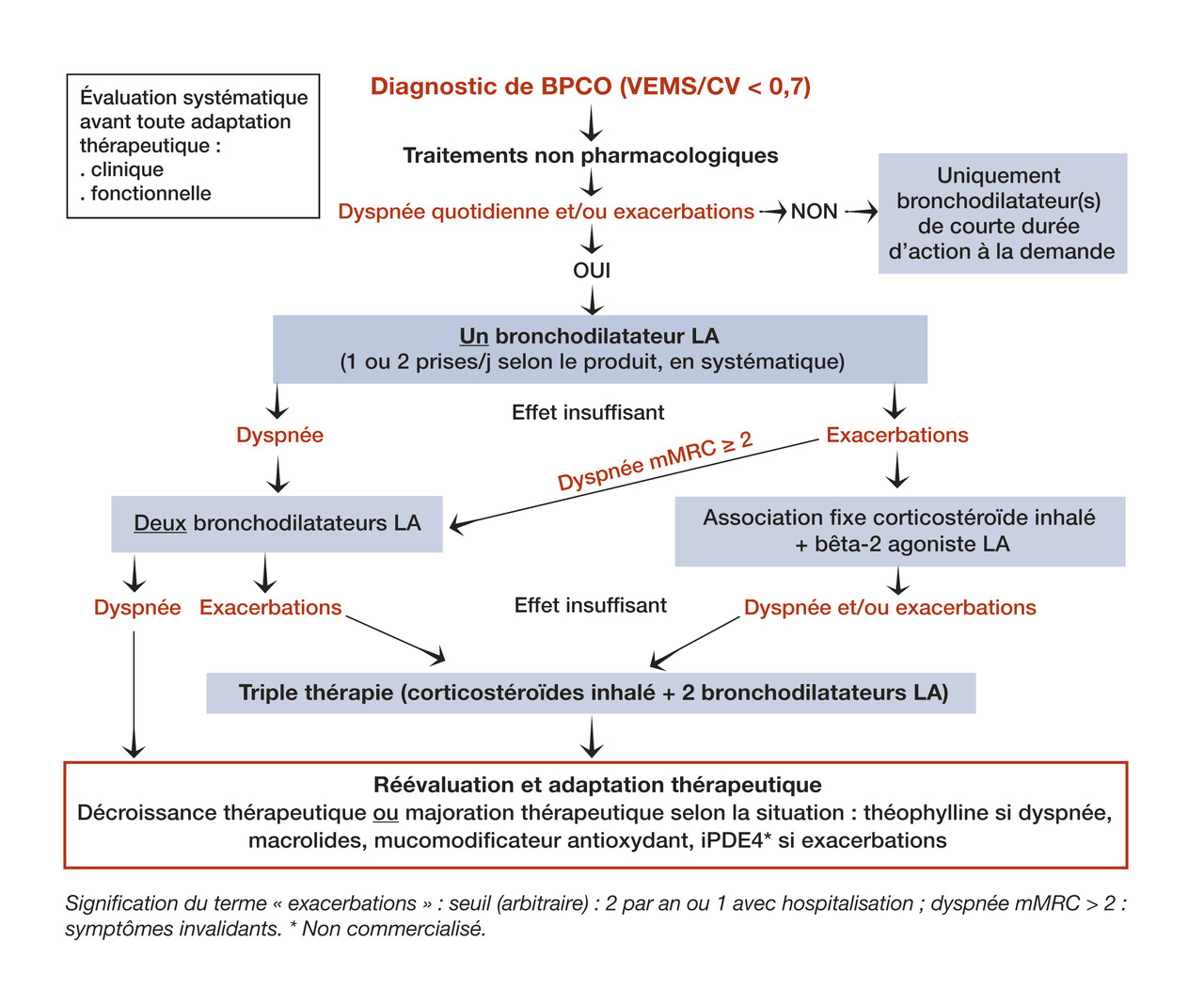
La stratégie thérapeutique4 (fig. 1) ne se discute qu’une fois le diagnostic confirmé par les EFR.
Non médicamenteuse
Essentielle, elle doit être proposée à tout patient atteint de BPCO quel que soit son stade, et systématiquement réévaluée avant d’affirmer l’inefficacité d’un traitement et d’accroître la pression thérapeutique.
Elle repose sur le maintien d’un bon état général par la pratique d’une activité physique régulière et un régime alimentaire équilibré. Elle est complétée par la prise en charge des comorbidités.
Le sevrage tabagique est un objectif primordial dans le traitement et la prévention primaire (ou secondaire) des comorbidités. Il doit être réabordé à chaque consultation en adaptant son discours aux éventuelles résistances du patient pour ne pas le rebuter définitivement. Lorsque ce dernier adhère au projet, il faut lui proposer une aide (substituts nicotiniques, désormais remboursés ; consultation avec un tabacologue). Après l’arrêt du tabac, il faut rechercher un syndrome de manque et surveiller une reprise de la consommation (qui est fréquente) pour adapter la prise en charge et parvenir à terme à un sevrage complet et définitif.
En cas de handicap significatif (encadré 2), une réhabilitation respiratoire doit être systématiquement discutée car les bénéfices sont nombreux, sur les symptômes, la tolérance à l’exercice, la qualité de vie et la consommation de soins.
Pharmacologique
La prévention des exacerbations, essentielle, repose sur le respect des recommandations officielles : vaccination contre la grippe (tous les ans) et contre le pneumocoque tous les 5 ans.
Le traitement de 1re intention repose sur les bronchodilatateurs (anticholinergiques et/ou β-2 mimétiques) : BDCA inhalés à la demande si les symptômes (dyspnée) sont épisodiques et peu intenses. BDLA en traitement de fond dans les autres cas. Ces derniers doivent être débutés en monothérapie lorsque le patient a une dyspnée d’effort persistante et/ou des exacerbations répétées (au moins 2 fois dans l’année ou 1 ayant nécessité une hospitalisation) [fig. 1].
Les bithérapies ont une place en 2e intention (association de 2 BDLA ou BDLA + corticostéroïdes inhalés, CSI). Contrairement à l’asthme où ils sont prescrits en 1re intention, les CSI dans la BPCO sont associés à un sur-risque de pneumopathies infectieuses. Ils sont indiqués chez patients ayant un rapport bénéfices-risques favorable, c’est-à-dire continuant à faire des exacerbations malgré une prise en charge non médicamenteuse optimale et par bronchodilatateurs inhalés.
En pratique, l’adaptation thérapeutique est fondée sur le contrôle des symptômes. Chez les patients ayant comme manifestation clinique principale une dyspnée, l’association de 2 BDLA est proposée (encadré 3).
Chez les malades ayant des exacerbations (au moins 2 dans l’année ou 1 seule mais grave), on préfère l’association BDLA + CSI. Si en outre le patient a une dyspnée chronique significative (il marche plus lentement que les personnes de son âge ou doit s’arrêter pour respirer lorsqu’il avance à son propre rythme sur terrain plat – stade 2 de l’échelle d’évaluation mMRC), une bithérapie de BDLA est préférable.
Il faut tenir compte autant que possible des indications d’AMM concernant le seuil de VEMS, exprimé en % de la valeur prédite : < 50 % pour béclométasone + formotérol ; < 60 % (pré-bronchodilatateur) pour fluticasone propionate + salmétérol ; < 70 % (post-bronchodilatateur) pour fluticasone furoate + vilantérol et budésonide + formotérol.
La bonne utilisation des traitements inhalés implique l’éducation des patients à la technique de prise, qui varie d’un système à l’autre (on peut s’aider par des vidéos proposées par la SPLF).5 Chaque erreur diminue, voire annule, la dose de médicament effectivement délivrée aux poumons (et donc son efficacité) et augmente le risque d’exacerbation. Si plusieurs molécules sont nécessaires, il faut essayer de simplifier la prise en proposant des associations fixes (cf. guide Zéphir de la SPLF, accessible à tout soignant).6
Ainsi, l’intensification du traitement ne peut s’envisager qu’après vérification que l’effet jugé insuffisant n’est pas lié à une utilisation erronée du dispositif, une mauvaise observance, un diag- nostic différentiel, une comorbidité ignorée ou prise en charge incomplète (y compris par les mesures non médicamenteuses).
La reconnaissance en affection de longue durée (ALD 14) concerne les patients ayant à l’état stable une pression partielle en oxygène mesurée en artériel (PaO2) < 60 mmHg, une PaCO2 > 50 mmHg et/ou un VEMS < 50 % des valeurs théoriques. L’oxygénothérapie est indiquée lorsque la PaO2 diurne en air ambiant à l’état stable (sur 2 mesures à 3 semaines d’intervalle) est < 55 mmHg ou comprise entre 56 et 59 mmHg si le patient a en plus une polyglobulie (hématocrite > 55 %), des désaturations nocturnes non liées à des apnées du sommeil et/ou des signes cliniques de cœur pulmonaire chronique et/ou une hypertension artérielle pulmonaire confirmée.
L’indication de la ventilation non invasive dans les hypercapnies chroniques et des méthodes de réduction d’emphysème, endobronchiques ou chirurgicales, voire de transplantation pulmonaire, relève du pneumologue.
Suivi : au cas par cas
La diversité des patients et des comorbidités associées implique des interactions étroites entre le médecin traitant et le pneumologue pour adapter la fréquence du suivi à chaque patient. Quelques règles générales sont proposées : contrôler le malade 1 à 3 mois après chaque changement thérapeutique puis tous les 3 à 12 mois, avec réévaluation de la fonction respiratoire au moins 1 fois par an.
Il est préférable de l’adresser à nouveau à un/son pneumologue si les symptômes respiratoires n’évoluent pas favorablement ou restent handicapants, s’il a des exacerbations, ou s’il bénéficie d’une corticothérapie inhalée (pour réévaluer le rapport bénéfices-risques).
aitement pharmacologique repose sur les bronchodila- tateurs, associés dans certains cas à une corticothérapie inhalée, après évaluation de la balance bénéfices-risques.
2. Réhabilitation respiratoire : encore insuffisamment prescrite
Elle est indiquée en cas de dyspnée significative (lorsque le patient doit marcher plus lentement ou s’arrêter), intolérance à l’effort ou diminution des activités quotidiennes. Ses 2 composantes principales sont le réentraînement à l’exercice, avec reprise d’activités physiques adaptées et l’éducation thérapeutique.
Le médecin généraliste joue un rôle clé pour maintenir les acquis : continuer l’activité physique (vélo, marche, escaliers, 3 à 5 fois par semaine pendant 30 à 45 minutes), poursuivre l’éducation thérapeutique.
Principales contre-indications : état respiratoire instable, pathologies cardiovasculaires interdisant le réentraînement à l’effort (épreuve d’effort préalable nécessaire).
3. Un arsenal thérapeutique bien fourni !
ß-2 mimétiques de courte durée d’action (CA), à la demande :
- salbultamol 100 μg/dose (Ventoline et génériques), 1 à 2 doses, ne pas dépasser 8 bouffées/j ;
- terbutaline 500 μg/dose (Bricanyl et génériques), 1 à 2 doses, pas plus de 8 x/j.
Anticholinergique CA, à la demande :
- ipratropium 20 μg/dose (Atrovent et génériques), 1 à 2 doses, 2 à 4 x/j.
ß-2 mimétiques de longue durée d’action (LA) en traitement de fond :
- salmétérol 50 μg/dose (Serevent et génériques), 1 dose 2 x/j ;
- ormotérol 12 μg/dose (Asmelor et génériques, Foradil ou Formoair), 1 dose 2 x/j ;
- indacatérol 150 à 300 μg/dose (Onbrez Breezhaler), 1 dose/j ;
- olodatérol 2,5 μg/dose (Striverdi Respimat), 2 doses 1 x/j.
Anticholinergique LA en traitement de fond :
- tiotropium 18 μg/dose (Spiriva), 1 dose/j ou Spiriva Respimat 2 doses de 2,5 μg en 1 prise/j ;
- glycopyrronium bromure, 63 μg/dose (Seebri Breezhaler), 1 dose/j ;
- uméclidinium 55 μg/dose (Incruse), 1 dose/j.
- indacatérol 85 μg et glycopyrronium 43 μg/dose (Ultibro Breezhaler), 1 dose/j ;
- uméclidinium et vilantérol 55/22 μg (Anoro Ellipta, Laventair Ellipta), 1 dose/j ;
- tiotropium + olodaterol 2,5/2,5 µg (Spiolto Respimat), 2 doses en 1 prise/j
- ß-2 mimétique LA et corticoïdes inhalés: ü budésonide + formotérol, 400/12 μg/dose (Symbicort Turbu- haler) ; 320/9 μg/dose (DuoResp Spiromax, Gibiter Easyhaler), 1 dose 2 x/j ; 160/4,5 (Symbicort Rapidhaler) 2 bouffées 2/jü fluticasone + salmétérol, 500/50 μg/dose (Seretide diskus), 1 dose 2 x/j ;
- béclométasone + formotérol, 100/6 μg/dose (Formodual, Innovair), 1-2 doses 2 x/j ;
- fluticasone furoate + vilantérol, 92/22 μg (Relvar Ellipta, Revinty Ellipta), 1 dose/j.
Trithérapie ß-2 mimétique LA, anticholinergique LA et corticoïdes inhalés :
- furoate de fluticasone, uméclidinium et vilantérol 92/55/22 μg (Elebrato Ellipta, Trelegy Ellipta), 1 dose/j ;
- dipropionate de béclométasone/fumarate de formotérol/glycopyrronium 87/5/9 μg/dose (Trimbow), 2 prises matin et soir.
1. Delmas MC, Pasquereau A, Roche N, Andler R, Richard JB; groupe Baromètre santé 2017. Connaissance de la bronchopneumopathie chronique obstructive (BPCO) en France : Baromètre santé 2017. BEH 2018 ;n° 35-36 :703-
2. HAS. BPCO : 3 outils pour améliorer le parcours de soins des patients. Avril 2016, actualisation novembre 2018. https://bit.ly/2zjWHfx
3. Jouneau S, Dres M, Guerder A, et al. Prise en charge des exacerbations de la bronchopneumopathie chronique obstructive (BPCO). Recommandations de la Société de pneumologie de langue française (texte court). Rev Mal Respir 2017;34:282-322.
4. Zysman M, Chabot F, Devillier P, et al. Optimisation du traitement médicamenteux des patients atteints de bronchopneumopathie chronique obstructive en état stable. Propositions de la Société de pneumologie de langue française. Rev Mal Respir 2016;33:911-36.
5. Guide Zéphir. Les thérapeutiques inhalées de l’asthme et de la BPCO chez l’adulte. https://splf.fr/videos-zephir/
6. Guide Zéphir. Guide des thérapeutiques inhalées dans l’asthme et la BPCO chez l’adulte. http://www.guidezephir.fr

 Encadrés
Encadrés