Une multitude de facteurs – héréditaires, environnementaux, liés au mode de vie – influent sur le risque de cancer colorectal. Au vu des dernières études, les connaissances sur leur impact et leur part respective ouvrent des opportunités en matière de prévention primaire, et ont des conséquences sur la stratégie de dépistage.
D’après : Denis B. Facteurs de risque et de protection du cancer colorectal. Rev Prat 2022;72(8):889-7.
Avec plus de 43 000 nouveaux cas et 17 000 décès en 2018 en France, le cancer colorectal (CCR) est le 3e cancer le plus fréquent et la 2e cause de mortalité par cancer.1 Bon nombre de ces CCR et de ces décès sont évitables. L’hérédité joue un rôle moindre que l’environnement et les comportements dans la genèse des CCR : 9 à 40 % d’entre eux sont attribués à des facteurs héréditaires, alors que la moitié sont liés à des facteurs de risque environnementaux et comportementaux modifiables associés au mode de vie occidental.2,3
Incidence et mortalité en France
À l’échelle mondiale, la France est, à l’instar de tous les pays riches, un pays à risque élevé de CCR. À l’échelle européenne, elle se situe dans la moyenne, les incidences les plus fortes étant observées en Europe centrale, orientale et septentrionale. Bien que notre pays ait été l’un des tout premiers à déployer sur tout son territoire national un programme de dépistage organisé (DO) dès 2009, l’incidence du CCR reste stable chez la femme et ébauche une baisse chez l’homme depuis 2005 (- 1,4 % par an entre 2010 et 2018).1 Mais en raison du vieillissement de la population, le nombre de nouveaux cas ne cesse d’augmenter (+ 1,5 % par an entre 1990 et 2018).
Au contraire, la mortalité par CCR diminue (- 1,6 % par an entre 1990 et 2018), principalement grâce aux progrès dans la prise en charge. Le taux de survie nette standardisée à cinq ans s’améliore et atteint 63 % chez les personnes diagnostiquées entre 2010 et 2015, parmi les meilleurs d’Europe.11 Malgré tout, le CCR reste un cancer au pronostic péjoratif en comparaison aux autres cancers faisant l’objet d’un dépistage, organisé ou individuel : taux de survie nette standardisée à cinq ans de 88 % pour le sein, 63 % pour le col de l’utérus, et 93 % pour la prostate.11
Facteurs de risque non modifiables
L’âge est un des facteurs de risque les plus forts de CCR, même si on assiste à une augmentation significative et relativement ubiquitaire d’incidence des CCR chez les moins de 50 ans. L’incidence est plus élevée chez l’homme que chez la femme, la différence apparaissant après 50 ans : 1,4 fois plus, en France, en 2018.1
Un antécédent personnel de polype adénomateux était considéré comme synonyme de risque élevé de CCR, relevant d’une surveillance coloscopique « à vie ».4, 5Cette notion est caduque. De nombreuses études ont démontré qu’une personne ayant un ou deux adénome(s) mesurant moins de 10 mm en dysplasie de bas grade réséqué(s) lors d’une coloscopie a un risque faible de CCR, inférieur à celui de la population générale, du fait de la réduction de risque conférée par la coloscopie et la polypectomie.6 En revanche, un antécédent personnel de CCR ou d’autres polypes (autres qu’hyperplasiques) confère toujours un risque élevé de CCR. Les recommandations professionnelles françaises ont été récemment actualisées en conséquence.6, 10
Certaines maladies sont associées à un sur-risque de CCR : maladie inflammatoire chronique intestinale (MICI), diabète de type 2, acromégalie, mucoviscidose, antécédent de cancer pédiatrique, radiothérapie, transplantation d’organe, urétéro-sigmoïdostomie, cancer du sein avant 50 ans.
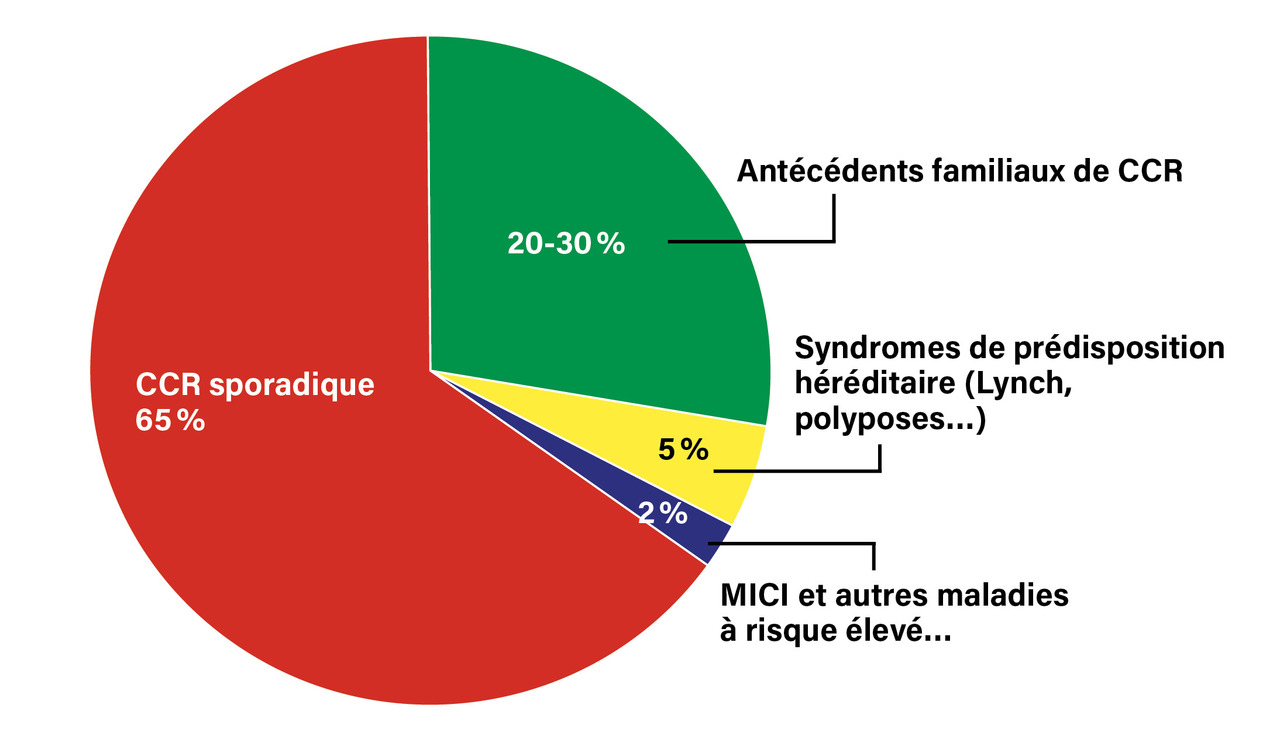
Les syndromes de prédisposition héréditaire au CCR (syndrome Lynch, cancer colorectal familial de type X, polyposes…) sont responsables de moins de 5 % des CCR (figure).3 Ils sont liés à des mutations constitutionnelles (ou germinales) de gènes, recherchées actuellement par séquençage de nouvelle génération : APC, MUTYH, POLE/POLD1, MLH1, MSH2, MSH6, PMS2, EPCAM, PTEN, STK11, BMPR1A, SMAD4, et CDH1.13Plusieurs polyposes, variant selon le type histologique des polypes, confèrent un risque très élevé de CCR, de 15 à 100 % sur la vie entière (tableau 1).13-16 Un endoscopiste doit référer à une consultation d’oncogénétique tout patient chez lequel il diagnostique, au cours d’une coloscopie ou de plusieurs coloscopies successives, au moins 10 à 15 adénomes selon les recommandations, au moins 5 polypes festonnés en amont du rectum, ou au moins 2 polypes hamartomateux.14, 16 La polypose festonnée est la plus fréquente, sans signature génétique à ce jour. Outre les polyposes classiques liées à une mutation du gène APC ou à une mutation bi-allélique du gène MUTYH, plusieurs nouvelles entités ont été décrites (mutations des gènes POLE/POLD1, AXIN2, NTHL1 et MSH3). Selon le type, une surveillance gastroduodénale, ampullaire, ou grêlique est indiquée en sus de la surveillance colorectale. Une (procto)colectomie prophylactique est proposée en réunion de concertation pluridisciplinaire dès que la polypose dépasse les possibilités de contrôle endoscopique.
Les antécédents familiaux de néoplasme colorectal (en l’absence de gène de syndrome de prédisposition héréditaire au CCR connu) confèrent un sur-risque de CCR corrélé au nombre, à la proximité, et à l’âge du/des parent(s) atteint(s), sans qu’il soit possible de définir de seuils précis.7-9 Plusieurs études récentes démontrent que ce sur-risque est relativement faible, bien moindre que celui conféré par le sexe masculin ou le tabac.7- 9,17,18 Il était surévalué dans les recommandations françaises de 2013, devenues obsolètes.4,5 Les recommandations européennes de 2019 restreignent la notion de risque élevé significatif (multiplié par 3) lié à des antécédents familiaux à deux situations : un parent au 1er degré atteint de CCR avant 50 ans et deux parents au 1er degré atteints de CCR quel que soit l’âge.9 Les antécédents familiaux de CCR ne font somme toute qu’avancer de cinq à quinze ans l’âge auquel le risque moyen est atteint.19
Facteurs de risque modifiables
La moitié des CCR pourraient être évités en modifiant l’exposition à des facteurs de risque environnementaux ou comportementaux (tableau 2).2
Alimentation
Les viandes transformées (charcuteries, viandes salées, séchées, fumées, en conserve) et rouges (hors volailles) sont classées comme agents respectivement « cancérogènes » et « probablement cancérogènes » par le CIRC, avec une relation dose-effet.3,12,20
L’influence du mode de cuisson de la viande rouge n’est pas formellement démontrée : les données expérimentales et épidémiologiques suggèrent un sur-risque de CCR associé à la viande « bien cuite » par le biais de la formation d’amines hétérocycliques, sans parler du sur-risque lié aux hydrocarbures aromatiques polycycliques issus d’une cuisson type barbecue. Les charcuteries (principalement jambon cuit, saucisses et saucissons cuits) sont la principale source (de 45 à 65 %) de nitrites alimentaires.21 Ils sont utilisés comme additifs alimentaires « conservateurs » pour leurs propriétés antioxydantes et antimicrobiennes et pour leur effet sur la couleur des produits. Classés « probablement cancérogènes » pour l’homme par le CIRC, les nitrites ingérés conduisent à la formation de composés endogènes nitrosés, notamment les nitrosamines.
Un rapport de l’Anses (juillet 2022) confirme l’association entre exposition aux nitrates et/ou nitrites via la viande transformée et le risque de CCR.21 Il recommande de limiter l’utilisation des additifs nitrés dans les viandes transformées et de limiter leur consommation à 150 g par semaine.21
La consommation d’aliments ultratransformés est associée à un risque accru de cancers et notamment de cancers du sein.22 L’association avec le CCR n’est pas formellement démontrée, bien qu’une étude espagnole récente suggère un sur-risque de CCR (OR = 1,11 pour une augmentation de consommation de 10 %).23
Par ailleurs, surpoids et obésité sont associés à une augmentation du risque de CCR.3,12,20
Alcool et tabac
L’alcool est classé cancérogène par le CIRC, avec une relation dose-effet.20 Si toutes les études démontrent une augmentation significative du sur-risque de CCR chez les buveurs de plus de deux verres par jour, l’effet d’une consommation légère à modérée reste controversé.24
Le tabagisme augmente de 15 à 20 % le risque de CCR avec une relation dose-dépendante, tant sur la quantité que sur la durée.25 Le sur-risque diminue après sevrage mais persiste durant environ 25 ans.
Expositions professionnelles, pesticides…
Globalement, le sur-risque de CCR lié à une exposition professionnelle est relativement faible, inférieur à celui lié au tabac et à l’alcool.22 Certains secteurs professionnels semblent plus à risque : industries du cuir, du plastique, du caoutchouc, du fer et de l’acier, exposition à l’amiante26 (SIR évalué à 1,07 et 1,16 dans deux méta-analyses récentes).27 La littérature concernant les pesticides est très riche et ses résultats contradictoires. La dernière revue de littérature portant sur 139 articles et 56 pesticides retient un sur-risque significatif de CCR associé aux produits suivants : aldicarbe, dicamba, fonofos, S-éthyl-dipropylthiocarbamate (EPTC), imazéthapyre, terbufos, trifluraline, toxaphène, pendiméthaline, dieldrine et aldrine, chlorpyrifos, carbaryl, heptachlore et acétochlore.28 L’usage de certains (pas tous) de ces produits est interdit en Europe et/ou aux États-Unis. En raison de leurs grandes difficultés méthodologiques, la plupart des études épidémiologiques échouent cependant à démontrer un sur-risque de CCR chez les personnes exposées aux pesticides en général, professionnellement ou non. Le CCR n’est pas cité dans les expertises Pesticides, effets sur la santé de l’Inserm de 2013 et 2021.
La pollution de l’air et de l’eau est associée à un sur-risque de CCR. Les particules fines en suspension dans l’air sont classées agents cancérogènes certains par le CIRC, l’association avec le cancer du poumon étant la mieux établie.2 Une méta-analyse récente démontre l’association entre pollution atmosphérique évaluée par le taux de particules et risque de CCR (RR = 1,35).29
De même, le rapport de l’Anses confirme l’association entre taux élevés de nitrates dans l’eau de boisson et risque de CCR.21 Ces nitrates sont dus à la contamination de l’eau par des activités anthropiques (engrais azotés, épandage de lisiers, rejets d’origine urbaine ou industrielle) et représentent 20 à 25 % de l’exposition totale aux nitrates.
Le CIRC évalue à 1,2 % la proportion de CCR attribuable aux radiations ionisantes d’origine médicale à visée diagnostique (radiologie et médecine nucléaire).2
Statut socio-économique
Le CCR ne fait pas partie des cancers les plus influencés par le niveau socio-économique tels que ceux du poumon, des voies aérodigestives supérieures et du col de l’utérus.2 Néanmoins, le pronostic est plus péjoratif et la mortalité par CCR augmentée chez les personnes défavorisées (revenus, éducation, isolement…).30 Concernant son incidence, les données sont plus hétérogènes : une augmentation d’incidence du CCR est observée chez les personnes défavorisées en Amérique du Nord, pas en Europe.30
Facteurs protecteurs
Les aliments riches en fibres (céréales complètes, légumes et fruits) réduisent le risque de CCR, de même que les produits laitiers (lait d’origine animale exclusivement, yaourts, fromages, à l’exception du beurre, de la crème fraîche et des desserts lactés) [tableau 2].3,12,20
L’activité physique diminue le risque : une méta-analyse a montré une diminution de 19 % du risque de CCR pour les niveaux d’activité physique les plus élevés par rapport aux niveaux les plus faibles.
Intérêt des médicaments/compléments alimentaires ?
La plupart s’avèrent inefficaces et/ou toxiques : calcium, vitamines dont vitamine D et acide folique, statines, AINS…31, 32 De même, le traitement hormonal substitutif de la ménopause réduit de 10 à 40 % le risque de CCR mais au prix d’une augmentation des risques de cancer mammaire et d’accident thromboembolique et cardiovasculaire.12 Certains agents réduisent le risque de CCR dans des groupes à risque spécifiques tels que la metformine en cas de diabète de type 2 et les amino-salicylés en cas de MICI colique, la prise d’aspirine réduit le risque d’adénome, d’adénome avancé, de CCR (de 20 à 40 %) et de décès par CCR. Cet effet protecteur ne serait observé qu’après dix ans et ne serait que suspensif. Il serait observé dès la dose de 75 mg/j avec une relation dose-effet jusqu’à 325 mg/j. Cependant, cette relation dose-effet est aussi observée pour le risque de saignement digestif et intracrânien. Actuellement, la prise d’aspirine est recommandée aux États-Unis dans trois situations : à faible dose pour la prévention du CCR chez les personnes à risque moyen ayant un risque d’accident cardiovasculaire supérieur ou égal à 10 % à dix ans, âgées de moins de 70 ans et ayant une espérance de vie de plus de dix ans et sans risque élevé de saignement ; en cas de syndrome de Lynch ; chez les personnes ayant un antécédent personnel de CCR (prévention tertiaire).32 Plusieurs questions restent en suspens, et font l’objet d’études en cours : dose et durée optimales, population cible, balance bénéfices-risques. Il est donc prématuré d’utiliser l’aspirine en prévention primaire du CCR hors de ces cas particuliers.
Pour mémoire, aucun agent n’a démontré son efficacité pour retarder le recours à la (procto)colectomie prophylactique ou contrôler les polypes restant après chirurgie en cas de polypose adénomateuse familiale (sulindac, célécoxib, aspirine…).
Le dépistage est-il vraiment efficace ?
Un des principaux facteurs de risque du CCR est l’absence de recours au dépistage. La plupart des modèles démontrent, à condition d’une adhésion théorique idéale de 100 %, l’équivalence des stratégies de dépistage par TIF, recto-sigmoïdoscopie et coloscopie en matière de réduction de mortalité par CCR.18 En revanche, les stratégies de dépistage endoscopique, recto-sigmoïdoscopique et coloscopique offrent une réduction d’incidence du CCR supérieure à celle du TIF. Les programmes de dépistage fondés sur le TIF (OC Sensor au seuil de 20 µg/g) réduisent la mortalité par CCR de 40 à 62 % entre participants et non participants et de 10 à 36 % entre invités et non invités, et réduisent l’incidence des CCR de 34 % entre participants et non participants et de 10 à 28 % entre invités et non invités.18 Enfin, le dépistage par TIF est la stratégie la plus rentable en matière de coût/efficacité, y compris avec un taux de participation de 30 %.18
Si le dépistage s’avère finalement le moyen le plus efficient de réduire le risque de CCR et de décès par CCR, encore faut-il pouvoir évaluer précisément le niveau de risque de CCR pour proposer à chacun un dépistage personnalisé.
À retenir
Environnement et comportement jouent un rôle plus important que l’hérédité dans la carcinogenèse colorectale. La part des CCR attribuable à une exposition professionnelle, la pollution ou un statut socio-économique défavorable est faible (mais pas nulle), bien moindre que pour le cancer du poumon. La moitié au moins des CCR sont liés à des facteurs de risque modifiables associés au mode de vie occidental tels que sédentarité, malbouffe et obésité. On ne peut que regretter la relative impuissance des systèmes politiques, sanitaires et sociaux face à la puissance de l’industrie agroalimentaire et de ses lobbies, y compris ceux du tabac et de l’alcool, pour mettre en œuvre une politique de prévention primaire du CCR.
Les recommandations hygiénodiététiques destinées à la prévention primaire du CCR n’ont rien de spécifique : pratique d’une activité physique (au moins 30 minutes par jour), maintien d’un indice de masse corporelle entre 18 et 25 kg/m2, limitation des viandes rouges (500 g par semaine) et charcuteries (150 g par semaine), augmentation des fibres alimentaires et produits laitiers, réduction de la consommation d’alcool (maximum 2 verres par jour, pas tous les jours) et éviction du tabac.20 Il est prématuré d’utiliser l’aspirine en prévention primaire du CCR en dehors du syndrome de Lynch et d’un risque cardiovasculaire significatif associé.
1. Defossez G, Le Guyader-Peyrou S, Uhry Z, et al. Estimations nationales de l’incidence et de la mortalité par cancer en France métropolitaine entre 1990 et 2018. Volume 1 Tumeurs solides. 2019;92-107.
2. Centre international de recherche sur le cancer. Les cancers attribuables au mode de vie et à l’environnement en France métropolitaine. 2018.
3. Keum N, Giovannucci E. Global burden of colorectal cancer: emerging trends, risk factors and prevention strategies. Nat Rev Gastroenterol Hepatol 2019;16:713-32.
4. HAS. Dépistage et prévention du cancer colorectal. Actualisation du référentiel de pratiques de l’examen périodique de santé (EPS). juin 2013.
5. HAS. Cancer colorectal : modalités de dépistage et de prévention chez les sujets à risque élevé et très élevé. mai 2017.
6. Robaszkiewicz M, Rahmi G, Lecomte T, et al. Modalités de surveillance après polypectomie colique. Hépato-Gastro & Oncologie digestive 2021;28:805-16.
7. Leddin D, Lieberman DA, Tse F, et al. Clinical practice guideline on screening for colorectal cancer in individuals with a family history of nonhereditary colorectal cancer or adenoma: the Canadian Association of Gastroenterology Banff Consensus. Gastroenterology 2018;155:1325-47.
8. Monahan KJ, Bradshaw N, Dolwani S, et al. Guidelines for the management of hereditary colorectal cancer from the British Society of Gastroenterology (BSG)/Association of Coloproctology of Great Britain and Ireland (ACPGBI)/United Kingdom Cancer Genetics Group (UKCGG). Gut 2020;69:411-44.
9. van Leerdam ME, Roos VH, van Hooft JE, et al. Endoscopic management of Lynch syndrome and of familial risk of colorectal cancer: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2019;51:1082-93.
10. Denis B. Médecine de précision et dépistage du cancer colorectal : une utopie ? Rev Prat 2022;72(8):825-33.
11. Launoy G, Cariou M, Bouvier AM, et al. Survie des personnes atteintes de cancer en France métropolitaine 1989-2018. Côlon et rectum. Santé publique France 2021.
12. Brenner H, Chen C. The colorectal cancer epidemic: A Challenges and opportunities for primary, secondary and tertiary prevention. Br J Cancer 2018;119:785-92.
13. Dhooge M, Perrod G. Polyposes digestives et syndromes de prédisposition au cancer colorectal. Quelle prise en charge en 2021 ? Hépato-Gastro & Oncologie digestive 2021;28:1112-32.
14. Colas C, Ribière S, Mariani P, et al. Du nouveau dans le champ des polyposes adénomateuses colorectales : synthèse des données disponibles en 2020. Hépato-Gastro & Oncologie digestive 2020;27:386-95.
15. Buisine MP, Bonnet D, Bonadona V, et al. La polypose associée à MUTYH : synthèse des données disponibles en 2020 et actualisation des recommandations françaises établies en 2012 sous l’égide de l’Institut National du Cancer (INCa). Hépato-Gastro & Oncologie digestive 2020;27:396-406.
16. van Leerdam ME, Roos VH, van Hooft JE, et al. Endoscopic management of polyposis syndromes: European Society of Gastrointestinal Endoscopy (ESGE) Guideline. Endoscopy 2019;51:877-95.
17. Roos VH, Mangas-Sanjuan C, Rodriguez-Girondo M, et al. Effects of family history on relative and absolute risks for colorectal cancer: A systematic review and meta-analysis. Clin Gastroenterol Hepatol 2019;17:2657-67.
18. Denis B, Plastaras L, Fraser CG. Test immunochimique quantitatif de recherche de sang fécal occulte : le couteau suisse. Hépato-Gastro & Oncologie digestive 2022;29:165-80.
19. Tian Y, Kharazmi E, Brenner H, et al. Calculating the starting age for screening in relatives of patients with colorectal cancer based on data from large nationwide data sets. Gastroenterology 2020;159:159-68.
20. Cottet V. Nutrition et prévention primaire du cancer colorectal. Hépato-Gastro & Oncologie digestive 2021;28:561-8.
21. ANSES. Évaluation des risques liés à la consommation de nitrates et nitrites. Avis révisé de l’ANSES. Rapport d’expertise collective. juillet 2022.
22. Fiolet T, Srour B, Sellem L, et al. Consumption of ultra-processed foods and cancer risk: results from NutriNet-Santé prospective cohort. BMJ 2018;360:k322.
23. Romaguera D, Fernández-Barrés S, Gracia-Lavedán E, et al. Consumption of ultra-processed foods and drinks and colorectal, breast, and prostate cancer. Clin Nutr 2021;40:1537-45.
24. McNabb S, Harrison TA, Albanes D, et al. Meta-analysis of 16 studies of the association of alcohol with colorectal cancer. Int J Cancer 2020;146:861-73.
25. Botteri E, Borroni E, Sloan EK, et al. Smoking and colorectal cancer risk, overall and by molecular subtypes: A meta-analysis. Am J Gastroenterol 2020;115:1940-9.
26. Oddone E, Modonesi C, Gatta G. Occupational exposures and colorectal cancers: A quantitative overview of epidemiological evidence. World J Gastroenterol 2014;20:12431-44.
27. Huang Q, Lan YJ. Colorectal cancer and asbestos exposure: an overview. Ind Health 2020;58:200-11.
28. Matich EK, Laryea JA, Seely KA, et al. Association between pesticide exposure and colorectal cancer risk and incidence: A systematic review. Ecotoxicol Environ Saf 2021;219:112327.
29. Pritchett N, Spangler EC, Gray GM, et al. Exposure to outdoor particulate matter air pollution and risk of gastrointestinal cancers in adults: A systematic review and meta-analysis of epidemiologic evidence. Environ Health Perspect 2022;130:36001.
30. Manser CN, Bauerfeind P. Impact of socioeconomic status on incidence, mortality, and survival of colorectal cancer patients: A systematic review. Gastrointest Endosc 2014;80:42-60.
31. Katona BW, Weiss JM. Chemoprevention of colorectal cancer. Gastroenterology 2020;158:368-88.
32. Liang PS, Shaukat A, Crockett SD. AGA clinical practice update on chemoprevention for colorectal neoplasia: Expert Review. Clin Gastroenterol Hepatol 2021;19:1327-36.

 Encadrés
Encadrés