La prise en charge du cancer de l’estomac, de pronostic sombre et de révélation souvent tardive, nécessite une bonne coordination ville-hôpital. Le bilan préthérapeutique, en particulier, peut et doit être initié par le médecin généraliste avant la consultation spécialisée et sans la retarder. Tout délai supplémentaire dans la prise en charge expose le patient à un risque de progression tumorale et à la survenue de complications qui peuvent faire annuler un projet initial de traitement curatif.
En France, en 2018, 2 794 personnes sont décédées d’un cancer de l’estomac et 4 264 nouveaux cas ont été rapportés. Environ la moitié des cas surviennent après 75 ans. L’incidence et la mortalité du cancer de l’estomac ont diminué régulièrement* ces dernières années grâce, notamment, à une meilleure prise en charge des facteurs de risque, dont le plus fréquent et le plus connu est l’infection chronique par Helicobacter pylori. L’éradication de son portage permet en effet de diminuer de moitié le risque de survenue d’un cancer gastrique.
Les autres facteurs de risque d’adénocarcinome gastrique (hors tumeurs de la jonction œsogastrique) sont la gastrite atrophique auto-immune, l’origine ethnique, la consommation d’alcool et de tabac, l’infection par le virus d’Epstein-Barr (EBV), les antécédents de gastrectomie partielle ancienne (plus de 10 ans) et les prédispositions génétiques ou antécédents familiaux.
Selon les données de la cohorte SEER, les patients atteints d’adénocarcinome gastrique ont un pronostic sombre, avec une survie à cinq ans estimée à 60 % pour les formes localisées, 21 % pour les formes locorégionales et inférieure à 5 % pour les formes métastatiques (
Des tableaux cliniques divers, tardifs et aspécifiques
Les modes de révélation du cancer gastrique sont nombreux : syndrome ulcéreux, dyspepsie, altération de l’état général, syndrome paranéoplasique (phlébite, acanthosis nigricans), occlusion (surtout pour les tumeurs de la jonction œsogastrique ou prépylorique), hémorragie (anémie ferriprive, hématémèse ou méléna), péritonite sur perforation, manifestations métastatiques (hépatomégalie, ascite, ganglion de Troisier). Ces symptômes, révélateurs de la maladie, sont souvent tardifs et peu spécifiques, et le diagnostic s’en trouve d’autant plus retardé.
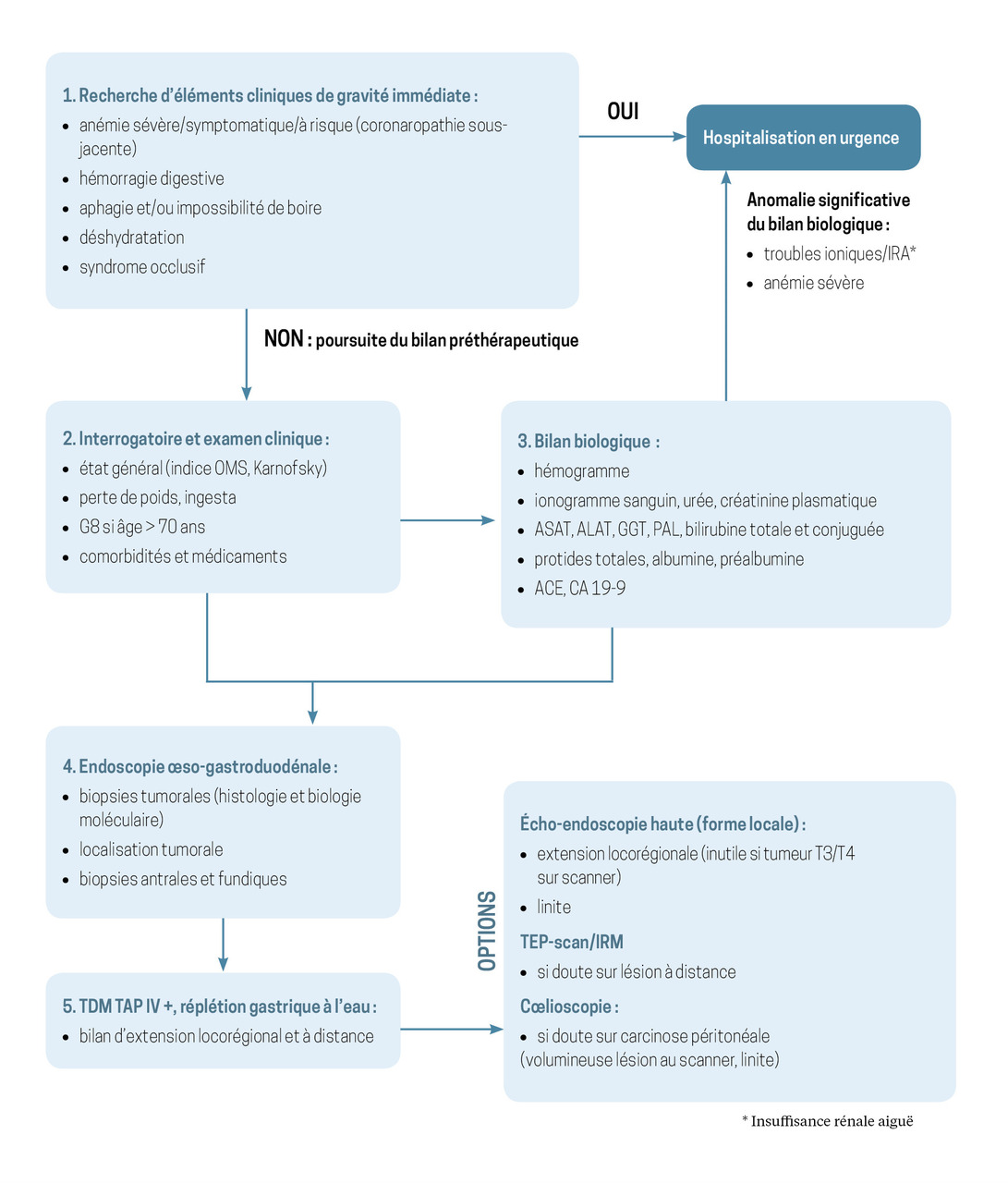
Un bilan préthérapeutique urgent et réalisable en ville (fig. 1)
Tout délai supplémentaire avant la prise en charge d’un cancer de l’estomac expose le patient à un risque de progression locorégionale ou métastatique de la tumeur (pouvant faire annuler un projet initial curatif) et à la survenue de complications liées à l’évolution tumorale (hémorragie digestive, occlusion). Il est donc impératif de rassembler tous les éléments nécessaires à la décision thérapeutique dans les meilleurs délais, d’autant que le diagnostic initial est souvent retardé par le caractère non spécifique et tardif des symptômes.
Le bilan préthérapeutique est une étape clé de la prise en charge, à débuter sans délai, dès le diagnostic. Il est, au moins en partie, réalisable en ville dans l’attente de la consultation spécialisée et sans la retarder. À son issue, les objectifs et modalités de prise en charge du patient sont décidés en milieu spécialisé et validés au cours d’une réunion de concertation pluridisciplinaire.
Des facteurs de gravité à connaître
Quelques situations d’urgence doivent être connues, et alerter au moment de la suspicion diagnostique. Ainsi, en présence d’une anémie mal tolérée ou à risque (coronaropathie préexistante), d’une hémorragie digestive (hématémèse ou méléna), d’une déshydratation installée ou prévisible (aphagie) ou d’un syndrome occlusif (occlusion haute par obstacle tumoral ou occlusion sur carcinose péritonéale), le patient doit être hospitalisé sans délai pour une prise en charge spécialisée.
Un diagnostic topographique et histologique (réf. 1)
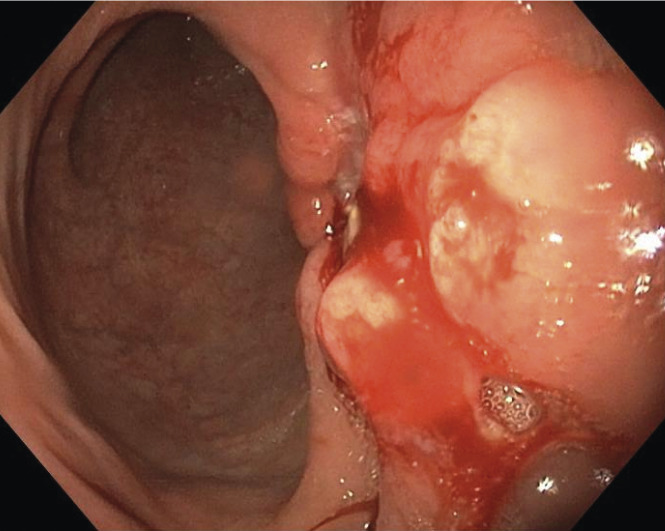
L’endoscopie œso-gastroduodénale est un examen incontournable du bilan préthérapeutique (
En cas de forte suspicion diagnostique à la gastroscopie (aspect macroscopique très évocateur de tumeur maligne), le reste du bilan préthérapeutique, et notamment le bilan d’extension, doit être programmé sans attendre la confirmation histologique, afin de limiter au minimum le délai entre diagnostic et prise en charge.
Un bilan d’extension en deux temps
Examens d’imagerie
Le scanner thoraco-abdominopelvien (TAP) avec injection de produit de contraste iodé et, si possible, avec réplétion gastrique à l’eau est nécessaire pour évaluer la résécabilité de la tumeur et rechercher des métastases à distance (hépatiques, pulmonaires et ganglionnaires principalement).
Le TEP-scanner n’est indiqué dans le bilan préthérapeutique que dans des cas particuliers, à la demande du spécialiste.
L’IRM hépatique peut aider au diagnostic de lésions difficilement caractérisables au scanner.
Écho-endoscopie
La réalisation d’une écho-endoscopie haute est indiquée dans les formes localisées (absence de métastases à distance au scanner) pour compléter le bilan d’extension locorégional. Elle recherche un envahissement pariétal de la tumeur et permet de détecter et de ponctionner des adénopathies périgastriques suspectes passées inaperçues au scanner.
En cas de tumeur superficielle, elle permet de déterminer les indications de traitement endoscopique par mucosectomie ou dissection sous-muqueuse.
Elle est aussi particulièrement utile dans le bilan préthérapeutique des linites gastriques, en en déterminant les limites d’extension proximale et distale. Elle n’est en revanche pas nécessaire si le scanner a mis en évidence une tumeur T3 ou T4 et/ou des adénopathies locorégionales suspectes. En effet, dans ce cas, l’indication d’une chimiothérapie périopératoire est d’emblée posée.
Évaluer l’état général et nutritionnel du patient
L’évaluation de l’état général et nutritionnel du patient est un élément important du bilan préthérapeutique, que la maladie soit ou non localisée.
Elle se fait à l’aide d’échelles objectives : indice OMS (
Rechercher un déficit en dihydropyrimidine déshydrogénase
Avant une chimiothérapie à base de fluoropyrimidines (5-fluoro-uracile [5-FU], capécitabine), il est recommandé de rechercher un déficit en dihydropyrimidine déshydrogénase (DPD) par la mesure de l’uracilémie. En effet, un déficit en DPD expose à un risque de toxicité grave potentiellement mortelle. Il doit conduire à une adaptation de dose (déficit partiel en DPD), ou à une contre-indication à l’utilisation des fluoropyrimidines (déficit complet en DPD).
Rechercher une prédisposition génétique
Les deux principales formes héréditaires de cancers gastriques connues aujourd’hui sont celles liées aux mutations du gène CDH1 (type diffus) et le syndrome de Lynch (type intestinal, le plus souvent). L’identification de formes de prédisposition génétique au cancer gastrique est essentielle, par ses conséquences pour le patient lui-même (prise en charge spécifique avec recherche, par exemple, d’autres localisations tumorales) mais également pour ses apparentés (tests génétiques ciblés afin d’identifier les personnes à risque devant bénéficier d’un programme de dépistage). Les patients doivent être adressés en consultation d’oncogénétique en cas de suspicion de prédisposition génétique : critères histologiques/moléculaires, âge au diagnostic, spectre des cancers associés et/ou antécédents familiaux (https://www.e-cancer.fr).
La recherche d’une infection par Helicobacter pylori suivie, le cas échéant, d’un traitement d’éradication (dont l’efficacité doit être systématiquement contrôlée par un test respiratoire) est recommandée chez tous les sujets ayant une forme héréditaire de cancer gastrique. Cette recherche est également recommandée, en dehors des formes héréditaires, chez les apparentés au 1er degré des patients atteints de formes « sporadiques », car il existe, pour eux aussi, un risque accru de cancer gastrique.
Une prise en charge plurielle
Prise en charge nutritionnelle et autres soins de support
Quels que soient le stade de la maladie et le projet thérapeutique envisagé, des soins de support – dont la prise en charge nutritionnelle, primordiale – doivent être mis en place précocement. Dès le diagnostic, des compléments nutritionnels peuvent être prescrits par voie orale.
Selon le projet thérapeutique et l’état nutritionnel initial, une nutrition entérale (voire parentérale) est discutée. Par exemple, en cas de dénutrition chez un patient avec un projet chirurgical curatif, une jéjunostomie d’alimentation est recommandée avant le traitement néo-adjuvant. Enfin, la prise en charge de la douleur et les traitements symptomatiques pour lutter, en particulier, contre les effets indésirables chimio-induits doivent également être mis en place.
Formes résécables par endoscopie
Dans de rares occasions, en cas de tumeur superficielle (et préférentiellement pour les adénocarcinomes de type intestinal), une résection endoscopique peut être envisagée en centre expert ou en centre de référence, après un bilan d’extension et locorégional endoscopique et écho-endoscopique exhaustif.
Chirurgie (réf. 2)
Avant une gastrectomie, les patients avec syndrome métabolique ou sarcopénique doivent bénéficier d’un programme de réhabilitation comportant une préparation physique, nutritionnelle (immunonutrition) et psychologique. Une cœlioscopie exploratrice peut être recommandée pour les adénocarcinomes gastriques cT3/T4 et/ou N+, à la recherche d’une carcinose péritonéale, d’autant plus en cas d’adénocarcinome à cellules peu cohésives. Les grands principes du traitement chirurgical reposent sur l’exérèse complète de la tumeur, associée à un curage ganglionnaire juxtagastrique (D1) ou périgastrique (D2), sans splénectomie (au minimum 15 et 25 ganglions respectivement). Les modalités de la gastrectomie varient en fonction de la localisation tumorale et de la présence ou non d’une linite :
– gastrectomie des quatre cinquièmes avec anastomose gastrojéjunale pour les cancers de l’antre ;
– gastrectomie totale avec anse grêle montée en Y pour les autres localisations ;
– gastrectomie totale pour les linites gastriques.
Une gastrectomie totale entraîne la survenue de séquelles fonctionnelles avec, notamment, une perte de poids dans la première année postopératoire (environ 15 % du poids corporel), un reflux œsophagien, un dumping syndrome (vidange gastrique accélérée) avec nécessité de fractionner les repas. Le risque de dumping syndrome, le reflux œsophagien et, plus modérément, la qualité de vie et la perte de poids peuvent être minorés par la création d’un réservoir jéjunal sur anse en Y pour le rétablissement de continuité après gastrectomie totale.
Chimiothérapie périopératoire
La chimiothérapie périopératoire des formes localisées de cancer gastrique est le traitement de référence ayant le plus haut niveau de preuve. Deux études randomisées ont en effet montré un allongement de la survie globale et de la survie sans récidive grâce à cette stratégie.3, 4 Le protocole FLOT est la référence en cas de tumeur ≥ T2 et/ou N+. Il associe 5-fluoro-uracile, oxaliplatine et docétaxel administrés toutes les deux semaines (4 cycles préopératoires et 4 cycles postopératoires).5
La chimiothérapie adjuvante (postopératoire) pour les patients non traités en préopératoire (situation de chirurgie en urgence, par exemple pour hémorragie ou occlusion) a démontré son efficacité, mais n’est faisable, en pratique, que dans environ 50 % des cas. En effet, le patient doit être en capacité de la supporter : l’altération de l’état général est souvent un obstacle à son recours.6
Chimiothérapie palliative
Lorsqu’une prise en charge curative est exclue, la sollicitation d’une équipe mobile de soins palliatifs, si elle existe, doit être envisagée précocement. Le choix de la chimiothérapie palliative dépend de différents critères : âge, état général et statut HER2 de la tumeur.
Chimiothérapie palliative de première ligne
Pour les tumeurs avec surexpression de HER2, la chimiothérapie de référence est l’association 5FU (ou capécitabine), cisplatine et trastuzumab (inhibiteur de HER2). En effet, l’étude ToGA a montré un bénéfice en survie globale pour les patients qui ont une tumeur surexprimant la protéine HER2 traités par l’association trastuzumab-chimiothérapie (versus chimiothérapie seule).7 Les résultats de plusieurs études rétrospectives et un accord d’expert permettent de remplacer le cisplatine par l’oxaliplatine dans cette situation. En raison de la cardiotoxicité du trastuzumab, l’Agence nationale de sécurité du médicament et des produits de santé (ANSM) recommande une surveillance de la fraction d’éjection ventriculaire gauche (FEVG) par échographie ou scintigraphie cardiaque tous les trois mois.
Pour les tumeurs sans surexpression de la protéine HER2, les protocoles de chimiothérapie de référence sont les bichimiothérapies (fluoropyrimidine et sel de platine). Si le patient est en excellent état général, une trichimiothérapie peut être proposée en ajoutant un taxane (DCF ou DCF modifié)8 ou une anthracycline à la bithérapie : ECF (association épirubicine, cisplatine et 5FU), ECX (association épirubicine, cisplatine et capécitabine), et EOX (association épirubicine, oxapliplatine et capécitabine).9
Chimiothérapie palliative de seconde ligne
L’utilisation d’un médicament non utilisé en première ligne de traitement doit être privilégiée. Les protocoles validés dans cette situation sont les suivants : docétaxel10 en monothérapie, irinotécan en monothérapie, ramucirumab seul ou associé au paclitaxel.11 À noter : le ramucirumab n’est pas remboursé en France dans cette indication. La Haute Autorité de santé a en effet considéré son service médical rendu comme insuffisant.
Autres
Le trifluridine-tipiracil (TAS-102) a montré un bénéfice de survie globale chez les patients prétraités par au moins deux lignes de chimiothérapie.12 Une autorisation de mise sur le marché a été accordée en France (et en Europe) en 2019.
Immunothérapie
Des études sont actuellement en cours afin d’identifier des sous-groupes de patients susceptibles de répondre à l’immunothérapie (tumeurs MSI, tumeurs EBV-positives ou expression tumorale de PD-L1).
Radiothérapie
Une radiothérapie ou une chimioradiothérapie doivent être discutées pour les adénocarcinomes gastriques non métastatiques incomplètement réséqués, si l’état général le permet. Dans les formes hémorragiques, après échec d’un traitement endoscopique (sclérose, plasma argon ou application d’une poudre hémostatique) et, en cas de non-résécabilité de la tumeur, une radiothérapie à visée hémostatique peut être également proposée.
Cas particulier des tumeurs occlusives
En cas de syndrome occlusif sur tumeur sténosante, des traitements endoscopiques palliatifs peuvent être envisagés chez les patients non opérables (pose de prothèse métallique expansive pour les tumeurs sténosantes envahissant le cardia ou l’orifice antropylorique). En cas d’échec du traitement endoscopique dans cette situation, une gastrectomie palliative à visée symptomatique ou une dérivation chirurgicale est possible chez un patient en bon état général.
* Les tumeurs de la jonction œsogastrique (JOG) ont, en revanche, une incidence en augmentation ; leurs principaux facteurs de risque sont le reflux gastro-œsophagien et le surpoids
Le maintien d’un bon état nutritionnel est fondamental pour optimiser la tolérance de la chimiothérapie. Une nutrition artificielle peut donc être nécessaire. Elle permet également de limiter les complications postopératoires.
La prévention des effets indésirables, notamment des nausées chimio-induites, est essentielle au maintien de l’état nutritionnel et, par conséquent, à l’administration d’une dose-intensité de chimiothérapie optimale.
Il existe de nombreuses solutions médicamenteuses et non médicamenteuses (acupuncture, auriculothérapie, hypnose) pour prévenir et/ou minimiser les effets indésirables chimio-induits.
Des documents à destination des patients sont accessibles sur le site de la Fédération française de cancérologie digestive (FFCD) : explications détaillées sur le déroulement de la chimiothérapie, effets secondaires potentiels en fonction du protocole, conseils généraux pour le patient sous chimiothérapie.(https://www.ffcd.fr/).
Le bilan préthérapeutique est une urgence et peut être, au moins en partie, mené en ville.
La confirmation diagnostique repose sur la réalisation d’une gastroscopie.
Le traitement des formes localisées consiste en une gastrectomie (totale ou partielle selon la localisation de la tumeur). Les formes métastatiques relèvent, quant à elles, d’une chimiothérapie palliative si l’état général du patient le permet.
La coordination ville-hôpital et la mise en place de soins de support sont essentielles, quel que soit le stade de la maladie, pour optimiser la prise en charge des patients.
Que dire à vos patients ?
Le maintien d’un bon état nutritionnel est fondamental pour optimiser la tolérance de la chimiothérapie. Une nutrition artificielle peut donc être nécessaire. Elle permet également de limiter les complications postopératoires.
La prévention des effets indésirables, notamment des nausées chimio-induites, est essentielle au maintien de l’état nutritionnel et, par conséquent, à l’administration d’une dose-intensité de chimiothérapie optimale.
Il existe de nombreuses solutions médicamenteuses et non médicamenteuses (acupuncture, auriculothérapie, hypnose) pour prévenir et/ou minimiser les effets indésirables chimio-induits.
Des documents à destination des patients sont accessibles sur le site de la Fédération française de cancérologie digestive (FFCD) : explications détaillées sur le déroulement de la chimiothérapie, effets secondaires potentiels en fonction du protocole, conseils généraux pour le patient sous chimiothérapie.().
1. Zaanan A, Bouché O, Benhaim L, et al. Gastric cancer: French intergroup clinical practice guidelines for diagnosis, treatments and follow-up (SNFGE, FFCD, GERCOR, UNICANCER, SFCD, SFED, SFRO). Dig Liver Dis 2018;50(8):768-79.
2. Voron T, Romain B, Bergeat D, et al. Prise en charge chirurgicale de l’adénocarcinome gastrique. Recommandations formalisées d’experts sous l’égide de l’Association française de chirurgie (AFC). Journal de chirurgie viscérale 2020;157(2):121-31.
3. Cunningham D, Allum WH, Stenning SP, et al. Perioperative chemotherapy versus surgery alone for resectable gastroesophageal cancer. N Engl J Med 2006;355(1):11-20.
4. Ychou M, Boige V, Pignon JP, et al. Perioperative chemotherapy compared with surgery alone for resectable gastro-esophageal adenocarcinoma: an FNCLCC and FFCD multicenter phase III trial. J Clin Oncol 2011;29(13):1715-21.
5. Al-Batran SE, Homann N, Pauligk C, et al. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet 2019;393(10184): 1948-57.
6. Paoletti X, Oba K, Burzykowski T, et al. Benefit of adjuvant chemotherapy for resectable gastric cancer: a meta-analysis. JAMA 2010;303(17): 1729-37.
7. Bang YJ, Van Cutsem E, Feyereislova A, et al. ToGA Trial Investigators: Trastuzumab in combination with chemotherapy versus chemotherapy alone for treatment of HER2-positive advanced gastric or gastro-oesophageal junction cancer (ToGA): a phase 3, open-label, randomised controlled trial. Lancet 2010;376(9742):687-97.
8. Van Cutsem E, Moiseyenko VM, Tjulandin S, et al. Phase III study of docetaxel and cisplatin plus fluorouracil compared with cisplatin and fluorouracil as first-line therapy for advanced gastric cancer: a report of the V325 Study Group. J Clin Oncol 2006;24(31):4991-7.
9. Guimbaud R, Louvet C, Ries P, et al. Prospective, randomized, multicenter, phase III study of fluorouracil, leucovorin, and irinotecan versus epirubicin, cisplatin, and capecitabine in advanced gastric adenocarcinoma: a French intergroup (Fédération francophone de cancérologie digestive, Fédération nationale des centres de lutte contre le cancer, and Groupe coopérateur multidisciplinaire en oncologie) study. J Clin Oncol 2014;32(31):3520-6.
10. Thuss-Patience PC, Kretzschmar A, Bichev D, et al. Survival advantage for irinotecan versus best supportive care as second-line chemotherapy in gastric cancer- A randomised phase III study of the Arbeitsgemeinschaft internistische onkologie (AIO). Eur J Cancer 2011;47(15):2306-14.
11. Wilke H, Muro K, Van Cutsem E, et al. Ramucirumab plus paclitaxel versus placebo plus paclitaxel I patients with previously treated advanced gastric or gastro-oesophageal junction adenocarcinoma (RAINBOW): a double-blind, randomized phase 3 trial. Lancet Oncol 2014;15(11):1224-35.
12. Shitara K, Doi T, Dvorkin M, et al. Trifluridine/tipiracil versus placebo in patients with heavily pretreated metastatic gastric cancer (TAGS): a randomised, double-blind, placebo-controlled, phase 3 trial. Lancet Oncol 2018;19(11):1437-48.

 Encadrés
Encadrés