7e cause de cancer chez la femme. La survie à 50 ans, tous stades confondus, est de 40 %.
Avec 4 615 nouveaux cas diagnostiqués en France en 2012, il représente 3 % des cancers féminins. L’âge moyen au diagnostic est de 65 ans. Son pronostic est sombre car le diagnostic est fait dans 75 % des cas à un stade avancé avec carcinose péritonéale, expliquant la mortalité importante. Il est la 4e cause de décès par cancer (3 140 décès annuels).
Principaux facteurs de risque : prédisposition héréditaire (syndrome sein-ovaire BRCA1 et BRCA2, syndrome de Lynch ; 10 à 15 % des cas), nulliparité, premières règles précoces, ménopause tardive et âge avancé. Facteurs protecteurs : prise d’une contraception orale, grossesse et allaitement.1
Principaux facteurs de risque : prédisposition héréditaire (syndrome sein-ovaire BRCA1 et BRCA2, syndrome de Lynch ; 10 à 15 % des cas), nulliparité, premières règles précoces, ménopause tardive et âge avancé. Facteurs protecteurs : prise d’une contraception orale, grossesse et allaitement.1
Classification
90 % sont des tumeurs épithéliales dont les 4 principaux types sont les carcinomes séreux, mucineux, endométrioïdes et à cellules claires ; 25 % sont des tumeurs de bas grade et 75 % de haut grade. Les premières sont moins agressives, à développement lent et bien différenciées, les secondes, peu différenciées à croissance rapide, ont un risque élevé de dissémination.
Un nouveau modèle de carcinogenèse en distingue 2 types : le I, constituant 25 % des cancers épithéliaux, généralement de bas grade, inclut les endométrioïdes, mucineux et séreux de bas grade, ainsi que les carcinomes à cellules claires ; le II (75 %) regroupe carcinomes endométrioïdes et séreux de haut grade, indifférenciés. Dans les types I à instabilité génomique faible, on retrouve les mutations somatiques KRAS, BRAF, PIK3CA, ERBB2, PTEN et CTNNB1. Les types II, à instabilité importante, sont en relation avec une anomalie du gène TP53 ou BRCA.2 Cette classification moléculaire ouvre des perspectives de thérapies ciblées.
Les tumeurs non épithéliales, rares, survenant chez la femme jeune ne sont pas abordées ici.3
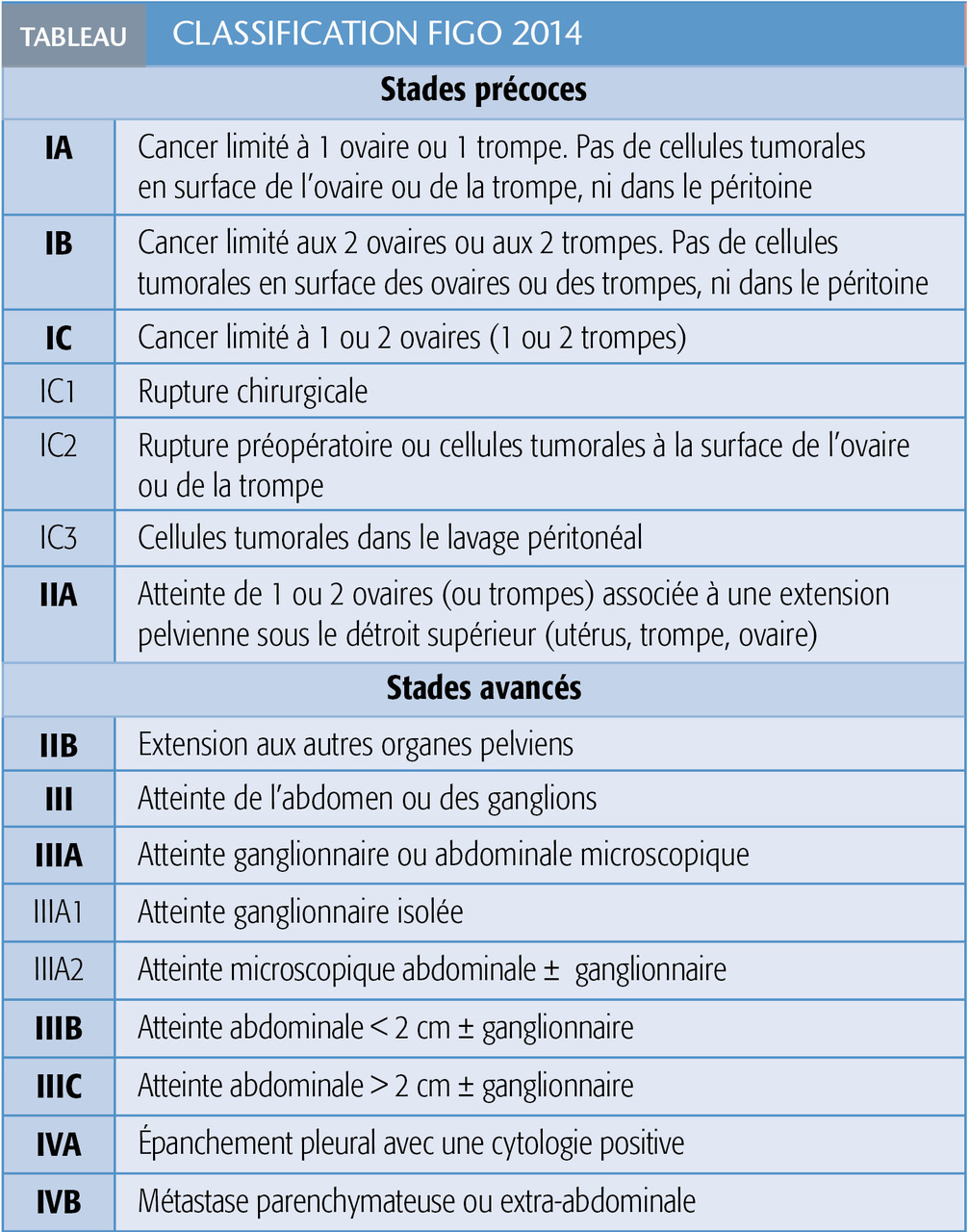
Selon la classification FIGO (tableau), on distingue les stades précoces (stades I et IIA) et les stades avancés (IIB à IV), qui représentent 75 % des cas, associés à un pronostic sombre.
Un nouveau modèle de carcinogenèse en distingue 2 types : le I, constituant 25 % des cancers épithéliaux, généralement de bas grade, inclut les endométrioïdes, mucineux et séreux de bas grade, ainsi que les carcinomes à cellules claires ; le II (75 %) regroupe carcinomes endométrioïdes et séreux de haut grade, indifférenciés. Dans les types I à instabilité génomique faible, on retrouve les mutations somatiques KRAS, BRAF, PIK3CA, ERBB2, PTEN et CTNNB1. Les types II, à instabilité importante, sont en relation avec une anomalie du gène TP53 ou BRCA.2 Cette classification moléculaire ouvre des perspectives de thérapies ciblées.
Les tumeurs non épithéliales, rares, survenant chez la femme jeune ne sont pas abordées ici.3
Selon la classification FIGO (tableau), on distingue les stades précoces (stades I et IIA) et les stades avancés (IIB à IV), qui représentent 75 % des cas, associés à un pronostic sombre.
Mode de découverte
Dans 70 % des cas, le cancer de l’ovaire est diagnostiqué tardivement et la symptomatologie est marquée : douleurs abdominales, distension abdominale, troubles du transit (syndrome tumoro-ascitique).
De manière occasionnelle, il peut être détecté plus précocement lors d’un examen gynécologique systématique retrouvant une masse pelvienne ou motivé par des douleurs gynécologiques. Il peut également être découvert sur une échographie systématique.
À ce jour, il n’existe aucun dépistage organisé, son bénéfice n’étant pas prouvé même en cas de prédispositions héréditaires (syndrome sein-ovaire associé à une mutation BRCA ou syndrome de Lynch). Les antécédents familiaux de cancers sont importants à noter à l’interrogatoire.
De manière occasionnelle, il peut être détecté plus précocement lors d’un examen gynécologique systématique retrouvant une masse pelvienne ou motivé par des douleurs gynécologiques. Il peut également être découvert sur une échographie systématique.
À ce jour, il n’existe aucun dépistage organisé, son bénéfice n’étant pas prouvé même en cas de prédispositions héréditaires (syndrome sein-ovaire associé à une mutation BRCA ou syndrome de Lynch). Les antécédents familiaux de cancers sont importants à noter à l’interrogatoire.
Bilan diagnostique et d’extension
L’échographie pelvienne sus-pubienne et endovaginale est l’examen de première intention, elle caractérise une masse annexielle suspecte. Plusieurs éléments sont à noter : taille, épaisseur et régularité de la paroi, végétations, nombre de locules, épanchement pelvien ou carcinose. Le doppler renseigne sur la vascularisation. Divers scores orientent le clinicien vers une lésion maligne ou bénigne.
En cas de suspicion de cancer, une tomodensitométrie thoraco- abdominopelvienne recherche une extension et évalue la résécabilité des lésions. Son compte-rendu doit être standardisé et décrire toutes les localisations de carcinose péritonéale, les ganglions suspects et l’éventuelle ascite. Quoique non recommandé en routine, le TEP-scanner apporte parfois des informations complémentaires en montrant les lésions hypermétaboliques péritonéales ou ganglionnaires.
À l’inverse, si l’échographie ne permet pas de statuer sur la malignité, devant une masse complexe ou indéterminée, l’IRM apparaît alors comme l’examen-clé.
Le bilan comporte aussi un dosage du CA 125 ± CA 19-9 et ACE si suspicion de tumeur mucineuse ou si on évoque une origine digestive.4
Récemment, un nouveau marqueur, l’HE4, semble plus spécifique ; couplé au CA 125 et au statut ménopausique, il contribue au score ROMA, prédictif du caractère suspect ou non d’une masse annexielle.5
En cas de suspicion de cancer, une tomodensitométrie thoraco- abdominopelvienne recherche une extension et évalue la résécabilité des lésions. Son compte-rendu doit être standardisé et décrire toutes les localisations de carcinose péritonéale, les ganglions suspects et l’éventuelle ascite. Quoique non recommandé en routine, le TEP-scanner apporte parfois des informations complémentaires en montrant les lésions hypermétaboliques péritonéales ou ganglionnaires.
À l’inverse, si l’échographie ne permet pas de statuer sur la malignité, devant une masse complexe ou indéterminée, l’IRM apparaît alors comme l’examen-clé.
Le bilan comporte aussi un dosage du CA 125 ± CA 19-9 et ACE si suspicion de tumeur mucineuse ou si on évoque une origine digestive.4
Récemment, un nouveau marqueur, l’HE4, semble plus spécifique ; couplé au CA 125 et au statut ménopausique, il contribue au score ROMA, prédictif du caractère suspect ou non d’une masse annexielle.5
Chirurgie et chimiothérapie
Le résidu tumoral postopératoire est le facteur pronostique principal des cancers avancés, et le chirurgien doit s’efforcer d’effectuer une cytoréduction complète.6
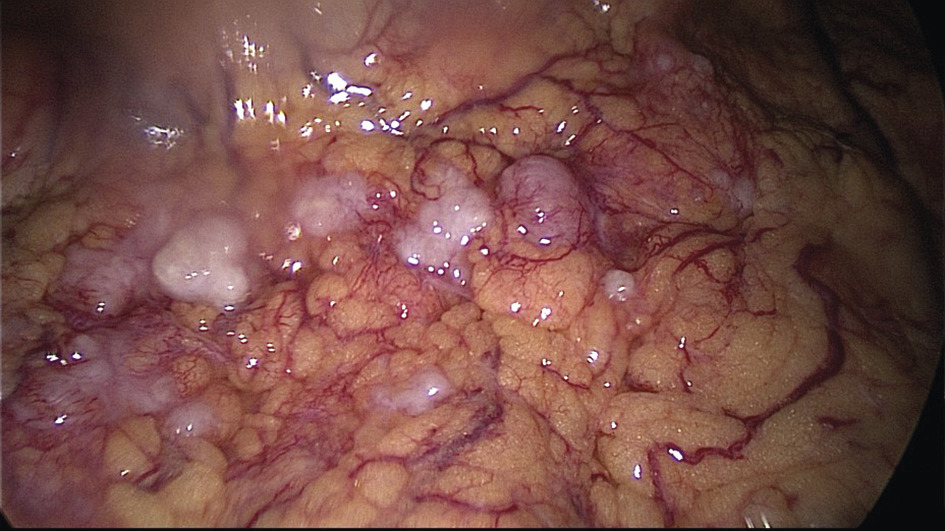
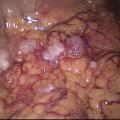
L’évaluation de la résécabilité repose sur les marqueurs tumoraux, le scanner thoraco-abdomino-pelvien ± le TEP-scan et la cœlioscopie exploratrice. L’imagerie permet d’analyser les sites difficiles ou impossibles à explorer chirurgicalement (atteinte thoracique, digestive, splénique, ganglions, métastases hépatiques parenchymateuses, pédicule hépatique…). La cœlioscopie offre une vue directe de la carcinose et de son étendue (fig. 1), sachant que des petites lésions (miliaire) peuvent être invisibles. Elle autorise cytologie et biopsies péritonéales qui confirment le diagnostic, et contribue aux scores d’étendue de carcinose (score de Sugarbaker) et de résécabilité. Critères de non-résécabilité : carcinose diffuse, rétraction du mésentère, résections digestives multiples au-delà de deux et infiltration profonde du pédicule hépatique.
Lorsqu’une cytoréduction complète est envisageable d’emblée, l’intervention est suivie d’une chimiothérapie. Dans le cas contraire, on débute par 3 cycles de carboplatine-taxol en néoadjuvant suivis d’une réévaluation clinique, biologique et d’imagerie. Si la néoplasie paraît résécable, on procède à une chirurgie d’intervalle, elle-même suivie de 3 autres cycles.
On peut associer à la chimiothérapie une thérapie ciblée par anti-angiogéniques (cf. infra).
La stratégie est décidée au cours d’une réunion de concertation pluridisciplinaire réunissant chirurgiens, anatomopathologistes, radiologues et oncologues.
L’évaluation de la résécabilité repose sur les marqueurs tumoraux, le scanner thoraco-abdomino-pelvien ± le TEP-scan et la cœlioscopie exploratrice. L’imagerie permet d’analyser les sites difficiles ou impossibles à explorer chirurgicalement (atteinte thoracique, digestive, splénique, ganglions, métastases hépatiques parenchymateuses, pédicule hépatique…). La cœlioscopie offre une vue directe de la carcinose et de son étendue (fig. 1), sachant que des petites lésions (miliaire) peuvent être invisibles. Elle autorise cytologie et biopsies péritonéales qui confirment le diagnostic, et contribue aux scores d’étendue de carcinose (score de Sugarbaker) et de résécabilité. Critères de non-résécabilité : carcinose diffuse, rétraction du mésentère, résections digestives multiples au-delà de deux et infiltration profonde du pédicule hépatique.
Lorsqu’une cytoréduction complète est envisageable d’emblée, l’intervention est suivie d’une chimiothérapie. Dans le cas contraire, on débute par 3 cycles de carboplatine-taxol en néoadjuvant suivis d’une réévaluation clinique, biologique et d’imagerie. Si la néoplasie paraît résécable, on procède à une chirurgie d’intervalle, elle-même suivie de 3 autres cycles.
On peut associer à la chimiothérapie une thérapie ciblée par anti-angiogéniques (cf. infra).
La stratégie est décidée au cours d’une réunion de concertation pluridisciplinaire réunissant chirurgiens, anatomopathologistes, radiologues et oncologues.
Chirurgie de cytoréduction
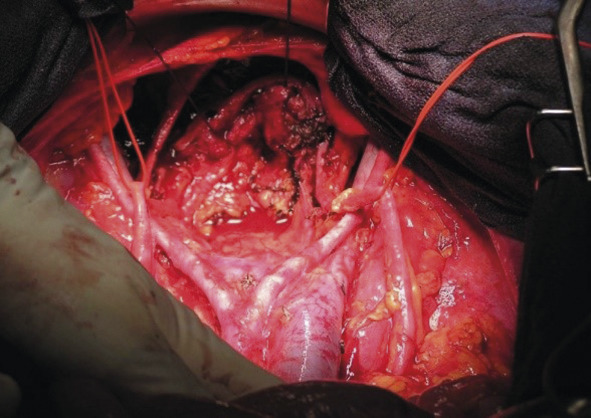
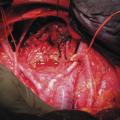
Elle doit être réalisée dans un centre expert, l’objectif chirurgical étant la cytoréduction complète (fig. 2).
La voie d’abord de référence est la laparotomie xiphopubienne. Au minimum : hystérectomie totale avec annexectomie bilatérale, omentectomie infragastrique, curage pelvien bilatéral, et lombo-aortique, enfin appendicectomie en cas de tumeur mucineuse. Des curages systématiques sont néanmoins discutés dans les stades avancés. En fonction de l’extension, le geste est radical (résection de la charnière recto-sigmoïdienne avec anastomose colorectale ± stomie de protection), voire supra-radical (péritonectomies étendues, et selon l’atteinte carcinomateuse, résection des coupoles diaphragmatiques, splénectomie ou autres résections digestives).
La voie d’abord de référence est la laparotomie xiphopubienne. Au minimum : hystérectomie totale avec annexectomie bilatérale, omentectomie infragastrique, curage pelvien bilatéral, et lombo-aortique, enfin appendicectomie en cas de tumeur mucineuse. Des curages systématiques sont néanmoins discutés dans les stades avancés. En fonction de l’extension, le geste est radical (résection de la charnière recto-sigmoïdienne avec anastomose colorectale ± stomie de protection), voire supra-radical (péritonectomies étendues, et selon l’atteinte carcinomateuse, résection des coupoles diaphragmatiques, splénectomie ou autres résections digestives).
Chimiothérapie
En dehors des stades IA-IB de bas grade, la chimiothérapie est systématique. Protocole standard : carboplatine et paclitaxel toutes les 3 semaines ; 3 cycles pour les stades précoces (après chirurgie) et 6 pour les formes avancées. Si elles sont opérables d’emblée, une chimiothérapie adjuvante est instaurée dès l’obtention de la cicatrisation (4 à 6 semaines après la chirurgie).
La chimiothérapie néoadjuvante est une alternative pour éviter une intervention incomplète ou trop morbide. Trois cycles, puis cytoréduction (si envisageable) suivie d’encore 3 à 4 cycles de carboplatine et taxol. Cette stratégie ne se discute qu’à partir du stade FIGO IIIC, non opérable d’emblée. Pas d’intérêt à prolonger la chimiothérapie après 6 à 9 cycles (fig. 3).
La chimiothérapie néoadjuvante est une alternative pour éviter une intervention incomplète ou trop morbide. Trois cycles, puis cytoréduction (si envisageable) suivie d’encore 3 à 4 cycles de carboplatine et taxol. Cette stratégie ne se discute qu’à partir du stade FIGO IIIC, non opérable d’emblée. Pas d’intérêt à prolonger la chimiothérapie après 6 à 9 cycles (fig. 3).
Thérapies ciblées
Le bévacizumab (Avastin), anticorps monoclonal anti-VEGF, anti- angiogénique, inhibe la croissance tumorale. Il est recommandé en cas de résidu tumoral macroscopique après cytoréduction initiale pour les stades IIIB à IV et pour les stades IIIC-IV définitivement non résécables de façon complète. Il est à discuter en RCP et avec la patiente dans les stades IIIB et IIIC avec exérèse macroscopiquement complète lors de la chirurgie initiale ou après chirurgie d’intervalle.7
Surveillance
Examen clinique et dosage des marqueurs tumoraux tous les 3 mois pendant 2 ans, puis tous les 6 mois durant 3 ans, permettent la détection précoce de symptômes et d’élévation du CA 125 (considéré comme l’indicateur de récidive, précédant souvent la rechute clinique de près de 6 mois).4 Une fois suspectée, la récidive est confirmée en imagerie : TEP-scan + scanner thoraco-abdomino-pelvien semble le meilleur moyen pour la détecter et évaluer la résécabilité chirurgicale. Dans plus de la moitié des cas, elle aboutit à une carcinose péritonéale. Si elle se répète : envahissement ganglionnaire et/ou métastases à distance.
Récidives et pronostic
Malgré le mauvais pronostic, plus de 70 % des patientes obtiennent une rémission complète. La survie globale à 5 ans est de 40 %, variant de 80 % pour les stades IA à 10 % pour les stades IV. La nette amélioration pronostique observée sur la dernière décennie résulte des nouvelles thérapeutiques ainsi que des progrès chirurgicaux. En dehors du stade initial, la qualité de la chirurgie et le type histologique de la tumeur paraissent être des facteurs pronostiques essentiels.
Néanmoins, 75 % des patientes récidivent malgré un traitement de 1re ligne adapté. Le délai d’apparition par rapport à la fin de la chimiothérapie est un élément majeur impactant le pronostic et la prise en charge.
On distingue les récidives platine-sensibles (diagnostiquées après un intervalle libre sans platine de plus de 12 mois), platine-intermédiaires (détectées 6 à 12 mois après la dernière dose) et platine-résistantes (survenant moins de 6 mois après).
Dans le premier cas : chimiothérapie de 2e ligne. Dans le deuxième, outre la chimiothérapie, la chirurgie peut trouver sa place, comme l’a montré l’essai randomisé DESKTOP III, comparant cytoréduction maximale suivie d’une chimiothérapie, versus chimiothérapie dans le cancer en rechute, sensible au platine.8 L’inclusion dans des essais médicaux ou chirurgicaux est large, et la CHIP (chimiothérapie intrapéritonéale hyperthermique) est en cours d’évaluation.9
Les thérapies ciblées (anti-angiogéniques ou inhibiteurs de PARP) sont également volontiers associées à la chimiothérapie. Dans l’essai multicentrique randomisé SOLO II, l’olaparib (Lynparza) en monothérapie d’entretien chez les patientes BRCA mutées en récidive sensible au platine, a entraîné une nette amélioration de la survie sans progression.10 Cet inhibiteur de PARP a ainsi obtenu l’AMM en 2017 dans cette indication. Ainsi, une consultation d’oncogénétique doit être proposée dès que possible et idéalement dès le diagnostic. Les inhibiteurs de PARP ont également montré leur bénéfice chez des patientes non mutées, et leur place dans la prise en charge des récidives est grandissante.
Néanmoins, 75 % des patientes récidivent malgré un traitement de 1re ligne adapté. Le délai d’apparition par rapport à la fin de la chimiothérapie est un élément majeur impactant le pronostic et la prise en charge.
On distingue les récidives platine-sensibles (diagnostiquées après un intervalle libre sans platine de plus de 12 mois), platine-intermédiaires (détectées 6 à 12 mois après la dernière dose) et platine-résistantes (survenant moins de 6 mois après).
Dans le premier cas : chimiothérapie de 2e ligne. Dans le deuxième, outre la chimiothérapie, la chirurgie peut trouver sa place, comme l’a montré l’essai randomisé DESKTOP III, comparant cytoréduction maximale suivie d’une chimiothérapie, versus chimiothérapie dans le cancer en rechute, sensible au platine.8 L’inclusion dans des essais médicaux ou chirurgicaux est large, et la CHIP (chimiothérapie intrapéritonéale hyperthermique) est en cours d’évaluation.9
Les thérapies ciblées (anti-angiogéniques ou inhibiteurs de PARP) sont également volontiers associées à la chimiothérapie. Dans l’essai multicentrique randomisé SOLO II, l’olaparib (Lynparza) en monothérapie d’entretien chez les patientes BRCA mutées en récidive sensible au platine, a entraîné une nette amélioration de la survie sans progression.10 Cet inhibiteur de PARP a ainsi obtenu l’AMM en 2017 dans cette indication. Ainsi, une consultation d’oncogénétique doit être proposée dès que possible et idéalement dès le diagnostic. Les inhibiteurs de PARP ont également montré leur bénéfice chez des patientes non mutées, et leur place dans la prise en charge des récidives est grandissante.
références
1. Binder-Foucard F, Bossard N, Delafosse P, Belot A, Woronoff AS, Remontet L; French network of cancer registries (Francim). Cancer incidence and mortality in France over the 1980-2012 period: solid tumors. Rev Epidemiol Sante Publique 2014;62:95-108.
2. Nezhat FR, Apostol R, Nezhat C, Pejovic T. New insights in the patho- physiology of ovarian cancer and implications for screening and prevention. Am J Obstet Gynecol 2015;213:262-7.
3. http://www.ovaire-rare.org
4. INCa. Cancers gynécologiques. Prévention et dépistage : recomman-dations et outils d’aide à la pratique. Janvier 2017. https://bit.ly/2BN1fg3
5. Salim E, Zubairi AM, Danish SH, Ali U. Diagnostic Accuracy of Risk of Ovarian Malignancy Algorithm (ROMA) in Post-Menopausal Patients with Ovarian Mass. J Coll Physicians Surg Pak 2018;28:440-4.
6. Chi DS, Eisenhauer EL, Zivanovic O, et al. Improved progression-free and overall survival in advanced ovarian cancer as a result of a change in surgical paradigm. Gynecol Oncol 2009;114:26-31.
7. ARCAGY-GINECO. Recommandations sur le cancer de l’ovaire et du col de l’utérus. Janvier 2016. https://bit.ly/2Q8pDS1
8. Bommert M, Harter P, Heitz F, du Bois A. When should Surgery be used for Recurrent Ovarian Carcinoma? Clin Oncol (R Coll Radiol) 2018;30:493-7.
9. NIH. Hyperthermic intra-peritoneal chemotherapy (HIPEC) in Relapse Ovarian Cancer Treatment (CHIPOR). https://bit.ly/2rjMag5
10. Pujade-Lauraine E, Ledermann JA, Selle F, et al; SOLO2/ENGOT-Ov21 investigators. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2017;18:1274-84.
2. Nezhat FR, Apostol R, Nezhat C, Pejovic T. New insights in the patho- physiology of ovarian cancer and implications for screening and prevention. Am J Obstet Gynecol 2015;213:262-7.
3. http://www.ovaire-rare.org
4. INCa. Cancers gynécologiques. Prévention et dépistage : recomman-dations et outils d’aide à la pratique. Janvier 2017. https://bit.ly/2BN1fg3
5. Salim E, Zubairi AM, Danish SH, Ali U. Diagnostic Accuracy of Risk of Ovarian Malignancy Algorithm (ROMA) in Post-Menopausal Patients with Ovarian Mass. J Coll Physicians Surg Pak 2018;28:440-4.
6. Chi DS, Eisenhauer EL, Zivanovic O, et al. Improved progression-free and overall survival in advanced ovarian cancer as a result of a change in surgical paradigm. Gynecol Oncol 2009;114:26-31.
7. ARCAGY-GINECO. Recommandations sur le cancer de l’ovaire et du col de l’utérus. Janvier 2016. https://bit.ly/2Q8pDS1
8. Bommert M, Harter P, Heitz F, du Bois A. When should Surgery be used for Recurrent Ovarian Carcinoma? Clin Oncol (R Coll Radiol) 2018;30:493-7.
9. NIH. Hyperthermic intra-peritoneal chemotherapy (HIPEC) in Relapse Ovarian Cancer Treatment (CHIPOR). https://bit.ly/2rjMag5
10. Pujade-Lauraine E, Ledermann JA, Selle F, et al; SOLO2/ENGOT-Ov21 investigators. Olaparib tablets as maintenance therapy in patients with platinum-sensitive, relapsed ovarian cancer and a BRCA1/2 mutation (SOLO2/ENGOT-Ov21): a double-blind, randomised, placebo-controlled, phase 3 trial. Lancet Oncol 2017;18:1274-84.