Les principaux facteurs de risque sont l’âge (> 50 ans), les antécédents personnels de pathologie mammaire (cancer du sein, hyperplasie atypique) ou familiaux de cancer du sein, notamment en cas de prédisposition génétique (mutation du gène BRCA1 ou 2), une radiothérapie thoracique à haute dose reçue dans le passé. Surpoids/obésité chez la femme ménopausée, longue exposition aux estrogènes, tabagisme et consommation d’alcool seraient aussi impliqués. L’activité physique est associée à une diminution du risque après la ménopause.2 Limiter ces facteurs et inciter au dépistage est essentiel : le médecin généraliste participe à l’éducation des patientes à la prévention.
Le dépistage comprend un examen clinique des seins par un professionnel de santé tous les ans dès l’âge de 25 ans et une mammographie tous les 2 ans avec double incidence et double lecture systématique, complétée si nécessaire par une échographie, entre 50 et 74 ans.3
En cas de risque génétique avéré (mutation prédisposante BRCA 1 ou 2) ou accru (3 cas de cancer du sein dans la famille au premier degré ou 1 cas < 35 ans, ou association cancer du sein et des ovaires, ou sein/prostate), une écho-mammographie annuelle et une IRM sont recommandées. Une consultation d’oncogénétique peut être proposée à ces femmes pour une recherche de mutation (panel de 12 gènes) et un suivi adapté.
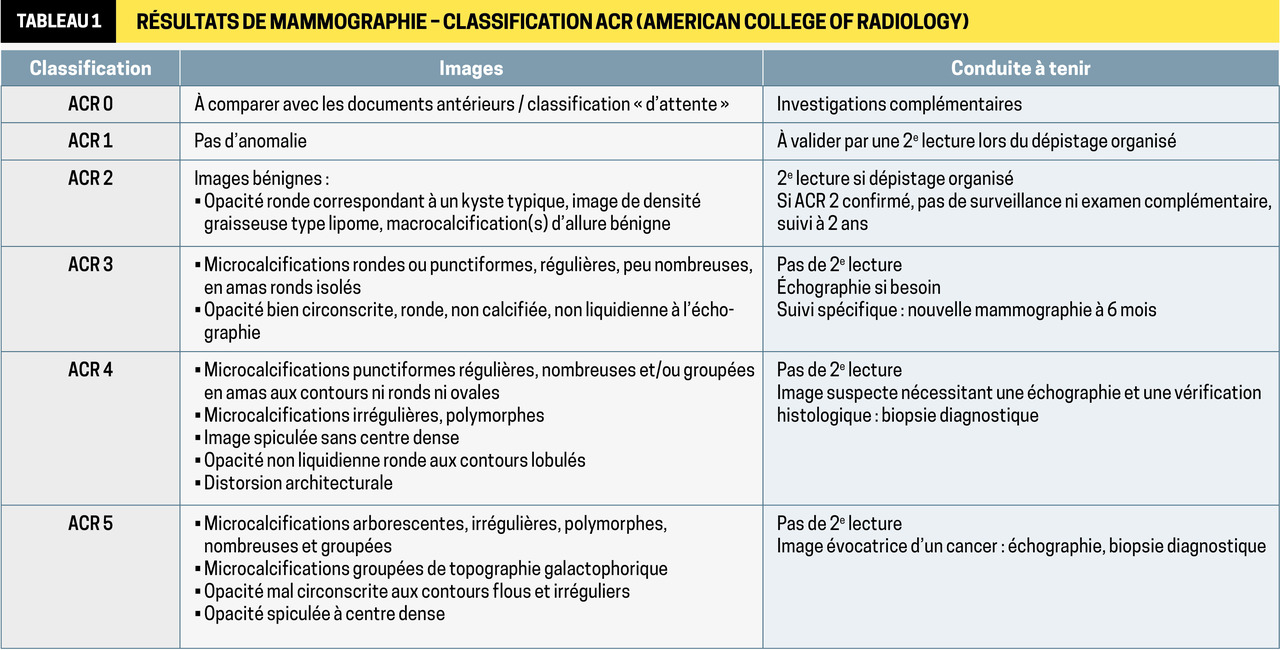
Diagnostic : radiologique
L’examen des seins recherche un signe révélateur : rougeur et peau d’orange (qui sont une des rares urgences en cancérologie) mais aussi voussure, méplat, rétraction, asymétrie axillaire ou mamelonnaire. On palpe les seins, la région mamelonnaire et rétromamelonnaire ; tout écoulement sanglant unipore (par 1 seul canal galactophorique) unilatéral est suspect jusqu’à preuve du contraire ; si un nodule est palpable, il faut le mesurer et apprécier sa mobilité par rapport à la peau et au plan profond.
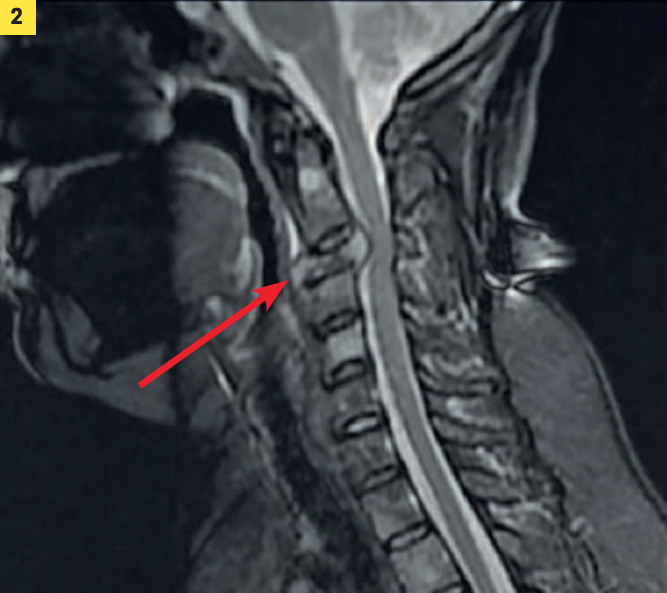
Des signes généraux, tels que fatigue et perte de poids, peuvent être associés. Une douleur élective osseuse, brutale et insomniante au niveau du dos mais également de l’humérus, surtout si elle est unilatérale, impose des radiographies ciblées, voire une scintigraphie osseuse ou un scanner. À noter que les métastases touchent par ordre de fréquence l’os, le foie et le poumon.
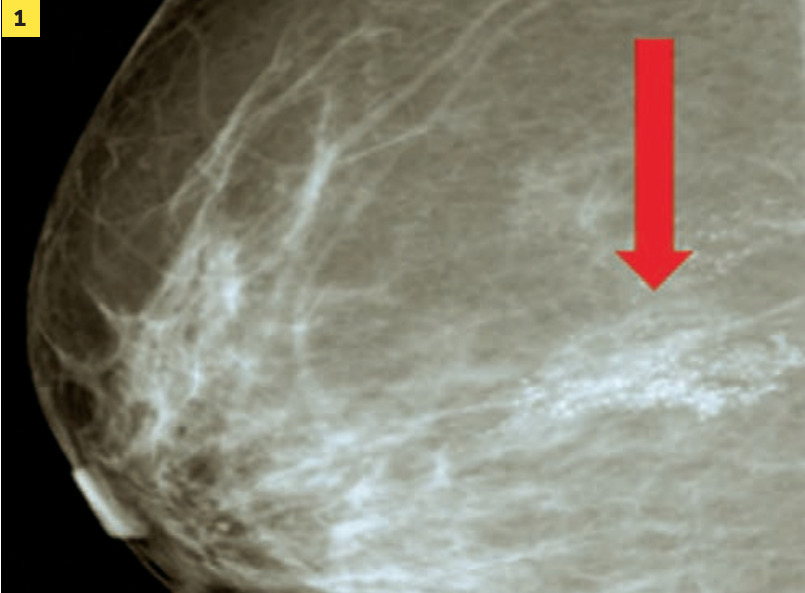
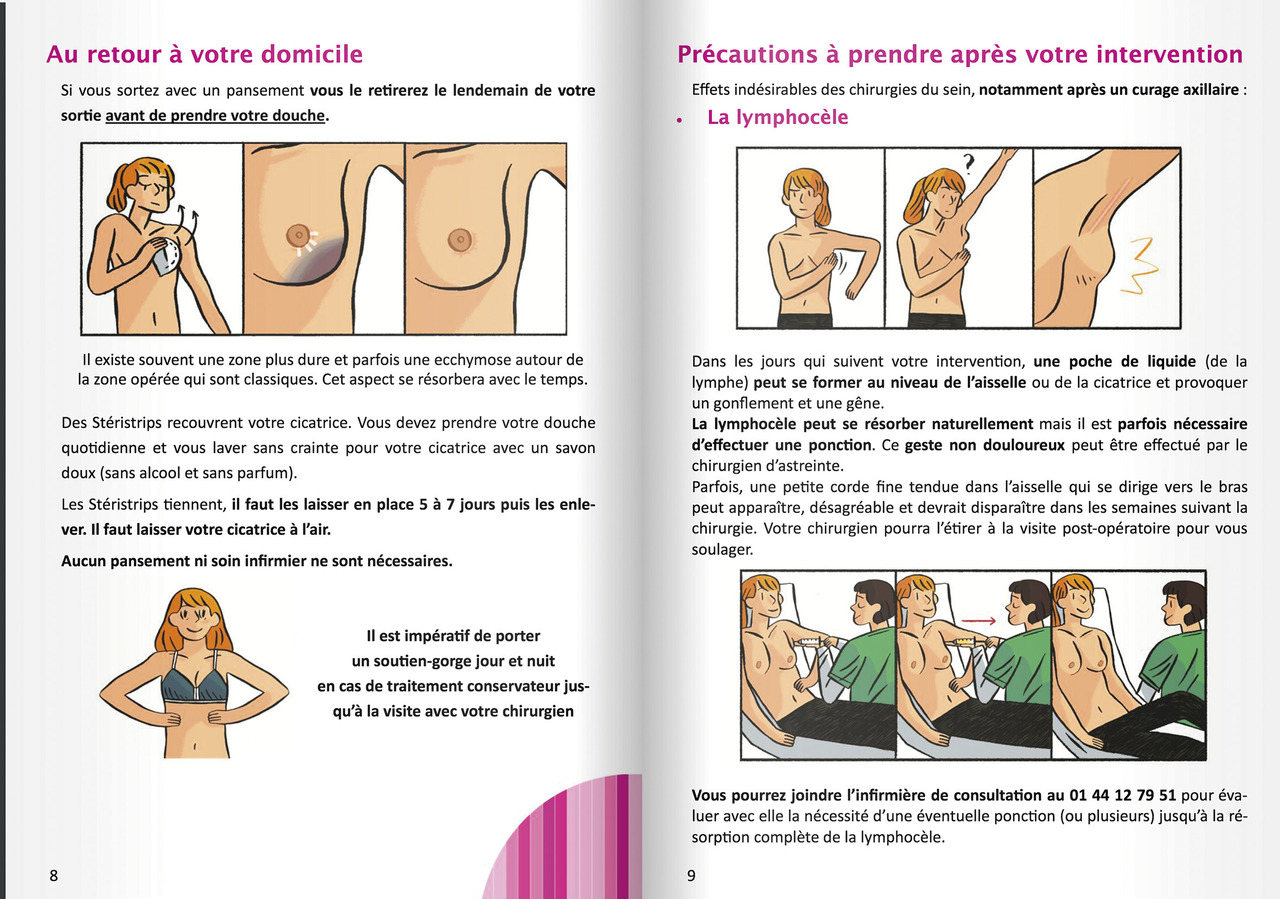
Mammographie et échographie des seins et des creux axillaires sont fondamentales pour le diagnostic et la caractérisation morphologique. Les anomalies retrouvées sont uniquement mammographiques dans le cas particulier de foyer de microcalcifications (isolé ou étendu dans le sein ;
La classification selon BI-RADS oriente la prise en charge (
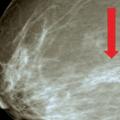
L’IRM est indiquée en cas d’adénopathie axillaire isolée malgré un bilan écho- et mammographique normal, chez les patientes à risque génétique (mutation BRCA), en cas d’antécédent d’irradiation thoracique (par exemple, lymphome de Hodgkin), de suspicion chez une femme jeune avant 35 ans, de doute sur une multifocalité, de densité mammaire élevée rendant l’interprétation de la mammographie difficile.
Bilan d’extension et facteurs pronostiques
Le bilan d’extension repose sur l’échographie abdomino-pelvienne. Si le cancer est supérieur à 2 cm (T2, T3), inflammatoire ou à risque métastatique, on réalise un scanner thoraco-abdominal, une scintigraphie osseuse, un bilan biologique incluant le CA 15-3. Dans les tumeurs inflammatoires et lors de certaines récidives, un TEP-scanner est indiqué.
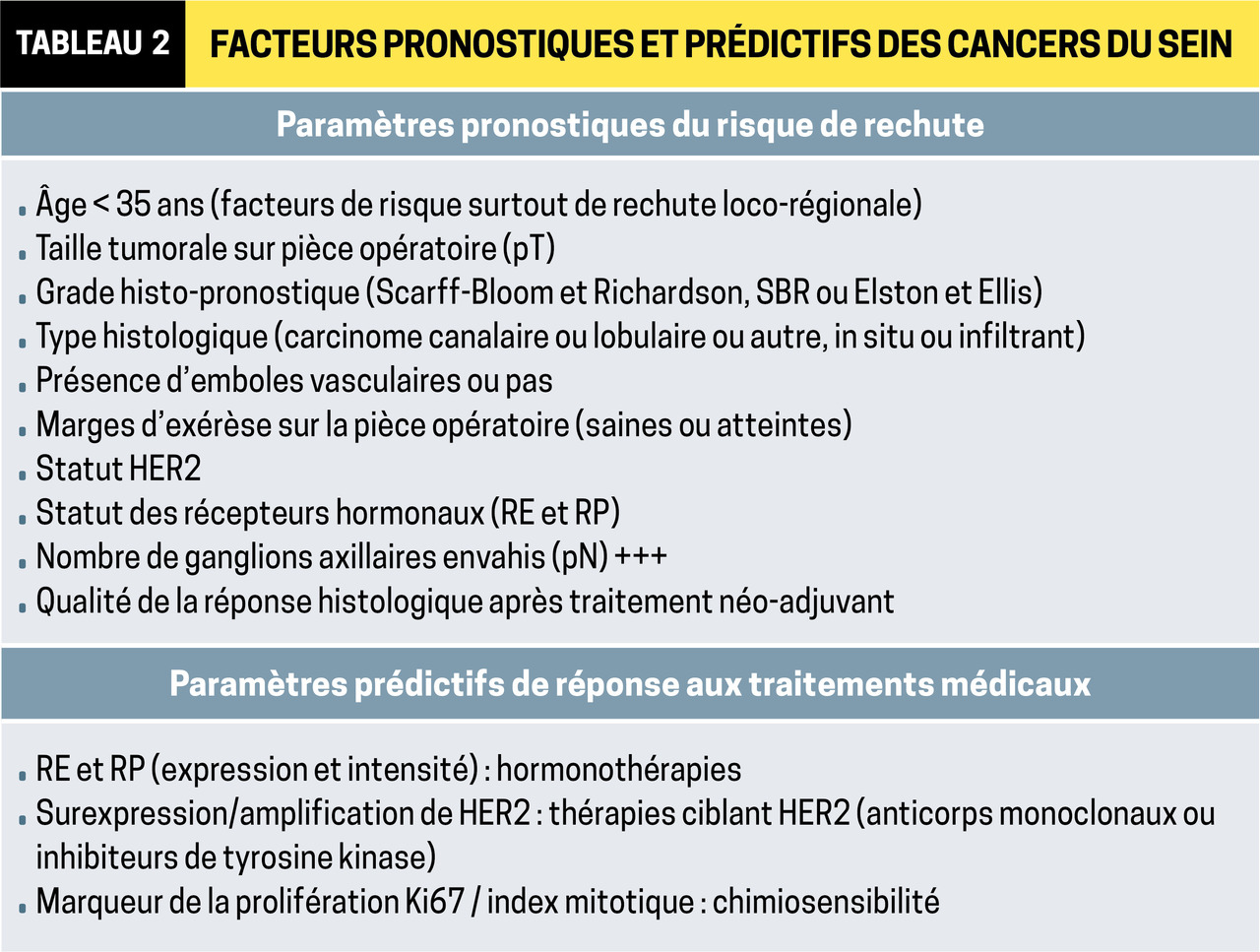
Une biopsie avec analyse histologique et immunohistochimique permet de classer les lésions et d’identifier les facteurs pronostiques et prédictifs (
Chirurgie première : dans 85 % des cas
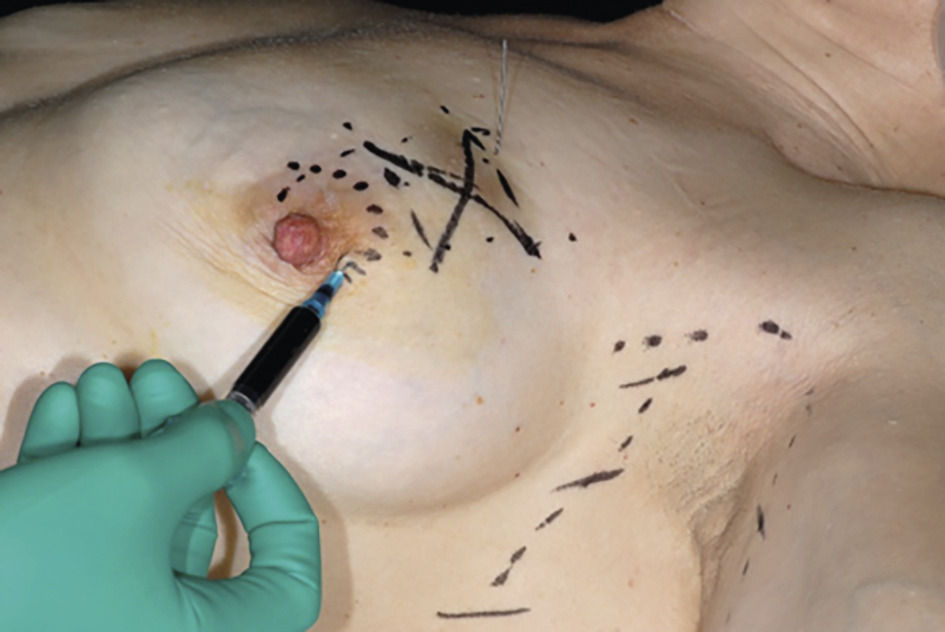
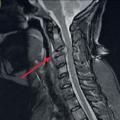
Lorsque le nodule est palpable, les marges sont faites manuellement ; dans les autres cas, le radiologue positionne en préopératoire un repère métallique ou magnétique sous échographie ou mammographie, qui guide le chirurgien. Parfois (15 % des cas), un geste oncoplastique est nécessaire pour éviter la déformation du sein. Ces traitements concernent principalement les tumeurs de moins de 5 cm (T1 et T2), après examen clinique et radiologique des seins (leur volume étant un facteur déterminant). On privilégie les cicatrices autour du mamelon, mais dans certains cas, si la tumeur est adhérente à la peau ou selon la consistance mammaire, on peut réaliser des cicatrices directes (en regard de la tumeur).
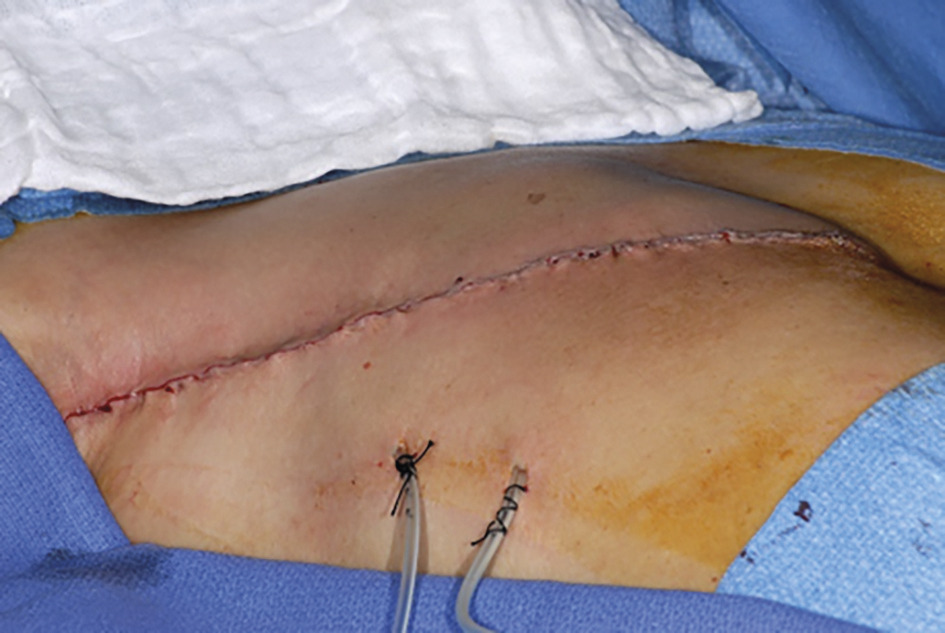
Le traitement radical (
La chirurgie axillaire s’est profondément modifiée ces 10 dernières années. La technique du ganglion sentinelle est devenue le gold standard depuis 2007 pour les cancers T1 ou T2 N0. Cela consiste à retirer le premier relais ganglionnaire axillaire homolatéral. Le repérage peut se faire grâce à un isotope (méthode de référence). Depuis 2010, de nouveaux colorants sont disponibles, tels qu’un traceur magnétique et le vert d’indocyanine ; le bleu patenté, très allergisant, est de moins en moins utilisé.
Plus invasif, le curage axillaire consiste à retirer une dizaine de ganglions sous la veine axillaire en respectant le muscle dentelé et grand dorsal. C’est une intervention douloureuse et pourvoyeuse de douleurs chroniques, lymphocèle, lymphœdème. Ces derniers doivent être repérés précocement afin de mettre en place une rééducation du tronc et du membre supérieur. Leur prévention est capitale (facteurs favorisants : prise poids et absence d’activité physique). Les patientes doivent en être informées en amont.
Actuellement, le ganglion sentinelle est négatif dans 70 % des interventions, permettant ainsi de réduire de deux tiers les effets néfastes du curage.
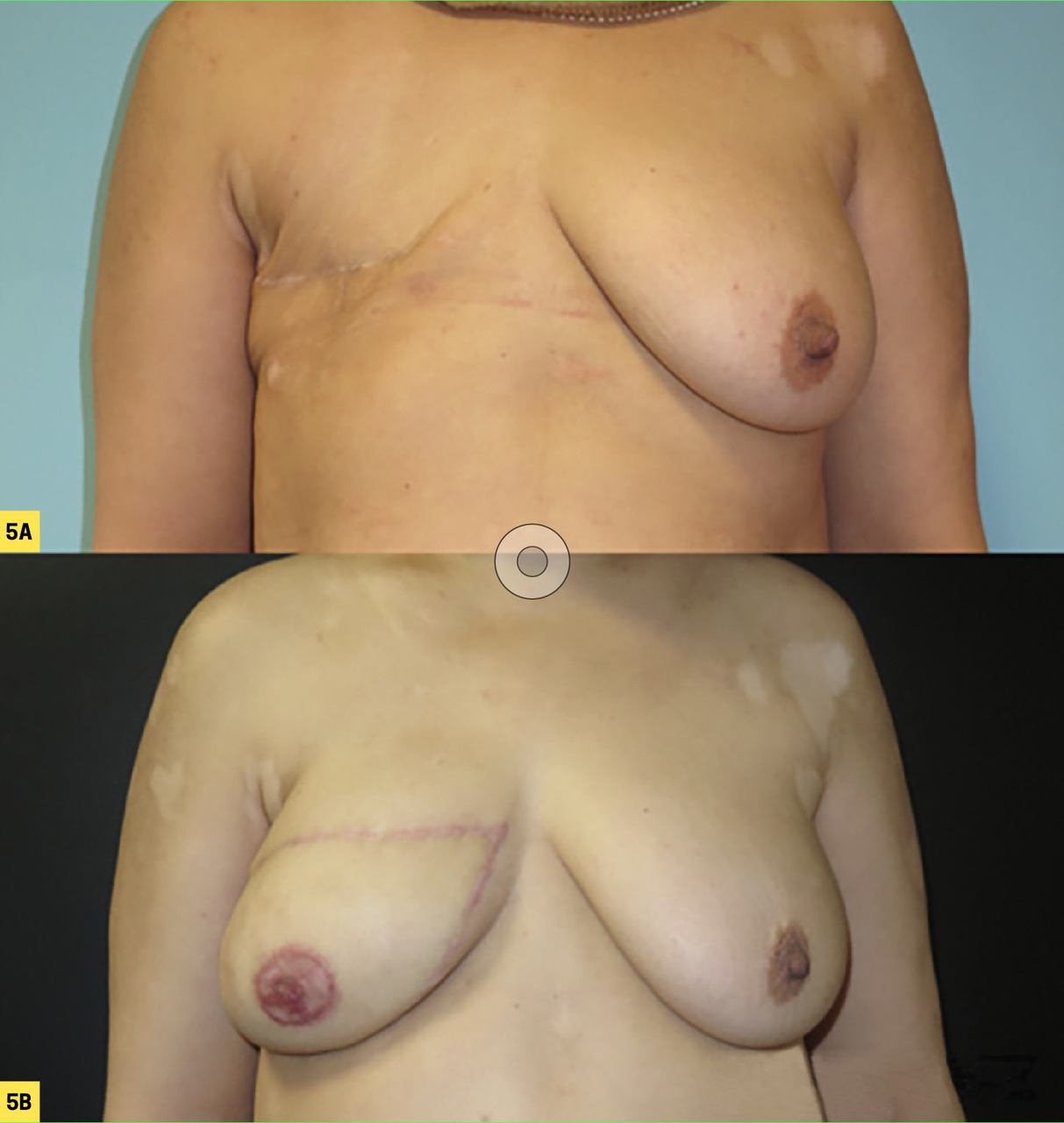
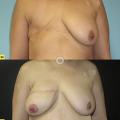
La chirurgie reconstructrice (
En pratique, parmi les patientes qui ont une mastectomie, soit 25 % des femmes traitées, 30 % ont une reconstruction chirurgicale. Les raisons de ce taux très bas sont multiples : refus d’une nouvelle hospitalisation, acceptation de l’asymétrie avec le temps, raisons financières, manque d’information. Les patientes peuvent en bénéficier à n’importe quel moment (même 10 ans après), ou préférer une autre approche (prothèse externe, tatouage, vêtements…). Dans tous les cas, il est essentiel de respecter leur choix, sans jugement, élément clé de leur reconstruction globale.
Traitements complémentaires
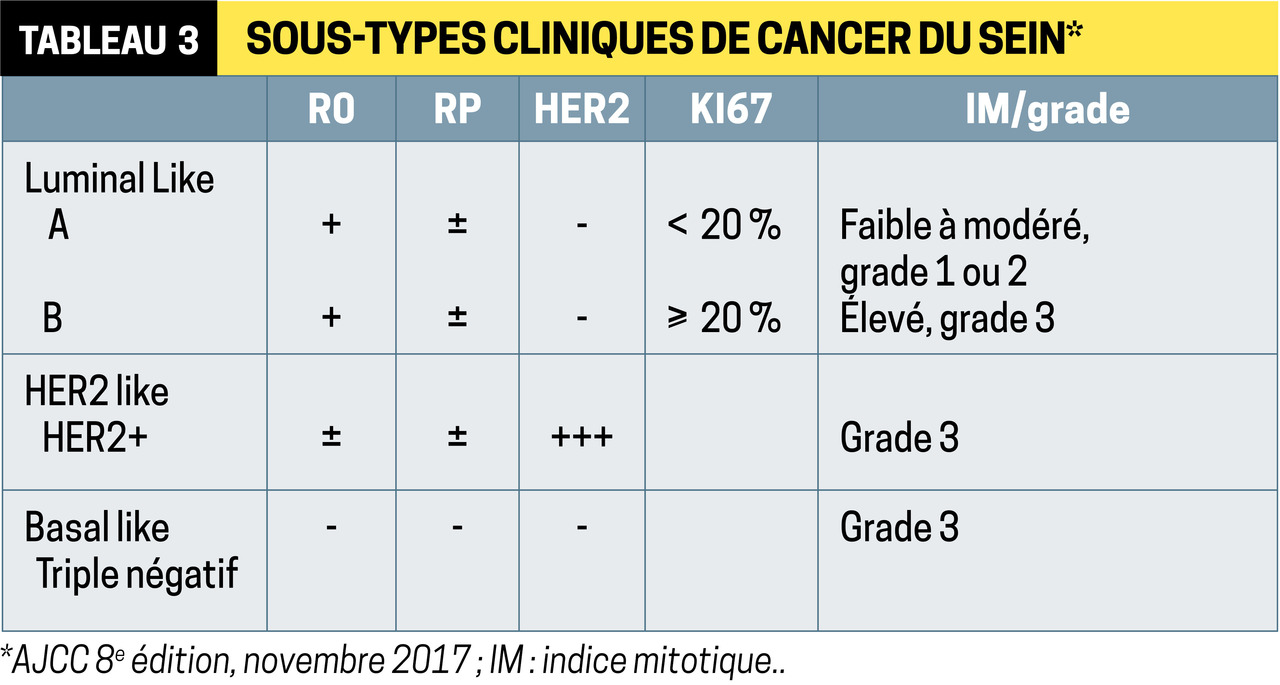
La chimiothérapie est indiquée dans les cancers proliférants et les grosses tumeurs : principalement les luminaux B T2, les triples négatifs et ceux surexprimant HER2. Dans la majorité des cas, elle est administrée après la chirurgie dans les 4 à 8 semaines, en prévention des récidives. Parfois, une analyse prédictive moléculaire permet de personnaliser le choix thérapeutique. Protocole habituel : 3 cycles de FEC 100 (5-fluoro-uracile, épirubicine, cyclophosphamide) suivis de 3 cycles de Taxotere (ou Taxol hebdomadaire). Si le HER2 est surexprimé par la tumeur, une thérapie ciblée, le trastuzumab (Herceptin et biosiminaires), est donnée en même temps et prolongée pendant 1 an.
La chimiothérapie est administrée via un cathéter à chambre implantable. Les cycles sont espacés de 3 semaines (durée totale : 4 mois).
Parfois, elle est prescrite en néoadjuvant, surtout en cas de grosses tumeurs proliférantes qui nécessiteraient une mastectomie totale, afin d’en diminuer la taille et de préserver le sein lors de la chirurgie, sans préjudice en termes de survie.
L’hormonothérapie est indiquée dans les cancers luminaux A et B (exprimant les récepteurs hormonaux), à l’issue des traitements loco-régionaux : tamoxifène pour les femmes non ménopausées et anti- aromatases (létrozole, exemestane ou anastrozole), pour les femmes ménopausées ou non, en association avec un agoniste de la LHRH. La durée de prescription est de 5 à 10 ans selon le type de cancer et l’âge des patientes.
Avant prescription de tamoxifène, une échographie pelvienne est réalisée pour bilan utéro-ovarien en raison d’un risque endométrial ou d’augmentation de volume d’un kyste ovarien. La patiente doit bénéficier d’une contraception efficace par stérilet au cuivre (car le tamoxifène est inducteur de l’ovulation).
Cette molécule est contre indiquée en cas de risque thrombo-embolique.
Bilan glucido-lipidique et densitométrie osseuse (risque ostéopénique et ostéoporotique) sont nécessaires avant traitement par anti-aromatases.
Une activité physique adaptée est bénéfique pendant la prise en charge et ensuite à vie. Elle est efficace en termes de gain en survie et diminution de récidive. Actuellement, les établissements hospitaliers la proposent dès le diagnostic, en individuel ou collectif, via des associations comme la CAMI, Siel Bleu… C’est un traitement au même titre que les autres. Selon l’amendement n° 917, mars 2015 : « Art. 1142 30. – Dans le cadre du parcours de soins des patients atteints d’une maladie de longue durée, le médecin traitant peut prescrire une activité physique adaptée à la pathologie, aux capacités physiques et au risque médical du patient… Les activités physiques adaptées sont dispensées par des organismes soumis aux dispositions du code du sport et labellisés par l’agence régionale de santé et par les services de l’État compétents, dans des conditions prévues par décret ». De plus, « une formation à la prescription d’une activité physique adaptée est dispensée dans le cadre des études médicales et paramédicales ».
Gérer les effets indésirables
Les complications chirurgicales postopératoires précoces (hématome, infection et désunion de cicatrice), rares (< 10 %), sont prises en charge par les équipes médico-infirmières hospitalières.
Le lymphocèle – poche de liquide lymphatique se formant après curage axillaire ou mastectomie – survient dans 20 à 40 % des cas ; la ponction est réalisée soit dans le service soit, dans certaines régions (Nantes), par les généralistes (des kits sont remis à la patiente à la sortie de l’hôpital).
Les effets secondaires de la radiothérapie, à court et long termes, réversibles ou non, sont bien connus : réactions cutanées aiguës, télangiectasies, rétractions cicatricielles cutanées, fibrose sous-cutanée ou pulmonaire, ostéonécrose costale, œdèmes des membres supérieurs et du creux axillaire, fatigue, morbidité cardiaque, tumeurs radio-induites, atteinte du plexus brachial.
Si les progrès de la chirurgie et de la radiothérapie ont pratiquement éliminé les plus sévères de ces complications, érythème, douleur et fatigue restent fréquents en cas d’irradiation externe délivrée sur la totalité du sein selon les modalités classiques. Des fiches sont remises aux patientes leur expliquant les signes d’appel et leur prise en charge.
L’alopécie est très fréquente dans les protocoles à base de FEC et de taxanes, ainsi que la leucopénie fébrile, qui nécessite un traitement rapide dans le service d’urgence le plus proche ou en oncologie. Toute fièvre survenant en cours de chimiothérapie impose une NFS, et en cas de leucopénie une hospitalisation.
Sous tamoxifène, une métrorragie post-ménopausique doit motiver une échographie pelvienne et une hystéroscopie-curetage ; toute suspicion de phlébite ou d’embolie pulmonaire doit être explorée ; sous anti-aromatase, surviennent surtout des arthralgies, le risque fracturaire est moindre.
Enfin, le médecin généraliste doit rappeler l’importance des règles hygiénodiététiques et de la pratique d’une activité physique régulière.
Surveillance (tableau 4)
Des manifestations cliniques – asthénie, amaigrissement, douleur osseuse brutale inhabituelle (rachis, membres inférieurs ou supérieurs), dyspnée, signe évocateur d’une métastase – imposent un bilan biologique complet (NFS, ASAT, ALAT, iono, urée, créatininémie, CA 15-3), une scintigraphie osseuse et/ou scanner thoraco-abdomino pelvien et/ou écho pelvienne.
Afin d’optimiser le suivi, un programme personnalisé de l’après-cancer (PPAC) a été testé lors du Plan cancer 2009-2013, puis progressivement mis en place. Il a notamment pour objectif la surveillance médicale conjointe entre spécialiste et médecin traitant. Les patientes concernées sont de plus en plus nombreuses en raison de la grande fréquence de cette maladie de moins en moins mortelle.
Perspectives
De nouvelles méthodes de dépistage sont à l’étude, telles que la détection transcutanée par odorologie canine (DTOC), avec une étude multicentrique à venir (cf. www.kdog.fr). En effet, les chiens sont dressés à reconnaître les composés organiques volatiles que dégage le cancer. Les signatures moléculaires (Oncotype DX, Mamma print, PAM 50) devraient permettre de mieux définir l’indication de la chimiothérapie (via le calcul d’un score de récidive). Les biomarqueurs circulants (ADN et cellules tumorales circulantes), dont l’intérêt clinique est à démontrer en termes de suivi, sont utiles pour adapter les chimiothérapies des cancers métastasés.
Les perspectives thérapeutiques sont multiples. En chirurgie : désescalade épargnant les ganglions axillaires non atteints (comme le ganglion sentinelle) ; techniques de reconstruction individualisée ; information sur la mastectomie en phase avec l’attente des patientes (site guerirleregard.fr). En radiothérapie : évolution vers des traitements hypofractionnés (13 à 16 plutot que 25) [essai START] ou intra-opératoires (étude Targit), voire abstention dans certains cas de cancers in situ (essai ROMANCE, en cours).
Pour les traitements systémiques : Herceptin en sous-cutané et thérapies per os (anti CDK4/6 : palbociclib, ribociclib) dans le cancer du sein localement avancé ou métastatique RH+/HER2-.
D’autres types d’information se développent : livrets ou films documentaires « co-construits » avec les patientes et avec des dessinateurs, réalisateurs (http://guerirleregard.fr). Associations et réseaux de patientes sont extrêmement actifs (www.monreseau-cancerdusein.com). Un semestriel, Rose Magazine, porte un nouveau regard sur les patients traités pour un cancer (https://www.rose-up.fr/magazine/).
Réunion de concertation pluridisciplinaire : quel intérêt ?
Les RCP sont obligatoires dans les établissements prenant en charge le cancer. Elles réunissent au minimum 3 spécialistes : chirurgien, oncologue et radiothérapeute ; les radiologues et les anatomopathologistes devraient participer, ou être joignables si besoin. Généralement, les dossiers sont soumis avant et après la chirurgie, avec les résultats histologiques complets, et dans tous les cas avant tout traitement néo-adjuvant. Ces réunions permettent de prendre des décisions partagées, d’anticiper la prise en charge à venir et de mieux préparer le parcours de soin de chaque patiente. Elles s’appuient sur des référentiels régionaux ou nationaux, et la concertation de spécialistes, pour décider à la fois du choix et de l’ordre des thérapeutiques. Les décisions sont transmises au médecin traitant, qui peut prendre part à la discussion s’il le souhaite, en particulier en cas de comorbidités, de fragilité sociale, etc.
Cas particulier : suivi des patientes sous tamoxifène
Si la femme n’est pas ménopausée, s’assurer d’une contraception efficace, prévoir une échographie pelvienne annuelle pour la surveillance utéro-ovarienne. Un aspect glandulo-kystique de l’endomètre est normal. Mais tout saignement anormal, en particulier chez les patientes ménopausées, doit conduire à une consultation gynécologique et une hystéroscopie avec curetage endométrial pour écarter un cancer de l’endomètre. Le risque est très faible (3 %), il est lié surtout à une exposition prolongée (> 5 ans).
En cas d’effets indésirables (bouffées de chaleur, arthralgie, insomnie, asthénie), on peut changer l’heure de la prise ou la répartir en 2 fois ; si la qualité de vie est altérée, réadresser la patiente à son oncologue pour discuter d’une autre hormonothérapie.
Chiffres clés
54 000 nouveaux cas par an en France.
âge médian : 61 ans.
Survie nette à 5 ans > 85 %.
Trois quarts de traitements conservateurs, un quart d’ablation du sein.
70 % de ganglions sentinelles, 30 % de curages axillaires.
Récidives :
– concernent 30 % des cancers de stades I et II ;
– 80 % surviennent dans les 5 premières années (mais celles tardives, même 20 ans après, sont possibles) ;
– 80 % sont symptomatiques.
2. Giuliano AE, Dale PS, Turner RR, Morton DL, Evans SW, Krasne DL. Improved axillary staging of breast cancer with sentinel lymphadenectomy. Ann Surg 1995;222:394-401.
3. Krag DN, Anderson SJ, Julian TB,et al. Sentinel-lymph-node resection compared with conventional axillary-lymph-node dissection in clinically node-negative patients with breast cancer: overall survival findings from the NSABP B-32 randomised phase 3 trial. Lancet Oncol 2010;11:927-33.
4. Mansel RE, Fallowfield L, Kissin M, et al. Randomized multicenter trial of sentinel node biopsy versus standard axillary treatment in operable breast cancer: the ALMANAC Trial. J Natl Cancer Inst. 2006;98:599-609. Erratum in: J Natl Cancer Inst 2006 ;98:876.
5. Héquet D, Zarca K, Dolbeault S, et al. Reasons of not having breast reconstruction: a historical cohort of 1937 breast cancer patients undergoing mastectomy. SpringerPlus 2013;2:325.
6. Senkus E, Kyriakides S, Ohno S, et al. Primary breast cancer: ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 2015;26(suppl 5):v8-30.
7. Sisler J, Chaput G, Sussman J, Ozokwelu E. Suivi après le traitement du cancer du sein. Can Fam Physician 2016;62:e578-85.
8. Cancer du sein : quel type de surveillance pour optimiser le suivi ? GENESIS 19 avril 2018. https://bit.ly/2Rsh05C
9. Bidard FC, Peeters DJ, Fehm T, et al. Clinical validity of circulating tumour cells in patients with metastatic breast cancer: a pooled analysis of individual patient data. Lancet Oncol 2014;15:406-14.

 Encadrés
Encadrés