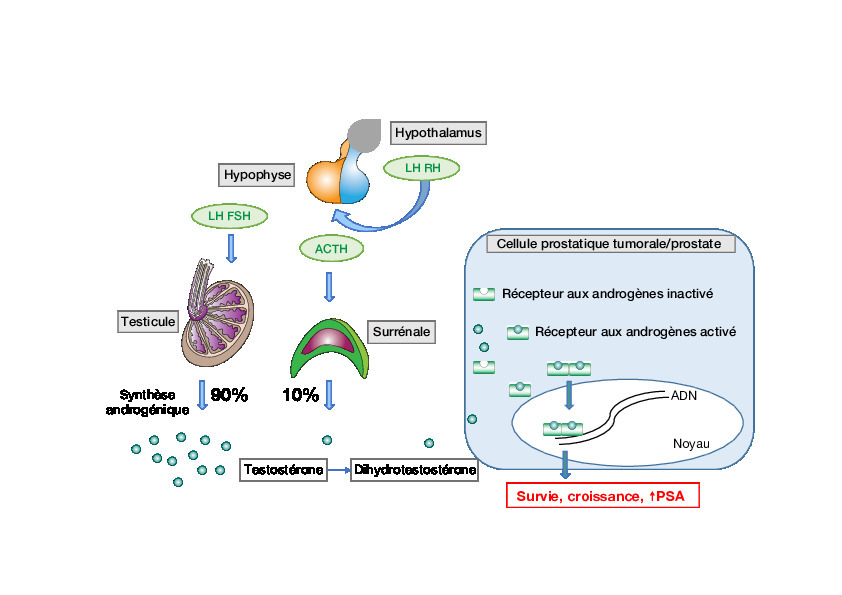
L’hormonothérapie est le traitement de référence au stade métastatique.
Avec environ 54 000 nouveaux cas diagnostiqués et 9 000 décès par an, le cancer de la prostate est le premier en termes d’incidence et la 3e cause de mortalité par cancer chez l’homme en France1 (âge moyen au diagnostic : 70 ans). Il est hormonodépendant. En effet, la voie de signalisation du récepteur aux androgènes, dont le ligand principal est la dihydrotestostérone, joue un rôle majeur dans le mécanisme oncogénique. Une fois activé, ce récepteur migre dans le noyau pour se fixer sur l’ADN et induire la transcription de gènes cibles impliqués dans la survie et la prolifération de la cellule prostatique (figure). Objectif de l’hormonothérapie : inhiber la synthèse des androgènes.
Deux types de traitement
Hormonothérapie conventionnelle
La déprivation androgénique est obtenue par castration chimique. Deux approches sont possibles.
Les analogues (agonistes) de l’hormone de libération de la lutéinostimuline ou LH-RH (leuproréline, Eligard, Enantone ; buséréline, Bigonist, Suprefact ; goséréline, Zoladex ; triptoréline, Decapeptyl, Salvacyl) sont des molécules synthétiques de forte affinité responsables d’une saturation des récepteurs hypophysaires et de leur désensibilisation. Toutefois, ils provoquent initialement une hyperproduction paradoxale de FSH (hormone folliculostimulante) et de LH (hormone lutéinisante) et, par conséquent, une augmentation des androgènes circulants. Il faut donc leur associer un anti-androgène périphérique pendant les premières 3 semaines (bicalutamide, flutamide, nilutamide), pour prévenir les éventuels symptômes (douleurs, rétention urinaire ou compression neurologique en cas de métastases rachidiennes) liés à cet effet « flare up ».
L’antagoniste de la LH-RH (dégarélix, Firmagon) bloque directement les récepteurs assurant une castration rapide.
Dans les 2 cas, la sécrétion des androgènes est supprimée via l’inhibition de la pulsatilité physiologique hypophysaire de la LH et de la FSH. Ces thérapies agissent sur la synthèse androgénique testiculaire, mais pas sur celle des surrénales ou des cellules tumorales prostatiques.
Les analogues (agonistes) de l’hormone de libération de la lutéinostimuline ou LH-RH (leuproréline, Eligard, Enantone ; buséréline, Bigonist, Suprefact ; goséréline, Zoladex ; triptoréline, Decapeptyl, Salvacyl) sont des molécules synthétiques de forte affinité responsables d’une saturation des récepteurs hypophysaires et de leur désensibilisation. Toutefois, ils provoquent initialement une hyperproduction paradoxale de FSH (hormone folliculostimulante) et de LH (hormone lutéinisante) et, par conséquent, une augmentation des androgènes circulants. Il faut donc leur associer un anti-androgène périphérique pendant les premières 3 semaines (bicalutamide, flutamide, nilutamide), pour prévenir les éventuels symptômes (douleurs, rétention urinaire ou compression neurologique en cas de métastases rachidiennes) liés à cet effet « flare up ».
L’antagoniste de la LH-RH (dégarélix, Firmagon) bloque directement les récepteurs assurant une castration rapide.
Dans les 2 cas, la sécrétion des androgènes est supprimée via l’inhibition de la pulsatilité physiologique hypophysaire de la LH et de la FSH. Ces thérapies agissent sur la synthèse androgénique testiculaire, mais pas sur celle des surrénales ou des cellules tumorales prostatiques.
Nouvelle génération
L’enzalutamide (Xtandi) et l’acétate d’abiratérone (Zytiga) ont montré un bénéfice significatif en termes de survie globale chez les patients métastatiques résistant à la castration, asymptomatiques ou peu symptomatiques, avant et après chimio-thérapie par docétaxel (Taxotere).2, 3 Ces molécules ont une efficacité équivalente et une bonne tolérance, le choix est fait selon le profil de toxicité et les comorbidités du patient.
L’acétate d’abiratérone est un inhibiteur oral sélectif et irréversible du cytochrome P450c17, enzyme capitale dans la biosynthèse des androgènes, responsable de la conversion de la prégnénolone et de la progestérone en DHEA, puis en andro-stènedione, précurseurs de la testostérone et de la dihydrotestostérone. Il bloque ainsi la synthèse des androgènes au niveau des glandes surrénales et des testicules. Sa toxicité est limitée par l’administration concomitante de 10 mg par jour de prednisone, dont l’objectif est de prévenir l’insuffisance surrénalienne et un éventuel hyperaldo-stéronisme secondaire responsable d’HTA, d’hypokaliémie et d’œdèmes sur rétention hydrosodée. Des troubles cardiaques et une cytolyse hépatique sont parfois décrits.
L’enzalutamide est un anti-androgène oral qui inhibe la liaison des androgènes au récepteur de façon compétitive et très sélective. À la différence des anti-androgènes périphériques de première génération, il bloque également la translocation nucléaire du récepteur, sa liaison à l’ADN et les interactions avec ses coactivateurs. Il est contre-indiqué en cas d’antécédents de crises d’épilepsie. Effets secondaires possibles : HTA, troubles mnésiques, chutes et arthralgies.
D’autres molécules ont montré un intérêt dans certaines indications, comme l’apalutamide (ATU) et le darolutamide (en cours de développement).
L’acétate d’abiratérone est un inhibiteur oral sélectif et irréversible du cytochrome P450c17, enzyme capitale dans la biosynthèse des androgènes, responsable de la conversion de la prégnénolone et de la progestérone en DHEA, puis en andro-stènedione, précurseurs de la testostérone et de la dihydrotestostérone. Il bloque ainsi la synthèse des androgènes au niveau des glandes surrénales et des testicules. Sa toxicité est limitée par l’administration concomitante de 10 mg par jour de prednisone, dont l’objectif est de prévenir l’insuffisance surrénalienne et un éventuel hyperaldo-stéronisme secondaire responsable d’HTA, d’hypokaliémie et d’œdèmes sur rétention hydrosodée. Des troubles cardiaques et une cytolyse hépatique sont parfois décrits.
L’enzalutamide est un anti-androgène oral qui inhibe la liaison des androgènes au récepteur de façon compétitive et très sélective. À la différence des anti-androgènes périphériques de première génération, il bloque également la translocation nucléaire du récepteur, sa liaison à l’ADN et les interactions avec ses coactivateurs. Il est contre-indiqué en cas d’antécédents de crises d’épilepsie. Effets secondaires possibles : HTA, troubles mnésiques, chutes et arthralgies.
D’autres molécules ont montré un intérêt dans certaines indications, comme l’apalutamide (ATU) et le darolutamide (en cours de développement).
Cancer localisé
Quatre approches peuvent être proposées aux patients : la surveillance active, la prostatectomie radicale, la radiothérapie externe associée ou non à l’hormonothérapie et la curiethérapie. Le choix repose sur le pronostic (faible, intermédiaire ou haut risque selon la classification d’Amigo, qui prend en compte taux de PSA, stade clinique T du TNM et score histopronostique de Gleason), l’âge, les comorbidités, le souhait du patient. L’hormonothérapie a une place en association à la radiothérapie externe prostatique chez les patients de risque intermédiaire (6 mois de traitement) ou haut (18 mois).
En cas de rechute biologique après traitement local (chirurgie ou radiothérapie), une hormonothérapie classique peut être instaurée de façon intermittente (interrompue lorsque la maladie est contrôlée, reprise si ascension du PSA > 10-20 ng/mL). L’objectif étant d’augmenter la survie en retardant l’apparition de la phase de résistance et d’améliorer la qualité de vie.
En cas de rechute biologique après traitement local (chirurgie ou radiothérapie), une hormonothérapie classique peut être instaurée de façon intermittente (interrompue lorsque la maladie est contrôlée, reprise si ascension du PSA > 10-20 ng/mL). L’objectif étant d’augmenter la survie en retardant l’apparition de la phase de résistance et d’améliorer la qualité de vie.
Cancer avancé
Qu’il soit métastatique d’emblée (15 % des cas) ou en rechute (25 à 50 %), la déprivation androgénique est la référence. On distingue 2 étapes dans l’histoire naturelle de ces tumeurs. Dans un premier temps, elles sont hormonosensibles (le PSA est contrôlé sous hormonothérapie classique). Puis elles évoluent vers une résistance à la castration (50 à 80 % des cas), à plus ou moins long terme, en environ 2 ans (PSA augmenté malgré un traitement optimal et testostéronémie effondrée, < 0,5 ng/mL) ; le pronostic est alors sombre : la médiane de survie globale est de 2 ans.
Pendant la phase d’hormonosensibilité, la chimiothérapie par docétaxel (Taxotere) est depuis 2015 le standard, en association à l’hormonothérapie classique, chez les malades avec une charge tumorale élevée et/ou symptomatiques.4 Par ailleurs, une étude randomisée de 2017 a montré, chez des patients métastatiques d’emblée à haut risque (au moins 2 des 3 critères suivants : score histopronostique de Glea-son > 8, au moins 3 métastases osseuses et des métastases viscérales), que l’ajout de l’acétate d’abiratérone (Zytiga) à l’hormonothérapie classique augmente la survie globale, diminuant d’environ 40 % le risque de décès et de plus de 50 % celui de rechute après 2 ans et demi de suivi.5
Durant la phase hormonoréfractaire, les anomalies de la voie du récepteur aux androgènes restent fortement impliquées dans la progression tumorale. L’hor-monothérapie conventionnelle doit donc être poursuivie, car un certain nombre de cellules tumorales y restent sensibles. On peut y associer plusieurs lignes de traitement. Cinq thérapies ont démontré un bénéfice en termes de survie globale : docétaxel (Taxotere), enzalutamide (Xtandi), acétate d’abiratérone (Zytiga), radiothérapie métabolique (radium 223) en cas de douleurs osseuses sans métastase viscérale, vaccin Sipuleucel-T.4 Les 2 dernières options ne sont pas disponibles en France.
Pendant la phase d’hormonosensibilité, la chimiothérapie par docétaxel (Taxotere) est depuis 2015 le standard, en association à l’hormonothérapie classique, chez les malades avec une charge tumorale élevée et/ou symptomatiques.4 Par ailleurs, une étude randomisée de 2017 a montré, chez des patients métastatiques d’emblée à haut risque (au moins 2 des 3 critères suivants : score histopronostique de Glea-son > 8, au moins 3 métastases osseuses et des métastases viscérales), que l’ajout de l’acétate d’abiratérone (Zytiga) à l’hormonothérapie classique augmente la survie globale, diminuant d’environ 40 % le risque de décès et de plus de 50 % celui de rechute après 2 ans et demi de suivi.5
Durant la phase hormonoréfractaire, les anomalies de la voie du récepteur aux androgènes restent fortement impliquées dans la progression tumorale. L’hor-monothérapie conventionnelle doit donc être poursuivie, car un certain nombre de cellules tumorales y restent sensibles. On peut y associer plusieurs lignes de traitement. Cinq thérapies ont démontré un bénéfice en termes de survie globale : docétaxel (Taxotere), enzalutamide (Xtandi), acétate d’abiratérone (Zytiga), radiothérapie métabolique (radium 223) en cas de douleurs osseuses sans métastase viscérale, vaccin Sipuleucel-T.4 Les 2 dernières options ne sont pas disponibles en France.
Prévention des complications
L’action suppressive en androgènes s’accompagne à moyen et long terme de certains effets secondaires : troubles vasomoteurs ou de la libido, dysfonction érectile, prise de poids, asthénie, syndrome métabolique, perte musculaire, déminéralisation osseuse (avec risque de fracture), dépression. La castration est responsable d’une augmentation de la morbi-mortalité cardiovasculaire, qui doit faire l’objet d’une prévention.
Les règles hygiénodiététiques telles que l’arrêt du tabac et de l’alcool, et la pratique d’une activité physique régulière quotidienne font partie intégrante du traitement. Plus cette dernière est initiée tôt, plus ses effets sont bénéfiques : protection cardiovasculaire, osseuse, métabolique et musculaire, amélioration de la qualité de vie et du pronostic.
Les règles hygiénodiététiques telles que l’arrêt du tabac et de l’alcool, et la pratique d’une activité physique régulière quotidienne font partie intégrante du traitement. Plus cette dernière est initiée tôt, plus ses effets sont bénéfiques : protection cardiovasculaire, osseuse, métabolique et musculaire, amélioration de la qualité de vie et du pronostic.
Encadre
Cas particulier : cancer non métastatique (CPRC M0) en phase hormonoréfractaire
La surveillance rapprochée du PSA sous déprivation androgénique permet de mettre en évidence de façon précoce une résistance à la castration. Chez certains patients, cette dernière se manifeste par l’élévation progressive de ce marqueur, alors que l’imagerie est normale (TDM thoraco-abdomino-pelvienne et scintigraphie osseuse). Selon 2 essais randomisés récents menés chez des patients à haut risque (temps de doublement du PSA < 10 mois), l’enzalutamide (Xtandi) et l’apalutamide (nouvel anti-androgène disponible en ATU) augmentent la survie sans métastase de plus de 3 ans par rapport au placebo.
références
1. Leone N; Francim, HCL, InVS, INCa. Les cancers en France, 2015.
2. Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2012;13:983-92.
3. Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014;371:424-33.
4. Cornford P, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part II: Treatment of Relapsing, Metastatic, and Castration-Resistant Prostate Cancer. Eur Urol 2017;71: 630-42.
5. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2017;377:352-60.
2. Fizazi K, Scher HI, Molina A, et al. Abiraterone acetate for treatment of metastatic castration-resistant prostate cancer: final overall survival analysis of the COU-AA-301 randomised, double-blind, placebo-controlled phase 3 study. Lancet Oncol 2012;13:983-92.
3. Beer TM, Armstrong AJ, Rathkopf DE, et al. Enzalutamide in metastatic prostate cancer before chemotherapy. N Engl J Med 2014;371:424-33.
4. Cornford P, Bellmunt J, Bolla M, et al. EAU-ESTRO-SIOG Guidelines on Prostate Cancer. Part II: Treatment of Relapsing, Metastatic, and Castration-Resistant Prostate Cancer. Eur Urol 2017;71: 630-42.
5. Fizazi K, Tran N, Fein L, et al. Abiraterone plus Prednisone in Metastatic, Castration-Sensitive Prostate Cancer. N Engl J Med 2017;377:352-60.

 Encadrés
Encadrés