Immunothérapie : une révolution
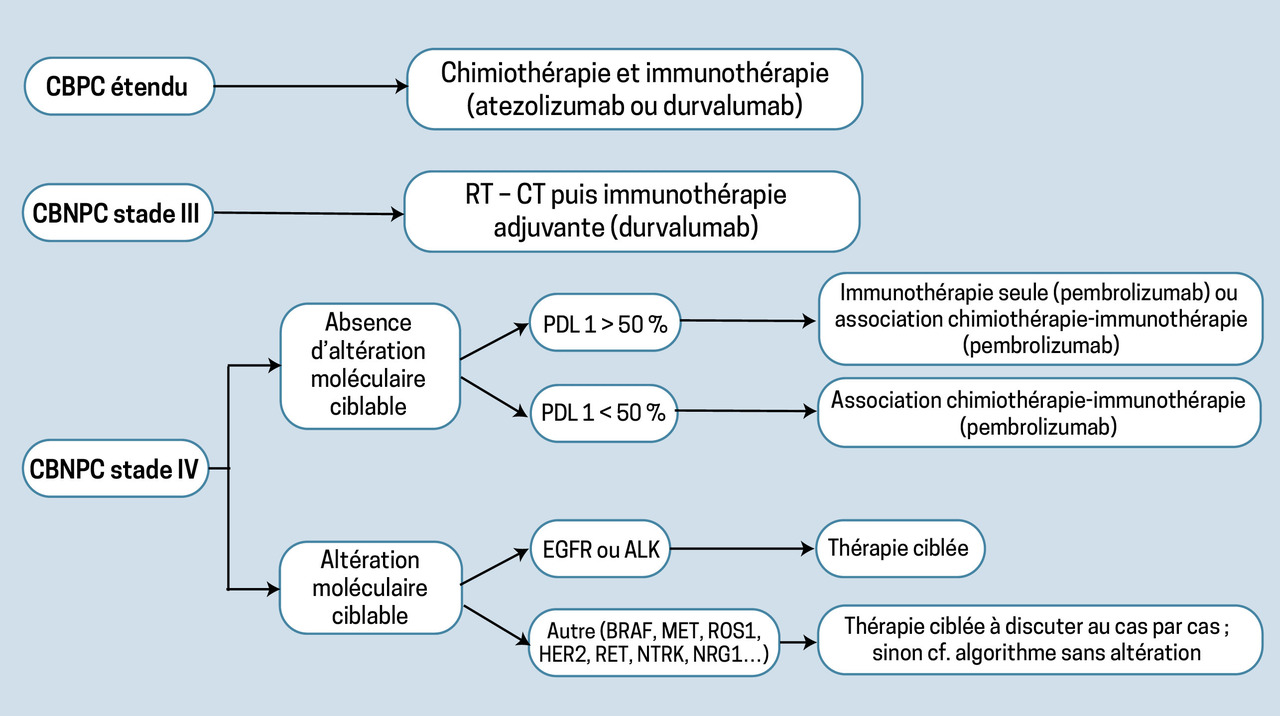
Dans les cancers bronchiques non à petites cellules (CBNPC) métastatiques, les inhibiteurs de la voie PD-1/PD-L1 ont d’abord été développés en monothérapie, en deuxième ligne, où ils ont démontré leur supériorité en termes de survie globale (SG) par rapport à la chimiothérapie par docétaxel (
Dans les CBNPC localement avancés non accessibles à la chirurgie, le durvalumab en consolidation pendant 1 an après radiochimiothérapie concomitante a lui aussi permis un allongement de la SG.
Enfin, dans les cancers bronchiques à petites cellules (CBPC) étendus, un gain de SG a également été observé en première ligne en cas d’ajout de l’atézoliumab ou du durvalumab à la chimiothérapie par platine et étoposide. Ces résultats ont profondément modifié la prise en charge des cancers pulmonaires (
La particularité de l’immunothérapie est d’engendrer des réponses de très longue durée. Ainsi, avec un recul de plus de 5 ans dans certaines études, on constate qu’une part non négligeable (environ 15-23 %) des patients traités par anti-PD-1 pour un CBNPC métastatique sont encore vivants.
À l’inverse, certains malades ne tirent aucun bénéfice de l’immunothérapie et voient même parfois leur tumeur croître plus rapidement sous traitement. Pour autant, il n’existe actuellement aucun marqueur clinique ou biologique permettant de prédire ces situations.
Si l’immunothérapie est mieux tolérée que la chimiothérapie (7 à 26 % d’effets indésirables de grade 3 ou plus liés aux anti-PD-1/PD-L1 dans les phase III), ces molécules ne sont pas dénuées d’effets indésirables. Leur profil de tolérance est singulier, essentiellement lié au risque d’auto-immunité par activation excessive du système immunitaire.3 Tous les organes peuvent être touchés. Le délai de survenue est extrêmement variable, allant de quelques semaines pour les atteintes cutanées à plusieurs mois ou années pour certaines endocrinopathies.
Les plus fréquents : fatigue, toxicités cutanées, avec principalement des rashs et des prurits peu sévères, digestives – diarrhées ou cytolyses le plus souvent modérées (1 % de grade 3 ou plus) – et endocriniennes (dysthyroïdies). Étant donné leur grande diversité, on doit les évoquer devant tout nouveau symptôme ou toute modification d’un symptôme existant.
Le patient doit aussi être informé des principaux signes inquiétants. En cas de suspicion d’un effet indésirable lié à l’immunothérapie, il faut :
– éliminer les diagnostics différentiels ;
– évaluer le grade de sévérité selon le Common Terminology Criteria for Adverse Events version 5 (CTCAE v5) ;
– déterminer la conduite à tenir selon ce grade (surveillance/arrêt de l’immunothérapie/corticothérapie/immunosuppresseur) ;
– surveiller l’évolution et décider de la poursuite ou de l’arrêt définitif de l’immunothérapie.
Des recommandations détaillées permettent la prise en charge de chacun des effets indésirables. 4 Dans la majorité des cas, la suspension au moins temporaire du traitement n’est envisagée qu’à partir du grade 2.
Exceptions : les toxicités neurologiques et cardiaques – pour lesquelles elle est recommandée dès le grade 1 – et thyroïdienne et cutanée où elle n’est préconisée qu’à partir du grade 3.
De manière intéressante, on n’observe pas de nouvelle nocivité ou d’effet synergique en cas d’association chimiothérapie-anti-PD-1/PD-L1 mais plutôt un effet cumulatif, ajoutant le risque d’auto-immunité aux effets indésirables habituels de la chimiothérapie.
Questions en suspens
Étant donné la complexité et l’intrication des phénomènes biologiques en jeu, il sera probablement nécessaire d’utiliser une combinaison de plusieurs de ces variables pour prédire l’efficacité des anti-PD-1/PD-L1.
Autre inconnue : la durée optimale du traitement. Dans les études, il était poursuivi jusqu’à progression ou toxicité au maximum 2 ans. Nous ne savons pas à l’heure actuelle s’il faut le maintenir au-delà ou, au contraire, s’il peut être arrêté plus précocement. La désescalade est un des grands enjeux des prochaines années.
Le schéma d’administration et les indications vont probablement encore évoluer. En effet, plusieurs études sont en cours pour évaluer l’immunothérapie en adjuvant ou néoadjuvant dans les stades précoces.
Certaines visent à améliorer l’efficacité des anti-PD-1/PD-L1 en les combinant avec d’autres inhibiteurs de point de contrôle immunitaire, des modulateurs du micro- environnement tumoral, des vaccins ou des thérapies cellulaires utilisant notamment des lymphocytes T génétiquement modifiés.5
Thérapies ciblées
Elles reposent sur le concept d’addiction oncogénique, modèle qui se distingue de celui, plus connu, de carcinogenèse multi-étapes où la cellule cancéreuse est l’étape finale d’un processus lent et progressif de modification d’une cellule initialement normale par l’accumulation d’altérations moléculaires. À l’inverse, dans l’addiction, le phénotype transformant est dû à l’acquisition d’une seule anomalie (le plus souvent génétique de type mutation ponctuelle, réarrangement chromosomique et amplification). La cellule cancéreuse devient alors dépendante d’une seule voie de signalisation, activée par l’altération moléculaire en cause. Corollaire : elle est vulnérable à l’inhibition de la voie dérégulée. Ce concept, dit de « talon d’Achille », sous-tend l’efficacité des thérapies ciblées, inhibiteurs ciblant spécifiquement la voie de signalisation pathologique. Leur usage requiert donc d’identifier au préalable l’aberration génétique en cause.
Les 2 grandes altérations moléculaires ciblées dans le cancer du poumon sont les mutations de l’EGFR (Epidermal Growth Factor Receptor) et les réarrangements ALK (Anaplastic Lymphoma Kinase). Elles sont détectées dans 10 et 5 % des CBNPC, respectivement, plus particulièrement chez les non-fumeurs. Les thérapies développées pour freiner l’effet prolifératif induit sont des inhibiteurs de tyrosine kinase (ITK), spécifiques d’EGFR ou ALK. Cette classe thérapeutique est reconnaissable au suffixe -ib.
Plusieurs ITK d’EGFR sont supérieurs à la chimiothérapie dès la première ligne de traitement des CBNPC EGFR-mutés de stade IV : géfitinib, Iressa ; erlotinib, Tarceva ; afatinib, Giotrif (amélioration de la survie sans progression). Il en va de même pour les ITK d’ALK dans les CBNPC ALK-réarrangés : crizotinib, Xalkori ; céritinib, Zykadia. D’une façon générale, la taille de la tumeur diminue chez la très grande majorité des patients. L’absence de progression tumorale dure environ 1 an en médiane mais peut atteindre plusieurs années. Néanmoins, la progression est inéluctable.
La tolérance est habituellement bonne, surtout comparée à celle de la chimiothérapie. Des effets secondaires cutanés (rash acnéiforme) ou digestifs (diarrhées) peuvent devenir gênants chez les patients traités sur une longue durée (jusqu’à progression). Il faut éviter les arrêts prolongés (> 1 semaine) en raison du risque de flambée tumorale (effet « flare up ») survenant en quelques semaines.
La majorité des mécanismes de résistance est connue. Il s’agit le plus souvent d’une nouvelle mutation émergeant au sein même de la kinase ciblée et empêchant l’ITK de la bloquer efficacement. Une nouvelle biopsie tumorale est alors nécessaire ou, lorsque la tumeur n’est pas accessible, une analyse sanguine, à la recherche d’ADN tumoral circulant (« biopsie liquide »).
Les ITK dits de « nouvelle génération » sont capables de surmonter les mutations de résistance, que ce soit dans les CBNPC EGFR-mutés (osimertinib, Tagrisso) ou dans les CBNPC ALK-réarrangés (alectinib, Alecensa ; brigatinib, Alunbrig ; lorlatinib, Lorviqua). Ils ont montré leur intérêt vis-à-vis de certaines progressions chez un patient sous ITK mais sont également efficaces pour retarder davantage la progression tumorale dès la première ligne. Cependant, là encore, elle est inéluctable.
Toutefois, l’émergence de ces thérapies a considérablement modifié le pronostic : la survie globale médiane est de l’ordre de 3 à 6 ans alors qu’elle n’était que de 1 an il y a encore quelques années.6
1. Toxicités des anti-PD-1/PD-L1
• Hyper-,hypothyroïdie, hypophysite, insuffisance surrénalienne, diabète
• Rash/acné, prurit, psoriasis, vitiligo, DRESS Syndrome, syndrome de Stevens-Johnson
• Néphrites
• Anémie hémolytique, thrombopénie, neutropénie, hémophilie
• Arthrite, dermatomyosite
• Pneumopathie interstitielle diffuse, pleurésie, granulomatose sarcoïdose-like
• Neuropathie, syndrome de Guillain-Barré, encéphalite, méningite, myasthénie, myélopathie
• Myocardite, péricardite, vascularite
• Uvéite, conjonctivite, sclérite/épisclérite, blépharite, inflammation de la rétine
• Gastrite, colite, iléite, pancréatite
• Hépatites auto-immune
2. Perspectives
D’autres altérations plus rares ont été détectées dans moins de 1 % des CBNPC : mutations BRAF, MET, HER2, réarrangement ROS1, RET, NTRK, NRG1.6 Le scénario est peu ou prou le même que pour les CBNPC EGFR-mutés dès lors qu’il existe une thérapie ciblée : efficacité rapide et spectaculaire, toxicité limitée mais progression tumorale systématique après quelques mois, voire années.
Toutefois, les mutations KRAS détectées dans 25 % des CBNPC principalement chez les Caucasiens fumeurs ne peuvent être ciblées dans leur totalité par les molécules actuelles. La mise au point d’un inhibiteur de KRAS est un grand défi. Les approches futures visent également le pool de cellules tumorales résiduelles qui survivent malgré l’ITK. Si les moyens d’éradiquer cette « maladie résiduelle » sont encore rudimentaires, une meilleure connaissance des mécanismes à l’œuvre fait espérer un contrôle plus prolongé.
2. Remon J, Ahn MJ, Girard N, et al. Advanced-Stage Non-Small Cell Lung Cancer: Advances in Thoracic Oncology 2018. J Thorac Oncol 2019;14:1134-55.
3. Champiat S, Lambotte O, Barreau E, et al. Management of immune checkpoint blockade dysimmune toxicities: a collaborative position paper. Ann Oncol 2016;27:559-74.
4. Brahmer JR, Lacchetti C, Schneider BJ, et al. Management of Immune-Related Adverse Events in Patients Treated With Immune Checkpoint Inhibitor Therapy: American Society of Clinical Oncology Clinical Practice Guideline. J Clin Oncol 2018;36:1714-68.
5. Remon J, Passiglia F, Ahn MJ, et al. Immune Checkpoint Inhibitors in Thoracic Malignancies: Review of the Existing Evidence by an IASLC Expert Panel and Recommendations. J Thorac Oncol 2020;15:914-47.
6. Remon J, Ahn MJ, Girard N, et al. Advanced-Stage Non-Small Cell Lung Cancer: Advances in Thoracic Oncology 2018. J Thorac Oncol 2019; 14:1134-55.

 Encadrés
Encadrés