en hausse chez la femme
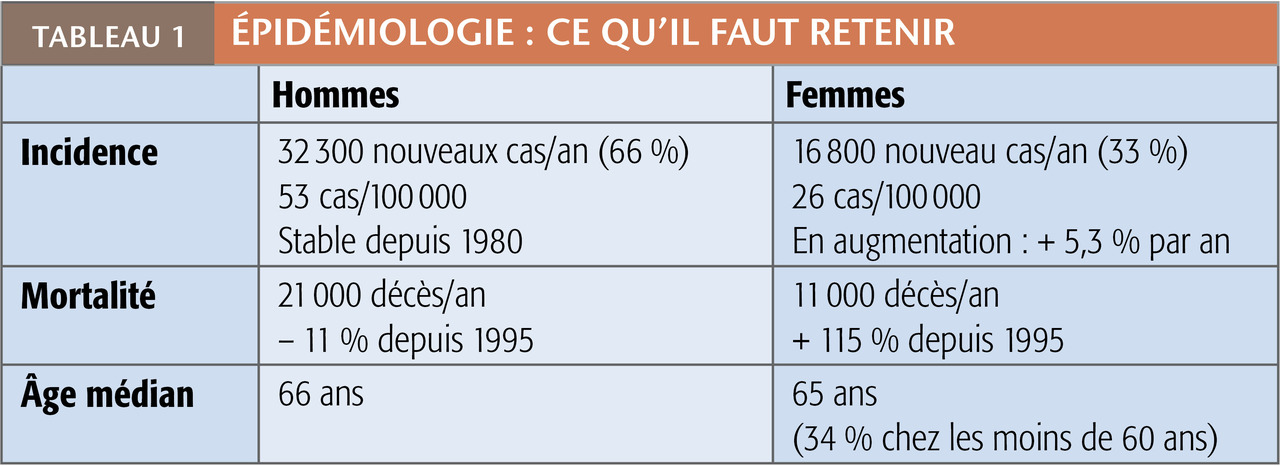
En France : environ 49 000 nouveaux cas en 2017, dont près de 32 300 (66 %) chez l’homme et 16 800 chez la femme. L’âge médian au diagnostic est de 65-66 ans mais 34 % sont découverts avant 60 ans chez la femme. La survie à 5 ans tous stades confondus est d’environ 16 % ; on déplore 32 000 décès par an (tableau 1).
Depuis 1980, l’incidence est stable chez l’homme (environ 53 cas pour 100 000 en 2017), témoignant de l’efficacité des politiques anti-tabac (tarifaires) et de la « dé-normalisation » sociale, alors que chez la femme (environ 26 cas pour 100 000 en 2017), elle a progressé de 5,3 % par an. De même, le taux de mortalité diminue chez l’homme (– 11 %) depuis 20 ans, alors qu’il ne fait qu’augmenter chez la femme (+ 115 %) depuis 1995.
Le tabagisme est responsable de 8 à 9 cancers sur 10, et multiplie le risque de leur apparition par 10-15. L’exposition passive continuelle l’augmente de 26 %. L’inhalation de fibres d’amiante le multiplie par 5, voire 50 chez un fumeur. L’Institut national de recherche et de sécurité (Inrs) estime qu’une origine professionnelle est retrouvée dans 15 % des cas (versus 4 à 8,5 % pour l’ensemble des cancers).
L’incidence augmente en cas d’antécédents familiaux, mais le facteur de confusion est lié au tabagisme (important à chaque génération). Il n’y a pas de gène de susceptibilité, même si une fréquence accrue d’adénocarcinomes pulmonaires a récemment été rapportée dans le très rare syndrome de Li-Fraumeni (mutation germinale du gène suppresseur de tumeur TP53).
Les personnes atteintes de maladies respiratoires chroniques, BPCO, fibrose pulmonaire idiopathique et les désormais rares silicoses ou béryllioses ont aussi un risque majoré, indépendamment de la consommation de tabac, ce qui souligne le rôle de l’inflammation bronchique.
pas un, mais des cancers
Les CBPC sont des tumeurs extrêmement agressives, à diagnostiquer et traiter en urgence en raison d’un temps de doublement de 3 mois. Ceux localisés au thorax comptent pour 30 % des cas au diagnostic, les formes disséminées pour environ 70 %. D’extension le plus souvent médiastinale, les complications locorégionales sont fréquentes, de même que les syndromes paranéoplasiques (encadré 1) notamment neurologiques.
Malgré la grande chimiosensibilité initiale, le taux de rechute est très élevé à cause de l’émergence précoce de clones résistants. Le pronostic est très mauvais.
Parmi les carcinomes bronchiques non à petites cellules, les 2 types histologiques prédominant sont l’adénocarcinome et le carcinome épidermoïde ; les carcinomes indifférenciés à grandes cellules, neuro-endocrines à grandes cellules ou sarcomatoïdes sont plus rares (15 %). Tous les CBNPC partagent la même classification TNM (tableau 2).
Les épidermoïdes (30-35 %) sont les cancers du fumeur, souvent proximaux. L’adénocarcinome (40-45 %) est lui aussi lié au tabagisme (bien qu’on puisse le retrouver chez d’authentiques « jamais fumeurs » ou « petits » fumeurs sevrés), mais il est plus fréquent chez la femme. Il est associé dans environ 15 % des cas à des anomalies moléculaires, répondant ainsi potentiellement aux nouvelles thérapeutiques orales ciblées.
Le facteur pronostique le plus déterminant est le stade tumoral au diagnostic. Malheureusement, 65 à 75 % des CBNPC sont découverts à une phase localement avancée ou métastatique (stade III ou IV) et 65 à 80 % des CBPC le sont lorsqu’ils sont disséminés. Ceci s’explique par l’agressivité intrinsèque de ces cancers, et par le fait qu’ils n’entraînent que tardivement des symptômes, souvent méconnus car banalisés chez un fumeur.
signaux d’alarme
À mesure que la tumeur grossit (extension locorégionale), elle envahit ou comprime des structures anatomiques adjacentes comme la plèvre (douleurs pariétales, épanchement pleural), les gros vaisseaux (syndrome cave supérieur), les corps vertébraux (douleur rachidienne, tassement vertébraux, radiculalgies, voire déficit moteur par compression médullaire), l’œsophage (dysphagie), la paroi thoracique (douleurs).
Ces cancers étant très lymphophiles, ils s’étendent vite aux ganglions voisins et peuvent entraîner des syndromes de compression médiastinale, l’extension se faisant vers les aires sus-claviculaires et axillaire homolatérale, avec des adénopathies à rechercher systématiquement.
Les métastases à distance sont parfois très précoces. Les sites préférentiels sont le poumon lui-même, son enveloppe, la plèvre, les surrénales, le cerveau, l’os et le foie. Ainsi des douleurs osseuses ou abdominales, des troubles neurologiques centraux ou un syndrome méningé, une hypercalcémie par lyse osseuse sont à redouter.
Chez un fumeur, une altération marquée de l’état général ou une fièvre vespérale au long cours imposent la recherche d’un cancer pulmonaire même en l’absence de signe respiratoire.
Les syndromes paranéoplasiques sont fréquents (jusqu’à 10 % des cas), surtout dans les CBPC (encadré 1). Chez un patient tabagique, ils motivent des investigations ; si les premiers résultats sont négatifs, il faut les répéter dans les 3 mois (possible apparition différée de la tumeur).
Des signes de gravité (dyspnée importante, hémoptysie, symptômes neurologiques en faveur d’une atteinte secondaire cérébrale, syndrome cave supérieur, manifestations évoquant une embolie pulmonaire) doivent faire orienter le sujet en urgence vers un service de pneumologie.
place de l’imagerie
Le scanner peut montrer des micronodules (< 3 mm), des nodules (3-30 mm) ou une masse pulmonaire (> 30 mm) suspects, une lymphangite carcinomateuse, un épanchement associé ou non à des épaississements pleuraux. Il permet l’appréciation qualitative du parenchyme pulmonaire, une destruction emphysémateuse témoignant d’une atteinte respiratoire post-tabagique jusqu’alors mésestimée.
Au scanner avec injection, on fait le bilan des adénomégalies médiastinales (> 1 cm de petit axe), des signes de compression (syndrome cave supérieur) ou de thrombose vasculaire infraclinique (artère pulmonaire : embolie pulmonaire).
Sur les coupes extrathoraciques on peut détecter des métastases cérébrales, surrénaliennes, ganglionnaires rétropéritonéales ou hépatiques ; celles touchant l’os sont révélées par les fenêtres osseuses.
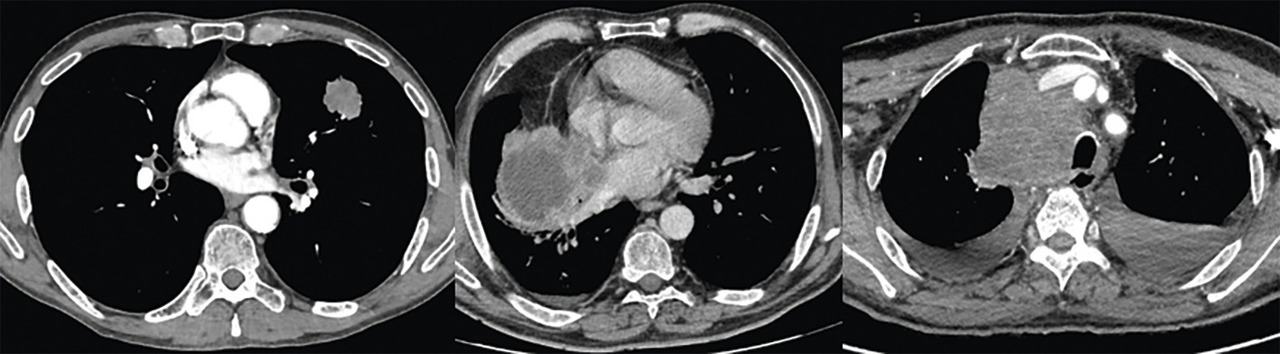
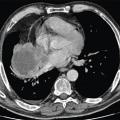
L’aspect radiologique de la lésion primitive oriente le diagnostic, bien que non spécifique : les CBPC se manifestent le plus souvent comme d’énormes complexes ganglio-tumoraux médiastinaux, les carcinomes épidermoïdes sont généralement situés au niveau des bronches proximales avec atélectasie d’aval, nécrose ou cavitation centrale ; enfin, les adénocarcinomes se caractérisent par des lésions périphériques (figure).
Devant une tumeur apparemment localisée au thorax relevant d’un traitement loco-régional, outre l’IRM cérébrale (si le scanner initial n’a pas inclus de coupes encéphaliques), la tomographie par émission de positons (TEP-scanner) permet un bilan d’extension médiastinale et extrathoracique exhaustif (cf. infra).
Diagnostic histologique
Réalisée sous anesthésie locale, par voie naso- ou orotrachéale, elle permet l’étude macroscopique précise de l’arbre trachéobronchique jusqu’aux bronches sous-segmentaires à la recherche d’un bourgeon tumoral, d’une infiltration muqueuse endobronchique ou d’une compression externe. Toute lésion suspecte est systématiquement biopsiée (4 à 6 fois). En cas de CBNPC localisé, des prélèvements systématiques des éperons de division bronchiques lobaires, en amont de la lésion, sont pratiqués pour écarter une extension lymphangitique sous-muqueuse (invisible à l’œil) faisant courir le risque d’un envahissement de suture en cas de chirurgie.
Si la fibroscopie simple n’est pas contributive (tumeur périphérique inaccessible), on envisage une :
– biopsie de métastase accessible (adénopathie sus-claviculaire, sous-cutanée, hépatique…) ;
– ponction transthoracique scanoguidée sous anesthésie locale ;
– écho-endoscopie bronchique pour cytoponction d’une adénopathie médiastinale ;
– médiastinoscopie pour abord vidéo-chirurgical de la chaîne ganglionnaire latéro-trachéale droite sous anesthésie générale, thoracoscopie et vidéo-chirurgie latérothoracique, pour exploration de la cavité pleurale ou des aires ganglionnaires médiastinales gauches, ou, rarement, thoracotomie exploratrice en l’absence d’adénomégalie médiastinale.
L’analyse histologique confirme l’infiltration des biopsies bronchiques ou ganglionnaires par des cellules malignes, et l’éventuel caractère invasif de la tumeur (franchissement de la membrane basale épithéliale bronchique).
Un aspect glandulaire avec coloration positive des mucines (PAS-diastase) est en faveur d’un adénocarcinome, une différenciation malpighienne avec ou sans kératinisation évoque un cancer épidermoïde, une architecture en rosette d’allure neuro-endocrine est caractéristique des carcinomes neuro-endocrines à petites ou grandes cellules.
L’immunomarquage anti-TTF1 (facteur de trans- cription nucléaire) est positif dans 85 à 90 % des adénocarcinomes bronchiques primitifs, contrairement à ceux d’origine extrathoracique (à l’exception du cancer de la thyroïde), permettant le plus souvent de différencier un primitif pulmonaire d’une lésion secondaire à un autre cancer.
Dans le CBNPC avancé, d’autres immunomarquages guident le choix thérapeutique : anticorps anti-PD-L1 (facteur prédictif de réponse à l’immunothérapie), anti-ALK et ROS1 (témoignant d’une translocation dans ces gènes).
Un panel d’anomalies moléculaires est recherché en cas de CBNPC non épidermoïde (ou plus rarement épidermoïde chez un jamais-fumeur), grâce à des techniques de séquençage de nouvelle génération : mutations ponctuelles d’EGFR, BRAF, HER2, c-MET, ou réarrangements ALK et ROS1. Ces mutations sont en effet prédictives de la réponse à des inhibiteurs de tyrosine-kinase oraux ciblant chacune d’elles.
bilan d’extension
– forme d’emblée multi-métastatique : tout traitement local à visée curative est contre-indiqué ; la poursuite du bilan (TEP) n’est pas nécessaire ;
– forme oligo-métastatique (1 ou 2 métastases de petite taille) : en cas de contrôle tumoral satisfaisant par une thérapie systémique, on entreprend plusieurs traitements locaux, sur le site primitif et les métastases, à visée curative. Une cartographie complète de l’atteinte néoplasique est réalisée par TEP-scanner ;
– cancer localisé ou localement avancé : une approche locale ou locorégionale à visée curative peut être envisagée, mais il faut éliminer toute métastase au TEP-scanner (contre-indication). Si cet examen confirme une maladie tumorale localisée au thorax mais s’accompagnant d’une ou plusieurs adénopathies médiastinales hypermétaboliques, la nature cancéreuse de ces dernières doit être prouvée soit par ponction sous écho-endoscopie bronchique ou œsophagienne, soit après abord chirurgical. En effet, l’atteinte ganglionnaire modifie la prise en charge (radiothérapie plutôt que chirurgie par exemple).
Le bilan d’extension permet de classer la maladie en 4 stades (classification TNM, tableau 3) :
– stades I ou II : cancers localisés accessibles chirurgicalement ;
– III : localement avancés relevant d’une radio-chimiothérapie ;
– IV : métastatiques, requérant un traitement systémique (chimiothérapie, thérapie ciblée ou immunothérapie).
Par ailleurs, en cas de chirurgie à visée carcinologique, un bilan fonctionnel doit vérifier sa faisabilité, incluant une évaluation cardiaque (échographie transthoracique) et pulmonaire par des épreuves fonctionnelles respiratoires scintigraphie pulmonaire et mesure de la VO2max.
CBPC : un pronostic sombre et peu de perspectives2
Au stade localisé au thorax (30 % des cas), le bilan détermine la faisabilité d’une radio-chimiothérapie concomitante visant une réponse tumorale objective quasi complète (persistance d’un reliquat tumoral minime). On l’obtient dans 60 % des cas (mais avec un taux de rechute très élevé dans les 18 premiers mois).
Soit 4 cycles de chimiothérapie, sur 3 à 4 mois – comprenant un sel de platine (carboplatine ou cisplatine) et de l’étoposide (VP16), administrés toutes les 3 semaines pendant 3 jours – et une radiothérapie de la tumeur et des aires ganglionnaires thoraciques atteintes (au minimum 60 grays [Gy] en fractions de 2 Gy).
En cas de forme disséminée (localisation secondaire extrathoracique), la chimiothérapie seule, le plus souvent 6 cycles de platine-VP16 ou PE (+ anthracycline, doxorubicine et cyclophosphamide selon le régime « PCDE »), donne un taux de réponse complète < 30 %, imposant une surveillance rapprochée (risque majeur de reprise évolutive).
Après radio-chimiothérapie ou chimiothérapie seule, la reprise évolutive ou rechute est traitée – si l’état général du patient le permet – par une chimiothérapie de 2e ligne. Si elle survient à plus de 3 mois (tumeur sensible), le même traitement peut être efficace.
En cas de récidive précoce, à moins de 3 mois (cancer résistant ou réfractaire, avec progression sous chimiothérapie initiale), le pronostic est mauvais malgré les options disponibles (topotécan IV ou oral, carboplatine + paclitaxel ou anthracycline + cyclophosphamide).
Le cerveau, site de rechute très fréquent (métastases microscopiques infraradiologiques d’emblée), est irradié de façon « prophylactique » : 25 Gy en cas de réponse apparemment complète au traitement initial.
CBNPC : une révolution thérapeutique
L’alternative est la radiothérapie stéréotaxique, réalisée si la capacité respiratoire est insuffisante (contre-indiquant une résection) et lorsqu’il s’agit d’un nodule périphérique de moins de 3 cm de diamètre, sans extension ganglionnaire. Délivrant de très hautes doses de radiations (80 à 100 Gy contre 66 habituellement), mais extrêmement focalisées par de multiples faisceaux sur un petit volume, elle permet une stérilisation tumorale en 3 à 5 séances. Un système robotisé guide cette véritable « radio-chirurgie » d’une précision extrême qui préserve au maximum les tissus sains environnants, avec contrôle et correction en temps réel des mouvements de la tumeur induits par la respiration.
Si l’analyse histologique de la pièce opératoire retrouve une tumeur primitive de taille > 4 cm et/ou une atteinte tumorale ganglionnaire satellite de la bronche ou médiastinale, une chimiothérapie adjuvante par un doublet comprenant un sel de platine est indiquée (4 cures), diminuant le risque de récidive et la mortalité de 5 à 14 % selon les essais.
Au stade localement avancé (III), le cancer est limité au thorax, mais non accessible à un geste local optimal car envahissant des structures médiastinales (vasculaires) ou pariétales, ou s’accompagnant de métastases ganglionnaires médiastinales. `
Si l’état général, respiratoire et cardiaque le permet, une radio-chimiothérapie locorégionale concomitante à visée curative est proposée (radio- thérapie : dose de 66 Gy par fractions de 1,8 pendant 6 semaines et demie ; chimiothérapie : doublet comprenant un sel de platine, en 3 à 4 cures). Le taux de rechute régionale ou à distance reste élevé dans les 2 premières années. Après cette séquence, ajouter le durvalumab, anti- corps monoclonal anti-PD-L1, s’est récemment montré efficace, allongeant la survie globale (AMM récente dans cette indication).
Dans les formes ganglionnaires pures sans envahissement médiastinal, une chimiothérapie néo-adjuvante vise à rendre la maladie tumorale accessible au geste chirurgical, en cas de réponse majeure.
Si contre-indication respiratoire à la radiothérapie du fait du volume à irradier, seul le traitement systémique est administré, mais le pronostic est sombre et proche de celui des formes métastatiques.
Tumeurs métastatiques (stade IV). Avec les chimiothérapies de dernière génération comprenant un sel de platine, le taux de survie est de 40 à 50 % à 1 an (contre 20 % ou moins en l’absence de traitement). Cependant, chez une fraction de patients, de nouvelles thérapeutiques permettent d’obtenir des rémissions prolongées.
Pour les carcinomes épidermoïdes, pas d’alté- ration moléculaire connue pouvant être ciblée. La chimiothérapie reste donc la référence : sel de platine + taxane ou gemcitabine. L’espoir vient de l’immunothérapie. En effet, les anti-PD-1 (nivolumab, Opdivo ou pembrolizumab, Keytruda) ou un anti-PD-L1 (atézolizumab, Tecentriq) restaurent la capacité des lymphocytes T à tuer les cellules cancéreuses.
Le pembrolizumab peut être administré en première ligne si la tumeur exprime fortement PD-L1 (plus de 50 % des cellules), obtenant 70 % de survie à 1 an. Si ce récepteur est moins présent, nivolumab et atézolizumab ont une place en deuxième ligne, après chimiothérapie à base de sel de platine. 20 à 25 % des patients ont des réponses majeures et une rémission prolongée au-delà de 2 ans (certains vivent plusieurs années en réponse quasi complète sans récidiver), ce qui est une révolution thérapeutique dans ces cancers ! Mais 10 % ont des progressions foudroyantes qu’on ne sait actuellement pas anticiper ; les autres malades rechutent au bout de 3 à 4 mois.
Dans 15 % des CBPNC non épidermoïdes (surtout adénocarcinomes), des anomalies moléculaires dites addictives sont responsables, à elles seules, de l’immortalité de la tumeur. Elles concernent des protéines kinases (capables de phosphoryler d’autres protéines) qui sont ainsi activées de manière permanente dans les cellules cancéreuses : mutations activatrices du gène de l’EGFR (12 % des CBNPC), réarrangements ALK (5 %), translocations ROS1 (1 %), mutation de BRAF V600E. Ces altérations sont plus fréquentes chez les patients jamais fumeurs (10 à 15 % des CBNPC) ou ex-fumeurs sevrés depuis plus de 15 ans ou encore ex-« petits fumeurs », chez les femmes et les Asiatiques.
Désormais recherchées en routine grâce aux plateformes régionales de génétique moléculaire financées par l’INCa, elles peuvent être ciblées par des inhibiteurs de kinase oraux spécifiques (anti- EGFR : osimertinib, Tagrisso, erlotinib, Tarceva, géfitinib, Iressa ; anti-ALK et ROS 1 : crizotinib, Xalkori, céritinib, Zykadia, alectinib, Alecensa, lorlatinib (ATU), brigatinib (ATU) ; anti-BRAF : dabrafénib, Tafinlar + tramétinib, Mekinist), induisant la mort des cellules tumorales. Les réponses sont souvent spectaculaires et les survies très prolongées, même chez des patients d’emblée métastatiques.
En l’absence d’altération moléculaire, la prise en charge repose sur les doublets de chimiothérapie à base de sel de platine (4 cures suivies d’un traitement de maintien par pémétrexed, Alimta, jusqu’à progression) ou sur l’immunothérapie dont la place en première ou deuxième ligne dépend là encore de l’expression de l’antigène PD-L1 par la tumeur (plus ou moins de 50 %).
Prochaine grande évolution (nouvelles AMM d’ici 1 an) : l’association, dès la première ligne, de chimiothérapie + immunothérapie ; en effet, les premiers essais de phase III montrent des survies de 70 % à 1 an, alors que les tumeurs exprimaient modestement le PD-L1 (> 1 % des cellules).
Surveillance
En cours de traitement, les effets secondaires de la chimiothérapie sont variables en fonction de la molécule, du dosage, de la répétition des protocoles et du terrain (éthylisme, dénutrition, comorbidités) ; ils ne sont pas toujours les mêmes d’une cure à l’autre. Les plus fréquents sont l’asthénie, les troubles digestifs (nausées-vomissements, de mieux en mieux prévenus par des associations de molécules anti-émétiques puissantes prescrites systématiquement : corticoïdes, sétrons, aprépitant), mais surtout l’hématotoxicité, la neutropénie fébrile pouvant tuer jusqu’à 10 % des patients selon une étude britannique récente. L’alopécie est de moins en moins fréquente (grâce aux molécules de 3e génération). Les neuropathies périphériques sont essentiellement liées au cisplatine, dont on limite le nombre de cures à 4 ou 6, et aux taxanes (paclitaxel et docétaxel) ; il faut dépister les signes avant-coureurs (paresthésies des extrêmités transitoires puis permanentes) afin d’interrompre le traitement responsable et ainsi éviter des symptômes altérant la qualité de vie.
Avec la radiothérapie thoracique, les 2 principaux risques sont l’œsophagite et la pneumo-pathie radiques. L’inflammation de l’œsophage est traitée par un antalgique général de palier 2 (tramadol) ou 3 (morphine, oxycodone, fentanyl) ; corticoïdes et IPP sont aussi très efficaces. Une sonde nasogastrique est proposée en cas de dénutrition sévère (heureusement devenue rare grâce aux progrès techniques). La pneumopathie radique peut survenir jusqu’à 3 à 6 mois après la fin du traitement et doit être recherchée devant tout symptôme respiratoire (toux, dyspnée, fièvre).
L’immunothérapie peut réactiver le système immunitaire contre des cellules normales de l’or- ganisme et provoquer des maladies auto-immunes. La majorité de ces effets indésirables sont réversibles et corticosensibles. Dans de rares cas, ils sont graves : pneumopathie interstitielle fibrosante ou colite auto-immune avec diarrhée profuse et déshydratation. Le médecin traitant doit donc dépister le moindre symptôme inhabituel chez un patient traité : une diarrhée à plus de 3 selles quotidiennes, une fatigue anormale (hypothyroïdie ou hypophysite), toute dyspnée doivent faire contacter l’oncologue thoracique ou l’hôpital.
Beaucoup de ces manifestations auto-immunes sont cependant asymptomatiques, révélées simplement par le bilan biologique : elles ne nécessitent alors aucun traitement. À noter que l’immunothérapie est contre-indiquée chez les patients aux antécédents de pathologie auto-immune ou nécessitant un immunosuppresseur (corticoïdes) au long cours.
Les thérapies ciblées orales sont le plus souvent bien tolérées. Principaux effets secondaires : diarrhées (aisément gérables), éruptions cutanées, mucites, plus rarement cytolyses hépatiques. Ils sont assez bien connus, et des traitements symptomatiques classiques (notamment dermatologiques) sont prescrits à visée préventive (savon doux, émollient gras, bains de bouche à base de bicarbonate de soude, éviction solaire). Il faut cependant être attentif aux interactions : les médicaments interagissant avec le cytochrome P450 sont contre-indiqués, de même que certains aliments (jus de pamplemousse ou d’agrumes exotiques, thé vert, herbes ou épices exotiques).
Ces signes systémiques, survenant au cours de l’évolution d’une néoplasie ou avant son apparition, sont liés à la synthèse par les cellules tumorales de peptides hormonaux ou sont médiés par des lymphocytes ou des anticorps dirigés contre un antigène commun aux cellules cancéreuses et aux tissus normaux (réaction auto-immune).
Ils peuvent toucher de nombreux systèmes : vasculaire (thromboses artérielles ou veineuses), dermatologique (dermatomyosite), rhumatologique (ostéo-arthropathie hypertrophiante pneumique de Pierre-Marie ou hippocratisme digital dans sa forme la plus simple), endocrinien (syndrome de sécrétion inappropriée d’hormone antidiurétique avec hyponatrémie profonde, hypercalcémie par sécrétion de peptide relié à la parathormone), ou neurologique (pseudomyasthénie, neuropathie périphérique, encéphalopathie).
• Aucun dépistage organisé n’existe au niveau national. Pourtant, l’essai randomisé NLST a montré en 2013, chez 50 000 fumeurs asymptomatiques (à plus de 30 paquets-années, actifs ou sevrés depuis moins de 15 ans et âgés de 55 à 74 ans), l’intérêt d’un scanner thoracique annuel à faible dose d’irradiation, sans injection : baisse de 20 % des décès par cancer bronchique et de 6,7 % de la mortalité globale, toutes causes confondues.4
• La découverte d’un nodule infracentimétrique sur le scanner thoracique d’un fumeur impose une surveillance ou des explorations selon sa taille initiale, la vitesse de croissance (volume), qui doit être évaluée à 3 mois d’intervalle s’il fait moins de 10 mm, un temps de doublement < 400 jours étant à haut risque de malignité.5
• Les nodules solides supracentimétriques justifient des explorations pouvant aboutir à une résection chirurgicale. Ceux « en verre dépoli », même supracentimétriques, correspondent le plus souvent à des lésions précancéreuses, pouvant rester stables plusieurs années : ils doivent être surveillés par scanner avec évaluation de la cinétique de croissance ; l’apparition de zones plus hétérognes et solides est suspecte et impose des explorations invasives.
Un pronostic qui s’améliore pour les CBNPC
✓ CBPC ; il n’y a pas eu de progrès significatif depuis plus de 30 ans.
✓ CBNPC
Les cancers localisés de stade I et II sont curables grâce aux progrès de la chirurgie thoracique et de l’anesthésie, ou de la radiothérapie stéréotaxique, ce qui soulève la question du repérage à ces stades « précoces ». La survie à 5 ans est respectivement de 65 et 50 %, sachant qu’elle est supérieure à 80 % pour les stades I diagnostiqués après dépistage scanographique.
Pour les tumeurs de stade III traitées par radio-chimiothérapie concomitante moderne, elle est de 20 à 25 %.
Enfin, dans les formes métastatiques (stade IV), elle est passée de moins de 1 % à 14 % à 5 ans, grâce aux thérapies ciblées (pour 15 % des patients avec anomalie moléculaire addictive) et aux immunothérapies (pour 20 % des malades).
2. INCa. Cancer bronchique à petites cellules. Référentiel national de RCP. Mars 2015.
https://bit.ly/2RHKSr5
3. INCa. Cancer bronchique non à petites cellules. Réfé-rentiel national de RCP. Mars 2015.
https://bit.ly/2C7oRwC
4. National Lung Screening Trial Research Team, Church TR, Black WC, Aberle DR, et al. Results of initial low-dose computed tomographic screening for lung cancer. N Engl J Med 2013;368:1980-91.
5. MacMahon H, Naidich DP, Goo JM, et al. Guidelines for Management of Incidental Pulmonary Nodules Detected on CT Images: From the Fleischner Society 2017. Radiology 2017;284:228-43.

 Encadrés
Encadrés