Maladies de l’adulte jeune, les cancers du testicule sont principalement des tumeurs germinales. De phénotype clairement malin, elles dérivent des gonocytes primordiaux, précurseurs embryonnaires des gamètes de l’adulte. D’un point de vue anatomopathologique, on distingue les séminomes purs (40 %)d’une part, et les tumeurs non séminomateuses d’autre part (60 %).
Les tumeurs non germinales (< 10 %), groupe très hétérogène, sont bénignes ou malignes, principalement issues des tissus de soutien du testicule (cellules de Sertoli et de Leydig). Elles ne sont pas abordées ici.
Facteur de risque : le cannabis !
L’incidence des tumeurs germinales du testicule (TGT) est en constante augmentation depuis plusieurs décennies dans les pays dits développés.1 En France, le nombre estimé de nouveaux cas annuels est d’environ 2 500, soit un taux d’incidence standardisé d’à peu près 7 à 8/100 000 hommes. Principaux facteurs de risque : la cryptorchidie, les antécédents personnels et familiaux de cancer du testicule, la trisomie 21 et, à un moindre degré, l’infertilité.
Selon des données récentes, la consommation précoce et régulière de cannabis favoriserait la survenue des tumeurs germinales non séminomateuses.2
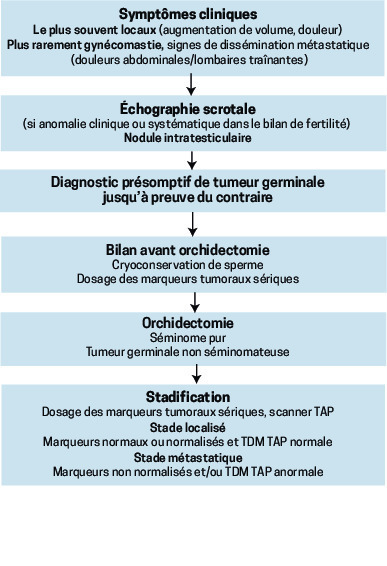
Signes d’appel : surtout locaux
Classiquement, les TGT sont diagnostiquées à l’occasion de symptômes locaux (pesanteur, tension, douleur) en relation avec le développement de la masse tumorale. Une échographie systématique réalisée lors d’un bilan d’infertilité peut être une circonstance de découverte. Plus rarement, des douleurs lombaires liées à une masse ganglionnaire rétropéritonéale, une adénopathie de Troisier, ou encore une gynécomastie (par sécrétion tumorale d’hCG) font suspecter le diagnostic chez un adulte jeune.
Un diagnostic en 3 étapes
La palpation scrotale, bilatérale et comparative, met en évidence un nodule ou une masse développée aux dépens d’un testicule (
L’échographie scrotale permet, outre de confirmer l’origine testiculaire de la masse, d’explorer le testicule controlatéral. Aspect échographique d’une TGT : nodule hypo-échogène, volontiers homogène pour les séminomes, plus hétérogène pour les tumeurs non séminomateuses.
L’orchidectomie confirme le diagnostic (on enlève testicule, annexes et cordon spermatique jusqu’à l’orifice inguinal ; une prothèse peut être mise en place dans le même temps ou à distance). C’est aussi la première étape thérapeutique. Avant cet acte, ne pas oublier de :
– demander un dosage sanguin des marqueurs tumoraux que sont l’alphafœtoprotéine (AFP), l’hormone chorionique gonadotrope (hCG) et les lacticodéshydrogénases (LDH) ;
– proposer au patient une cryoconservation de sperme (mesure médicolégale).
Le bilan d’extension, très simple, comporte un dosage postopératoire de ces marqueurs et un scanner thoraco-abdominopelvien (TAP). Pas de TEP-FDG en première intention.
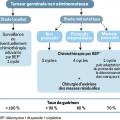
Traiter selon la gravité
Stades localisés : surveillance
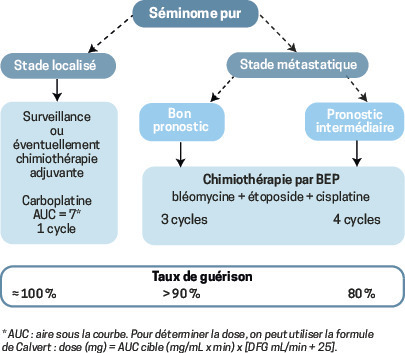
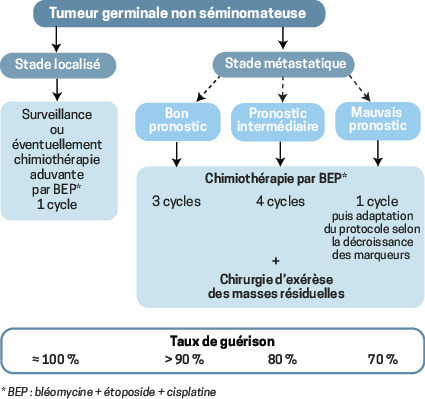
Les tumeurs de stade I sont définies par l’absence de métastase au scanner TAP et la normalisation des marqueurs tumoraux sériques s’ils étaient anormaux avant l’orchidectomie. Comme le geste chirurgical guérit à lui seul 85 % des séminomes purs et 70 % des tumeurs non séminomateuses, la surveillance est majoritairement préconisée.
La chimiothérapie adjuvante peut être discutée au cas par cas pour des patients anxieux ou risquant d’échapper à la surveillance. Quelle que soit l’attitude retenue, les taux de guérison avoisinent les 100 %.
Métastases = chimiothérapie
Le protocole de référence est le BEP : bléomycine 30 mg dose totale à J1, J8 et J15, étoposide 100 mg/m2/j de J1 à J5, cisplatine 20 mg/m2/j de J1 à J5. Chaque cycle est débuté toutes les 3 semaines et est délivré en hospitalisation conventionnelle de J1 à J5 et en hospitalisation de jour à J8 et J15.
Doses et intervalles doivent être rigoureusement respectés. Le nombre de cycles est adapté au groupe pronostique de la classification internationale, selon le niveau d’élévation des marqueurs tumoraux et d’éventuelles métastases viscérales extrapulmonaires (foie, cerveau ou os). La toxicité pulmonaire potentielle de la bléomycine impose la réalisation d’épreuves fonctionnelles respiratoires avant de débuter la chimiothérapie et au-delà de la dose totale de 270 mg (3 cycles) si elle doit être poursuivie. Pour les tumeurs non séminomateuses, une chirurgie d’exérèse de toutes les masses métastatiques résiduelles supracentimétriques s’impose au décours de la chimiothérapie.
Taux de guérison : 95 %
Le cisplatine a transformé le pronostic d’une maladie autrefois mortelle. Le nombre de décès liés aux TGT est de moins de 100 par an en France, soit un taux de mortalité de 0,2/100 000 hommes. Sont concernés les patients métastatiques ayant un mauvais pronostic avec, au diagnostic, une très forte masse tumorale ou des métastases viscérales extrapulmonaires, et pour lesquels la recherche clinique doit être poursuivie.
Séquelles à long terme
Le risque de récidive tumorale après traitement devient très faible au-delà de 5 ans : les examens complémentaires de surveillance ne sont alors plus préconisés. Les patients doivent cependant être avertis d’un risque de TGT sur le testicule controlatéral d’environ 2 à 3 %, qui court jusqu’à 20 ans au moins après la première tumeur. Il justifie l’éducation à l’autopal- pation testiculaire régulière et une écho- graphie en cas de doute ou de symptôme.
Malgré des taux de guérison très élevés, la survie globale à long terme demeure inférieure à celle de la population générale, sauf lorsque la prise en charge se résume à une orchidectomie.3, 4 Cause hypothétique : des séquelles potentiellement mortelles à long terme, comme les seconds cancers et les pathologies cardiovasculaires.
Plusieurs études ont en effet mis en évidence une hausse du risque d’événements cardiovasculaires (ECV) chez les patients ayant reçu une chimiothérapie au décours de l’orchidectomie.5, 6 Dans l’année qui suit le diagnostic surviennent infarctus du myocarde (IdM), accidents vasculaires cérébraux (AVC) et embolies pulmonaires. Puis l’incidence de ces EVC rejoint celle de la population générale avant d’augmenter de nouveau au-delà de 10 ans pour les IdM et les AVC. Mécanismes invoqués : toxicité vasculaire du cisplatine et hypercoagulabilité à court terme, syndrome métabolique, hypercholestérolémie et HTA à long terme. En pratique, un traitement anticoagulant est recommandé lors de la chimiothérapie en cas de masse tumorale métastatique initiale importante puis un dépistage et une gestion optimaux des facteurs de risque cardiovasculaires à long terme.
Le risque de seconds cancers (thyroïde, poumon, appareil digestif…) est multiplié d’un facteur 2 environ chez les patients recevant une chimiothérapie après l’orchidectomie et d’un facteur 4 si une chimiothérapie de rattrapage pour rechute s’avère nécessaire.7
Le cisplatine expose à une fréquence accrue de fatigue chronique (15 à 30 %), de syndrome métabolique et d’ECV (cf supra), de troubles de l’audition (20 à 50 %), de neuropathie périphérique (30 %) et de dégradation de la fonction rénale (25 à 50 %). Les fourchettes de fréquence sont larges et varient selon le nombre de cycles reçus mais aussi selon l’évaluation objective par des examens complémentaires ou ressentie par les patients. Les séquelles sévères, impactant l’autonomie, surviendraient dans environ 10 % des cas.8 Un certain nombre de mesures de suivi et de prévention s’impose (
Le droit à l’oubli offre la possibilité aux patients traités depuis plus de 10 ans de ne pas déclarer cet antécédent lors de formalités administratives, notamment les demandes de prêts bancaires. En effet, la probabilité de récidive au-delà de 2 ans de suivi est très faible, quel que soit le groupe pronostique initial. Avant 10 ans, une procédure, régulièrement réactualisée sur le site de l’INCa, permet pour certaines pathologies, dont les tumeurs germinales de faible volume métastatique, d’obtenir des prêts bancaires inférieurs à 320 000 euros sans surprime ni exclusion, mais la déclaration demeure obligatoire. Le délai est de 3 ans pour les séminomes de stade localisé et de 6 ans pour les tumeurs non séminomateuses localisées et l’ensemble des tumeurs germinales avec métastases limitées aux ganglions rétropéritonéaux.
Cancer testiculaire : suivi à long terme
Pour tous les patients
Tumeurs germinales du testicule controlatéral
Éducation à l’autopalpation testiculaire
Pour ceux traités par chimiothérapie
Asthénie, syndrome métabolique, obésité, HTA, événements cardiovasculaires
Prévention des facteurs de risque cardiovasculaires, activités physiques régulières
Troubles de l’audition et acouphènes
Conseils de protection auditive (environnement, médicaments, HTA)
Neuropathie périphérique
Prévention des facteurs aggravants (diabète, alcool…)
Altération de la fonction rénale
Hyperhydratation systématique lors de l’administration du cisplatine
Contre-indication des AINS pendant la chimiothérapie
Limiter les imageries avec produits de contraste iodés
Conseils de protection rénale à long terme (médicaments, HTA)
Seconds cancers
Prévention des facteurs de risque (tabac, alcool…)
1. Ribassin-Majed L, Le-Teuff G, Hill C. La fréquence des cancers en 2016 et leur évolution. Bull Cancer 2017;107:20-4.
2. Ghasemiesfe M, Barrow, B, Leonard S, Keyhani S, Korenstein, D. Association between marijuana use and risk of cancer. A systematic review and meta-analysis. JAMA Network Open 2019;2:e1916318.
3. Ko JJ, Bernard B, Tran B, et al. Conditional survival of patients with metastatic testicular germ cell tumors treated with first-line curative therapy. J Clin Oncol 2016;34:714-20.
4. Kvammen O, Myklebust TA, Solberg A, et al. Long-term relative survival after diagnosis of testicular germ cell tumor. Cancer Epidemiol Biomarkers Prev 2016;25:773-9.
5. Fung C, Fossa SD, Milano MT, et al. Cardiovascular disease mortality after chemotherapy or surgery for testicular nonseminoma: a population-based study. J Clin Oncol 2015;33:3105-15.
6. Lauritsen J, Hansen MK, Bandak M, et al. Cardiovascular risk factors and disease after male germ cell cancer. J Clin Oncol 2019;38:584-92.
7. Kier MG, Hansen MK, Lauritsen J, et al. Second malignant neoplasms and cause of death in patients with germ cell cancer. JAMA Oncol 2016;2:1624-7.
8. Kerns SL, Fung C, Monahan PO, et al. Cumulative burden of morbidity among testicular cancer survivors after standard cisplatin-based chemotherapy: a multi-institutional study. J Clin Oncol 2018;36:1505-12.

 Encadrés
Encadrés