Une grande diversité de tumeurs dont le traitement peut être source de handicaps, qui eux-mêmes doivent être pris en charge.
Les cancers nasosinusiens (CNS) désignent les tumeurs des fosses nasales et des sinus de la face. Ils comptent pour 3 % des cancers des voies aérodigestives supérieures et moins de 1 % de l’ensemble des cancers diagnostiqués. Nous n’aborderons pas les cancers dits de la base du crâne (essentiellement de type sarcome), les lymphomes nasosinusiens, les métastases nasosinusiennes de tumeurs solides primitives extrasinusiennes et les carcinomes nasopharyngés liés à EBV (UCNT : Undifferentiated carcinoma of the nasopharyngeal type). En effet, leur prise en charge est spécifique, même s’ils partagent avec les CNS les conséquences fonctionnelles de l’atteinte tumorale et de leurs traitements. Malgré ces exclusions, les cancers nasosinusiens restent caractérisés par une grande variété histologique et, pour certains, par une carcinogenèse notable. C’est le cas des carcinomes épidermoïdes, qui peuvent être associés au virus HPV1, des sarcomes radio-induits et, surtout, de l’adénocarcinome de la fente olfactive (dont le plus fréquent est l’adénocarcinome de type intestinal) pour lequel une exposition professionnelle est présente dans 7 à 40 % des cas. Facilement évoquée chez les travailleurs du bois, cette dernière concerne les activités utilisant colles ou vernis à base de résines contenant du formol, composés du chrome, l’industrie agroalimentaire et du textile (travailleurs du cuir), l’agriculture, la métallurgie du nickel, les laboratoires d’anatomopathologie, l’industrie de la porcelaine, des émaux et des céramiques (tableaux de maladies professionnelles : 10 ter, 37 ter, 43 bis, 47 B du régime général et 36 C du régime agricole).
Des cancers rares
Pour illustrer la rareté et l’hétérogénéité des cancers nasosinusiens, la base de données du Réseau d’expertise français des cancers ORL rares (REFCOR), qui ne croise pas ses données avec le réseau lymphome ou le réseau sarcome et exclut les UCNT, avait inclus, en 2019, 2 772 patients atteints de CNS sur une période de dix ans. Parmi eux, on comptait 8 % d’adénocarcinomes, 16 % de carcinomes épidermoïdes (plus fréquents dans la littérature), 8 % de mélanomes muqueux, 8 % de neuroblastomes, 7 % de carcinomes adénoïdes kystiques (CAK), 4 % de carcinomes indifférenciés (SNUC), 2 % de sarcomes, 1 % d’adénocarcinomes mucineux, 1 % de carcinomes neuroendocrines et 25 % d’autres histologies (tableau 1 ).
Les taux de survie à cinq ans sont, par ordre décroissant, de 72 % pour les neuroblastomes, 63 % pour les adénocarcinomes, 50 à 60 % pour les carcinomes neuro-endocrines à grandes cellules, 53 % pour les épidermoïdes, 25 à 50 % pour les adénoïdes kystiques, 35 % pour les neuro-endocrines à petites cellules et 35 % pour les indifférenciés et nouvelles entités.2
Si leur évolution commune est essentiellement locorégionale, celle de certains CNS est systémique, parfois fulgurante (carcinomes NUT, ou carcinomes neuroendocrines) ou si progressive que l’on diffère parfois des années le début d’un traitement systémique (CAK métastatiques pulmonaires).
Les taux de survie à cinq ans sont, par ordre décroissant, de 72 % pour les neuroblastomes, 63 % pour les adénocarcinomes, 50 à 60 % pour les carcinomes neuro-endocrines à grandes cellules, 53 % pour les épidermoïdes, 25 à 50 % pour les adénoïdes kystiques, 35 % pour les neuro-endocrines à petites cellules et 35 % pour les indifférenciés et nouvelles entités.2
Si leur évolution commune est essentiellement locorégionale, celle de certains CNS est systémique, parfois fulgurante (carcinomes NUT, ou carcinomes neuroendocrines) ou si progressive que l’on diffère parfois des années le début d’un traitement systémique (CAK métastatiques pulmonaires).
Diverses circonstances de découverte et de diagnostic
Au moment du diagnostic, les patients peuvent être symptomatiques ou asymptomatiques.
Clinique : l’unilatéralité des signes est suspecte
Lors de la découverte des cancers nasosinusiens, les signes rhinologiques, non spécifiques et dont les fréquences respectives varient selon les études (tableau 2 ), sont souvent au premier plan.
Les signes d’extension méningée ou orbitaire sont souvent révélateurs d’une volumineuse lésion. Dans tous les cas, l’unilatéralité des symptômes doit faire éliminer systématiquement une tumeur nasale. Le diagnostic est histologique, après biopsie au cours d’un examen nasofibroscopique, qu’il est recommandé de faire relire dans le cadre du réseau d’expertise REFCORpath, du fait de la difficulté du diagnostic différentiel de certaines entités (tableau 1 ).
Les signes d’extension méningée ou orbitaire sont souvent révélateurs d’une volumineuse lésion. Dans tous les cas, l’unilatéralité des symptômes doit faire éliminer systématiquement une tumeur nasale. Le diagnostic est histologique, après biopsie au cours d’un examen nasofibroscopique, qu’il est recommandé de faire relire dans le cadre du réseau d’expertise REFCORpath, du fait de la difficulté du diagnostic différentiel de certaines entités (
L’imagerie est parfois révélatrice
Dans le cadre d’une découverte fortuite ou d’un dépistage professionnel, l’imagerie peut révéler un aspect tumoral ou pseudotumoral, une lésion ostéolytique devant toujours faire évoquer une tumeur maligne. Le plus souvent, c’est le diagnostic endoscopique qui oriente vers une imagerie complémentaire.
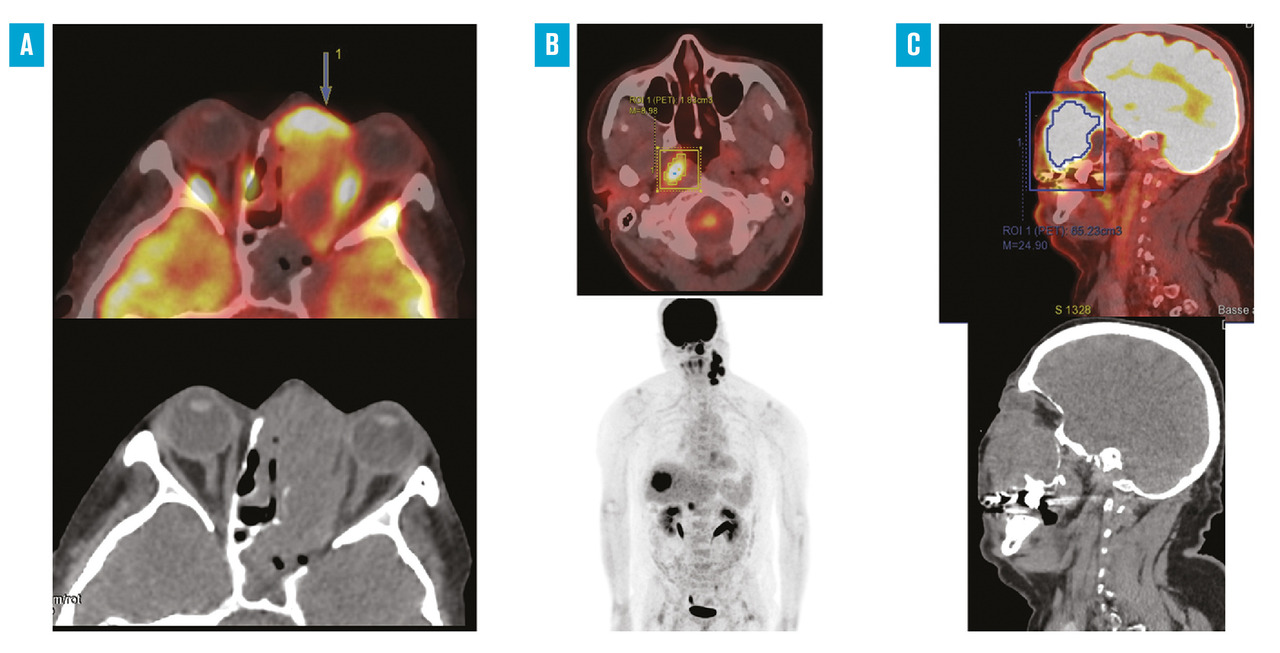
Tomodensitométrie et IRM sont complémentaires car il n’existe pas de densité ou de signal spécifique de l’histologie des cancers nasosinusiens, même si le machine learning appliqué à la radiomique est prometteur ; les tumeurs doivent être différenciées de l’environnement inflammatoire et rétentionnel systématiquement présent dans les cavités nasosinusiennes. L’injection de produit de contraste permet de mieux analyser le contenu d’une opacité nasosinusienne ; cependant, ses capacités de distinction, entre une néoformation et une rétention de 85 % dans le sinus maxillaire, diminuent considérablement dans l’ethmoïde et le sphénoïde. La prescription d’une imagerie métabolique n’est pas systématique, dépendant du type histologique, et reste donc du domaine des spécialistes au cours du bilan d’extension, ou du suivi thérapeutique (fig. 1 ).
Tomodensitométrie et IRM sont complémentaires car il n’existe pas de densité ou de signal spécifique de l’histologie des cancers nasosinusiens, même si le machine learning appliqué à la radiomique est prometteur ; les tumeurs doivent être différenciées de l’environnement inflammatoire et rétentionnel systématiquement présent dans les cavités nasosinusiennes. L’injection de produit de contraste permet de mieux analyser le contenu d’une opacité nasosinusienne ; cependant, ses capacités de distinction, entre une néoformation et une rétention de 85 % dans le sinus maxillaire, diminuent considérablement dans l’ethmoïde et le sphénoïde. La prescription d’une imagerie métabolique n’est pas systématique, dépendant du type histologique, et reste donc du domaine des spécialistes au cours du bilan d’extension, ou du suivi thérapeutique (
Traitements : la chirurgie souvent centrale
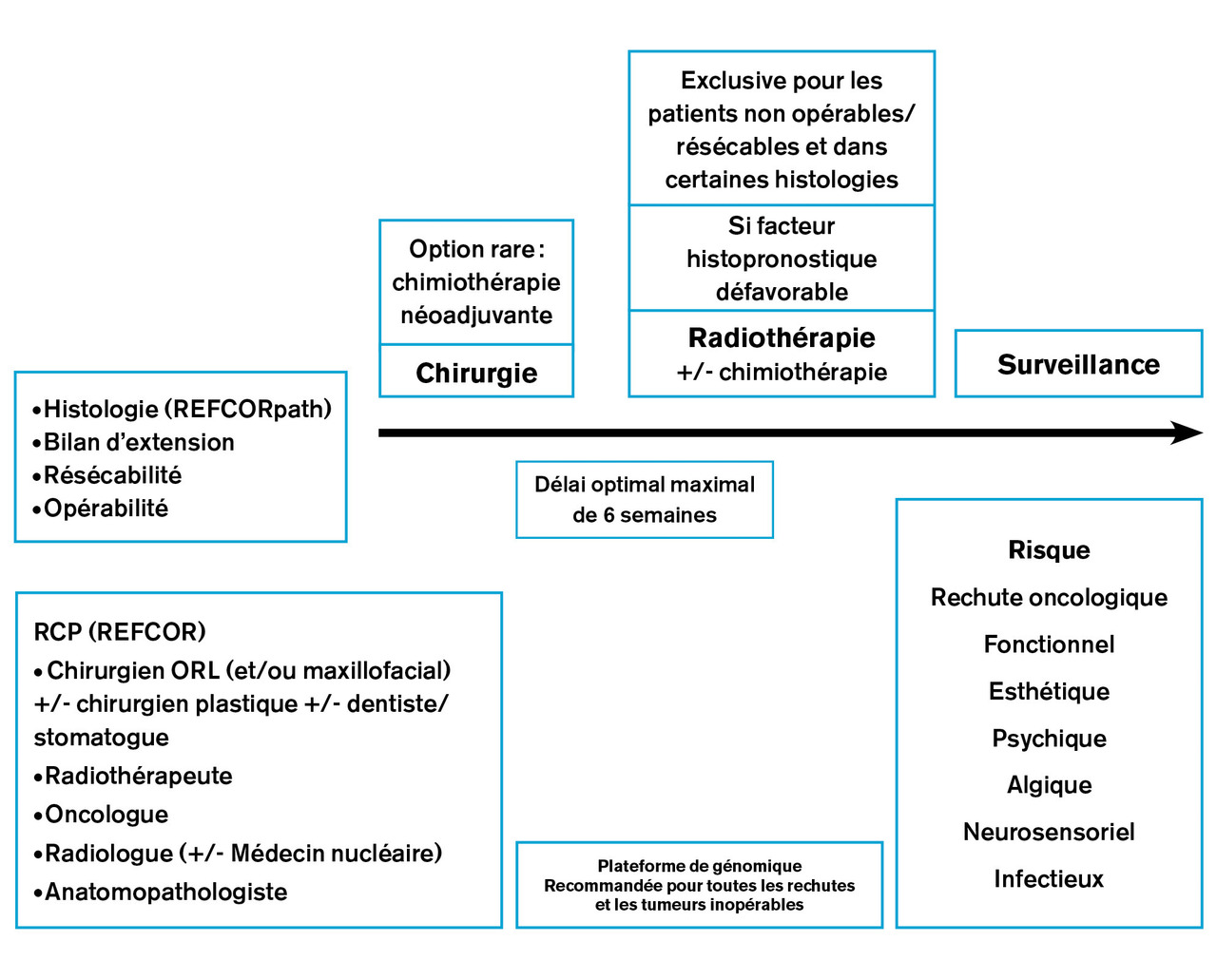
La prise en charge thérapeutique des cancers nasosinusiens dépend essentiellement de l’histologie, de l’extension tumorale, idéalement transcrite grâce à une classification internationale (pour laquelle les radiologues spécialisés apportent une plus-value certaine), et des caractéristiques du patient (tableau 3 , fig. 2 ). La chirurgie occupe le plus souvent une place centrale, la radiothérapie et les traitements systémiques pouvant être associés ou utilisés de manière exclusive. Du fait de leur spécificité et leur rareté, les traitements des CNS doivent être discutés lors d’une réunion de concertation pluridisciplinaire (RCP) de recours, organisée au niveau régional par le REFCOR via des centres de référence labellisés par l’INCa, et au niveau national via une RCP bimensuelle.
Distinguer résécabilité et opérabilité
L’indication opératoire et la technique d’exérèse dépendent de la localisation et de l’extension tumorale. La priorité est d’effectuer une exérèse tumorale complète avec des marges de sécurité carcinologique compatible avec une morbidité acceptable (alors que le taux de mortalité péri-opératoire varie selon les techniques et les équipes de 0 à 10 %). La notion de résécabilité, qui dépend de la situation anatomique et de l’extension tumorale, est différente de la notion d’opérabilité, qui dépend du patient et qui prend en compte non seulement le statut tumoral mais aussi l’âge, les comorbidités, l’adhésion au traitement et le profil du patient.
La voie d’abord dépend de l’extension tumorale, de l’histologie et du savoir-faire des équipes. L’abord préférentiel est endonasal (chirurgie endoscopique) qui, à contrôle tumoral équivalent, réduit la morbidité à condition que la résection, si elle est fragmentée, soit carcinologique. Plusieurs voies d’abord externes peuvent être utilisées, comme les voies transfaciales (paralatéronasale, sous-labiale ou procédure de degloving), et les voies en double abord (comprenant une voie sous-frontale ou une voie sous-fronto-orbito-nasale). Voies externes et endoscopiques peuvent être combinées, en simple équipe ORL, mais également en double équipe ORL-neurochirurgicale ou ORL-ophtalmologique. Enfin, contrairement à la majorité des autres localisations tumorales, l’exérèse en monobloc des CNS est rarement possible mais reste sans conséquence carcinologique grâce au recours fréquent à un traitement multimodal (radiothérapie et traitements systémiques).
La voie d’abord dépend de l’extension tumorale, de l’histologie et du savoir-faire des équipes. L’abord préférentiel est endonasal (chirurgie endoscopique) qui, à contrôle tumoral équivalent, réduit la morbidité à condition que la résection, si elle est fragmentée, soit carcinologique. Plusieurs voies d’abord externes peuvent être utilisées, comme les voies transfaciales (paralatéronasale, sous-labiale ou procédure de degloving), et les voies en double abord (comprenant une voie sous-frontale ou une voie sous-fronto-orbito-nasale). Voies externes et endoscopiques peuvent être combinées, en simple équipe ORL, mais également en double équipe ORL-neurochirurgicale ou ORL-ophtalmologique. Enfin, contrairement à la majorité des autres localisations tumorales, l’exérèse en monobloc des CNS est rarement possible mais reste sans conséquence carcinologique grâce au recours fréquent à un traitement multimodal (radiothérapie et traitements systémiques).
Radiothérapie : deuxième modalité thérapeutique majeure
Dans la prise en charge des cancers nasosinusiens, la radiothérapie est quasi systématiquement proposée de manière adjuvante (après chirurgie), mais elle peut aussi être exclusive (en cas de tumeur non résécable ou inopérable), voire palliative. Elle cible le lit tumoral et dans certains cas les relais ganglionnaires. En effet, le risque ganglionnaire est faible dans les adénocarcinomes ethmoïdaux et les carcinomes adénoïdes kystiques, mais plus important dans les carcinomes indifférenciés, neuroblastomes, carcinomes épidermoïdes et neuro-endocrines nasosinusiens, pouvant justifier une radiothérapie prophylactique.
Dans tous les cas, la technique de choix est une radiothérapie conformationnelle par modulation d’intensité (RCMI), largement diffusée sur le territoire, ou une protonthérapie (4 centres en France en 2021), qui toutes deux permettent à la fois d’améliorer la précision de rayonnement thérapeutique et de diminuer les toxicités invalidantes dans ces régions fonctionnellement majeures. Elle peut être aussi optimisée par hadronthérapie par ions carbones (non disponibles en France) pour les CAK. Les formules dites de dose painting devraient à l’avenir permettre d’encore mieux moduler les doses en fonction des extensions tumorales et probablement d’y intégrer les données anatomopathologiques et de neuronavigation endoscopique.3
Dans tous les cas, la technique de choix est une radiothérapie conformationnelle par modulation d’intensité (RCMI), largement diffusée sur le territoire, ou une protonthérapie (4 centres en France en 2021), qui toutes deux permettent à la fois d’améliorer la précision de rayonnement thérapeutique et de diminuer les toxicités invalidantes dans ces régions fonctionnellement majeures. Elle peut être aussi optimisée par hadronthérapie par ions carbones (non disponibles en France) pour les CAK. Les formules dites de dose painting devraient à l’avenir permettre d’encore mieux moduler les doses en fonction des extensions tumorales et probablement d’y intégrer les données anatomopathologiques et de neuronavigation endoscopique.3
Quels traitements systémiques ?
Il s’agit essentiellement des chimiothérapies, souvent à base de cisplatine, utilisées comme traitements palliatifs (pour augmenter la survie et/ou la qualité de vie), ou dans un cadre adjuvant, lorsqu’une réponse tumorale est attendue, dans les formes rapidement évolutives ou à haut potentiel métastatique (SNUC et tumeurs à composantes neuroendocrines non opérables), ou concomitant à la radiothérapie (essai clinique de phase III SANTAL, soutenu par le REFCOR).
Du fait de l’hétérogénéité des tumeurs, aucune molécule ne peut être utilisée dans le cadre d’une autorisation de mise sur le marché, comme c’est généralement le cas pour les maladies rares. Il est de ce fait recommandé d’inclure les patients dans les bases de données nationales et dans des essais cliniques. Il est également recommandé de leur faire bénéficier d’un portrait moléculaire, par le biais des plateformes moléculaires de France Génomique, qui pourra éventuellement mettre à jour une cible thérapeutique adaptée à un traitement de nouvelle génération, qu’il s’agisse d’une thérapie ciblée ou d’une immunothérapie (ayant par exemple démontré son intérêt dans la prise en charge des mélanomes muqueux non résécables).4
Du fait de l’hétérogénéité des tumeurs, aucune molécule ne peut être utilisée dans le cadre d’une autorisation de mise sur le marché, comme c’est généralement le cas pour les maladies rares. Il est de ce fait recommandé d’inclure les patients dans les bases de données nationales et dans des essais cliniques. Il est également recommandé de leur faire bénéficier d’un portrait moléculaire, par le biais des plateformes moléculaires de France Génomique, qui pourra éventuellement mettre à jour une cible thérapeutique adaptée à un traitement de nouvelle génération, qu’il s’agisse d’une thérapie ciblée ou d’une immunothérapie (ayant par exemple démontré son intérêt dans la prise en charge des mélanomes muqueux non résécables).4
Ne pas négliger les séquelles et les soins de support
Les résultats des traitements oncologiques des cancers nasosinusiens s’améliorent progressivement, et la question des séquelles thérapeutiques est un sujet majeur dont la campagne « Quoi ma gueule ? », lancée par l’association de patients CORASSO, marque l’importance individuelle et sociale.
Il faut distinguer les séquelles thérapeutiques temporaires (jusqu’à plusieurs mois après le traitement) pour lesquelles la patience, l’accessibilité du service référent et les petits moyens sont requis, des séquelles définitives engageant une prise en charge médicale et psychosociale à la hauteur des enjeux de réparation.Nous évoquerons essentiellement les séquelles après chirurgie, sachant que la radiothérapie est pourvoyeuse de toxicités significatives et prolongées de la muqueuse nasale (croûtes endonasales, parfois hémorragiques et surinfectées, pouvant être douloureuses et nauséabondes chez près de 75 % des patients à court ou moyen termes),5 de toxicités optiques, auditives (aggravées par la chimiothérapie), souvent négligées malgré leur impact négatif sur la qualité de vie des patients,6 endocriniennes (atteinte hypophysaire) ou neurologiques (fatigue et cognition) dans environ 40 % des cas à moyen ou long termes.7-10
La moitié environ des patients n’a pas de douleur faciale ou dentaire après chirurgie par voie externe, et encore moins après chirurgie endonasale seule ; l’autre moitié est équilibrée par des antalgiques de palier I ou II entre J1 et J12 postopératoires.11 Les douleurs neuropathiques sont fréquentes en cas de tumeurs très évoluées et nécessitent des traitements adaptés spécifiques.
Il faut distinguer les séquelles thérapeutiques temporaires (jusqu’à plusieurs mois après le traitement) pour lesquelles la patience, l’accessibilité du service référent et les petits moyens sont requis, des séquelles définitives engageant une prise en charge médicale et psychosociale à la hauteur des enjeux de réparation.Nous évoquerons essentiellement les séquelles après chirurgie, sachant que la radiothérapie est pourvoyeuse de toxicités significatives et prolongées de la muqueuse nasale (croûtes endonasales, parfois hémorragiques et surinfectées, pouvant être douloureuses et nauséabondes chez près de 75 % des patients à court ou moyen termes),5 de toxicités optiques, auditives (aggravées par la chimiothérapie), souvent négligées malgré leur impact négatif sur la qualité de vie des patients,6 endocriniennes (atteinte hypophysaire) ou neurologiques (fatigue et cognition) dans environ 40 % des cas à moyen ou long termes.7-10
La moitié environ des patients n’a pas de douleur faciale ou dentaire après chirurgie par voie externe, et encore moins après chirurgie endonasale seule ; l’autre moitié est équilibrée par des antalgiques de palier I ou II entre J1 et J12 postopératoires.11 Les douleurs neuropathiques sont fréquentes en cas de tumeurs très évoluées et nécessitent des traitements adaptés spécifiques.
Moins de complications après chirurgie endoscopique
Les complications infectieuses concernent environ 10 % des opérés. Il s’agit en particulier des méningites, qui évoluent le plus souvent favorablement sous antibiothérapie.12 Des suppurations sous-cutanées et ostéites du volet peuvent être traitées chirurgicalement avec dépose du volet, au prix d’importantes séquelles esthétiques.
Certaines voies d’abord sont de moins en moins utilisées du fait de l’impact cosmétique de ces complications : rétractions cutanées en regard du volet (os perdu), invagination de l’aile du nez en profondeur et latéralement avec asymétrie faciale, ou rétrécissement du vestibule narinaire avec obstruction nasale. Alors que les conséquences esthétiques sont quasi nulles en cas de chirurgie endoscopique (ou liées à l’importance du lit d’exérèse carcinologique et à sa localisation), l’incidence d’une cicatrice jugée disgracieuse après chirurgie par voie paralatéronasale serait comprise entre 2,2 et 10,1 %. L’avantage indéniable du degloving est l’absence de cicatrice faciale. Cependant, 61,3 % des patients estiment que leur visage s’est modifié après cette procédure, même si la demande réparatrice demeure faible.11 La plupart des auteurs ont constaté qu’il existait une hypertrophie de la cicatrice les trois premiers mois, qui disparaît par la suite. De rares sténoses narinaires, des synéchies vestibulaires, un collapsus narinaire peuvent également altérer le confort respiratoire.
Certaines voies d’abord sont de moins en moins utilisées du fait de l’impact cosmétique de ces complications : rétractions cutanées en regard du volet (os perdu), invagination de l’aile du nez en profondeur et latéralement avec asymétrie faciale, ou rétrécissement du vestibule narinaire avec obstruction nasale. Alors que les conséquences esthétiques sont quasi nulles en cas de chirurgie endoscopique (ou liées à l’importance du lit d’exérèse carcinologique et à sa localisation), l’incidence d’une cicatrice jugée disgracieuse après chirurgie par voie paralatéronasale serait comprise entre 2,2 et 10,1 %. L’avantage indéniable du degloving est l’absence de cicatrice faciale. Cependant, 61,3 % des patients estiment que leur visage s’est modifié après cette procédure, même si la demande réparatrice demeure faible.11 La plupart des auteurs ont constaté qu’il existait une hypertrophie de la cicatrice les trois premiers mois, qui disparaît par la suite. De rares sténoses narinaires, des synéchies vestibulaires, un collapsus narinaire peuvent également altérer le confort respiratoire.
Des conséquences neurologiques
Les atteintes neurologiques peuvent être liées à la tumeur, aggravées ou non résolues par le traitement. Les hypoesthésies et anesthésies du territoire du nerf infra-orbitaire sont rapportées chez 15 à 30 % des patients opérés, quelle que soit la voie d’abord ;11, 13 les hypoesthésies, anesthésies, névralgie dentaire peuvent également être observées après chirurgie.14 En l’absence de solution de continuité du nerf pour raison carcinologique, il s’agit d’hypoesthésies et/ou de paresthésies transitoires, qui persistent en moyenne trois mois, jamais au-delà de six.
L’anosmie est présente dans près de 100 % des cas, sans solution thérapeutique validée.
L’anosmie est présente dans près de 100 % des cas, sans solution thérapeutique validée.
Des impacts oculaires
Alors que diplopie ou exophtalmie sont des signes évolutifs des CNS, les séquelles ophtalmologiques postopératoires sont essentiellement des diplopies transitoires (toujours moins de 6 mois) qui régressent spontanément ou après des séances de rééducation orthoptique.
Un larmoiement est également noté dans environ 30 % des cas ; il peut être définitif. Une amblyopie est possible, nécessitant de changer la correction optique d’environ 30 % des patients opérés entre 40 et 80 ans, qui avaient un trouble de la réfraction préexistant. Les champs de radiothérapie peuvent inclure une partie de l’orbite ou des nerfs crâniens et favoriser l’apparition d’une cataracte (à traiter sans contre-indication oncologique). Plus rarement, et toujours imposé par l’envahissement de la zone tumorale, le risque de cécité à cinq ans varie de 0 à 5 %. Il convient donc de discuter de la prise de risque avec le patient, dès lors qu’une dose plus élevée sur l’un des nerfs optiques expose à une probabilité de complication unilatérale sévère supérieure à 5 % à cinq ans.
Les principales séries de la littérature font également part de complications lacrymales, par voie de degloving ou paralatéronasale. Il s’agit d’épiphora, d’écoulement sale de l’angle interne de l’œil, et de dacryocystites. L’épiphora, toujours présent après dacryocystectomie, persiste dans 30 % des cas après réparation des voies lacrymales, mais tend à être moins fréquent chez les sujets irradiés en adjuvant.11 Le risque, tout aussi impactant sur la qualité de vie, d’épisode infectieux du sac lacrymal semble être de 10 %. Ces complications lacrymales peuvent bénéficier d’un traitement, peropératoire ou dans un second temps, qui n’a que peu ou pas d’efficacité sur l’épiphora.
Un larmoiement est également noté dans environ 30 % des cas ; il peut être définitif. Une amblyopie est possible, nécessitant de changer la correction optique d’environ 30 % des patients opérés entre 40 et 80 ans, qui avaient un trouble de la réfraction préexistant. Les champs de radiothérapie peuvent inclure une partie de l’orbite ou des nerfs crâniens et favoriser l’apparition d’une cataracte (à traiter sans contre-indication oncologique). Plus rarement, et toujours imposé par l’envahissement de la zone tumorale, le risque de cécité à cinq ans varie de 0 à 5 %. Il convient donc de discuter de la prise de risque avec le patient, dès lors qu’une dose plus élevée sur l’un des nerfs optiques expose à une probabilité de complication unilatérale sévère supérieure à 5 % à cinq ans.
Les principales séries de la littérature font également part de complications lacrymales, par voie de degloving ou paralatéronasale. Il s’agit d’épiphora, d’écoulement sale de l’angle interne de l’œil, et de dacryocystites. L’épiphora, toujours présent après dacryocystectomie, persiste dans 30 % des cas après réparation des voies lacrymales, mais tend à être moins fréquent chez les sujets irradiés en adjuvant.11 Le risque, tout aussi impactant sur la qualité de vie, d’épisode infectieux du sac lacrymal semble être de 10 %. Ces complications lacrymales peuvent bénéficier d’un traitement, peropératoire ou dans un second temps, qui n’a que peu ou pas d’efficacité sur l’épiphora.
Autres conséquences
Le risque de trismus doit également être connu, lié à l’irradiation fréquente de l’articulation temporomandibulaire. Associé aux hyposialies et aux ostéoradionécroses, ces complications font du suivi dentaire régulier un élément fondamental de la surveillance.
Alors que les fistules buccosinusiennes sont exceptionnelles, les fuites de liquide cérébrospinal sont plus fréquentes, et régressent habituellement sous simple traitement médical.
Alors que les fistules buccosinusiennes sont exceptionnelles, les fuites de liquide cérébrospinal sont plus fréquentes, et régressent habituellement sous simple traitement médical.
Une prise en charge très spécialisée
La prise en charge des cancers nasosinusiens est très diverse et spécialisée, exigeant un avis en centre expert membre du REFCOR. Les patients doivent par ailleurs être informés de l’existence d’associations, comme CORASSO, qui peuvent aussi leur offrir un soutien humain, un lieu de partage d’expériences et des informations sur les prises en charge du handicap.
Références
1. Oliver JR, Lieberman SM, Tam MM, Liu CZ, Li Z, Hu KS, et al. Human papillomavirus and survival of patients with sinonasal squamous cell carcinoma. Cancer 2020;126:1413-23.
2. Thariat J, Moya Plana A, Vérillaud B, Vergez S, Ferrand FR, Digue L, et al.; membres REFCOR. Diagnostic, pronostic et traitement des carcinomes nasosinusiens (hors mélanomes, sarcomes et lymphomes). Bull Cancer 2020;107:601-11.
3. Thariat J, Carsuzaa F, Marcy PY, Verillaud B, de Gabory L, Ferrand FR. Precision postoperative radiotherapy in sinonasal carcinomas after endonasal endoscopic surgery. Cancers (Basel) 2021;13:4802.
4. Moya-Plana A, Herrera Gómez RG, Rossoni C, Dercle L, Ammari S, Girault I, et al. Evaluation of the efficacy of immunotherapy for non-resectable mucosal melanoma. Cancer Immunol Immunother 2019;68:1171-8.
5. Yin G, Tu B, Ye L. Correlation of intensity-modulated radiation therapy at a specific radiation dose with the prognosis of nasal mucous damage after radiotherapy. Radiat Environ Biophys 2020;59:245-55.
6. Weiss A, Kuonen R, Brockmeier H, Grotzer M, Candreia C, Maire R, et al.; Swiss Pediatric Oncology Group (SPOG). Audiological monitoring in Swiss childhood cancer patients. Pediatr Blood Cancer 2018;65.
7. Mourad WF, Hauerstock D, Shourbaji RA, Hu KS, Culliney B, Li Z, et al. Trimodality management of sinonasal undifferentiated carcinoma and review of the literature. Am J Clin Oncol 2013;36:584-8.
8. Duprez F, Madani I, Morbée L, Bonte K, Deron P, Domján V, et al. IMRT for sinonasal tumors minimizes severe late ocular toxicity and preserves disease control and survival. Int J Radiat Oncol Biol Phys 2012;83:252-9.
9. Askoxylakis V, Hegenbarth P, Timke C, Saleh-Ebrahimi L, Debus J, Röder F, et al. Intensity modulated radiation therapy (IMRT) for sinonasal tumors: a single center long-term clinical analysis. Radiat Oncol 2016;11:17.
10. Antognoni P, Turri-Zanoni M, Gottardo S, Molteni M, Volpi L, Facco C, et al. Endoscopic resection followed by adjuvant radiotherapy for sinonasal intestinal-type adenocarcinoma: Retrospective analysis of 30 consecutive patients. Head Neck 2015;37:677-84.
11. De Gabory L, Stoll D. Evaluation du degloving dans la chirurgie des tumeurs du massif facial : à propos de 170 cas. Dans : XXXVIIIe rapport de la Société française de carcinologie cervico-faciale. Paris : EDK, Paris ; 2007. Fontanel JP, Klossek JM. Les voies d’abord du massif facial et des cavités naso-sinusiennes ; p. 179-89.
12. Ganly I, Patel SG, Singh B, Kraus DH, Bridger PG, Cantu G, et al. Complications of craniofacial resection for malignant tumors of the skull base: report of an International Collaborative Study. Head Neck 2005;27:445-51.
13. Delank KW, Franzen W, Hüttenbrink KB, Stoll W. Long-term results of lateral rhinotomy with medial maxillo-ethmoidectomy. Laryngorhinootologie 1994;73:270-3.
14. Védrine L, Bauduceau O, Fayolle M, Le Moulec S, Ceccaldi B. Combined chemotherapy and radiation therapy for intracranial germinomas. The Val-de-Grace hospital experience. Cancer Radiother 2005;9:335-40.
2. Thariat J, Moya Plana A, Vérillaud B, Vergez S, Ferrand FR, Digue L, et al.; membres REFCOR. Diagnostic, pronostic et traitement des carcinomes nasosinusiens (hors mélanomes, sarcomes et lymphomes). Bull Cancer 2020;107:601-11.
3. Thariat J, Carsuzaa F, Marcy PY, Verillaud B, de Gabory L, Ferrand FR. Precision postoperative radiotherapy in sinonasal carcinomas after endonasal endoscopic surgery. Cancers (Basel) 2021;13:4802.
4. Moya-Plana A, Herrera Gómez RG, Rossoni C, Dercle L, Ammari S, Girault I, et al. Evaluation of the efficacy of immunotherapy for non-resectable mucosal melanoma. Cancer Immunol Immunother 2019;68:1171-8.
5. Yin G, Tu B, Ye L. Correlation of intensity-modulated radiation therapy at a specific radiation dose with the prognosis of nasal mucous damage after radiotherapy. Radiat Environ Biophys 2020;59:245-55.
6. Weiss A, Kuonen R, Brockmeier H, Grotzer M, Candreia C, Maire R, et al.; Swiss Pediatric Oncology Group (SPOG). Audiological monitoring in Swiss childhood cancer patients. Pediatr Blood Cancer 2018;65.
7. Mourad WF, Hauerstock D, Shourbaji RA, Hu KS, Culliney B, Li Z, et al. Trimodality management of sinonasal undifferentiated carcinoma and review of the literature. Am J Clin Oncol 2013;36:584-8.
8. Duprez F, Madani I, Morbée L, Bonte K, Deron P, Domján V, et al. IMRT for sinonasal tumors minimizes severe late ocular toxicity and preserves disease control and survival. Int J Radiat Oncol Biol Phys 2012;83:252-9.
9. Askoxylakis V, Hegenbarth P, Timke C, Saleh-Ebrahimi L, Debus J, Röder F, et al. Intensity modulated radiation therapy (IMRT) for sinonasal tumors: a single center long-term clinical analysis. Radiat Oncol 2016;11:17.
10. Antognoni P, Turri-Zanoni M, Gottardo S, Molteni M, Volpi L, Facco C, et al. Endoscopic resection followed by adjuvant radiotherapy for sinonasal intestinal-type adenocarcinoma: Retrospective analysis of 30 consecutive patients. Head Neck 2015;37:677-84.
11. De Gabory L, Stoll D. Evaluation du degloving dans la chirurgie des tumeurs du massif facial : à propos de 170 cas. Dans : XXXVIIIe rapport de la Société française de carcinologie cervico-faciale. Paris : EDK, Paris ; 2007. Fontanel JP, Klossek JM. Les voies d’abord du massif facial et des cavités naso-sinusiennes ; p. 179-89.
12. Ganly I, Patel SG, Singh B, Kraus DH, Bridger PG, Cantu G, et al. Complications of craniofacial resection for malignant tumors of the skull base: report of an International Collaborative Study. Head Neck 2005;27:445-51.
13. Delank KW, Franzen W, Hüttenbrink KB, Stoll W. Long-term results of lateral rhinotomy with medial maxillo-ethmoidectomy. Laryngorhinootologie 1994;73:270-3.
14. Védrine L, Bauduceau O, Fayolle M, Le Moulec S, Ceccaldi B. Combined chemotherapy and radiation therapy for intracranial germinomas. The Val-de-Grace hospital experience. Cancer Radiother 2005;9:335-40.