Depuis 20 ans, la mise sur le marché de nombreux médicaments antiépileptiques de nouvelle génération a fondamentalement modifié les habitudes de prescription. Quelle place reste-t-il pour les antiépileptiques dits d’ancienne génération, notamment la carbamazépine ?
Caractéristiques et mécanismes d’action
La carbamazépine (Tegretol) a été mise sur le marché en France dans les années 1960 et possède une autorisation de mise sur le marché dans trois domaines :
– l’épilepsie ; indication en monothérapie de première intention ou en association dans les épilepsies focales avec ou sans généralisation secondaire et des crises généralisées tonico-cloniques primaires, chez l’adulte et l’enfant ;
– la psychiatrie ; indication en prévention des rechutes dans le cadre du trouble bipolaire, notamment chez les patients ayant une résistance relative, des contre-indications ou une intolérance au lithium et dans le traitement des états d’excitation maniaque ou hypomaniaque ;
– la douleur : indication dans le traitement des névralgies du trijumeau et du glossopharyngien et des douleurs neuropathiques de l’adulte.
– l’épilepsie ; indication en monothérapie de première intention ou en association dans les épilepsies focales avec ou sans généralisation secondaire et des crises généralisées tonico-cloniques primaires, chez l’adulte et l’enfant ;
– la psychiatrie ; indication en prévention des rechutes dans le cadre du trouble bipolaire, notamment chez les patients ayant une résistance relative, des contre-indications ou une intolérance au lithium et dans le traitement des états d’excitation maniaque ou hypomaniaque ;
– la douleur : indication dans le traitement des névralgies du trijumeau et du glossopharyngien et des douleurs neuropathiques de l’adulte.
Structure chimique et galénique
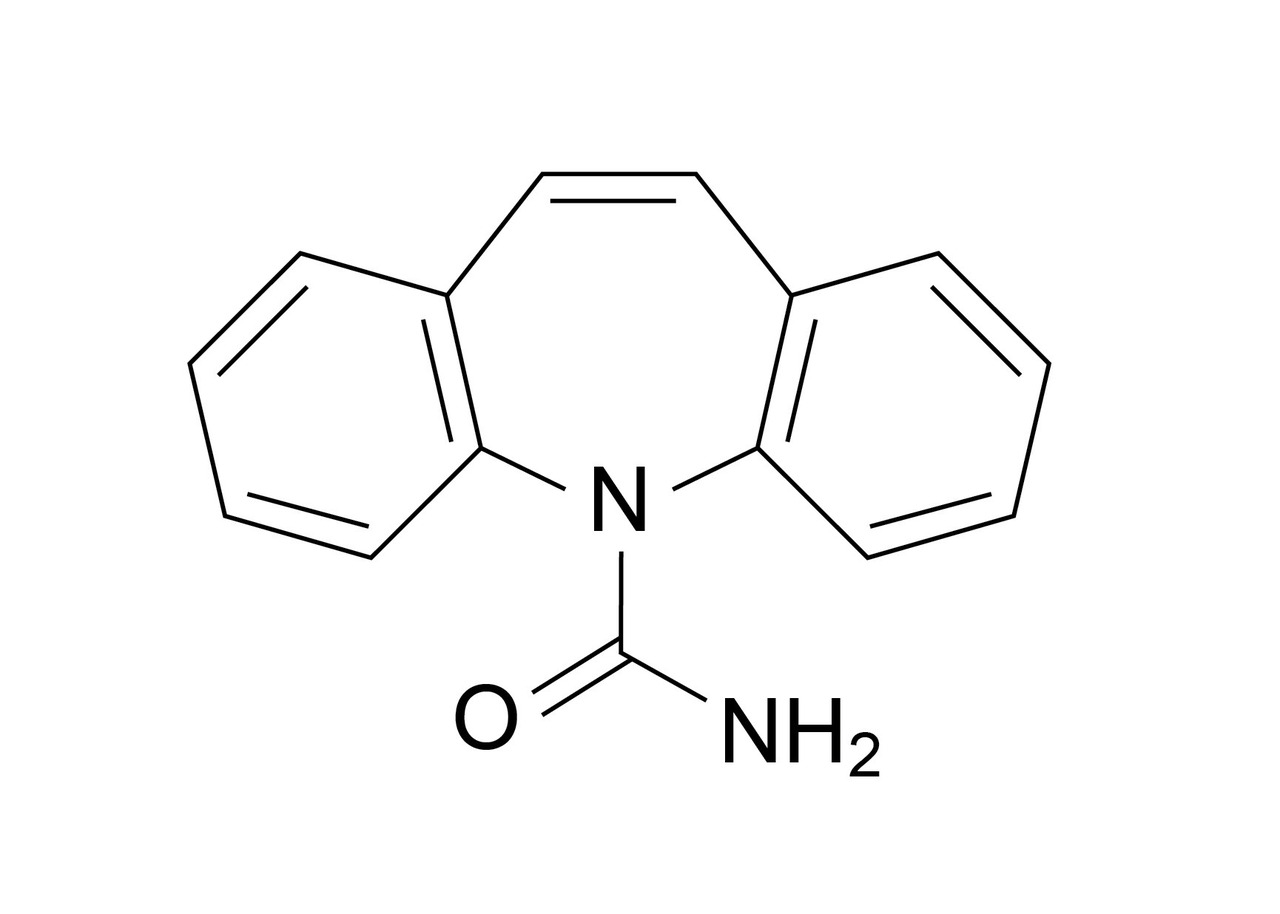
La carbamazépine appartient à la classe des dibenzazépines : composés chimiques avec deux cycles benzéniques fusionnés à un groupe azépine, tout comme l’oxcarbazépine (Trileptal) et l’eslicarbazépine (Zebinix) [v. figure ].
Elle existe sous forme de comprimés à 200 mg (libération simple) ou à libération prolongée (LP) : LP 200 mg, LP 400 mg ou de solution buvable (1 mL = 100 mg).
Il n’existe pas de forme intraveineuse de la carbamazépine.
Elle existe sous forme de comprimés à 200 mg (libération simple) ou à libération prolongée (LP) : LP 200 mg, LP 400 mg ou de solution buvable (1 mL = 100 mg).
Il n’existe pas de forme intraveineuse de la carbamazépine.
Principales caractéristiques pharmacologiques
La carbamazépine est métabolisée via le CYP3A4 en carbamazépine-10,11-époxyde, son métabolite actif, également responsable de la majorité de ses effets indésirables. Ses principales caractéristiques sont :1, 2
– une absorption orale lente, avec des pics de concentration culminant autour de 4 heures après une dose, mais une excellente biodisponibilité globale d’environ 90 % ;
– une forte induction enzymatique, y compris sur ses propres métabolites (médicament auto-inducteur) ; la carbamazépine est en effet un puissant inducteur de plusieurs des enzymes du cytochrome (CYP) P450 et des uridine-glucuronosyl transférases ;
– une demi-vie oscillant entre 16 et 24 heures ;
– une excrétion urinaire ;
– un passage transplacentaire et dans le lait maternel.
– une absorption orale lente, avec des pics de concentration culminant autour de 4 heures après une dose, mais une excellente biodisponibilité globale d’environ 90 % ;
– une forte induction enzymatique, y compris sur ses propres métabolites (médicament auto-inducteur) ; la carbamazépine est en effet un puissant inducteur de plusieurs des enzymes du cytochrome (CYP) P450 et des uridine-glucuronosyl transférases ;
– une demi-vie oscillant entre 16 et 24 heures ;
– une excrétion urinaire ;
– un passage transplacentaire et dans le lait maternel.
Mécanisme d’action
La carbamazépine est un stabilisateur de membrane bloqueur des canaux sodiques entraînant une diminution de l’excitabilité neuronale.3
Quelle efficacité ?
L’ensemble des études cliniques démontre une efficacité jamais surpassée de la carbamazépine dans l’épilepsie focale.
Les études anciennes comparant son efficacité à celle de médicaments antiépileptiques d’ancienne génération montraient une efficacité supérieure en cas de comparaison avec le phénobarbital4 ou la primidone ou dans le cadre des épilepsies focales avec le valproate de sodium5 et une efficacité égale en cas de comparaison avec la phénytoïne.6
L’étude SANAD (Standard and New Antiepileptic Drugs), étude contrôlée ouverte en simple aveugle comparant la carbamazépine, la gabapentine, la lamotrigine, l’oxcarbazépine et le topiramate dans l’épilepsie focale, avait inclus 1 721 patients épileptiques ambulatoires au Royaume-Uni.7 Dans cette étude, la carbamazépine était supérieure à la gabapentine pour la période allant jusqu’à 12 mois de rémission et avait un avantage non significatif sur la lamotrigine, le topiramate et l’oxcarbazépine.
Plus récemment, l’efficacité et la tolérabilité d’un certain nombre de nouveaux antiépileptiques, dont le lévétiracétam, le lacosamide, l’eslicarbazépine et le zonisamide, ont été évaluées dans le cadre d’essais comparatifs directs contre la carbamazépine à libération prolongée chez des adultes souffrant d’épilepsie focale récemment diagnostiquée.8-11 Aucun de ces nouveaux médicaments n’a montré une efficacité ou une tolérabilité supérieure à celles de la carbamazépine à libération prolongée.
Les études anciennes comparant son efficacité à celle de médicaments antiépileptiques d’ancienne génération montraient une efficacité supérieure en cas de comparaison avec le phénobarbital4 ou la primidone ou dans le cadre des épilepsies focales avec le valproate de sodium5 et une efficacité égale en cas de comparaison avec la phénytoïne.6
L’étude SANAD (Standard and New Antiepileptic Drugs), étude contrôlée ouverte en simple aveugle comparant la carbamazépine, la gabapentine, la lamotrigine, l’oxcarbazépine et le topiramate dans l’épilepsie focale, avait inclus 1 721 patients épileptiques ambulatoires au Royaume-Uni.7 Dans cette étude, la carbamazépine était supérieure à la gabapentine pour la période allant jusqu’à 12 mois de rémission et avait un avantage non significatif sur la lamotrigine, le topiramate et l’oxcarbazépine.
Plus récemment, l’efficacité et la tolérabilité d’un certain nombre de nouveaux antiépileptiques, dont le lévétiracétam, le lacosamide, l’eslicarbazépine et le zonisamide, ont été évaluées dans le cadre d’essais comparatifs directs contre la carbamazépine à libération prolongée chez des adultes souffrant d’épilepsie focale récemment diagnostiquée.8-11 Aucun de ces nouveaux médicaments n’a montré une efficacité ou une tolérabilité supérieure à celles de la carbamazépine à libération prolongée.
Quels effets indésirables ?
Profil général
Comme la plupart des médicaments antiépileptiques, la carbamazépine peut provoquer des effets indésirables portant sur le système nerveux central : sédation, asthénie, céphalées, sensations vertigineuses, instabilité, voire nausées, diplopie, nystagmus. Ces effets sont majorés en cas de titration trop rapide ou de surdosage.
Elle peut également engendrer comme nombre d’autres médicaments antiépileptiques :
– des effets indésirables digestifs : hépatopathie, élévation des transaminases, et/ou des phosphatases alcalines et/ou des gamma-glutamyl transférases, troubles digestifs (transit, nausées, douleurs abdominales) ;
– des effets indésirables hématologiques : leucopénie, thrombopénie, anémie, aplasie ;
– des effets indésirables osseux : les antiépileptiques d’ancienne génération sont connus pour leur rôle délétère sur le capital osseux, notamment les inducteurs enzymatiques, diminution de la densité minérale osseuse, ostéopénie, voire ostéoporose.
Elle peut également engendrer comme nombre d’autres médicaments antiépileptiques :
– des effets indésirables digestifs : hépatopathie, élévation des transaminases, et/ou des phosphatases alcalines et/ou des gamma-glutamyl transférases, troubles digestifs (transit, nausées, douleurs abdominales) ;
– des effets indésirables hématologiques : leucopénie, thrombopénie, anémie, aplasie ;
– des effets indésirables osseux : les antiépileptiques d’ancienne génération sont connus pour leur rôle délétère sur le capital osseux, notamment les inducteurs enzymatiques, diminution de la densité minérale osseuse, ostéopénie, voire ostéoporose.
Effets indésirables spécifiques
Par ailleurs, la carbamazépine a également des effets secondaires qui lui sont propres.
Une allergie cutanée démontrée à la carbamazépine contre-indique normalement l’essai d’autres molécules de la classe des dibenzazépines, à savoir l’oxcarbazépine (Trileptal) et l’eslicarbazépine (Zebinix).
Chez les Asiatiques (notamment les Chinois Han et les Thaïlandais), la recherche de l’allèle HLA-B*1502 doit être systématique avant instauration de la carbamazépine du fait d’un risque accru de syndrome de Stevens-Johnson en présence de ces allèles qui contre-indiquent alors la prescription de carbamazépine ; chez les Japonais ou les Européens du Nord, c’est l’allèle HLA-A*3101 qui doit être recherché avant de prescrire la carbamazépine.
Il a également été suggéré une possible aggravation de la fréquence des crises dans l’épilepsie à paroxysme rolandique, épilepsie focale idiopathique réputée bénigne du jeune enfant ; cela dit, ces cas demeurent anecdotiques, et le dogme de la non-prescription de carbamazépine dans les épilepsies à paroxysme rolandique commence à être remis en cause.
On ne dispose pas à l’heure actuelle de données sur un éventuel risque neurodéveloppemental lié à la prise de carbamazépine pendant la grossesse.
Les médicaments antiépileptiques peuvent également subir une induction avec la carbamazépine : clonazépam, éthosuximide, valproate de sodium, felbamate, lévétiracétam, lamotrigine, lacosamide, oxcarbazépine, eslicarbazépine, pérampanel, rufinamide, stiripentol, tiagabine, topiramate, zonisamide.
Certaines associations sont même contre-indiquées avec la carbamazépine :
– médicaments antirétroviraux indiqués dans le traitement de l’infection par le virus de l’immunodéficience humaine (VIH) : cobicistat, rilpivirine ;
– médicaments de l’hépatite C : daclatasvir, dasabuvir, lédipasvir, ombitasvir + paritaprévir, sofosbuvir, télaprévir, velpatasvir ;
– médicament antituberculeux : délamanide ;
- médicaments antimycosiques : isavuconazole, voriconazole ;
– médicament antipsychotique atypique : lurasidone.
À l’inverse, certains médicaments vont jouer sur le métabolisme de la carbamazépine (inhibition hépatique) en augmentant ses concentrations plasmatiques, avec un risque de surdosage et d’effets indésirables. C’est le cas des médicaments suivants : dextropropoxyphène, érythromycine, josamycine, isoniazide, cimétidine, sertraline… C’est le cas également du jus de pamplemousse.
Allergies cutanées
La carbamazépine comporte un risque non négligeable de réaction allergique cutanée, notamment au moment de son instauration : allant de la simple éruption cutanée à des tableaux cliniques plus graves : syndromes DRESS, de Stevens-Johnson ou de Lyell.Une allergie cutanée démontrée à la carbamazépine contre-indique normalement l’essai d’autres molécules de la classe des dibenzazépines, à savoir l’oxcarbazépine (Trileptal) et l’eslicarbazépine (Zebinix).
Chez les Asiatiques (notamment les Chinois Han et les Thaïlandais), la recherche de l’allèle HLA-B*1502 doit être systématique avant instauration de la carbamazépine du fait d’un risque accru de syndrome de Stevens-Johnson en présence de ces allèles qui contre-indiquent alors la prescription de carbamazépine ; chez les Japonais ou les Européens du Nord, c’est l’allèle HLA-A*3101 qui doit être recherché avant de prescrire la carbamazépine.
Risque d’aggravation de certains types de crises d’épilepsie généralisée
La carbamazépine est déconseillée dans les épilepsies généralisées idiopathiques car potentiellement aggravante des absences et des myoclonies.12Il a également été suggéré une possible aggravation de la fréquence des crises dans l’épilepsie à paroxysme rolandique, épilepsie focale idiopathique réputée bénigne du jeune enfant ; cela dit, ces cas demeurent anecdotiques, et le dogme de la non-prescription de carbamazépine dans les épilepsies à paroxysme rolandique commence à être remis en cause.
Troubles de la conduction cardiaque
La carbamazépine, comme de nombreux antiépileptiques bloqueurs sodiques, peut entraîner des troubles de l’excitabilité ou de la conduction cardiaque. Elle est d’ailleurs contre-indiquée en cas de bloc atrioventriculaire.Hyponatrémie
Des études montrent qu’une hyponatrémie survient chez environ un quart des patients sous carbamazépine.13 La plupart du temps, cette hyponatrémie demeure modérée (> 128 mmol/L) et asymptomatique et n’impose pas de mesures ou surveillance particulière. Elle peut parfois s’avérer sévère, notamment en cas de coprescription de médicaments connus pour donner des hyponatrémies, comme les inhibiteurs de la recapture de la sérotonine et les diurétiques, et nécessiter des mesures correctives.Tératogénicité
La carbamazépine (Tegretol) possède une potentielle tératogénicité dose-dépendante (au-delà de 600 à 800 mg/j selon les registres). Elle peut donc être autorisée en l’absence d’alternative thérapeutique pendant la grossesse mais à faible dose (400 mg/j). Par ailleurs, certaines études suggèrent un risque accru de non-fermeture du tube neural (spina bifida) indépendant de la dose.On ne dispose pas à l’heure actuelle de données sur un éventuel risque neurodéveloppemental lié à la prise de carbamazépine pendant la grossesse.
Risques d’interactions médicamenteuses
On doit prendre garde, en cas de coprescription, à la baisse des concentrations plasmatiques des médicaments subissant un métabolisme hépatique des isoenzymes du cytochrome P450, et donc à leur potentielle perte d’efficacité. C’est le cas avec certains médicaments anticoagulants et antiagrégants plaquettaires : antagonistes de la vitamine K en général et simvastatine spécifiquement, rivaroxaban, apixaban, ticagrélor ; avec certains immunosuppresseurs : ciclosporine, évérolimus, sirolimus, tacrolimus ; avec les corticoïdes et l’hydrocortisone ; avec certains psychotropes : halopéridol, quétiapine… ; avec les estroprogestatifs (baisse de l’efficacité contraceptive)…Les médicaments antiépileptiques peuvent également subir une induction avec la carbamazépine : clonazépam, éthosuximide, valproate de sodium, felbamate, lévétiracétam, lamotrigine, lacosamide, oxcarbazépine, eslicarbazépine, pérampanel, rufinamide, stiripentol, tiagabine, topiramate, zonisamide.
Certaines associations sont même contre-indiquées avec la carbamazépine :
– médicaments antirétroviraux indiqués dans le traitement de l’infection par le virus de l’immunodéficience humaine (VIH) : cobicistat, rilpivirine ;
– médicaments de l’hépatite C : daclatasvir, dasabuvir, lédipasvir, ombitasvir + paritaprévir, sofosbuvir, télaprévir, velpatasvir ;
– médicament antituberculeux : délamanide ;
- médicaments antimycosiques : isavuconazole, voriconazole ;
– médicament antipsychotique atypique : lurasidone.
À l’inverse, certains médicaments vont jouer sur le métabolisme de la carbamazépine (inhibition hépatique) en augmentant ses concentrations plasmatiques, avec un risque de surdosage et d’effets indésirables. C’est le cas des médicaments suivants : dextropropoxyphène, érythromycine, josamycine, isoniazide, cimétidine, sertraline… C’est le cas également du jus de pamplemousse.
Intérêt du dosage sanguin
Les dosages plasmatiques des médicaments antiépileptiques ne doivent pas être effectués en routine comme outil de surveillance des patients. Les principales indications pour demander un dosage plasmatique de la carbamazépine ou des médicaments antiépileptiques coprescrits sont :
– une suspicion de non-observance ; seuls des taux très bas ou nuls permettent un diagnostic de non-observance ; attention, un dosage en zone infrathérapeutique ne doit pas conduire à augmenter systématiquement la posologie du médicament en l’absence de crises ;
– des signes cliniques de surdosage ;
– des interactions complexes : polythérapie antiépileptique avec persistance de crises, on rappelle par ailleurs le caractère auto-inducteur du médicament ;
– la grossesse (en fin de grossesse, on assiste souvent à une accélération de la clairance des médicaments et à un déplacement des fractions liées aux protéines).
– une suspicion de non-observance ; seuls des taux très bas ou nuls permettent un diagnostic de non-observance ; attention, un dosage en zone infrathérapeutique ne doit pas conduire à augmenter systématiquement la posologie du médicament en l’absence de crises ;
– des signes cliniques de surdosage ;
– des interactions complexes : polythérapie antiépileptique avec persistance de crises, on rappelle par ailleurs le caractère auto-inducteur du médicament ;
– la grossesse (en fin de grossesse, on assiste souvent à une accélération de la clairance des médicaments et à un déplacement des fractions liées aux protéines).
Quelle place pour traiter en 2020 ?
À ce jour, la carbamazépine reste indiquée en première intention dans le traitement des épilepsies focales nouvellement diagnostiquées dans la plupart des guidelines : NICE 2012 et ILAE 2013.14, 15
Néanmoins, le profil de tolérance du médicament et son fort caractère inducteur incitent à ne le préconiser qu’en deuxième ou troisième intention en cas d’échec des premières lignes. Son profil indéniable d’efficacité en fait toujours un acteur majeur de la pharmacopée antiépileptique, et il apparaît encore de nos jours difficile de qualifier une épilepsie focale de pharmacorésistante sans l’avoir testée (ou un autre membre de la famille des dibenzazépines).
Un autre intérêt majeur de la carbamazépine concerne les patients souffrant tout à la fois d’épilepsie et d’autres comorbidités psychiatriques ou algiques. On peut alors repositionner la carbamazépine en première ligne chez ces patients, avec un bémol chez la femme en âge de procréer (inefficacité de la contraception estroprogestative, tératogénicité dose-dépendante).
Néanmoins, le profil de tolérance du médicament et son fort caractère inducteur incitent à ne le préconiser qu’en deuxième ou troisième intention en cas d’échec des premières lignes. Son profil indéniable d’efficacité en fait toujours un acteur majeur de la pharmacopée antiépileptique, et il apparaît encore de nos jours difficile de qualifier une épilepsie focale de pharmacorésistante sans l’avoir testée (ou un autre membre de la famille des dibenzazépines).
Un autre intérêt majeur de la carbamazépine concerne les patients souffrant tout à la fois d’épilepsie et d’autres comorbidités psychiatriques ou algiques. On peut alors repositionner la carbamazépine en première ligne chez ces patients, avec un bémol chez la femme en âge de procréer (inefficacité de la contraception estroprogestative, tératogénicité dose-dépendante).
Références
1. Gierbolini J, Giarratano M, Benbadis SR. Carbamazepine-related antiepileptic drugs for the treatment of epilepsy – a comparative review. Expert Opin Pharmacother 2016:17:885-8.
2. Zaccara G, Perucca E Interactions between antiepileptic drugs, and between antiepileptic drugs and other drugs. Epileptic Disord 2014;16:409-32.
3. Sills GJ, Rogawski MA. Mechanisms of action of currently used antiseizure drugs. Neuropharmacol 2020;168:107966.
4. Nevitt SJ, Marson AG, Tudur Smith C. Carbamazepine versus phenobarbitone monotherapy for epilepsy: an individual participant data review. Cochrane Database Syst Rev 2018;10(10):CD001904.
5. Marson AG, Williamson PR, Hutton JL, Clough HE, Chadwick DW. Carbamazepine versus valproate monotherapy for epilepsy. Cochrane Database Syst Rev 2000;2000(3):CD001030.
6. Nevitt SJ, Marson AG, Weston J, Smith CT. Camazepine versus phenytoin monotherapy for epilepsy: an individual participant data review. Cochrane Database Syst Rev 2017;2017(2):CD001911.
7. Marson A, Al-Kharusi A, Alwaidh M, et al. The SANAD study of effectiveness of carbamazépine, gabapentin, lamotrigine, oxcarbazépine, or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. Lancet 2007;369:1000-15.
8. Brodie MJ, Overstall PW, Giorgi L. Multicentre, double-blind, randomised comparison between lamotrigine and carbamazepine in elderly patients with newly diagnosed epilepsy. The UK Lamotrigine Elderly Study Group. Epilepsy Res 1999;37:81-7.
9. Baulac M, Brodie MJ, Patten A, Segieth J, Giorgi L. Efficacy and tolerability of zonisamide versus controlled-release carbamazepine for newly diagnosed partial epilepsy: a phase 3, randomised, double-blind, non-inferiority trial. Lancet Neurol 2012;11:579-88.
10. Baulac M, Rosenow F, Toledo M, et al. Efficacy, safety, and tolerability of lacosamide monotherapy versus controlled-release carbamazepine in patients with newly diagnosed epilepsy: a phase 3, randomised, double-blind, non-inferiority trial. Lancet Neurol 2017;16:43-54.
11. Trinka E, Ben-Menachem E, Kowacs PA, et al. Efficacy and safety of eslicarbazepine acetate versus controlled-release carbamazepine monotherapy in newly diagnosed epilepsy: a phase III double-blind, randomized, parallel-group, multicenter study. Epilepsia 2018;59:479-91.
12. Genton P, Gelisse P, Thomas P, Dravet C. Do carbamazepine and phenytoin aggravate juvenile myoclonic epilepsy? Neurology 2000;55:1106-9.
13. Berghuis B, van der Palen J, de Haan GJ, et al; the EpiPGX consortium. Carbamazepine and oxcarbazepine induced hyponatremia in people with epilepsy. Epilepsia 2017;58:1227-33.
14. National Clinical Guideline Centre (UK); Royal College of Physicians. The epilepsies: the diagnosis and management of the epilepsies in adults and children in primary and secondary care. Clinical guidance 137, NICE 2012. http://guidance.nice.org.uk/CG137.
15. Glauser T, Ben-Menachem E, Bourgeois B, et al; ILAE Subcommission on AED Guidelines. Updated ILAE evidence review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia 2013;54:551-63.
2. Zaccara G, Perucca E Interactions between antiepileptic drugs, and between antiepileptic drugs and other drugs. Epileptic Disord 2014;16:409-32.
3. Sills GJ, Rogawski MA. Mechanisms of action of currently used antiseizure drugs. Neuropharmacol 2020;168:107966.
4. Nevitt SJ, Marson AG, Tudur Smith C. Carbamazepine versus phenobarbitone monotherapy for epilepsy: an individual participant data review. Cochrane Database Syst Rev 2018;10(10):CD001904.
5. Marson AG, Williamson PR, Hutton JL, Clough HE, Chadwick DW. Carbamazepine versus valproate monotherapy for epilepsy. Cochrane Database Syst Rev 2000;2000(3):CD001030.
6. Nevitt SJ, Marson AG, Weston J, Smith CT. Camazepine versus phenytoin monotherapy for epilepsy: an individual participant data review. Cochrane Database Syst Rev 2017;2017(2):CD001911.
7. Marson A, Al-Kharusi A, Alwaidh M, et al. The SANAD study of effectiveness of carbamazépine, gabapentin, lamotrigine, oxcarbazépine, or topiramate for treatment of partial epilepsy: an unblinded randomised controlled trial. Lancet 2007;369:1000-15.
8. Brodie MJ, Overstall PW, Giorgi L. Multicentre, double-blind, randomised comparison between lamotrigine and carbamazepine in elderly patients with newly diagnosed epilepsy. The UK Lamotrigine Elderly Study Group. Epilepsy Res 1999;37:81-7.
9. Baulac M, Brodie MJ, Patten A, Segieth J, Giorgi L. Efficacy and tolerability of zonisamide versus controlled-release carbamazepine for newly diagnosed partial epilepsy: a phase 3, randomised, double-blind, non-inferiority trial. Lancet Neurol 2012;11:579-88.
10. Baulac M, Rosenow F, Toledo M, et al. Efficacy, safety, and tolerability of lacosamide monotherapy versus controlled-release carbamazepine in patients with newly diagnosed epilepsy: a phase 3, randomised, double-blind, non-inferiority trial. Lancet Neurol 2017;16:43-54.
11. Trinka E, Ben-Menachem E, Kowacs PA, et al. Efficacy and safety of eslicarbazepine acetate versus controlled-release carbamazepine monotherapy in newly diagnosed epilepsy: a phase III double-blind, randomized, parallel-group, multicenter study. Epilepsia 2018;59:479-91.
12. Genton P, Gelisse P, Thomas P, Dravet C. Do carbamazepine and phenytoin aggravate juvenile myoclonic epilepsy? Neurology 2000;55:1106-9.
13. Berghuis B, van der Palen J, de Haan GJ, et al; the EpiPGX consortium. Carbamazepine and oxcarbazepine induced hyponatremia in people with epilepsy. Epilepsia 2017;58:1227-33.
14. National Clinical Guideline Centre (UK); Royal College of Physicians. The epilepsies: the diagnosis and management of the epilepsies in adults and children in primary and secondary care. Clinical guidance 137, NICE 2012. http://guidance.nice.org.uk/CG137.
15. Glauser T, Ben-Menachem E, Bourgeois B, et al; ILAE Subcommission on AED Guidelines. Updated ILAE evidence review of antiepileptic drug efficacy and effectiveness as initial monotherapy for epileptic seizures and syndromes. Epilepsia 2013;54:551-63.