Le carcinome basocellulaire (CBC) est le cancer cutané le plus fréquent (75 %). Son incidence augmente avec l’âge et varie en fonction du phototype des populations et du taux d’ensoleillement des pays. En France, elle s’élève à 70 pour 100 000 habitants. Le risque moyen pour les personnes à peau claire de développer un CBC au cours de leur vie est d’environ 30 %. Le CBC est plus fréquent chez les hommes que chez les femmes, avec un rapport homme/femme d’environ 2 :1. Ce phénomène peut être attribué à l’évolution des comportements vestimentaires et d’exposition au soleil des femmes. L’âge moyen de survenue se situe autour de 65 ans ; environ 50 % des cas sont compris entre 60 et 79 ans ; plus de 80 % des tumeurs sont situées dans la région « tête et cou ».
À la différence du carcinome épidermoïde, il se développe de novo , il n’y a pas de lésion précancéreuse.
Le facteur de risque principal est l’exposition solaire cumulative. Le CBC apparaît donc le plus souvent au niveau des régions photoexposées. Autres facteurs de risque : radiodermites, immunodépression, antécédents familiaux de CBC, certaines génodermoses comme l’albinisme, xeroderma pigmentosum (maladie génétique rare, responsable d’une sensibilité extrême aux UV), nævomatose basocellulaire ou syndrome de Gorlin (caractérisée par la survenue de très nombreux CBC et liée à la mutation d’un gène de la voie de signalisation Hedgehog). Le risque de CBC post-transplantation est multiplié par 6 à 16, avec un sur-risque chez les receveurs de rein. Cependant, dans cette population le principal risque est le carcinome épidermoïde (CEC) avec un rapport CBC/CEC inversé comparativement à la population générale.
L’exposition aux UV étant un facteur de risque partagé par différents cancers de la peau, le dépistage est important, notamment en cas d’antécédents de tumeur cutanée ; il repose sur un examen clinique soigneux.1
Quand l’évoquer ?
Le CBC se développe à partir des cellules basales de l’épiderme. Le visage est la localisation la plus fréquente (front, tempes, joues). Plus rarement, il apparaît au niveau des régions non photoexposées ; il ne touche pas les muqueuses et ne métastase qu’exceptionnellement.
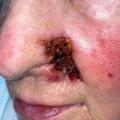
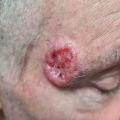
Les lésions se manifestent sous forme d’une plaque ou « papule », ou d’un nodule de couleur rosée ou grisâtre, d’aspect scléreux, lisse, pouvant être parcouru de fines télangiectasies. On observe parfois une ulcération ou érosion en « coup d’ongle » ou une discrète hémorragie, voire plus rarement une pigmentation qui doit faire évoquer le diagnostic différentiel de mélanome nodulaire.
En raison de son caractère indolore et de sa croissance lente, la lésion est le plus souvent méconnue du patient. Le CBC étant le plus souvent situé au niveau des régions photoexposées, donc facilement visibles, le praticien peut en faire le diagnostic lors d’une consultation pour un autre motif. Toute lésion perlée, ulcérée, télangiectasique ayant des difficultés à cicatriser sur plusieurs mois doit faire évoquer un CBC. En l’absence de prise en charge, l’évolution est inexorable, entraînant au maximum un délabrement majeur, atteignant parfois le muscle et les organes sous-jacents.
Si dans la majorité des cas la clinique est évocatrice, le diagnostic de certitude est histologique : mise en évidence d’une prolifération de petites cellules basophiles centrales rondes ou ovalaires entourées d’une couche périphérique cubique à disposition palissadique.
Trois sous-types cliniques sont décrits :
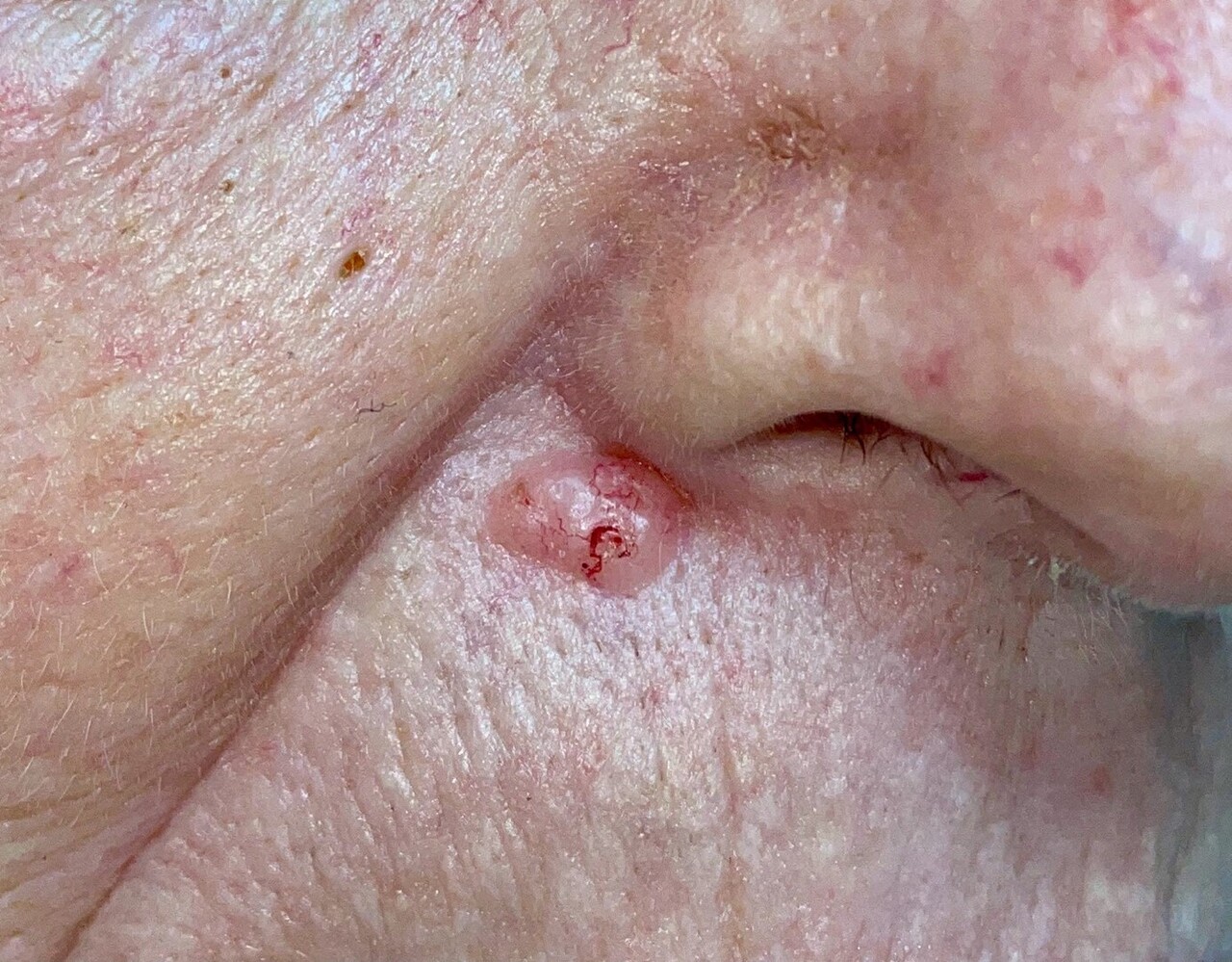
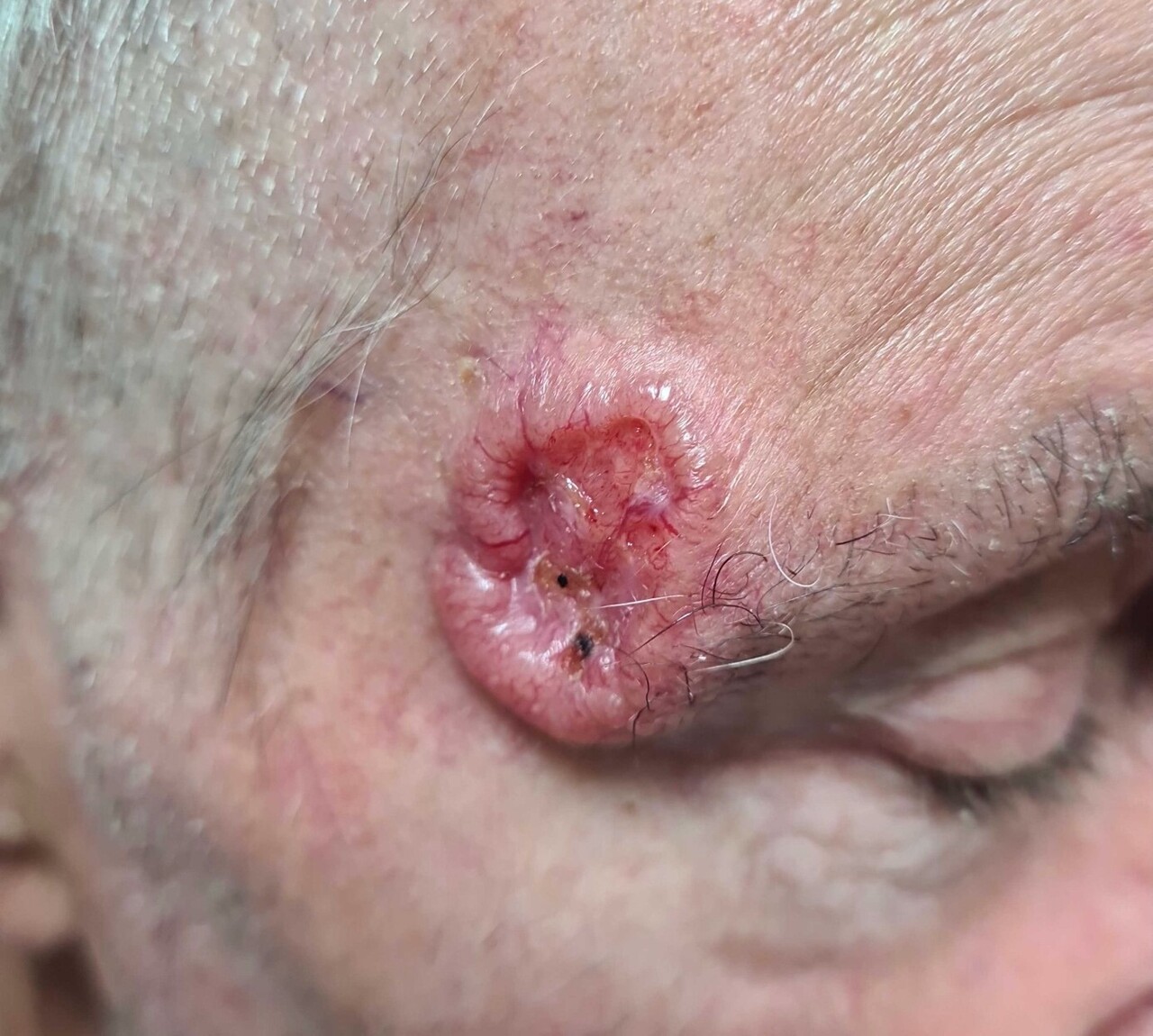
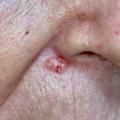
– CBC nodulaire : lésion ferme, lisse, bien limitée, pouvant parfois prendre un aspect kystique ou avoir une progression centrifuge (le plus répandu, fig. 1) ;
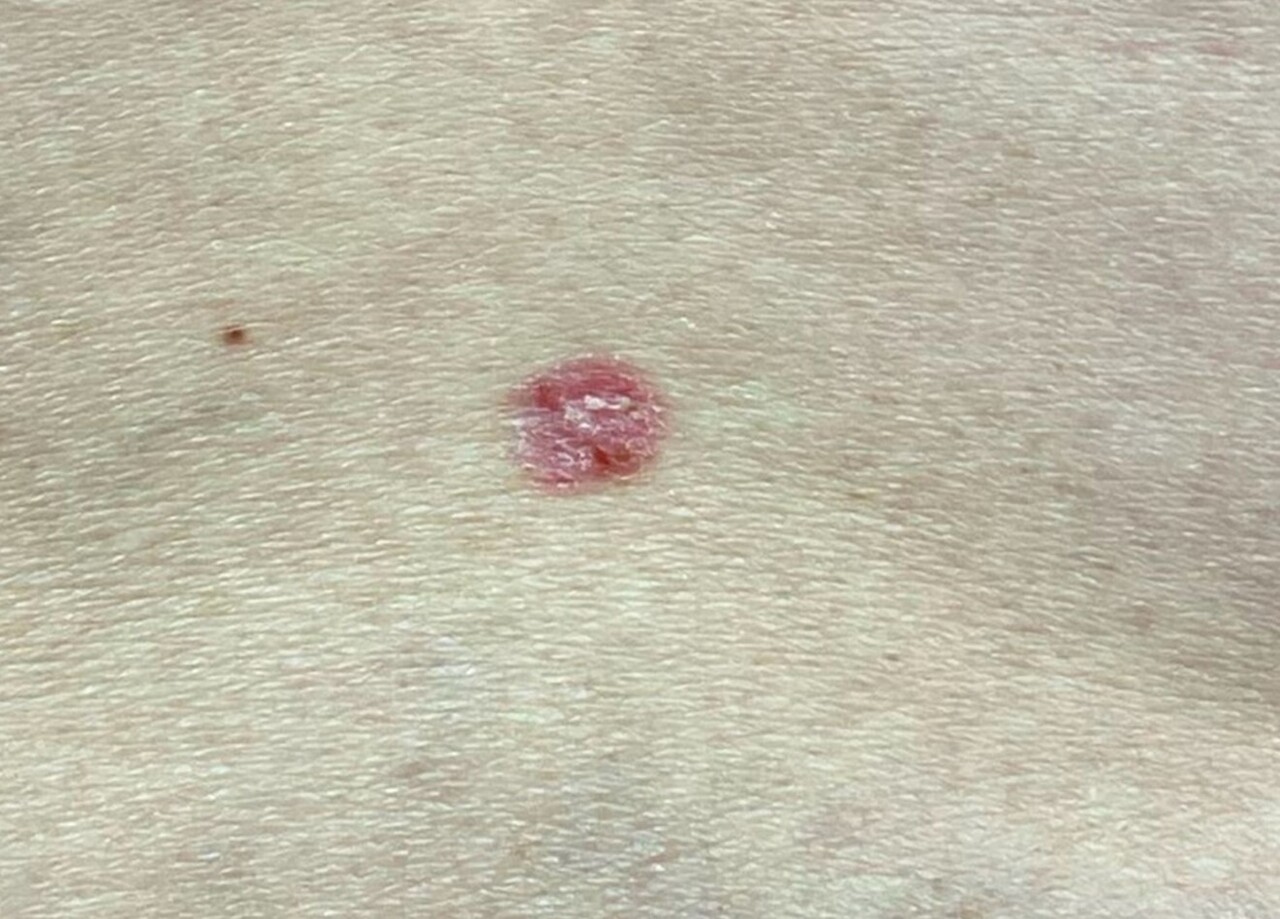
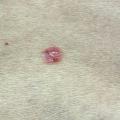
– superficiel : plaque érythémato-squameuse, bordée de perles parfois non visibles à l’œil nu, s’étendant progressivement (fig. 2) ; la localisation préférentielle est le tronc ; il peut être d’emblée multifocal ;
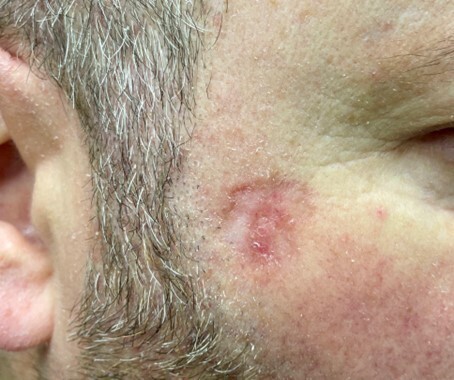
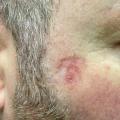
– sclérodermiforme : cicatrice blanchâtre, mal limitée, volontiers atrophique (fig. 3).
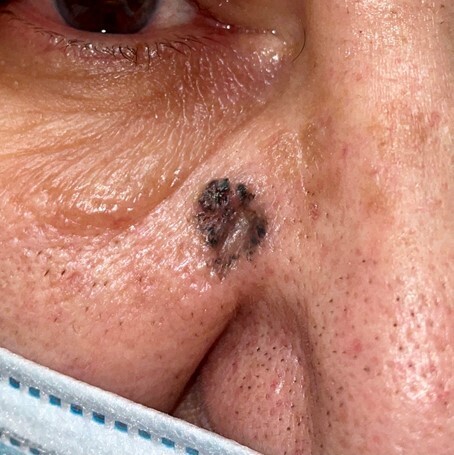
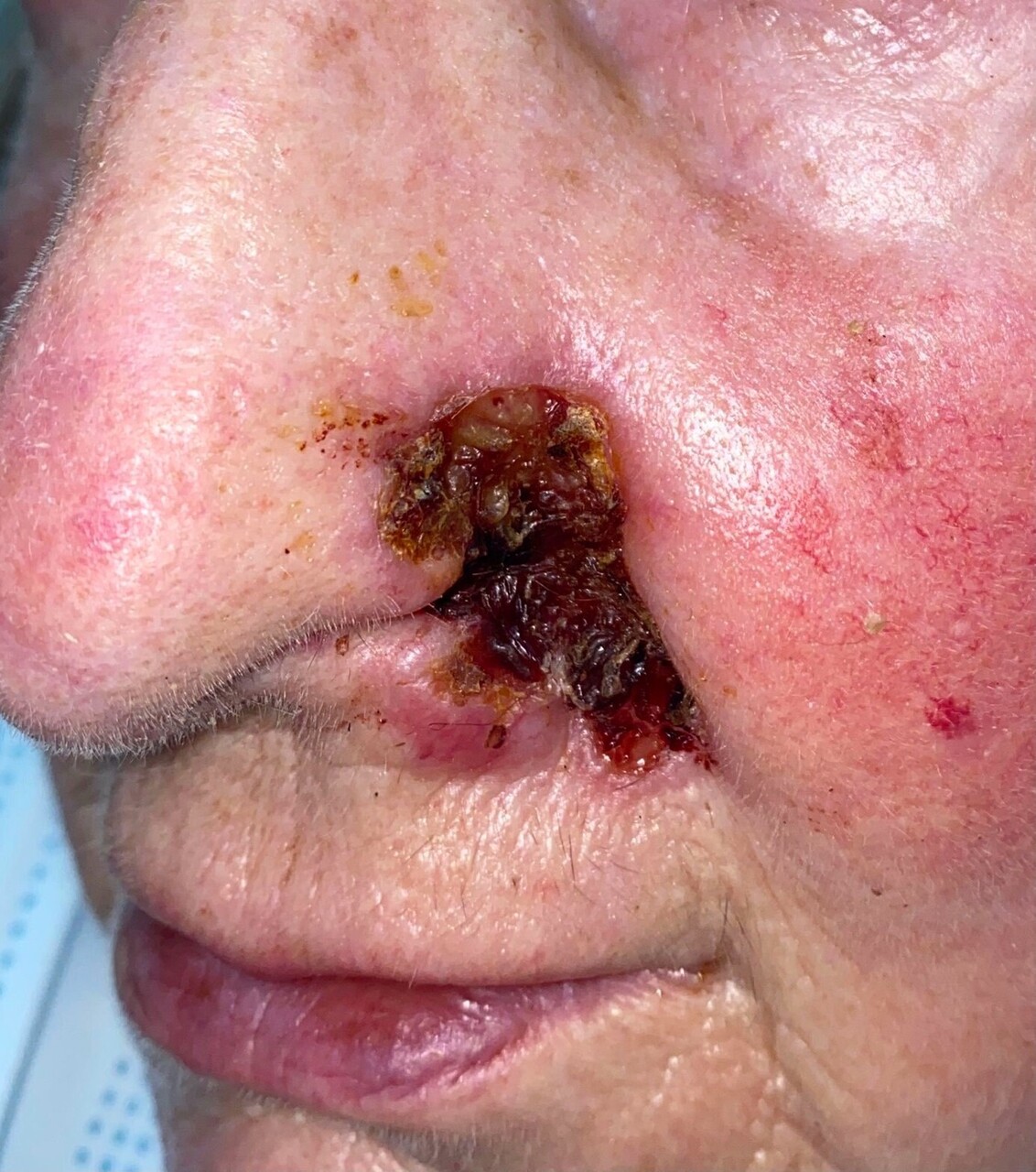
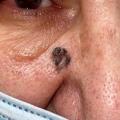
Toutes ces formes peuvent, au cours de l’évolution, se pigmenter (et mimer un mélanome) (fig. 4) ou s’ulcérer.
On distingue également 4 sous-types histologiques (nodulaire, superficiel, infiltrant [fig. 5], sclérodermiforme [fig. 6]), qui peuvent s’associer.
Les diagnostics différentiels sont nombreux : carcinomes épidermoïdes, neuroendocrines, cancers annexiels, nævus, fibroxanthomes atypiques et exceptionnellement mélanomes (en cas de CBC tatoué). Les lésions sclérodermiformes peuvent évoquer une cicatrice ou une plaque de morphée. Celles superficielles miment une maladie de Bowen, une plaque de psoriasis, d’eczéma, de lupus érythémateux ou une kératose séborrhéique au stade initial.
Quel bilan ?
Les performances de l’examen à l’œil nu sont améliorées par la dermatoscopie : la sensibilité passe de de 66,9 % à 85 % et la spécificité de 97,2 % à 98,2 %.2
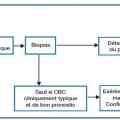
Une biopsie cutanée pour analyse histologique est recommandée avant tout traitement pour les lésions de grande taille (fig. 7). Elle peut être réalisée au cabinet médical sous anesthésie locale : un prélèvement de 0,3 à 0,5 cm de diamètre est inclus dans le formol et adressé au laboratoire d’anatomopathologie, accompagné des renseignements cliniques (âge, antécédents et facteurs de risque, traitements, aspect, taille, localisation, hypothèses diagnostiques, récidive ou apparition de novo). Le bilan d’extension n’est pas recommandé. Cependant, des examens complémentaires d’imagerie sont justifiés lorsqu’il existe une suspicion d’envahissement locorégional, pour identifier une atteinte sous-jacente (afin de décider par exemple de la faisabilité d’une chirurgie). Selon la localisation, une tomodensitométrie ou une IRM sont envisagées.
La discussion en réunion de concertation pluridisciplinaire est réservée aux cas compliqués ayant plusieurs facteurs de risque (CBC de mauvais pronostic, nombreuses comorbidités), d’envahissement locorégional, de nécessité d’une chirurgie complexe.
Évolution et pronostic
L’évolution est caractérisée par une extension locale dans les tissus adjacents ; les cas métastatiques sont exceptionnels.
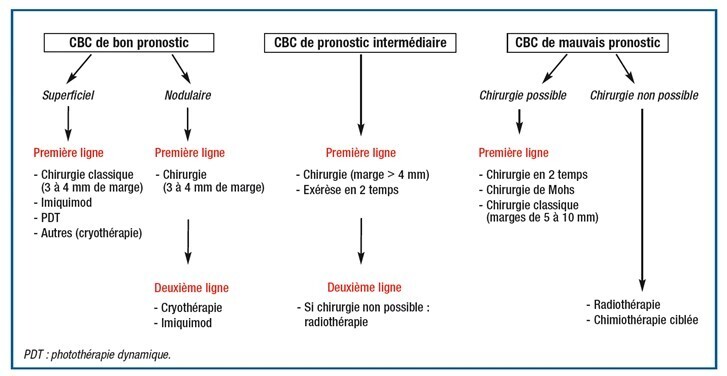
Plus de 95 % des CBC sont de bon pronostic et faciles à traiter par la chirurgie classique ou par une série de traitements alternatifs en aveugle, au moins à la phase initiale.1
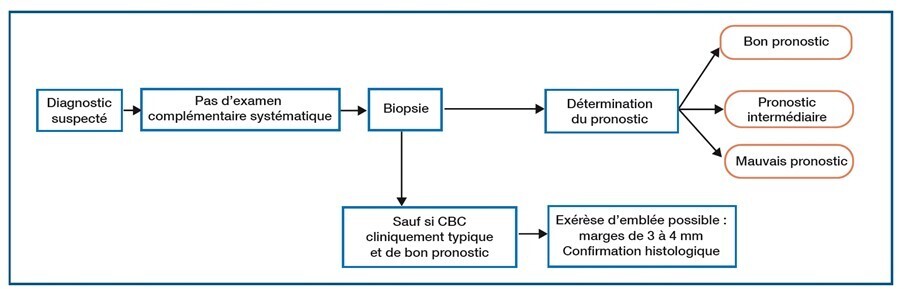
D’après l’Anaes, on peut classer les tumeurs en 3 groupes pronostiques, en fonction du risque de récidive et d’envahissement local, ainsi que de la difficulté de prise en charge en cas de rechute (encadré 1).3
De manière générale, les facteurs de difficultés thérapeutique sont :
– la difficulté technique de maintenir la fonction et l’esthétique en raison de la taille ou de la localisation (yeux, nez, lèvres et oreilles) de la tumeur ;
– les limites mal définies de la lésion ;
– de multiples récidives antérieures sur le visage, la réticence du patient ou les comorbidités limitant la chirurgie ;
– une radiothérapie antérieure.1
Quels traitements ?
Chirurgie : plusieurs types
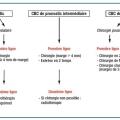
C’est le traitement de référence (fig. 8). L’exérèse doit être carcinologique et emporter la totalité de la tumeur, permettant un contrôle histologique des marges. Les techniques varient selon la localisation tumorale et les habitudes des centres et des praticiens (encadré 2). La reconstruction par greffe ou lambeau est discutée au cas par cas en fonction de la situation et de l’étendue de la perte de substance. L’examen anatomopathologique de la pièce opératoire permet de confirmer le diagnostic si une ablation est réalisée d’emblée et de poser l’indication d’une reprise chirurgicale en cas d’exérèse incomplète.
Radiothérapie
Traitement de seconde intention (fig. 8), son indication doit être discutée en réunion de concertation pluridisciplinaire. Elle est réservée, lorsqu’elle est réalisable, aux CBC inopérables (contre-indication chirurgicale, envahissement locorégional, refus du patient, terrain débilité : nombreuses comorbidités, espérance de vie réduite), chez les patients âgés de plus de 60 ans. Elle n’est pas recommandée en cas de CBC sclérodermiforme, syndrome de Gorlin et xeroderma pigmentosum. Le taux de récidive à 5 ans varie selon les auteurs de 6 à 10 %.
Photothérapie dynamique
Il s’agit de la destruction sélective des cellules tumorales par phototoxicité. Elle est recommandée en cas de CBC superficiels.
Elle repose sur l’application d’un photosensibilisant (aminolévulinate de méthyle, Metvixia ; acide 5 -aminolévulinique, Effala) qui est absorbé sélectivement par le tissu malade. Après une période d’incubation de 3 h, la région de la peau à traiter est illuminée pendant 10 minutes par une source lumineuse rouge délivrant 37 joules/cm2. Un kératolytique est préalablement appliqué sur les lésions hyperkératosiques pour améliorer l’efficacité. Une protection oculaire est indispensable pendant l’illumination. Lors du traitement, des sensations de brûlure et de picotement sont possibles ; elles sont soulagées par la vaporisation d’eau froide ou la prise préalable d’antalgique de palier I. Une photoprotection des zones traitées est recommandée pendant 24 h.
Le taux de récidive à 5 ans est de 22 % pour les CBC superficiels ayant initialement répondu à la photothérapie dynamique à 3 mois, soit 92 à 97 % des tumeurs. Une seule ou deux séances à une semaine d’intervalle ont une efficacité similaire, évaluée 3 mois après l’illumination.
Imiquimod
Cette molécule immunomodulatrice (Aldara) induit la synthèse de cytokines (IFN) intervenant dans la régulation de l’immunité à médiation cellulaire.
Elle est indiquée dans les CBC superficiels de surface < à 2 cm, siégeant en dehors des zones à risque.
Posologie : 1 application par jour, 5 jours sur 7 pendant 6 semaines. Le taux de réponse à 5 ans est de 86,9 % avec ce schéma thérapeutique.
Les effets indésirables les plus fréquents sont : érythème, œdème, prurit au site ; leur fréquence augmente avec le nombre d’utilisations.
Cryothérapie à l’azote liquide
La destruction de la tumeur par la congélation n’est pas recommandée en 1re intention ; elle est déconseillée dans les sous-types infiltrants ou sclérodermiformes.
Pour les CBC de petite taille et de faible épaisseur, elle a un intérêt dans certaines situations : âge avancé, handicap, contre-indication à l’anesthésie. Le taux de réponse à 5 ans est similaire à celui de la chirurgie conventionnelle (5 à 10 %). La cicatrisation est obtenue entre 4 et 8 semaines et une hypochromie définitive peut persister.
Curetage-électrocoagulation
Cette technique consiste à enlever la lésion avec une curette tranchante sous anesthésie locale. Ses indications sont très restreintes en France : tumeurs de petite taille (< à 2 cm), bien délimitées, situées au niveau de zones non à risque (non pileuses ni riches en tissu graisseux), de type histologique non agressif. Les résultats sont opérateur-dépendants et l’aspect cicatriciel (sur le plan esthétique) n’est pas supérieur à celui de l’exérèse chirurgicale. Le taux de récidive à 5 ans est d’environ 7 - 13 %.
Thérapie ciblée
Le vismodégib (Erivedge) et le sonidégib (Odomzo) (tableau 1) sont des inhibiteurs sélectifs de la voie de signalisation Hedgehog (ISHH), impliquée dans 90 % des CBC. Ils agissent en se fixant à la protéine transmembranaire SMO.
Les ISHH ont une AMM dans le traitement des CBC localement avancés pour lesquels la chirurgie et la radiothérapie ne sont pas autorisées. Il permet une réduction de la masse tumorale. Les taux de réponse clinique objective sont aux alentours de 60 % avec un contrôle de la maladie de 83 à 91 % (incluant la stabilité, la réponse partielle et la réponse complète).4 Sa mise en place impose une discussion préalable en réunion de concertation pluridisciplinaire.
La prescription est réservée aux oncologues et aux dermato-oncologues. Des effets indésirables invalidants et fréquents sont rapportés dans la littérature : spasmes musculaires responsables de douleurs (74,6 %), alopécie (65,9 %), dysgueusie (59 %), asthénie (47,1 %), nausée (34,8 %), diarrhées (33,3 %), perte d’appétit (30 %) ou de poids (50 %), aménorrhée (30 %). Son fort potentiel tératogène impose une contraception efficace jusqu’à 2 ans après son arrêt. Le sonidégib semble mieux toléré, sans étude comparative permettant d’affirmer avec certitude ce point.4
Malgré leur efficacité, les toxicités sont parfois importantes chez des patients âgés rendant difficile un traitement au long cours. Le taux de récidive est de 30 à 50 % à l’arrêt des traitements.5,6 Des stratégies sont donc nécessaires pour maintenir cette réponse dans le temps et diminuer les toxicités. L’essai VISMONEO a montré l’intérêt du vismodégib comme traitement néoadjuvant avant une chirurgie des CBC localement avancés.7 Dans une étude en cours, une radiothérapie de clôture est proposée aux patients en réponse complète en vue de maintenir la réponse thérapeutique dans le temps (RADIOSONIC NCT05561634).
Immunothérapie
Le CBC ne fait pas partie des indications validées d’immunothérapie. L’essai AcSé Nivolumab a étudié l’efficacité et la tolérance du nivolumab (anti-PD1) dans des cancers rares résistants aux thérapies standards et sans autre option envisageable. En cas d’échec des ISHH, les anti-PD1 semblent être une solution thérapeutique innovante dans la prise en charge des CBC avancés, avec un contrôle de la maladie dans presque 70 % des cas.8
Les chimiothérapies classiques n’ont pas d’indication ; des traitements à base de sels de platine ont été utilisés pour des carcinomes inopérables et complexes, mais leur efficacité est variable.
Autres options (pas d’AMM)
Le laser CO2 peut être utile dans les CBC superficiels étendus multiples du tronc, mais les études ne permettent pas de conclure sur son efficacité.3
Le 5 -FU topique est un analogue de la pyrimidine qui inhibe la synthèse de l’ADN des cellules tumorales. Il n’a pas l’AMM dans les CBC ; bien que son efficacité à court terme soit satisfaisante, le taux de récidive à 5 ans est élevé par rapport à ceux des autres traitements.
Prévention et surveillance
Il est indispensable de rappeler les règles de photoprotection aux patients : limiter au maximum les expositions entre midi et 16 heures, préférer une protection vestimentaire (chapeau, T-shirt et lunettes), utiliser une crème solaire adaptée au phototype, à renouveler toutes les 2 heures et en quantité suffisante.
Le suivi après traitement est essentiel : tous les 3 à 6 mois pour les sujets à risque et tous les ans pour les autres, pendant 5 ans au minimum et au mieux à vie (fig. 9). En raison de la pénurie de dermatologues, les modalités actuelles de surveillance posent des difficultés ; des schémas allégés impliquant une surveillance conjointe entre le médecin généraliste et le dermatologue sont souhaitables ainsi qu’une implication du malade dans un processus d’autosurveillance.
Il est indispensable de surveiller régulièrement la cicatrice après exérèse pour dépister une récidive. Le risque de rechute le plus élevé concerne les CBC situés dans la région centrofaciale (canthus, nez, région palpébrale), ayant une taille > à 2 cm et de type sclérodermiforme (la tumeur est plus difficile à délimiter et à enlever).
Pour plus de documentations et de fiches patients :
– Site de la Société française de dermatologie (SFD) : https ://www.sfdermato.org/
– Site du Groupe de cancérologie cutané de la SFD : https ://www.cancer-et-peau.com/
1. Trois groupes pronostiques3
Bon pronostic
– CBC superficiels primaires
– Tumeur fibro-épithéliale de Pinkus (variante rare de CBC habituellement localisée sur le bas du dos)
– CBC nodulaires primaires, bien limités, < 1 cm sur la zone à risque intermédiaire de récidive et < 2 cm sur la zone à bas risque de récidive*
Mauvais pronostic
– Formes cliniques sclérodermiformes ou mal limitées ou histologiques agressives
– Formes récidivées (à l’exception des CBC superficiels)
– CBC nodulaires de la zone à haut risque de récidive et de taille > 1 cm
Pronostic intermédiaire
– CBC superficiels récidivés
– CBC nodulaires < 1 cm sur la zone à haut risque de récidive, > 1 cm sur la zone à risque intermédiaire, > 2 cm sur la zone à bas risque
* Zones du corps à risque faible : tronc et membres.
Risque intermédiaire : front, joues, menton, cuir chevelu et cou.
Risque élevé : nez et régions péri-orificielles de l’extrémité céphalique.
2. Différents types de chirurgie
Chirurgie-suture classique. Les marges latérales de 4 mm sont suffisantes pour la plupart des tumeurs (pronostic faible ou intermédiaire) ; elles sont plus larges (5 - 10 mm) pour les CBC de mauvais pronostic récidivants ou sclérodermiformes. Les marges profondes sont situées dans les tissus graisseux hypodermiques. Le taux de récidive à 5 ans est de 5 à 10 % pour les tumeurs primitives et de 10 à 20 % pour les récidivantes.2
Chirurgie en deux temps. L’exérèse de la lésion est réalisée dans un premier temps et la pièce opératoire est fixée en paraffine, ce qui permettrait de mieux conserver la morphologie tissulaire.
Dans l’attente des résultats histologiques, des soins locaux par pansements gras sont effectués, et on procède ensuite à la reconstruction. Les données de la littérature ne sont pas suffisantes pour évaluer le taux de récidive à 5 ans.
Exérèse avec examen extemporané. Cette technique en un temps nécessite la présence, lors de l’intervention, d’un anatomopathologiste qui analyse la pièce dès l’ablation (sur coupes congelées), permettant ainsi une suture ou une reconstruction immédiate. Toutes les berges doivent être examinées. Le risque de faux négatif est de l’ordre de 5 %. Taux de récidive à 5 ans : de 0,7 à 2,1 % pour les tumeurs primitives et 4,4 % pour les récidivantes.
Chirurgie micrographique de Mohs. La tumeur est enlevée avec des marges millimétriques, après avoir coloré de façon précise les contours.
Ensuite, des recoupes de 2 mm sont faites sur l’ensemble de la surface de la perte de substance créée par l’ablation, puis examinées au microscope sur coupes congelées en extemporané. Si des foyers tumoraux sont repérés sur les berges, les recoupes sont répétées jusqu’à ablation totale du cancer.
Cette technique, longue et coûteuse, nécessite une bonne coordination (réalisation conjointe du geste chirurgical, de la préparation des lames et de leur lecture par un anatomopathologiste présent pendant toute la durée de l’intervention). Elle permet une exérèse tumorale complète en périphérie et en profondeur, avec de faibles marges. Les taux de récidive varient de 1 % pour les tumeurs primitives à 5 % pour celles récidivantes.
2. Reiter O, Mimouni I, Gdalevich M, et al. The diagnostic accuracy of dermoscopy for basal cell carcinoma: A systematic review and meta-analysis. J Am Acad Dermatol 2019;80(5):1380-8.
3. Anaes. Prise en charge diagnostique et thérapeutique du carcinome basocellulaire de l’adulte. Ann Pathol 2004;24(5);460-72.
4. Dummer R, Ascierto PA, Basset-Seguin N, et al. Sonidegib and vismodegib in the treatment of patients with locally advanced basal cell carcinoma: a joint expert opinion. J Eur Acad Dermatol Venereol 2020;34(9):1944-56.
5. Herms F, Lambert J, Grob JJ, et al. Follow-Up of Patients With Complete Remission of Locally Advanced Basal Cell Carcinoma After Vismodegib Discontinuation: A Multicenter French Study of 116 Patients. J Clin Oncol 2019;37(34):3275-85.
6. Bassompierre A, Dalac S, Dreno B, et al. Efficacy of sonic hedgehog inhibitors rechallenge, after initial complete response in recurrent advanced basal cell carcinoma: a retrospective study from the CARADERM database. ESMO Open 2021;6(6):100284.
7. Bertrand N, Guerreschi P, Basset-Seguin N, et al. Vismodegib in neoadjuvant treatment of locally advanced basal cell carcinoma: First results of a multicenter, open-label, phase 2 trial (VISMONEO study). eClinicalMedecine 26 avril 2021.
8. Veron M, Marabelle A, Grob JJ, et al. AcSé Nivolumab : résultats préliminaires pour le carcinome baso-cellulaire avancé. Ann Dermatol Vénérol 2020;147(12):A129-30.

 Encadrés
Encadrés