L’incidence de ces tumeurs rares viro-induites par le papillomavirus augmente, en particulier chez les hommes homosexuels. Le traitement, fondé sur une association de chimio- et de radiothérapie concomitantes, permet une rémission complète dans 80 % des cas, mais la vaccination anti-HPV est la principale source d’espoir.
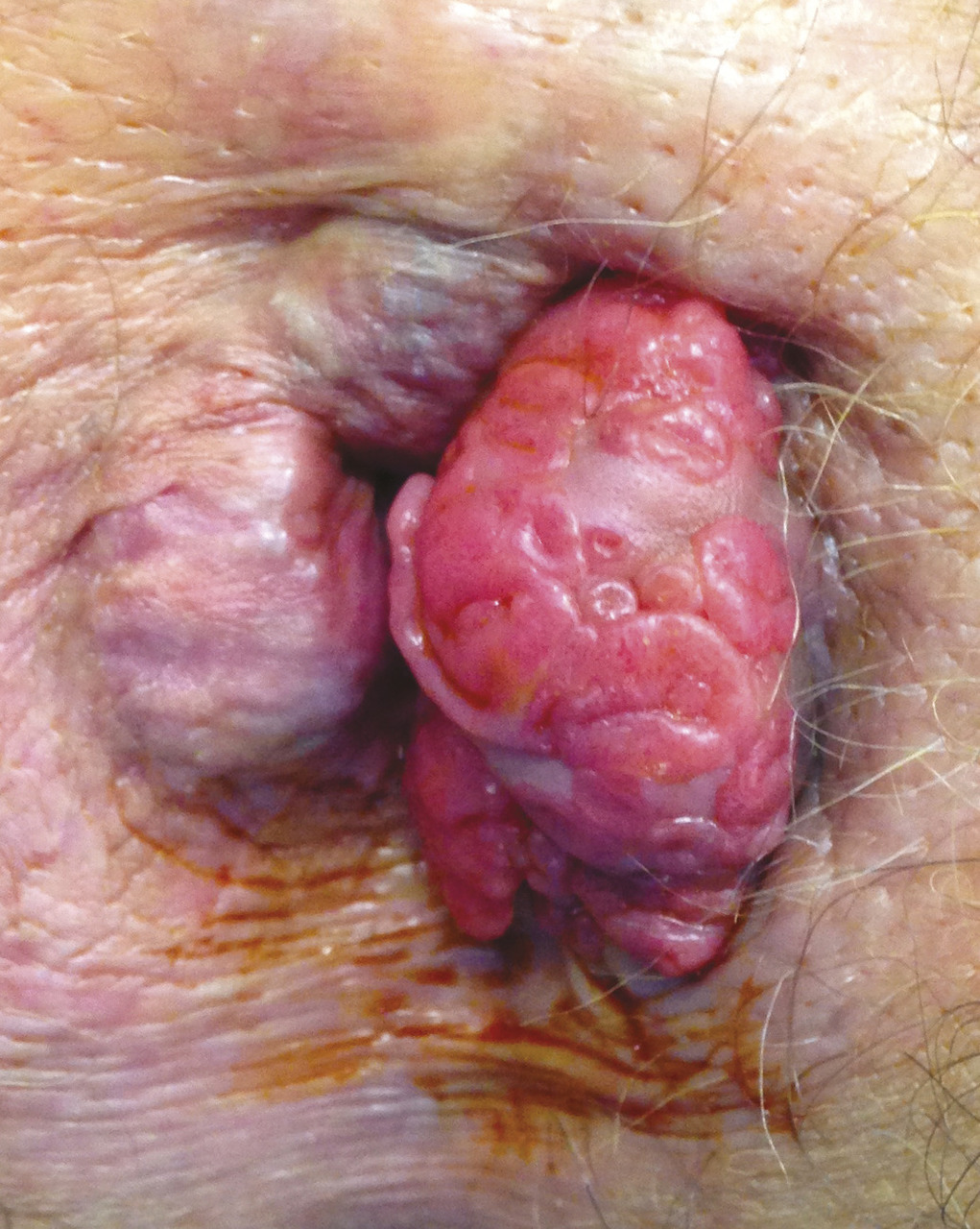
Les tumeurs anales regroupent les tumeurs du canal anal (85 %) et celles de la marge anale (15 %) [fig. 1], même si l’Organisation mondiale de la santé classe ces dernières parmi les tumeurs cutanées. Elles sont rares, représentant 3 % des tumeurs digestives,1 plus fréquentes chez la femme (sex ratio de 4 en France). Leur incidence est en augmentation, avec 900 nouveaux cas par an en France ; l’âge au diagnostic autour de 60 ans diminue ces dernières années.2 Certains pays occidentaux, comme les États-Unis, ont noté une augmentation des nouveaux cas de 18 % entre 2015 et 2018.3 Un pic d’incidence est à noter chez une population dite à risque : les hommes ayant des rapports sexuels avec des hommes et/ou infectés par le virus de l’immunodéficience humaine (VIH).4 Le facteur de risque le plus important dans cette population comme chez le reste des sujets concernés est l’infection par le papillomavirus (human papillomavirus [HPV]). Les carcinomes épidermoïdes représentent 95 % des cas, les adénocarcinomes sont beaucoup plus rares, développés aux dépens des glandes anales et de plus mauvais pronostic.
Facteurs de risque
Ils sont résumés dans le tableau 1.
Papillomavirus
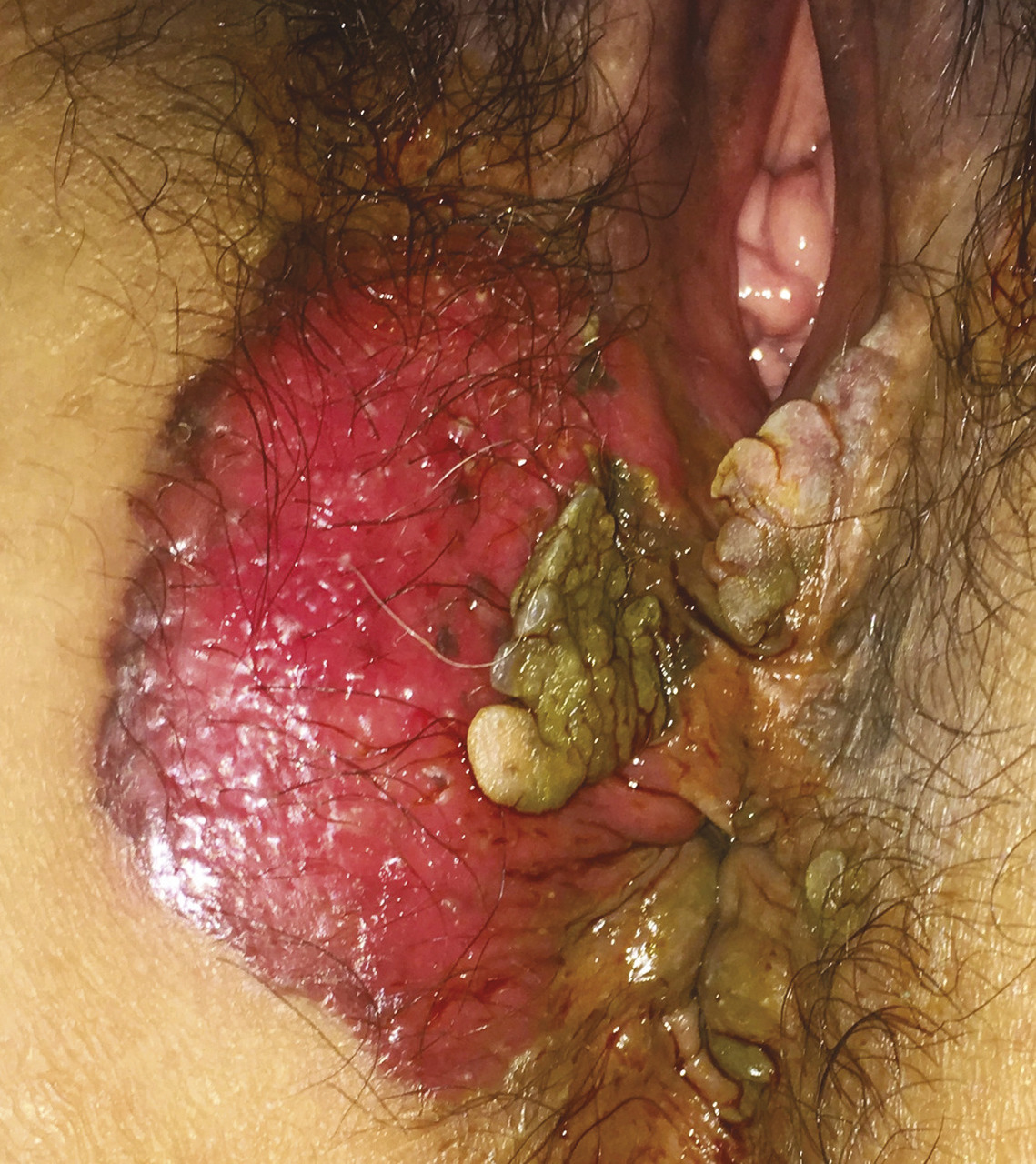
Le papillomavirus est un virus oncogène responsable de l’infection sexuellement transmissible la plus fréquente au monde, 80 % des patients sont infectés durant la 1re année après leurs rapports sexuels. Ce virus comporte plus de 120 génotypes que l’Agence internationale de recherche sur le cancer a classé en trois catégories : papillomavirus à haut risque dont les papillomavirus de génotypes 16 et 18, responsables de la grande majorité des tumeurs anales, papillomavirus à bas risque et papillomavirus à risque inconnu.5 Le mécanisme de carcinogenèse est mal élucidé, mais on sait que le papillomavirus peut intégrer son ADN à celui de la cellule hôte, provoquant ainsi une dérégulation du cycle cellulaire, une instabilité génomique, une modification épigénétique, un stress oxydatif cellulaire conduisant à une inflammation.6 Ces événements sont responsables de la survenue de lésions histologiques précancéreuses dite néoplasies intra- épithéliales (AIN) qui peuvent être de bas grade (AIN 1) ou de haut grade (AIN 2 et 3 [fig. 2]) ; ces dernières peuvent faire l’objet d’un dépistage ciblé chez les populations à risque du fait de leur possible évolution, sous l’influence d’autres facteurs, vers des cancers invasifs. La recherche de l’ADN du papillomavirus est positive dans 97 % des cas, selon une étude française publiée en 2011, le génotype le plus fréquent est HPV 16 (75 % des cas) suivi de HPV 18 (6 % des cas).7 La rareté de ce cancer et la clairance virale (disparition spontanée du virus grâce à l’immunité antivirale naturelle) de plus de 70 % après un délai de 6 à 12 mois8 rendent l’étude de la chronologie de cette carcinogenèse difficile.
Infection par le VIH
L’immunodépression favorise la transformation des néoplasies intra-épithéliales en cancer invasif. Selon la base de données du réseau FRANCIM, 263 cas de cancer anal invasif ont été répertoriés chez les patients infectés par le VIH, 91 % étaient des hommes (dont 72 % homosexuels) avec un âge médian de 45 ans. L’incidence était de 56,3/100 000 personnes/an dans cette population et de 95/100 000 personnes/an chez les homosexuels masculins. Le risque chez ces derniers s’ils étaient infectés par le VIH était 5 fois supérieur à celui des femmes infectées.9 L’augmentation de l’incidence persiste malgré un traitement antirétroviral prolongé et efficace, suggérant que la restauration immune est sans effet sur le risque de survenue de néoplasies intra-épithéliales et de cancer.10 Une étude a montré que les durées cumulées passées avec un nombre de lymphocytes CD4 bas (< 200/mm3) et une charge virale élevée (> 100 000 copies/mL) augmenteraient le risque.11
Autres facteurs de risque
Sont également des facteurs de risque de carcinome du canal anal :
– l’exposition prolongée aux immunosuppresseurs, que ce soit dans le cadre de greffes d’organes ou d’autres pathologies, avec un ratio de risque standardisé de 4,8 ;12
– des antécédents de lésions précancéreuses ou de carcinome invasif du col utérin, de la vulve ou de la verge, des condylomes du fait d’une carcinogenèse un peu similaire rapportée au papillomavirus ;
– une maladie de Bowen pour les carcinomes de la marge anale (cutanés) ;
– le tabagisme ;
– les rapports sexuels anaux réceptifs (chez les hommes et chez les femmes).
– l’exposition prolongée aux immunosuppresseurs, que ce soit dans le cadre de greffes d’organes ou d’autres pathologies, avec un ratio de risque standardisé de 4,8 ;12
– des antécédents de lésions précancéreuses ou de carcinome invasif du col utérin, de la vulve ou de la verge, des condylomes du fait d’une carcinogenèse un peu similaire rapportée au papillomavirus ;
– une maladie de Bowen pour les carcinomes de la marge anale (cutanés) ;
– le tabagisme ;
– les rapports sexuels anaux réceptifs (chez les hommes et chez les femmes).
Qu’en est-il du dépistage ?
Il est recommandé par l’Institut national du cancer. Des recommandations ont été émises en 2017 par un groupe d’experts regroupant infectiologues spécialistes du VIH, proctologues, radiothérapeutes, pharmacologues et oncologues, sous la direction du Pr Philippe Morlat et sous l’égide du Conseil national du sida et des hépatites virales et de l’Agence nationale de recherche sur le sida et les hépatites virales.13
Ce dépistage (tableau 2) doit être pratiqué par un proctologue ou gastro- entérologue et consiste en un toucher rectal et une anuscopie simple annuels. Cependant, certains considèrent que cette méthode dépiste surtout les petits cancers débutants, tandis que d’autres (notamment les Américains) préconisent des techniques plus sensibles pour la détection de néoplasies intra-épithéliales de haut grade, comme le frottis anal et/ou la recherche d’ADN d’HPV 16 dans le sang, suivi, en cas d’anomalie, d’une anuscopie de haute résolution (technique d’accès limité à ce jour et dont la place est encore débattue).14
La recherche d’ADN d’HPV 16 n’est pas recommandée encore France, en dehors du domaine de la recherche scientifique.
Une méta-analyse récente a étudié l’intérêt d’un dépistage par frottis anal, pratiqué chez cette population à risque par des infirmières, et a révélé une sensibilité assez intéressante, autour de 85 %, mais une assez mauvaise spécificité, autour de 40 %.15 Le frottis seul n’est donc pas recommandé.
Le traitement des lésions néoplasiques intraépithéliales, une fois détectées, est mal codifié ; on préconise de plus en plus la surveillance pour les lésions de bas grade (AIN 1), vu leur faible risque de transformation en lésion cancéreuse. Pour les lésions de haut grade (AIN 2 et 3), un traitement ablatif est souvent pratiqué : excision chirurgicale, électrodestruction, photothérapie dynamique.16 Des immunomodulateurs locaux topiques peuvent être utilisés, comme l’imiquimod (Aldara) ou le fluoro-uracile, mais avec de faibles niveaux de preuve, étant donné l’absence d’essais randomisés contrôlés bien conduits et le faible effectif dans le peu d’essais existants.
Ce dépistage (tableau 2) doit être pratiqué par un proctologue ou gastro- entérologue et consiste en un toucher rectal et une anuscopie simple annuels. Cependant, certains considèrent que cette méthode dépiste surtout les petits cancers débutants, tandis que d’autres (notamment les Américains) préconisent des techniques plus sensibles pour la détection de néoplasies intra-épithéliales de haut grade, comme le frottis anal et/ou la recherche d’ADN d’HPV 16 dans le sang, suivi, en cas d’anomalie, d’une anuscopie de haute résolution (technique d’accès limité à ce jour et dont la place est encore débattue).14
La recherche d’ADN d’HPV 16 n’est pas recommandée encore France, en dehors du domaine de la recherche scientifique.
Une méta-analyse récente a étudié l’intérêt d’un dépistage par frottis anal, pratiqué chez cette population à risque par des infirmières, et a révélé une sensibilité assez intéressante, autour de 85 %, mais une assez mauvaise spécificité, autour de 40 %.15 Le frottis seul n’est donc pas recommandé.
Le traitement des lésions néoplasiques intraépithéliales, une fois détectées, est mal codifié ; on préconise de plus en plus la surveillance pour les lésions de bas grade (AIN 1), vu leur faible risque de transformation en lésion cancéreuse. Pour les lésions de haut grade (AIN 2 et 3), un traitement ablatif est souvent pratiqué : excision chirurgicale, électrodestruction, photothérapie dynamique.16 Des immunomodulateurs locaux topiques peuvent être utilisés, comme l’imiquimod (Aldara) ou le fluoro-uracile, mais avec de faibles niveaux de preuve, étant donné l’absence d’essais randomisés contrôlés bien conduits et le faible effectif dans le peu d’essais existants.
Et la prévention ?
La prévention primaire des tumeurs anales passe par la vaccination anti-HPV (tableau 3).
Une revue récente de plusieurs études à ce sujet a conclu que la vaccination anti-HPV serait plus efficace si on la pratiquait chez l’ensemble des garçons avant leur premier rapport sexuel.17
Malheureusement, cette vaccination peine à s’étendre en France, chez les filles comme chez les garçons, en raison d’une certaine méconnaissance ou réticence, voire de résistance dans notre société et même dans les milieux médicaux.
Une revue récente de plusieurs études à ce sujet a conclu que la vaccination anti-HPV serait plus efficace si on la pratiquait chez l’ensemble des garçons avant leur premier rapport sexuel.17
Malheureusement, cette vaccination peine à s’étendre en France, chez les filles comme chez les garçons, en raison d’une certaine méconnaissance ou réticence, voire de résistance dans notre société et même dans les milieux médicaux.
Quel diagnostic, quel bilan ?
Le tableau clinique initial peut mimer des pathologies bénignes, d’où le diagnostic des formes évoluées (fig. 2) : saignement, symptôme le plus fréquent, mimant une pathologie hémorroïdaire ; douleur anale ou simple prurit anal ; palpation d’une tuméfaction anale ; alternance de diarrhée/constipation, voire incontinence anale ; fissure ou fistule anale.
L’examen clinique proctologique explore le siège, l’aspect, l’étendue, la taille de la lésion et la tonicité du sphincter, couplé à une anuscopie puis à une palpation des aires ganglionnaires inguinales, et doit se terminer par une biopsie en vue d’une confirmation histologique. Il peut se faire sous anesthésie générale chez les patients très algiques. Un bilan d’imagerie (tableau 4) est complété par : une coloscopie, à la recherche d’un cancer colorectal synchrone ; un examen gynécologique avec frottis cervicovaginal ; une ponction des ganglions inguinaux en cas de doute sur leur origine (en raison de leur rôle pronostique) ; une sérologie pour le VIH, un dosage de marqueurs tumoraux sanguins (par exemple squamous cell carcinoma [SCC]).
L’examen clinique proctologique explore le siège, l’aspect, l’étendue, la taille de la lésion et la tonicité du sphincter, couplé à une anuscopie puis à une palpation des aires ganglionnaires inguinales, et doit se terminer par une biopsie en vue d’une confirmation histologique. Il peut se faire sous anesthésie générale chez les patients très algiques. Un bilan d’imagerie (tableau 4) est complété par : une coloscopie, à la recherche d’un cancer colorectal synchrone ; un examen gynécologique avec frottis cervicovaginal ; une ponction des ganglions inguinaux en cas de doute sur leur origine (en raison de leur rôle pronostique) ; une sérologie pour le VIH, un dosage de marqueurs tumoraux sanguins (par exemple squamous cell carcinoma [SCC]).
Classification et pronostic (tableau 5)
Sont considérés comme facteurs de mauvais pronostic indépendants : une taille tumorale supérieure à 5 cm, l’atteinte ganglionnaire et le sexe masculin.
Traitement
Formes localisées
Jusqu’au début des années 1970, le traitement reposait sur la chirurgie non conservatrice, qui consistait en une amputation abdomino-périnéale, c’est-à-dire avec colostomie définitive. Les taux de survie étaient médiocres, avec des récidives locorégionales. En conséquence, l’idée d’un traitement conservateur à base d’association de radiothérapie et de chimiothérapie concomitantes a émergé.20
La radiochimiothérapie concomitante concerne toutes les tumeurs classées plus de T1N0. Elle associe une radiothérapie qui délivre une dose totale de 45 à 59 Gy incluant le canal anal et les aires ganglionnaires inguinales (la dose de 59 Gy concerne les tumeurs > T1 et comprend une surimpression tumorale de 9 à 14 Gy) à une chimiothérapie à base de 5-fluoro-uracile (5-FU) à 1 000 mg/m2 de J1 à J4 et de J29 à J32 et mitomycine C à 10 mg/m2 à J1 et J29 (soit une séance à la 1re semaine et une seconde à la 5e semaine de radiothérapie).
La radiothérapie est effectuée selon une technique dite en modulation d’intensité qui permet de mieux cibler la lésion tumorale en épargnant au mieux les tissus avoisinants.
C’est devenu le standard depuis les résultats de l’essai de phase III américain RTOG 98-11 qui a comparé cette association à celle à base de cisplatine et 5-FU :21 la survie sans maladie à 5 ans était de 67,8 % contre 57,8 % (p = 0,006) et la survie globale était de 78,3 % contre 70,7 % (p = 0,026) en faveur du groupe traité par 5-FU et mitomycine C.
Le 5-FU peut être remplacé par sa prodrogue orale, la capécitabine, à la dose de 825 mg/m2 deux fois par jour tout au long de la radiothérapie.22
Une consultation préalable de fertilité doit être proposée aux patients désireux de procréation en raison du risque de stérilité.
La chimiothérapie d’inductionavant radio-chimiothérapie concomitante n’a pas montré de bénéfice.21, 23 Elle peut être utilisée chez certains patients très symptomatiques en attendant la mise en place de la radio-chimiothérapie concomitante, mais doit être validée lors d’une réunion de concertation pluridisciplinaire (RCP).
La chimiothérapie de maintenance après radio-chimiothérapie concomitante n’a pas montré de bénéfice non plus.24
La radiothérapie exclusive est préconisée en cas de contre-indication à la chimiothérapie (sujets âgés inéligibles…) ou les petites tumeurs T1, voire inférieures à 1 cm, sans atteinte ganglionnaire. Ce dernier sous-groupe ne représente qu’environ 15 % des patients inclus dans les grands essais de radio-chimiothérapie concomitante, nous ne disposons donc pas d’un niveau de preuve assez élevé pour en faire un standard. Une telle décision doit faire l’objet d’une discussion en RCP.
La curiethérapie est réservée aux petites tumeurs centimétriques, mais nous ne disposons pas d’assez de données pour y recourir en routine.
La chirurgie peut consister en :
– une exérèse locale, indiquée dans les petits carcinomes de la marge anale de taille ≤ 2 cm, bien différenciés, avec des marges de sécurité suffisantes, à condition de ne pas compromettre la fonction sphinctérienne ;25 elle doit être pratiquée par un praticien expérimenté ;
– une amputation abdomino-périnéale, indiquée comme traitement de rattrapage en cas de persistance tumorale après radio-chimiothérapie concomitante (ce qui peut arriver dans environ 25 % des cas) ou de récidive locale à distance de celle-ci ou comme traitement de première intention en cas de contre-indication à une radio-chimiothérapie concomitante (antécédent de radiothérapie pelvienne, par exemple pour cancer du col utérin ou de la prostate) ;
– une colostomie avant radio-chimiothérapie concomitante, en cas de tumeur très évoluée hyperalgique et/ou obstructive et/ou responsable d’incontinence majeure et/ou surinfectée et/ou ayant d’importantes fistules tumoro-périnéales ou pelviennes.
Un curage ganglionnaire inguinal est rarement pratiqué en raison de sa morbidité. Il est indiqué en cas de récidive inguinale, en association avec l’amputation abdomino-périnéale ou seul en cas de récidive exclusivement inguinale, mais il est rarement pratiqué.
La radiochimiothérapie concomitante concerne toutes les tumeurs classées plus de T1N0. Elle associe une radiothérapie qui délivre une dose totale de 45 à 59 Gy incluant le canal anal et les aires ganglionnaires inguinales (la dose de 59 Gy concerne les tumeurs > T1 et comprend une surimpression tumorale de 9 à 14 Gy) à une chimiothérapie à base de 5-fluoro-uracile (5-FU) à 1 000 mg/m2 de J1 à J4 et de J29 à J32 et mitomycine C à 10 mg/m2 à J1 et J29 (soit une séance à la 1re semaine et une seconde à la 5e semaine de radiothérapie).
La radiothérapie est effectuée selon une technique dite en modulation d’intensité qui permet de mieux cibler la lésion tumorale en épargnant au mieux les tissus avoisinants.
C’est devenu le standard depuis les résultats de l’essai de phase III américain RTOG 98-11 qui a comparé cette association à celle à base de cisplatine et 5-FU :21 la survie sans maladie à 5 ans était de 67,8 % contre 57,8 % (p = 0,006) et la survie globale était de 78,3 % contre 70,7 % (p = 0,026) en faveur du groupe traité par 5-FU et mitomycine C.
Le 5-FU peut être remplacé par sa prodrogue orale, la capécitabine, à la dose de 825 mg/m2 deux fois par jour tout au long de la radiothérapie.22
Une consultation préalable de fertilité doit être proposée aux patients désireux de procréation en raison du risque de stérilité.
La chimiothérapie d’inductionavant radio-chimiothérapie concomitante n’a pas montré de bénéfice.21, 23 Elle peut être utilisée chez certains patients très symptomatiques en attendant la mise en place de la radio-chimiothérapie concomitante, mais doit être validée lors d’une réunion de concertation pluridisciplinaire (RCP).
La chimiothérapie de maintenance après radio-chimiothérapie concomitante n’a pas montré de bénéfice non plus.24
La radiothérapie exclusive est préconisée en cas de contre-indication à la chimiothérapie (sujets âgés inéligibles…) ou les petites tumeurs T1, voire inférieures à 1 cm, sans atteinte ganglionnaire. Ce dernier sous-groupe ne représente qu’environ 15 % des patients inclus dans les grands essais de radio-chimiothérapie concomitante, nous ne disposons donc pas d’un niveau de preuve assez élevé pour en faire un standard. Une telle décision doit faire l’objet d’une discussion en RCP.
La curiethérapie est réservée aux petites tumeurs centimétriques, mais nous ne disposons pas d’assez de données pour y recourir en routine.
La chirurgie peut consister en :
– une exérèse locale, indiquée dans les petits carcinomes de la marge anale de taille ≤ 2 cm, bien différenciés, avec des marges de sécurité suffisantes, à condition de ne pas compromettre la fonction sphinctérienne ;25 elle doit être pratiquée par un praticien expérimenté ;
– une amputation abdomino-périnéale, indiquée comme traitement de rattrapage en cas de persistance tumorale après radio-chimiothérapie concomitante (ce qui peut arriver dans environ 25 % des cas) ou de récidive locale à distance de celle-ci ou comme traitement de première intention en cas de contre-indication à une radio-chimiothérapie concomitante (antécédent de radiothérapie pelvienne, par exemple pour cancer du col utérin ou de la prostate) ;
– une colostomie avant radio-chimiothérapie concomitante, en cas de tumeur très évoluée hyperalgique et/ou obstructive et/ou responsable d’incontinence majeure et/ou surinfectée et/ou ayant d’importantes fistules tumoro-périnéales ou pelviennes.
Un curage ganglionnaire inguinal est rarement pratiqué en raison de sa morbidité. Il est indiqué en cas de récidive inguinale, en association avec l’amputation abdomino-périnéale ou seul en cas de récidive exclusivement inguinale, mais il est rarement pratiqué.
Formes métastatiques d’emblée ou récidivantes non résécables
Ces formes sont rares.
La chimiothérapie est le standard dans cette situation souvent dramatique. La combinaison de cisplatine et de 5-FU est la référence26, mais, depuis peu, l’association docétaxel, 5-FU et cisplatine constitue le nouveau standard français car il a montré des taux de réponse spectaculaires.27 Un essai de phase II randomisé présenté au dernier congrès de l’European Society for Medical Oncology (ESMO 2018) a montré la supériorité en taux de réponse objective (critère principal) de l’association carboplatine et paclitaxel à la combinaison de cisplatine et de 5-FU.28
L’immunothérapie constitue un espoir pour ces tumeurs qui deviennent redoutables après échec d’une radio-chimiothérapie concomitante ou d’une chimiothérapie de première ligne. Le rationnel repose sur le caractère viro-induit de ces tumeurs et la réponse immunitaire engendrée, ciblant les oncoprotéines du papillomavirus. Des anticorps anti-program death-1 (anti-PD-1) comme le pembrolizumab et le nivolumab déjà disponibles dans d’autres tumeurs (par exemple le mélanome et le poumon) ont montré une certaine efficacité, après échec de la chimiothérapie. Le premier a montré un taux de contrôle de la maladie à 57 %29, le deuxième un taux de réponse de 78 % et une médiane de survie globale de 11,5 mois.30 L’essai français multicentrique SCARCE, ouvert actuellement, compare en première ligne une chimiothérapie par docétaxel, 5-FU et cisplatine modifié à la même chimiothérapie associée à une immunothérapie (atézolizumab, Roche).
Des traitements locaux peuvent être proposés en cas de tableau uni- ou paucimétastatique, de préférence en cas de métastases métachrones : chirurgie des métastases, radiothérapie stéréotaxique, thérapies ablatives de métastases hépatique ou pulmonaire (radiofréquence, micro- ondes, cryothérapie).
La chimiothérapie est le standard dans cette situation souvent dramatique. La combinaison de cisplatine et de 5-FU est la référence26, mais, depuis peu, l’association docétaxel, 5-FU et cisplatine constitue le nouveau standard français car il a montré des taux de réponse spectaculaires.27 Un essai de phase II randomisé présenté au dernier congrès de l’European Society for Medical Oncology (ESMO 2018) a montré la supériorité en taux de réponse objective (critère principal) de l’association carboplatine et paclitaxel à la combinaison de cisplatine et de 5-FU.28
L’immunothérapie constitue un espoir pour ces tumeurs qui deviennent redoutables après échec d’une radio-chimiothérapie concomitante ou d’une chimiothérapie de première ligne. Le rationnel repose sur le caractère viro-induit de ces tumeurs et la réponse immunitaire engendrée, ciblant les oncoprotéines du papillomavirus. Des anticorps anti-program death-1 (anti-PD-1) comme le pembrolizumab et le nivolumab déjà disponibles dans d’autres tumeurs (par exemple le mélanome et le poumon) ont montré une certaine efficacité, après échec de la chimiothérapie. Le premier a montré un taux de contrôle de la maladie à 57 %29, le deuxième un taux de réponse de 78 % et une médiane de survie globale de 11,5 mois.30 L’essai français multicentrique SCARCE, ouvert actuellement, compare en première ligne une chimiothérapie par docétaxel, 5-FU et cisplatine modifié à la même chimiothérapie associée à une immunothérapie (atézolizumab, Roche).
Des traitements locaux peuvent être proposés en cas de tableau uni- ou paucimétastatique, de préférence en cas de métastases métachrones : chirurgie des métastases, radiothérapie stéréotaxique, thérapies ablatives de métastases hépatique ou pulmonaire (radiofréquence, micro- ondes, cryothérapie).
Soins de support
Une des directives majeures du Plan cancer comporte la prise en charge :
– de la douleur avant et après traitement ;
– des effets aigus des traitements (hématotoxicité, néphrotoxicité, diarrhée, mucite, radiodermite et épithélite, cystite avec pollakiurie…). Il a été noté que même si la réponse thérapeutique est identique à stade égal entre les patients séropositifs et séronégatifs pour le VIH, la toxicité du traitement peut être majorée chez ces ceux qui sont séropositifs, essentiellement si leur infection par le VIH est mal contrôlée ;
– des effets tardifs de la radiothérapie : digestifs (douleur, incontinence, rectorragie, diarrhée chronique, sténose anale), sexuels (sécheresse et sténose vaginale, troubles érectiles), urinaires (dysurie et incontinence), osseux (fracture du bassin) ;
– psychologique : des patients jeunes souffrant déjà de leur séropositivité ; de l’impact des stomies définitives et même temporaires.
– de la douleur avant et après traitement ;
– des effets aigus des traitements (hématotoxicité, néphrotoxicité, diarrhée, mucite, radiodermite et épithélite, cystite avec pollakiurie…). Il a été noté que même si la réponse thérapeutique est identique à stade égal entre les patients séropositifs et séronégatifs pour le VIH, la toxicité du traitement peut être majorée chez ces ceux qui sont séropositifs, essentiellement si leur infection par le VIH est mal contrôlée ;
– des effets tardifs de la radiothérapie : digestifs (douleur, incontinence, rectorragie, diarrhée chronique, sténose anale), sexuels (sécheresse et sténose vaginale, troubles érectiles), urinaires (dysurie et incontinence), osseux (fracture du bassin) ;
– psychologique : des patients jeunes souffrant déjà de leur séropositivité ; de l’impact des stomies définitives et même temporaires.
Évaluation et surveillance
Évaluation après radio-chimiothérapie concomitante
L’évaluation doit être pratiquée le plus tard possible, en raison de la lenteur de la réponse et de l’inflammation locale post-thérapeutique prolongée. Dans l’étude ACT II,24 l’évaluation a révélé une réponse complète à 26 semaines de la fin de la radio-chimiothérapie chez 29 % des patients considérés comme non répondeurs lors de leur évaluation à 11 semaines.
L’examen clinique reste essentiel et peut être fait à partir de 8 semaines de la fin de la radio-chimiothérapie.
Il est inutile de faire un bilan d’imagerie avant 3 mois sauf en cas de forte suspicion de progression tumorale, l’imagerie par résonance magnétique et la tomodensitométrie couplée à l’émission de positons (TEP-TDM) sont aujourd’hui les examens les plus recommandés.31, 32
Le dosage du squamous cell carcinoma n’a d’intérêt que si sa valeur était initialement élevée.
Une biopsie est faite seulement en cas de suspicion de progression ; elle est proscrite pour l’évaluation de la réponse, et non recommandée avant 6 mois.
L’examen clinique reste essentiel et peut être fait à partir de 8 semaines de la fin de la radio-chimiothérapie.
Il est inutile de faire un bilan d’imagerie avant 3 mois sauf en cas de forte suspicion de progression tumorale, l’imagerie par résonance magnétique et la tomodensitométrie couplée à l’émission de positons (TEP-TDM) sont aujourd’hui les examens les plus recommandés.31, 32
Le dosage du squamous cell carcinoma n’a d’intérêt que si sa valeur était initialement élevée.
Une biopsie est faite seulement en cas de suspicion de progression ; elle est proscrite pour l’évaluation de la réponse, et non recommandée avant 6 mois.
Surveillance après rémission complète
Les modalités de surveillance sont précisées dans le tableau 6.
Environ 80 % des rechutes surviennent durant les deux premières années.33
Environ 80 % des rechutes surviennent durant les deux premières années.33
Persistance ou récidive tumorale après radio-chimiothérapie concomitante
Environ 20 à 30 % des patients récidivent.36 Les facteurs prédictifs de cette récidive sont les tumeurs volumineuses, l’atteinte ganglionnaire, les patients séropositifs pour le VIH, du fait d’éventuelles interruptions de traitement pour toxicité. Le traitement de rattrapage est l’amputation abdomino-périnéale. V
Références
1. Grabar S, Costagliola D, Bouvier AM. Épidémiologie du cancer de l’anus. Cancéro Dig 2011;3:251-7.
2. Abramowitz L, Jacquard AC, Jaroud F, et al. Human papillomavirus genotype distribution in anal cancer in France: the EDiTH V study. Int J Cancer 2011;129:433-9.
3. American Cancer Society. Cancer facts and figures 2018. Atlanta (GA): American Cancer Society, 2018.
4. Hleyhel M, Hleyhel M, Bouvier AM, et al. Risk of no-AIDS-defining cancers among HIV-1-infected individuals in France between 1997 and 2009: results from a French cohort. AIDS 2014;28;2109-18.
5. Munoz N, Bosch FX, de Sanjosé S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348:518-27.
6. Senapati R, et al. Molecular mechanisms of HPV mediated neoplastic progression. Infect Agent Cancer 2016;11:59.
7. Abramowitz L, Jacquard AC, Jaroud F, et al. Human papillomavirus genotype distribution in anal cancer in France: the EDITH V study. Int J Cancer 2011;129;433-9.
8. Shvetsov YB, Hernandez BY, McDuffie K, et al. Duration and clearance of anal human papillomavirus (HPV) infection among women: the Hawaii HPV cohort study. Clin Infect Dis 2009:48:536-46.
9. Piketty C, et al. The incidence of anal cancer remains Increased despite Prolonged exposure to cART in the French Hospital Database on HIV. Presented at International AIDS Society Conference, Rome, Italy, 17-20 July 2011.
10. Palefsky JM, Holly EA, Efirdc JT, et al. Anal intraepithelial neoplasia in the highly active antiretroviral therapy era among HIV-positive men who have sex with men. AIDS 2005;2005;19:1407-14.
11. Guiguet M, Boué F, Cadranel J, et al. Effect of immunodeficiency, HIV viral load, and antiretroviral therapy on the risk of individual malignancies (FHDH-ANRS C04): a prospective cohort study. Lancet Oncol 2009;10:1152-9.
12. Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet 2007;370:59-67.
13. Prise en charge médicale des personnes vivant avec le VIH – Recommandations du groupe d’expert sous la direction du Pr Philippe Morlat, 2017. https://cns.sante.fr ou https://bit.ly/2AU0kYH
14. Pernot S, Boucheron P, Péré H, et al. Comparison of anal cancer screening strategies including standard anuscopy, anal cytology and HPV genotyping in HIV-positive men who have sex with men. British Journal of Cancer 2018;119:381-6.
15. Gonçalves JCN, Macedo ACL, Madeira K et al. Accuracy of anal cytology for diagnostic of precursor lesions of anal cancer: systematic review and meta-analysis. Dis Colon Rectum 2019;62:112-20.
16. Park IU, Palefsky JM. Evaluation and management of anal intraepithelial neoplasia in HIV-positive men who have sex with men. Curr Infect Dis Rep 2010; 12;126-33.
17. Harder T, Wichmann O, Klug SJ, van der Sande MAB, Wiese-Posselt M. Efficacy, effectiveness and safety of vaccination against human papilloma virus in males: a systematic review. BMC Medicine 2018;16:110.
18. Otto SD, Lee L, Buhr HJ, Frericks B, Höcht S, Kroesen AJ. Staging anal cancer: prospective comparison of transanal endoscopic ultrasound and magnetic resonance imaging. J Gastrointest Surg 2009;13;1292-8.
19. Trautmann TG, Zuger JH. Positron emission tomography for pretreatment evaluation in cancer for the anal canal. Mol Imaging Biol 2005;7:309-13.
20. Nigro ND. An evaluation of combined therapy for squamous cell cancer of the anal canal. Dis Colon Rectum 1984;27:763-6.
21. Gunderson LL, Winter KA, Ajani JA, et al. Long-term update of US GI intergroup RTOG 98-11 phase III trial for anal carcinoma: survival, relapse, and colostomy failure with concurrent chemoradiation involving fluorouracil/ mitomycin versus fluorouracil/ cisplatin. J Clin Oncol 2012;30:4344-51.
22. Meulendijks D, Dewit L, Tomasoa NB, et al. Chemoradiotherapy with capecitabine for locally advanced anal carcinoma: an alternative treatment option. Br J Cancer 2014;111:1726-33.
23. Peiffert D, Tournier-Rangeard L, Gérard JP, et al. Induction chemotherapy and dose intensification of radiation boost in locally advanced anal canal carcinoma: final analysis of randomized UNI-CANCER ACCORD 03 trial. J Clin Oncol 2012;30:1941-8.
24. James RD, Glynne-Jones R, Meadows HM, et al. Mitomycin or cisplatin chemoradiation with or without maintenance chemotherapy for treatment of squamous-cell carcinoma of the anus (ACT II): a randomized, phase 3, open-label, 2 x 2 factorial trial. Lancet Oncol 2013;14:516-24.
25. Namiq K, et al. Localised squamous cell carcinoma of the anus: clinical outcomes following local excision. Colorectal Dis 2016;18:30.
26. Faivre C, Rougier P, Ducreux M, et al. Carcinome épidermoïde métastatique de l’anus : étude rétrospective de l’efficacité de l’association de 5-fluoro-uracile en perfusion continue et de cisplatine. Bull Cancer 1999;86:861-5.
27. Kim S, François É, André T, et al. Docetaxel, cisplatin, and fluorouracil chemotherapy for metastatic or unresectable locally reccurent anal squamous cell carcinoma (Epitopes-HPV02): a multicenter, single-arm, phase 2 study. Lancet 2018;19:1094-106.
28. Rao S, et al. InterAACT: A multicentre open label randomised phase II advanced anal cancer trial of cisplatin (CDDP) plus 5-fluorouracil (5-FU) vs carboplatin (C) plus weekly paclitaxel (P) in patients (pts) with inoperable locally recurrent (ILR) or metastatic treatment naïve disease - An International Rare Cancers Initiative (IRCI) Trial. LBA21.
29. Otta PA, Piha-Paul SA, Munster P, et al. Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with recurrent carcinoma of the anal canal. Ann Oncol 2017;28:1036-41.
30. Morris VK, Salem ME, Nimeiri H, et al. Nivolumab for previously treated unresctable metastatic anal cancer (NCI9673): a multicentre, single-arm, phase 2 study. Lancet Oncol 2017;18:446-53.
31. Kochhar R, Renehan AG, Mullan D, Chakrabarty B, Saunders MP, Carrington BM. The assessment of local response using MRI at 3 and 6 month post chemoradiotherapy in patients with anal cancer. Eur Radiol 2017;27:607-17.
32. Nguyen BT, Joon DL, Khoo V, et al. Assessing the impact of FDG-PET in the management of anal cancer. Radiother Oncol 2008;87:367-82.
33. Sebag-Montefiore D, James R, Meadows H, et al. The pattern and timing of disease recurrence in squamous cancer of the anus – mature results from the NCRI ACT II trial. J clin Oncol 2012;30:abstr 4029.
34. Geh I, Gollins S, Renehan A, et al. Association of coloproctology of Great Britain & Ireland (ACPGBI): Guidelines for the management of cancer of the colon, rectum en Anus (2017) – Anal cancer. Colorectal Disease 2017;19(Suppl. 1):82-97.
35. NCCN Guidelines: National Comprehensive Cancer Netword, 2016.
36. Roohipour R, Patil S, Goodman KA, et al. Squamous cell carcinoma of the anal canal : predictors of treatment outcome. Dis Colon Rectum 2008;51:147-53.
2. Abramowitz L, Jacquard AC, Jaroud F, et al. Human papillomavirus genotype distribution in anal cancer in France: the EDiTH V study. Int J Cancer 2011;129:433-9.
3. American Cancer Society. Cancer facts and figures 2018. Atlanta (GA): American Cancer Society, 2018.
4. Hleyhel M, Hleyhel M, Bouvier AM, et al. Risk of no-AIDS-defining cancers among HIV-1-infected individuals in France between 1997 and 2009: results from a French cohort. AIDS 2014;28;2109-18.
5. Munoz N, Bosch FX, de Sanjosé S, et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer. N Engl J Med 2003;348:518-27.
6. Senapati R, et al. Molecular mechanisms of HPV mediated neoplastic progression. Infect Agent Cancer 2016;11:59.
7. Abramowitz L, Jacquard AC, Jaroud F, et al. Human papillomavirus genotype distribution in anal cancer in France: the EDITH V study. Int J Cancer 2011;129;433-9.
8. Shvetsov YB, Hernandez BY, McDuffie K, et al. Duration and clearance of anal human papillomavirus (HPV) infection among women: the Hawaii HPV cohort study. Clin Infect Dis 2009:48:536-46.
9. Piketty C, et al. The incidence of anal cancer remains Increased despite Prolonged exposure to cART in the French Hospital Database on HIV. Presented at International AIDS Society Conference, Rome, Italy, 17-20 July 2011.
10. Palefsky JM, Holly EA, Efirdc JT, et al. Anal intraepithelial neoplasia in the highly active antiretroviral therapy era among HIV-positive men who have sex with men. AIDS 2005;2005;19:1407-14.
11. Guiguet M, Boué F, Cadranel J, et al. Effect of immunodeficiency, HIV viral load, and antiretroviral therapy on the risk of individual malignancies (FHDH-ANRS C04): a prospective cohort study. Lancet Oncol 2009;10:1152-9.
12. Grulich AE, van Leeuwen MT, Falster MO, Vajdic CM. Incidence of cancers in people with HIV/AIDS compared with immunosuppressed transplant recipients: a meta-analysis. Lancet 2007;370:59-67.
13. Prise en charge médicale des personnes vivant avec le VIH – Recommandations du groupe d’expert sous la direction du Pr Philippe Morlat, 2017. https://cns.sante.fr ou https://bit.ly/2AU0kYH
14. Pernot S, Boucheron P, Péré H, et al. Comparison of anal cancer screening strategies including standard anuscopy, anal cytology and HPV genotyping in HIV-positive men who have sex with men. British Journal of Cancer 2018;119:381-6.
15. Gonçalves JCN, Macedo ACL, Madeira K et al. Accuracy of anal cytology for diagnostic of precursor lesions of anal cancer: systematic review and meta-analysis. Dis Colon Rectum 2019;62:112-20.
16. Park IU, Palefsky JM. Evaluation and management of anal intraepithelial neoplasia in HIV-positive men who have sex with men. Curr Infect Dis Rep 2010; 12;126-33.
17. Harder T, Wichmann O, Klug SJ, van der Sande MAB, Wiese-Posselt M. Efficacy, effectiveness and safety of vaccination against human papilloma virus in males: a systematic review. BMC Medicine 2018;16:110.
18. Otto SD, Lee L, Buhr HJ, Frericks B, Höcht S, Kroesen AJ. Staging anal cancer: prospective comparison of transanal endoscopic ultrasound and magnetic resonance imaging. J Gastrointest Surg 2009;13;1292-8.
19. Trautmann TG, Zuger JH. Positron emission tomography for pretreatment evaluation in cancer for the anal canal. Mol Imaging Biol 2005;7:309-13.
20. Nigro ND. An evaluation of combined therapy for squamous cell cancer of the anal canal. Dis Colon Rectum 1984;27:763-6.
21. Gunderson LL, Winter KA, Ajani JA, et al. Long-term update of US GI intergroup RTOG 98-11 phase III trial for anal carcinoma: survival, relapse, and colostomy failure with concurrent chemoradiation involving fluorouracil/ mitomycin versus fluorouracil/ cisplatin. J Clin Oncol 2012;30:4344-51.
22. Meulendijks D, Dewit L, Tomasoa NB, et al. Chemoradiotherapy with capecitabine for locally advanced anal carcinoma: an alternative treatment option. Br J Cancer 2014;111:1726-33.
23. Peiffert D, Tournier-Rangeard L, Gérard JP, et al. Induction chemotherapy and dose intensification of radiation boost in locally advanced anal canal carcinoma: final analysis of randomized UNI-CANCER ACCORD 03 trial. J Clin Oncol 2012;30:1941-8.
24. James RD, Glynne-Jones R, Meadows HM, et al. Mitomycin or cisplatin chemoradiation with or without maintenance chemotherapy for treatment of squamous-cell carcinoma of the anus (ACT II): a randomized, phase 3, open-label, 2 x 2 factorial trial. Lancet Oncol 2013;14:516-24.
25. Namiq K, et al. Localised squamous cell carcinoma of the anus: clinical outcomes following local excision. Colorectal Dis 2016;18:30.
26. Faivre C, Rougier P, Ducreux M, et al. Carcinome épidermoïde métastatique de l’anus : étude rétrospective de l’efficacité de l’association de 5-fluoro-uracile en perfusion continue et de cisplatine. Bull Cancer 1999;86:861-5.
27. Kim S, François É, André T, et al. Docetaxel, cisplatin, and fluorouracil chemotherapy for metastatic or unresectable locally reccurent anal squamous cell carcinoma (Epitopes-HPV02): a multicenter, single-arm, phase 2 study. Lancet 2018;19:1094-106.
28. Rao S, et al. InterAACT: A multicentre open label randomised phase II advanced anal cancer trial of cisplatin (CDDP) plus 5-fluorouracil (5-FU) vs carboplatin (C) plus weekly paclitaxel (P) in patients (pts) with inoperable locally recurrent (ILR) or metastatic treatment naïve disease - An International Rare Cancers Initiative (IRCI) Trial. LBA21.
29. Otta PA, Piha-Paul SA, Munster P, et al. Safety and antitumor activity of the anti-PD-1 antibody pembrolizumab in patients with recurrent carcinoma of the anal canal. Ann Oncol 2017;28:1036-41.
30. Morris VK, Salem ME, Nimeiri H, et al. Nivolumab for previously treated unresctable metastatic anal cancer (NCI9673): a multicentre, single-arm, phase 2 study. Lancet Oncol 2017;18:446-53.
31. Kochhar R, Renehan AG, Mullan D, Chakrabarty B, Saunders MP, Carrington BM. The assessment of local response using MRI at 3 and 6 month post chemoradiotherapy in patients with anal cancer. Eur Radiol 2017;27:607-17.
32. Nguyen BT, Joon DL, Khoo V, et al. Assessing the impact of FDG-PET in the management of anal cancer. Radiother Oncol 2008;87:367-82.
33. Sebag-Montefiore D, James R, Meadows H, et al. The pattern and timing of disease recurrence in squamous cancer of the anus – mature results from the NCRI ACT II trial. J clin Oncol 2012;30:abstr 4029.
34. Geh I, Gollins S, Renehan A, et al. Association of coloproctology of Great Britain & Ireland (ACPGBI): Guidelines for the management of cancer of the colon, rectum en Anus (2017) – Anal cancer. Colorectal Disease 2017;19(Suppl. 1):82-97.
35. NCCN Guidelines: National Comprehensive Cancer Netword, 2016.
36. Roohipour R, Patil S, Goodman KA, et al. Squamous cell carcinoma of the anal canal : predictors of treatment outcome. Dis Colon Rectum 2008;51:147-53.