Cette affection, rare mais non exceptionnelle, simule un syndrome coronaire aigu clinique, électrocardiographique et biologique. Chez une femme ménopausée, il faut toujours y penser.
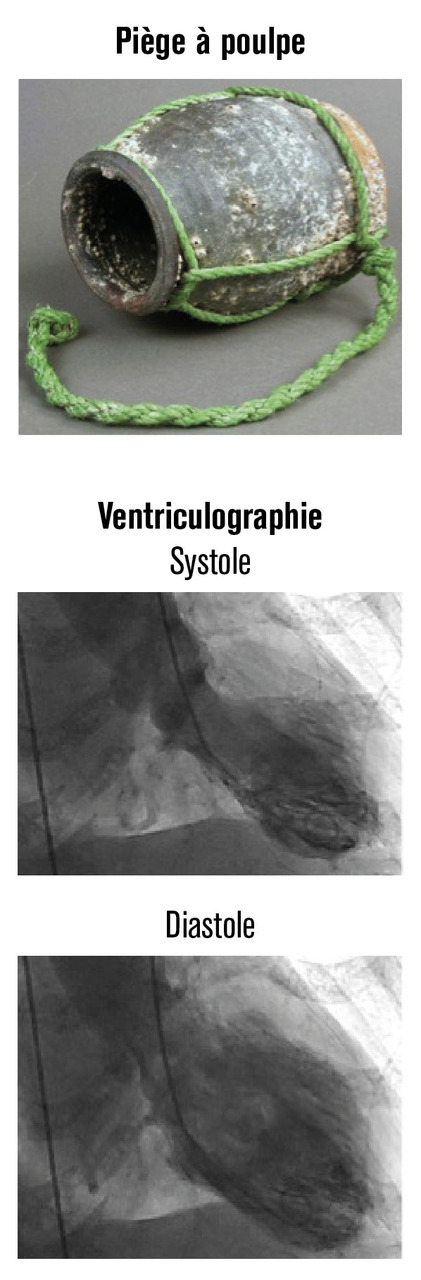
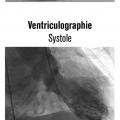
Parfois aussi appelée cardiomyopathie de stress ou syndrome de ballonisation apicale transitoire du ventricule gauche, la cardiomyopathie de Takotsubo se caractérise par une dysfonction aiguë transitoire et une déformation ventriculaire gauche à type de ballonisation apicale associée à un sus-décalage du segment ST à l’électrocardiogramme et à une élévation modérée de la troponine sans anomalie notable à la coronarographie. Rapportée pour la première fois par l’équipe du Massachussetts Hospital en 1986,1 la cardiomyopathie de Takotsubo a été individualisée à propos de cinq cas par H. Sato en 1991.2 Il a comparé la déformation ventriculaire gauche à un takotsubo, piège à poulpe utilisé par les pêcheurs japonais (fig. 1 ). Il serait donc plus juste de parler de cardiomyopathie en forme de takotsubo.
Surtout chez les femmes ménopausées
La cardiomyopathie de Takotsubo survient préférentiellement chez des femmes ménopausées, laissant suggérer le rôle protecteur des estrogènes sur l’action des catécholamines, également retrouvé sur le modèle animal de rat ovariectomisé. La prévalence en France est estimée entre 1 et 2 % des syndromes coronaires aigus. N. Mansencal a étudié la prévalence de la cardiomyopathie de Takotsubo dans un centre parisien et deux centres d’Île-de-France : 20 cardiomyopathies de Takotsubo ont été retrouvées sur 2 547 coronarographies réalisées pour douleur thoracique aiguë (0,78 %) et 2,17 % des coronarographies normales.3 L’incidence dans la population générale serait de 54,9 par million d’habitants pour les femmes et 3,6 par million d’habitants pour les hommes.4 Dans l’Observatoire français des syndromes de Takotsubo (OFSETT),5 nous avons noté 91,5 % de femmes d’une moyenne d’âge de 71,4 ± 12,1 ans qui, en comparaison des syndromes coronaires aigus de cette population, avaient moins d’antécédents et de facteurs de risque cardiovasculaire.
Une physiopathologie mal élucidée
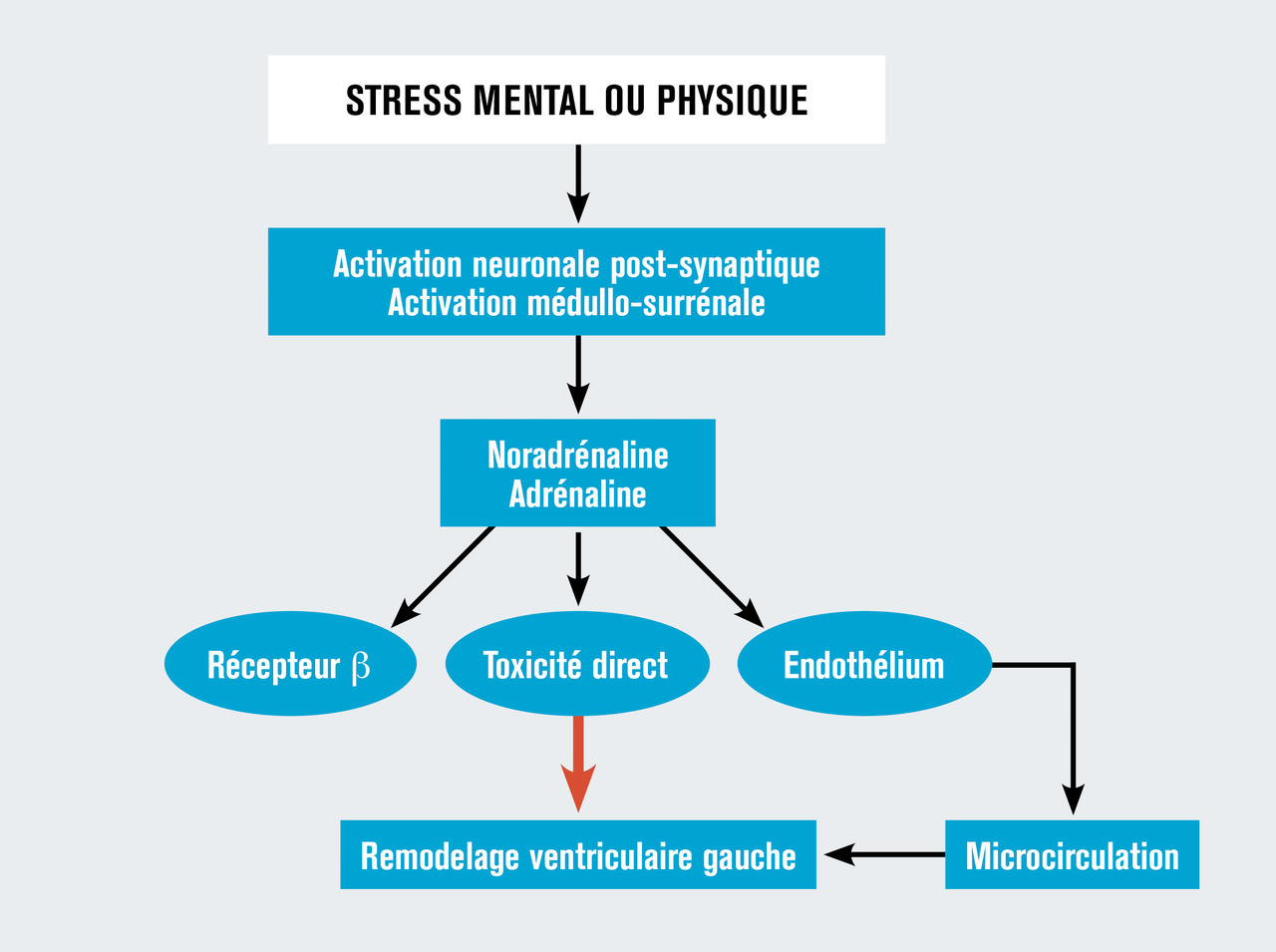
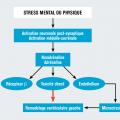
Non encore totalement élucidée, il a été évoqué un infarctus myocardique avorté par rupture de plaque non visible ou thrombus spontanément lysé, un spasme diffus des vaisseaux coronaires ou une dysfonction de la microcirculation. Il existe, en revanche, des arguments solides pour évoquer la responsabilité de la sécrétion de catécholamines secondaire à la survenue d’un stress physique ou mental. Il s’ensuit une activation neuronale post-synaptique et médullo-surrénale avec sécrétion de noradrénaline et d’adrénaline qui agissent sur les bêtarécepteurs adrénergiques mais aussi par toxicité directe et action sur l’endothélium de la microcirculation coronaire, ces deux derniers phénomènes contribuant au remodelage ventriculaire gauche (fig. 2 ). La localisation apicale de la ballonisation du ventricule serait en rapport avec une répartition inhomogène des récepteurs β1 et β2 myocardiques entre la base et l’apex du ventricule gauche.
Un diagnostic d’élimination
Signes et symptômes
Le registre OFSETT a inclus 117 patients ayant un tableau compatible avec le diagnostic de cardiomyopathie de Takotsubo.5 Les symptômes à l’admission étaient : une douleur thoracique (80,5 %), une dyspnée (24,1 %), une syncope (6,1 %), une insuffisance cardiaque aiguë (6,1 %), un choc cardiogénique (3,5 %), une arythmie (3,3 %). Un événement de stress initial était retrouvé dans 64,3 % des cas, plus souvent mental (70,4 %) que physique (26,1 %). Il est convenu actuellement de distinguer les stress primaires occasionnels (décès de proche, accident…) des stress secondaires à une agression médicale ou chirurgicale.
Électrocardiogramme
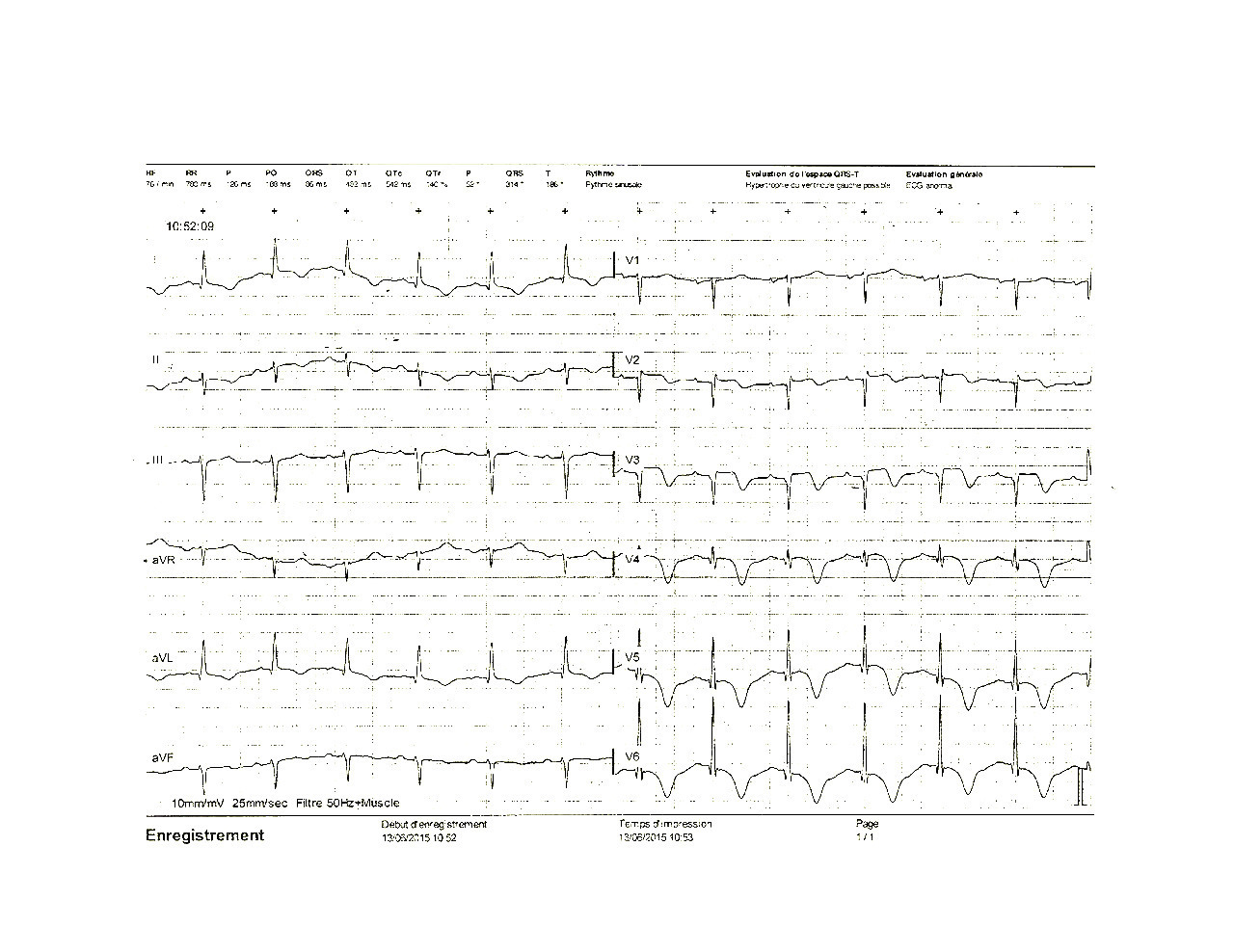
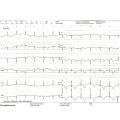
On retrouve dans le registre OFSETT des signes évoquant un syndrome coronaire aigu (fig. 3 ) avec, par ordre de fréquence, une inversion de l’onde T (71,6 %), le plus souvent en antérieur (78,4 %) et en particulier en V4, V5, V6, puis un sus-décalage de ST (41,7 %) en antérieur (95,7 %) surtout en V2, V3 (80 %) et enfin une onde Q (29,1 %) également le plus souvent en antérieur (76,6 %) en V1, V2, V3 (73 %).5 L’évolution se fait en trois phases : dans les 48 premières heures on observe un sus-décalage de ST et parfois une inversion de T et/ou une onde Q, puis avant le troisième jour une disparition de l’onde Q avec persistance du sus-décalage de ST, qui va régresser pour ne laisser au-delà du troisième jour que les ondes T inversées, qui peuvent persister jusqu’à 1 à 2 mois.
Échocardiographie
L’échocardiographie, toujours réalisée, montre à la phase aiguë des renseignements sur la morpho-logie du ventricule gauche, une dysfonction systolique ventriculaire gauche avec fraction d’éjection (FEVG) abaissée en moyenne à 41,7 ± 10,1 %,5 une dysfonction diastolique associée parfois ou un retentissement ventriculaire droit. On note parfois une obstruction dynamique intraventriculaire gauche associée ou non à une insuffisance mitrale.6 L’échocardiographie peut détecter un thrombus intraventriculaire gauche. La morphologie la plus fréquente du ventricule gauche est la ballonisation apicale typique avec akinésie apicale et moyenne dans deux tiers des cas ; la forme médiane est retrouvée dans un tiers des cas, la forme inversée avec akinésie basale ou la forme focale sont beaucoup plus rares.
Bilan biologique
Il montre une élévation de la troponine, mais moins importante, et une élévation du peptide cérébral natriurétique (brain natriuretic peptide [BNP]) ou de sa fraction N-terminale (NT-proBNP), mais plus importante que dans l’infarctus du myocarde. La détermination du rapport BNP/troponine peut donc contribuer au diagnostic différentiel. La méta-analyse de 13 registres7 trouve une augmentation de la troponine dans 85 % des cas. Dans une étude, le taux moyen de troponine est de 0,17 à 2,14.8 Dans une autre, le NT-proBNP est élevé en moyenne à 4 382 pg/mL.9
Coronarographie
La cardiomyopathie de Takotsubo étant un diagnostic d’élimination, la coronarographie doit toujours être réalisée afin d’exclure une occlusion coronaire. Dans le registre OFSETT,5 elle a été pratiquée dans 98,7 % des cas, se révélant normale dans 77,9 % et ne montrant que des anomalies mineures dans 22,1 % des cas. La ventriculographie, si elle est réalisée, permet d’étudier la déformation ventriculaire gauche et de mesurer la FEVG, informations souvent déjà connues par l’échocardiographie.
Imagerie par résonance magnétique
Elle doit être réalisée chaque fois que possible, car outre les renseignements morphologiques et sur la fonction ventriculaire, elle permet de différencier la cardiomyopathie de Takotsubo de l’infarctus myocardique devant l’absence de rehaussement tardif. I. Eitel10 a étudié, entre janvier 2005 et janvier 2008, 6 100 coronarographies de syndromes coronaires aigus retrouvant 59 patients avec coronarographie normale et ballonisation à la ventriculographie (1 %). L’imagerie par résonance magnétique a confirmé un infarctus du myocarde pour 13 d’entre eux (22 %), une myocardite pour 8 (13,6 %) et une cardiomyopathie de Takotsubo pour 38 (64,4 % dont 36 femmes d’âge moyen 73 ± 10 ans), avec un contrôle à 3 mois des cardiomyopathies de Takotsubo qui montrait une normalisation du ventricule gauche.
Critères diagnostiques
En 2004, les critères diagnostiques de la Mayo Clinic modifiés ont été publiés ; ils sont au nombre de 6 :11
– présence de troubles de la cinétique ventricule gauche sans concordance vasculaire coronaire ;
– existence (non obligatoire) d’un stress déclenchant ;
– absence d’occlusion coronaire ou de rupture de plaque athéromateuse ;
– sus-décalage du segment ST et/ou inversion des ondes ;
– élévation modérée de la troponine ;
– absence de phéochromocytome ou de myocardite.
Plus récemment en 2017, J. Ghadri a calculé, à partir des données du registre international des syndromes de Takotsubo,12 un score clinique : l’interTAK diagnostic score. Il est fondé sur le sexe féminin, l’existence d’un stress émotionnel ou physique, l’absence de sous-décalage de ST sauf en aVR, la présence d’un allongement du QTc et enfin de troubles psychiques ou neurologiques.
– présence de troubles de la cinétique ventricule gauche sans concordance vasculaire coronaire ;
– existence (non obligatoire) d’un stress déclenchant ;
– absence d’occlusion coronaire ou de rupture de plaque athéromateuse ;
– sus-décalage du segment ST et/ou inversion des ondes ;
– élévation modérée de la troponine ;
– absence de phéochromocytome ou de myocardite.
Plus récemment en 2017, J. Ghadri a calculé, à partir des données du registre international des syndromes de Takotsubo,12 un score clinique : l’interTAK diagnostic score. Il est fondé sur le sexe féminin, l’existence d’un stress émotionnel ou physique, l’absence de sous-décalage de ST sauf en aVR, la présence d’un allongement du QTc et enfin de troubles psychiques ou neurologiques.
Une évolution le plus souvent favorable
Avec une mortalité intrahospitalière faible, l’évolution est le plus souvent favorable avec restitution d’une morphologie et d’une FEVG normales. G. Parodi a comparé l’évolution de deux groupes de patients aux caractéristiques identiques, l’un ayant un syndrome coronaire aigu avec lésions coronaires (groupe 1) et l’autre avec une cardiomyopathie de Takotsubo (groupe 2).13 La FEVG était comparable dans les deux groupes à l’admission (35 %) mais elle était de 45 % dans le groupe 1 et de 55 % dans le groupe 2 (p = 0,021) à la sortie. La survie à 6 mois était de 86 % dans le groupe 1 et de 97 % dans le groupe 2 (p = 0,055), les événements cardiovasculaires non mortels étaient de 69 % dans le groupe 1 et de 92 % dans le groupe 2 (p = 0,001). De rares complications à la phase aiguë ont été rapportées :7 insuffisance cardiaque et œdème aigu pulmonaire (15 %), choc cardiogénique (10 %), thrombus intraventriculaire et formes récidivantes (3 %). Des arythmies ventriculaires sont possibles, notées dans 10 % des cas,14 avec des facteurs prédictifs tels une syncope, une forte élévation de la troponine, l’utilisation de la dobutamine, l’âge relativement jeune des patients.
Une prise en charge médicale et psychologique
Traitement médicamenteux
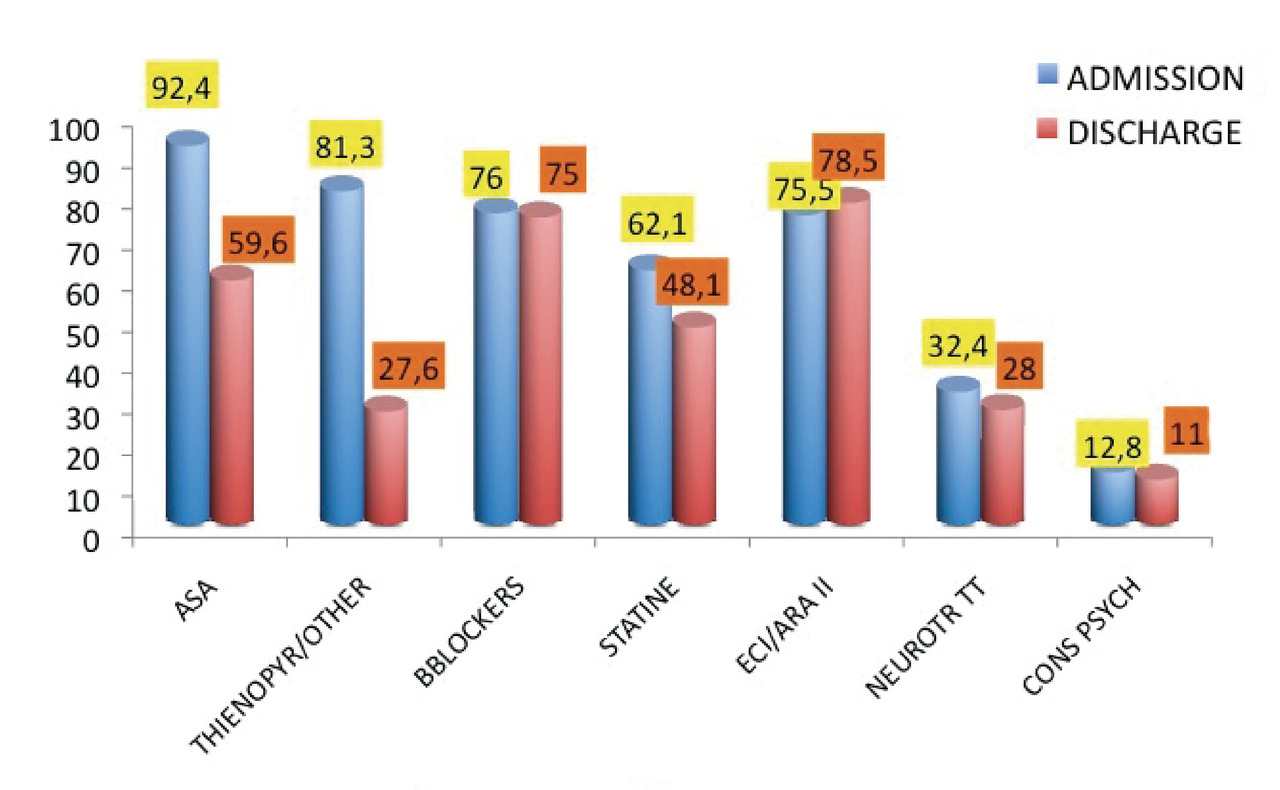
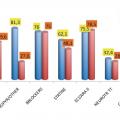
Avec le registre OFSETT,5 nous avons repris les traitements médicamenteux prescrits à l’admission et à la sortie de l’hôpital (fig. 4 ). Il montre une similitude de prise en charge initiale avec l’infarctus du myocarde associant aspirine, thiénopyridine, bêta-bloquant, statines et inhibiteurs de l’enzyme de conversion (IEC) ou antagonistes des récepteurs de l’angiotensine II (ARA II). À la sortie, le diagnostic confirmé, sont diminués l’aspirine et les autres antiagrégants plaquettaires, à un moindre degré les statines, alors que sont maintenus sans changement les bêtabloquant et les IEC/ARA II, correspondant donc à la prise en compte de l’absence de risque coronaire et de la dilatation ventriculaire gauche. Le traitement médical peut aussi comporter des médicaments spécifiques d’une complication.
Prise en charge psychothérapique
Une consultation psychologique est indispensable, avec un suivi ultérieur si nécessaire. Cette mesure semble toutefois insuffisamment entreprise. En effet, seulement 12,8 % des patients inclus dans le registre OFSETT en ont bénéficié.5
CHEZ UNE FEMME MÉNOPAUSÉE, TOUJOURS Y PENSER !
La cardiomyopathie de Takotsubo doit donc être évoquée devant un tableau de syndrome coronaire aigu et confirmée pour une prise en charge adaptée au mécanisme physiopathologique de cette affection rare mais non exceptionnelle.
Références
1. Case records of Massachussetts Hospital. A 44 years woman with substernal pain and pulmonary edema after severe emotial stress. N Engl J Med 1986;314:1240-7.
2. Dote K, Sato H, Tateishi H, Uchida T, Ishihara M. Myocardial stunning due to simultaneous multivessel coronary spasms : a review of 5 cases ( in Japan ). J Cardiol 1991;21:203-14.
3. Mansencal N, Auvert B, N’Guetta R, et al. Prospective assessment of incidence of Tako-Tsubo cardiomyopathy in a very large urban agglomeration. Int J Cardiol 2013;168:2791-5.
4. Mansencal N, Dubourg O. What is the risk of Takotsubo in women? Presse Med 2018;47:817-22.
5. Yayehd K, N’da N, Belle L, et al. ; OFSETT investigators. Management of Takotsubo cardiomyopathy in non-academic hospitals in France : The Observational French Syndromes of TakoTsubo (OFSETT) study. Arch Cardiovasc Dis 2016;109:4-12.
6. Citro R, Piscione F, Parodi G, Salerno-Uriarte J, Bossone E. Role of echocardiography in Takotsubo cardiomyopathy. Heart Failure Clin 2013;9:157-66.
7. Pilgrim TM, Wiss TR. Takotsubo cardiomyopathy or transient left ventricular apical ballooning syndrome: a systematic review. Int J Cardiol 2008;124:283-92.
8. Singh NK, Rumman S, Mikell FL, Nallamothu N, Rangaswamy C. Stress cardiomyopathy: clinical and ventriculographic characteristics in 107 North American subjects. Int J Cardiol 2010;141:297-303.
9. Nguyen TH, Neil CJ, Sterdlov AL, et al. N-terminal pro-brain natriuretic protein levels in takotsubo cardiomyopathy. Am J Cardiol 2011;108:1316-21.
10. Eitel I, Behrendt F, Schindler K et al. Differential diagnosis of suspected apical ballooning using contrast-enhanced magnetic resonance imaging. Eur Heart J 2008;29:2651-9.
11. Bybee KA, Prasad A, Barsness GW, et al. Clinical characteristics and thrombolysis in myocardial infarction frame counts in women with transient left ventricular apical ballooning syndrome. Am J Cardiol 2004;94:343-6.
12. Ghadri JR, Cammann VL, Jurisic S et al.; InterTAK co-investigators. A novel clinical score (interTAK diagnostic score) to differentiate takotsubo syndrome from acute coronary syndrome : results from the international Takotsubo Registry. Eur J Heart Fail 2017;19:1036-42.
13. Parodi G, Del Pace S, Carraba N et al. Incidence, clinical findings and outcome of women with left ventricular apical ballooning syndrome. Am J Cardiol 2007;99:182-5.
14. Auzel O, Mustafic H, Pillière R, El Mahmoud R, Dubourg O, Mansencal N. Incidence, characteristics, risks factors and outcomes of Takotsubo cardiomyopathy with and without ventricular arrythmia. Am J Cardiol 2016;117:1242-7.
2. Dote K, Sato H, Tateishi H, Uchida T, Ishihara M. Myocardial stunning due to simultaneous multivessel coronary spasms : a review of 5 cases ( in Japan ). J Cardiol 1991;21:203-14.
3. Mansencal N, Auvert B, N’Guetta R, et al. Prospective assessment of incidence of Tako-Tsubo cardiomyopathy in a very large urban agglomeration. Int J Cardiol 2013;168:2791-5.
4. Mansencal N, Dubourg O. What is the risk of Takotsubo in women? Presse Med 2018;47:817-22.
5. Yayehd K, N’da N, Belle L, et al. ; OFSETT investigators. Management of Takotsubo cardiomyopathy in non-academic hospitals in France : The Observational French Syndromes of TakoTsubo (OFSETT) study. Arch Cardiovasc Dis 2016;109:4-12.
6. Citro R, Piscione F, Parodi G, Salerno-Uriarte J, Bossone E. Role of echocardiography in Takotsubo cardiomyopathy. Heart Failure Clin 2013;9:157-66.
7. Pilgrim TM, Wiss TR. Takotsubo cardiomyopathy or transient left ventricular apical ballooning syndrome: a systematic review. Int J Cardiol 2008;124:283-92.
8. Singh NK, Rumman S, Mikell FL, Nallamothu N, Rangaswamy C. Stress cardiomyopathy: clinical and ventriculographic characteristics in 107 North American subjects. Int J Cardiol 2010;141:297-303.
9. Nguyen TH, Neil CJ, Sterdlov AL, et al. N-terminal pro-brain natriuretic protein levels in takotsubo cardiomyopathy. Am J Cardiol 2011;108:1316-21.
10. Eitel I, Behrendt F, Schindler K et al. Differential diagnosis of suspected apical ballooning using contrast-enhanced magnetic resonance imaging. Eur Heart J 2008;29:2651-9.
11. Bybee KA, Prasad A, Barsness GW, et al. Clinical characteristics and thrombolysis in myocardial infarction frame counts in women with transient left ventricular apical ballooning syndrome. Am J Cardiol 2004;94:343-6.
12. Ghadri JR, Cammann VL, Jurisic S et al.; InterTAK co-investigators. A novel clinical score (interTAK diagnostic score) to differentiate takotsubo syndrome from acute coronary syndrome : results from the international Takotsubo Registry. Eur J Heart Fail 2017;19:1036-42.
13. Parodi G, Del Pace S, Carraba N et al. Incidence, clinical findings and outcome of women with left ventricular apical ballooning syndrome. Am J Cardiol 2007;99:182-5.
14. Auzel O, Mustafic H, Pillière R, El Mahmoud R, Dubourg O, Mansencal N. Incidence, characteristics, risks factors and outcomes of Takotsubo cardiomyopathy with and without ventricular arrythmia. Am J Cardiol 2016;117:1242-7.