La transfusion de produits sanguins labiles (concentrés de globules rouges, concentrés de plaquettes, plasma thérapeutique) est une thérapeutique utilisée régulièrement pour des patients dont l’état le nécessite, principalement en oncohématologie et en cancérologie, en chirurgie et en traumatologie, et en obstétrique. Les années récentes ont connu un développement important de la recherche en médecine transfusionnelle, couvrant toute la chaîne transfusionnelle, du donneur au receveur. Si les résultats de cette recherche induisent à des degrés divers des modifications de la pratique de la transfusion, trois nouveautés peuvent être considérées comme particulièrement marquantes, par leur incidence sur la pratique clinique de la transfusion de produits sanguins labiles et la sécurité des patients. Il s’agit de la gestion du sang du patient, de l’atténuation d’agents infectieux et des pratiques de transfusion massive. L’objectif de cet article (qui reflète les opinions de l’auteur et pas nécessairement celles de son affiliation) est de présenter une mise au point sur ces évolutions des pratiques et les avantages qui peuvent en être attendus.
Gestion du sang du patient
L’expression anglaise « patient blood management » devrait se traduire par « gestion du sang du patient et du sang pour le patient » (GSP). Cette gestion peut se définir comme « une approche thérapeutique centrée sur le patient, fondée sur des preuves scientifiques, multidisciplinaire, visant à optimiser la prise en charge de chaque patient qui pourrait avoir besoin de transfusion et par conséquent l’utilisation de produits sanguins ».1 Son développement croissant dans les années récentes atteste d’une réémergence des principes de base de la médecine transfusionnelle, qui doivent guider la prescription de produits sanguins labiles et le conseil transfusionnel : apporter aux patients dont l’état le nécessite le bon produit sanguin de qualité et en quantité requises. Les bases scientifiques de la gestion du sang du patient ont conduit à élaborer ses deux composantes comme des moyens pour optimiser le traitement des patients susceptibles de nécessiter des transfusions de globules rouges : des politiques de transfusion restrictives, et des alternatives à la transfusion.
Les politiques restrictives de transfusion, concernant la gestion du sang pour le patient, reposent sur des essais cliniques contrôlés ayant comparé des patients recevant des transfusions de concentrés de globules rouges avec un seuil d’hémoglobine plus haut (9-10 g/dL ; stratégies libérales) ou plus bas (7-8 g/dL ; stratégies restrictives). La méta-analyse la plus récente, intégrant les résultats de 37 essais cliniques ayant inclus 19 049 patients,2 a montré, pour les patients ne souffrant pas d’insuffisance coronarienne sous-jacente, l’absence de différence significative entre les deux stratégies pour la mortalité à 30 jours et pour la morbidité. En dehors des patients insuffisants coronaires, pour lesquels d’autres études sont nécessaires, la stratégie restrictive de transfusion de concentrés de globules rouges avec un seuil d’hémoglobine entre 7 et 8 g/dL apparaît donc globalement sûre et permet de réduire notablement l’utilisation de ces produits. Naturellement, le taux d’hémoglobine ne peut être qu’un guide utile à la décision de transfuser, qui doit toujours impliquer une évaluation clinique individuelle.
Les alternatives à la transfusion, concernant la gestion du propre sang du patient, sont fondées sur trois piliers : optimiser les propres réserves de sang du patient (volume sanguin et masse de globules rouges), minimiser les pertes sanguines, optimiser la tolérance du patient à l’anémie (v. tableau). Ces principes peuvent aisément être étendus à d’autres indications cliniques de la transfusion.
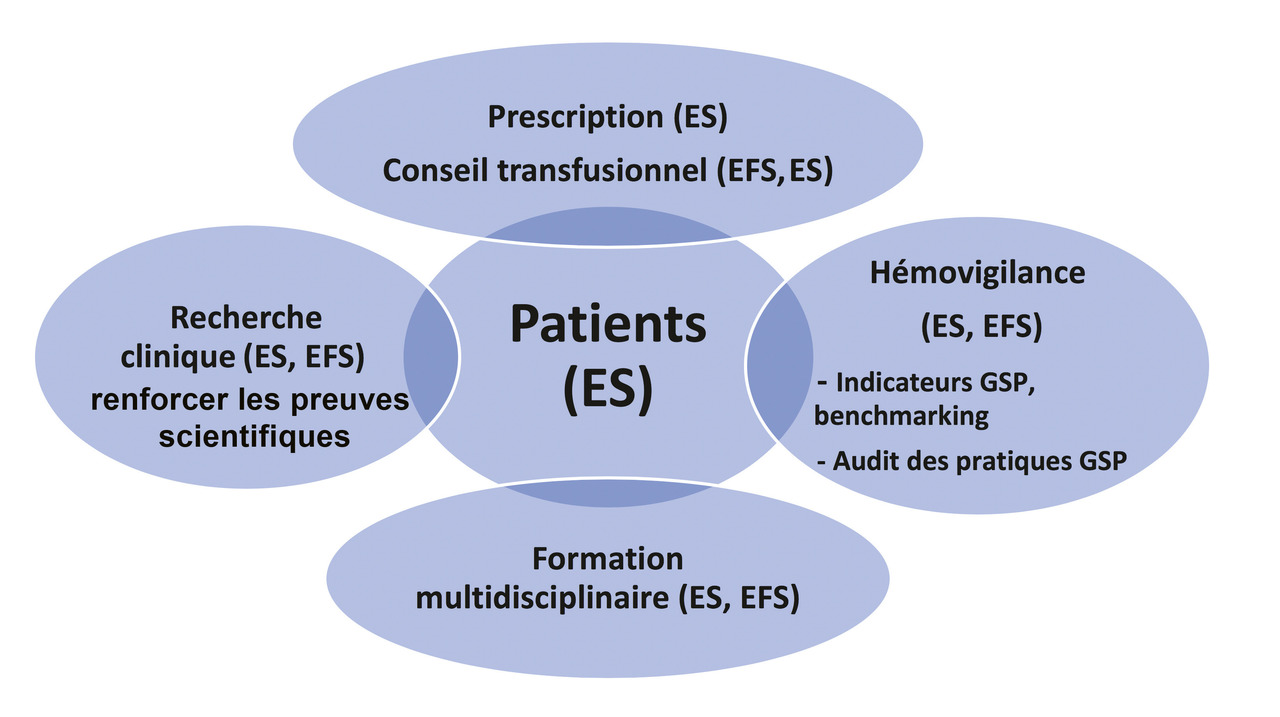
La combinaison des principes de la gestion du sang du patient conduit à évoluer d’une « approche produit » vers une « approche patient » avec des mesures adaptées à l’état de chaque patient, telles que la détection et la prise en charge de l’anémie préopératoire, la réduction des pertes sanguines iatrogènes, la prévention et la correction d’anomalies de l’hémostase et de la coagulation, la pratique de transfusion d’un seul concentré de globules rouges à la fois. Avec les formations nécessaires, cette « approche patient » devrait impliquer des évolutions importantes de la prescription et du conseil transfusionnel (réduction attendue de l’utilisation des concentrés de globules rouges et du plasma thérapeutique), de l’hémovigilance (suivi et benchmarking des pratiques de GSP avec les indicateurs appropriés, audits des pratiques de GSP), et de la recherche clinique en médecine transfusionnelle pour renforcer le niveau de preuves scientifiques. Une collaboration renforcée entre les établissements de santé et l’Établissement français du sang (EFS) serait de nature à favoriser le développement de la gestion du sang en France dans ces trois directions, en soulignant l’importance de la formation multidisciplinaire (v. figure). La publication de recommandations de gestion du sang du patient est attendue prochainement, à la suite d’une conférence de consensus internationale récente (https://icc-pbm.eu/), à laquelle la Société française de transfusion sanguine a contribué, avec la participation de 12 délégués représentant quatre sociétés savantes françaises particulièrement impliquées dans la transfusion sanguine (Société française d’anesthésie et de réanimation, Société de réanimation de langue française, Société française d’hématologie, Société francophone de greffe de moelle et de thérapie cellulaire).
Les politiques restrictives de transfusion, concernant la gestion du sang pour le patient, reposent sur des essais cliniques contrôlés ayant comparé des patients recevant des transfusions de concentrés de globules rouges avec un seuil d’hémoglobine plus haut (9-10 g/dL ; stratégies libérales) ou plus bas (7-8 g/dL ; stratégies restrictives). La méta-analyse la plus récente, intégrant les résultats de 37 essais cliniques ayant inclus 19 049 patients,2 a montré, pour les patients ne souffrant pas d’insuffisance coronarienne sous-jacente, l’absence de différence significative entre les deux stratégies pour la mortalité à 30 jours et pour la morbidité. En dehors des patients insuffisants coronaires, pour lesquels d’autres études sont nécessaires, la stratégie restrictive de transfusion de concentrés de globules rouges avec un seuil d’hémoglobine entre 7 et 8 g/dL apparaît donc globalement sûre et permet de réduire notablement l’utilisation de ces produits. Naturellement, le taux d’hémoglobine ne peut être qu’un guide utile à la décision de transfuser, qui doit toujours impliquer une évaluation clinique individuelle.
Les alternatives à la transfusion, concernant la gestion du propre sang du patient, sont fondées sur trois piliers : optimiser les propres réserves de sang du patient (volume sanguin et masse de globules rouges), minimiser les pertes sanguines, optimiser la tolérance du patient à l’anémie (v. tableau). Ces principes peuvent aisément être étendus à d’autres indications cliniques de la transfusion.
La combinaison des principes de la gestion du sang du patient conduit à évoluer d’une « approche produit » vers une « approche patient » avec des mesures adaptées à l’état de chaque patient, telles que la détection et la prise en charge de l’anémie préopératoire, la réduction des pertes sanguines iatrogènes, la prévention et la correction d’anomalies de l’hémostase et de la coagulation, la pratique de transfusion d’un seul concentré de globules rouges à la fois. Avec les formations nécessaires, cette « approche patient » devrait impliquer des évolutions importantes de la prescription et du conseil transfusionnel (réduction attendue de l’utilisation des concentrés de globules rouges et du plasma thérapeutique), de l’hémovigilance (suivi et benchmarking des pratiques de GSP avec les indicateurs appropriés, audits des pratiques de GSP), et de la recherche clinique en médecine transfusionnelle pour renforcer le niveau de preuves scientifiques. Une collaboration renforcée entre les établissements de santé et l’Établissement français du sang (EFS) serait de nature à favoriser le développement de la gestion du sang en France dans ces trois directions, en soulignant l’importance de la formation multidisciplinaire (v. figure). La publication de recommandations de gestion du sang du patient est attendue prochainement, à la suite d’une conférence de consensus internationale récente (https://icc-pbm.eu/), à laquelle la Société française de transfusion sanguine a contribué, avec la participation de 12 délégués représentant quatre sociétés savantes françaises particulièrement impliquées dans la transfusion sanguine (Société française d’anesthésie et de réanimation, Société de réanimation de langue française, Société française d’hématologie, Société francophone de greffe de moelle et de thérapie cellulaire).
Atténuation des agents infectieux
Avec l’objectif de réduire encore le risque de transmission par transfusion d’agents infectieux transmissibles, depuis fin 2017, tous les concentrés de plaquettes délivrés par l’EFS sont sécurisés par l’atténuation des agents pathogènes par un traitement physico-chimique consistant à illuminer les concentrés de plaquettes en solution de conservation aux rayons ultraviolets A en présence d’amotosalène (après traitement, la majorité de l’amotosalène est éliminée). En plus de la destruction des virus enveloppés, des bactéries, et des parasites qui pourraient se trouver dans les produits (malgré la sélection médicale des donneurs et les tests de détection d’agents infectieux pratiqués sur chaque don), le traitement permet également une inactivation des lymphocytes T prévenant la multiplication des lymphocytes présents dans les produits sanguins labiles et évitant la réaction du greffon contre l’hôte. Le traitement étant inefficace contre les virus non enveloppés, les produits sécurisés par cette méthode sont susceptibles de transmettre, entre autres, le virus de l’hépatite E (VHE), à craindre particulièrement pour les patients immunodéprimés. La prévention de la transmission du VHE passe par une détection de l’ARN du virus chez les donneurs, effectuée soit chez tous les donneurs, comme en Angleterre ou aux Pays-Bas, soit sur une partie des donneurs comme en France.3 Ainsi, pour les patients à haut risque, l’EFS met à disposition des produits sanguins labiles (concentrés de plaquettes, de globules rouges et plasmas) étiquetés « VHE négatif », pour lesquels le contrôle de l’absence du génome viral du VHE chez les donneurs a été effectué.
La question d’une altération possible de l’efficacité hémostatique des concentrés de plaquettes sécurisés par amotosalène a été posée de manière récurrente. Une étude clinique contrôlée réalisée en France4 a montré qu’elle n’était pas inférieure à celle des concentrés de plaquettes en solution de conservation mais non traités par amotosalène (utilisés en France avant les concentrés de plaquettes inactivés). Les règles de prescription et d’utilisation des concentrés de plaquettes sécurisés par amotosalène restent donc inchangées par rapport aux concentrés non viro-atténués utilisés antérieurement.
Concernant les plasmas thérapeutiques et leur sécuri- sation vis-à-vis des agents transmissibles, les cliniciens en France ont aujourd’hui le choix entre trois produits : le plasma frais congelé sécurisé par quarantaine, le plasma frais congelé sécurisé par atténuation d’agents pathogènes par amotosalène et l’Octaplas sécurisé par atténuation d’agents pathogènes par solvant et détergent. Les deux premiers sont distribués par l’EFS et le troisième par les pharmacies hospitalières, du fait du statut de médicament dérivé du sang conféré en 2015 à ce produit.5 À ce jour, il n’existe pas d’argument scientifique conduisant à recommander un plasma par rapport à un autre. La traçabilité et le signalement des effets indésirables du plasma sécurisé par solvant-détergent relèvent à la fois de la pharmacovigilance, en raison de son statut de médicament, et de l’hémovigilance, en raison de son caractère de produit transfusionnel.
La question d’une altération possible de l’efficacité hémostatique des concentrés de plaquettes sécurisés par amotosalène a été posée de manière récurrente. Une étude clinique contrôlée réalisée en France4 a montré qu’elle n’était pas inférieure à celle des concentrés de plaquettes en solution de conservation mais non traités par amotosalène (utilisés en France avant les concentrés de plaquettes inactivés). Les règles de prescription et d’utilisation des concentrés de plaquettes sécurisés par amotosalène restent donc inchangées par rapport aux concentrés non viro-atténués utilisés antérieurement.
Concernant les plasmas thérapeutiques et leur sécuri- sation vis-à-vis des agents transmissibles, les cliniciens en France ont aujourd’hui le choix entre trois produits : le plasma frais congelé sécurisé par quarantaine, le plasma frais congelé sécurisé par atténuation d’agents pathogènes par amotosalène et l’Octaplas sécurisé par atténuation d’agents pathogènes par solvant et détergent. Les deux premiers sont distribués par l’EFS et le troisième par les pharmacies hospitalières, du fait du statut de médicament dérivé du sang conféré en 2015 à ce produit.5 À ce jour, il n’existe pas d’argument scientifique conduisant à recommander un plasma par rapport à un autre. La traçabilité et le signalement des effets indésirables du plasma sécurisé par solvant-détergent relèvent à la fois de la pharmacovigilance, en raison de son statut de médicament, et de l’hémovigilance, en raison de son caractère de produit transfusionnel.
Pratiques de transfusion massive
Depuis longtemps, de nombreuses expériences ont permis de suspecter le rôle bénéfique de l’administration concomitante de plasma thérapeutique et de concentrés de globules rouges chez les blessés ayant un choc hémorragique dans des situations de traumatologie en milieu civil ou militaire. Une étude clinique contrôlée a permis de comparer chez des patients ayant un traumatisme grave et des saignements majeurs l’administration de plasma, de plaquettes et de globules rouges dans un ratio de 1-1-1 par rapport à un ratio de 1-1-2.6 Si aucune différence significative de mortalité n’a été observée à 24 heures ou à 30 jours, une hémostase a été obtenue chez plus de patients du groupe « 1-1-1 », et moins de décès à 24 heures par exsanguination ont été observés dans ce groupe. L’apport rapide des trois produits est considéré aujourd’hui comme un standard thérapeutique pour la transfusion massive chez les patients en état de choc hémorragique sévère. Le plasma thérapeutique étant devenu dans ces situations un produit d’urgence vitale, des adaptations se sont révélées nécessaires pour permettre sa délivrance en urgence. Il s’agit principalement de la mise à disposition de plasma frais congelé prédécongelé (pour éliminer le temps de la décongélation) et de la mise à disposition de plasma lyophilisé (PLYO). Ce plasma est préparé par le centre de transfusion sanguine des armées par lyophilisation à partir d’un mélange de plasmas frais congelés sécurisés vis-à-vis des agents pathogènes (par amotosalène). Le mélange est préparé à partir de plasmas provenant de 10 donneurs au maximum, de groupes sanguins A, B et AB, exempts d’anticorps immuns anti-A ou anti-B, et mélangés dans des proportions choisies pour obtenir un plasma à usage universel pour le groupe sanguin ABO. Ses conditions de conservation, moins contraignantes, et sa reconstitution rapide devraient permettre de faciliter son usage en préhospitalier, après une étude clinique en secteur civil en cours, destinée à préciser ses indications dans la prise en charge très précoce des hémorragies graves.
1. Folléa G. Gestion du sang du patient et pour le patient. Transfus Clin Biol 2016;23:175-84.
2. Carson JL, Stanworth SJ, Alexander JH, et al. Clinical trials evaluating red blood cell transfusion thresholds: An updated systematic review and with additional focus on patients with cardiovascular disease. Am Heart J 2018;200:96-101.
3. Domanovic D, Tedder R, Blümel J, et al. Hepatitis E and blood donation safety in selected European countries: a shift to screening? Euro Surveill 2017;22.pii :30514.
4. Garban F, Guyard A, Labussière H, et al. Comparison of the hemostatic efficacy of pathogen-reduced platelets vs untreated platelets in patients with thrombocytopenia and malignant hematologic diseases: a randomized clinical trial. JAMA Oncol 2018;4:468-75.
5. Djoudi R. Plasma : produit sanguin ou médicament ? Rev Prat 2018;68:487-91.
6. Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma. The PROPPR randomized clinical trial. JAMA 2015;313:471-82 .
Tableau. D’après la réf. 1.
Tableau. D’après la réf. 1.
Références
1. Folléa G. Gestion du sang du patient et pour le patient. Transfus Clin Biol 2016;23:175-84.
2. Carson JL, Stanworth SJ, Alexander JH, et al. Clinical trials evaluating red blood cell transfusion thresholds: An updated systematic review and with additional focus on patients with cardiovascular disease. Am Heart J 2018;200:96-101.
3. Domanovic D, Tedder R, Blümel J, et al. Hepatitis E and blood donation safety in selected European countries: a shift to screening? Euro Surveill 2017;22.pii :30514.
4. Garban F, Guyard A, Labussière H, et al. Comparison of the hemostatic efficacy of pathogen-reduced platelets vs untreated platelets in patients with thrombocytopenia and malignant hematologic diseases: a randomized clinical trial. JAMA Oncol 2018;4:468-75.
5. Djoudi R. Plasma : produit sanguin ou médicament ? Rev Prat 2018;68:487-91.
6. Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma. The PROPPR randomized clinical trial. JAMA 2015;313:471-82
2. Carson JL, Stanworth SJ, Alexander JH, et al. Clinical trials evaluating red blood cell transfusion thresholds: An updated systematic review and with additional focus on patients with cardiovascular disease. Am Heart J 2018;200:96-101.
3. Domanovic D, Tedder R, Blümel J, et al. Hepatitis E and blood donation safety in selected European countries: a shift to screening? Euro Surveill 2017;22.pii :30514.
4. Garban F, Guyard A, Labussière H, et al. Comparison of the hemostatic efficacy of pathogen-reduced platelets vs untreated platelets in patients with thrombocytopenia and malignant hematologic diseases: a randomized clinical trial. JAMA Oncol 2018;4:468-75.
5. Djoudi R. Plasma : produit sanguin ou médicament ? Rev Prat 2018;68:487-91.
6. Holcomb JB, Tilley BC, Baraniuk S, et al. Transfusion of plasma, platelets, and red blood cells in a 1:1:1 vs a 1:1:2 ratio and mortality in patients with severe trauma. The PROPPR randomized clinical trial. JAMA 2015;313:471-82