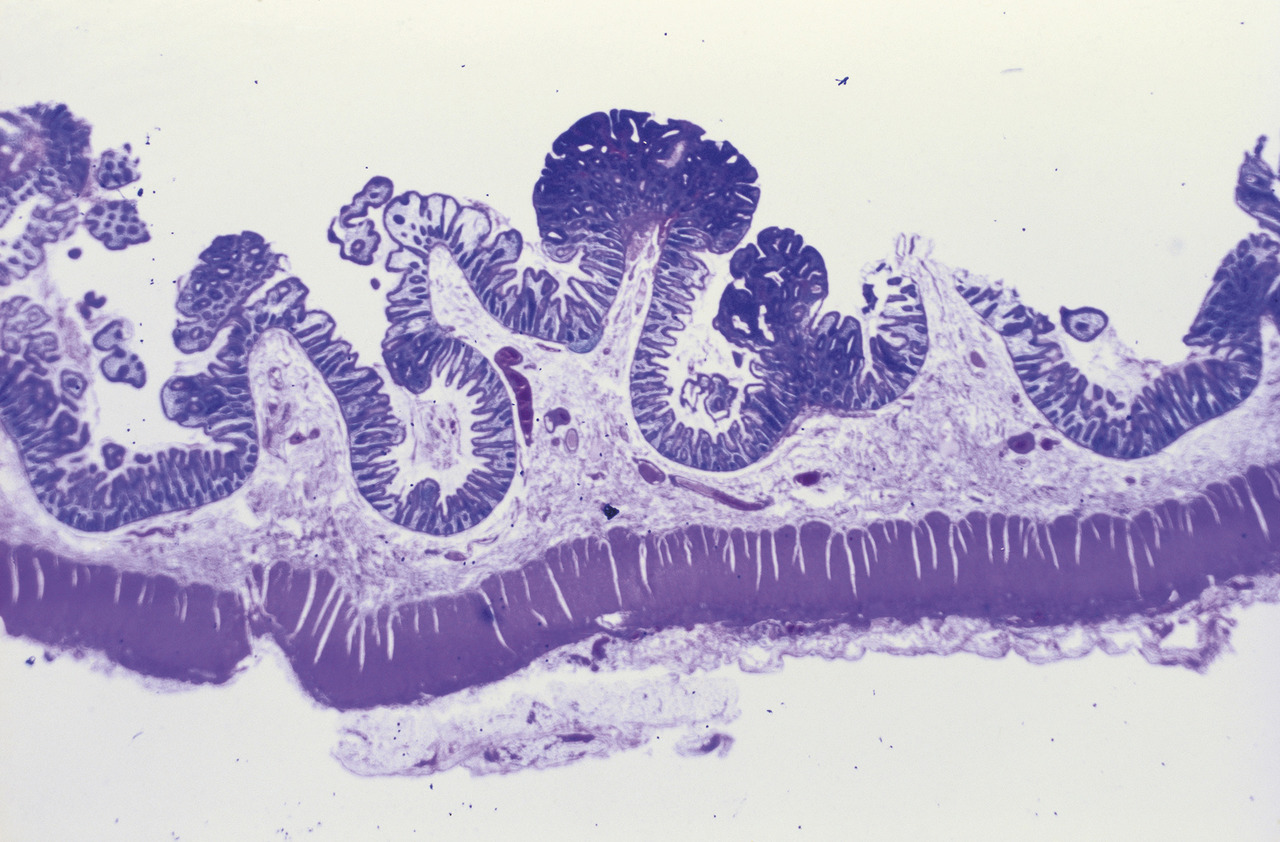
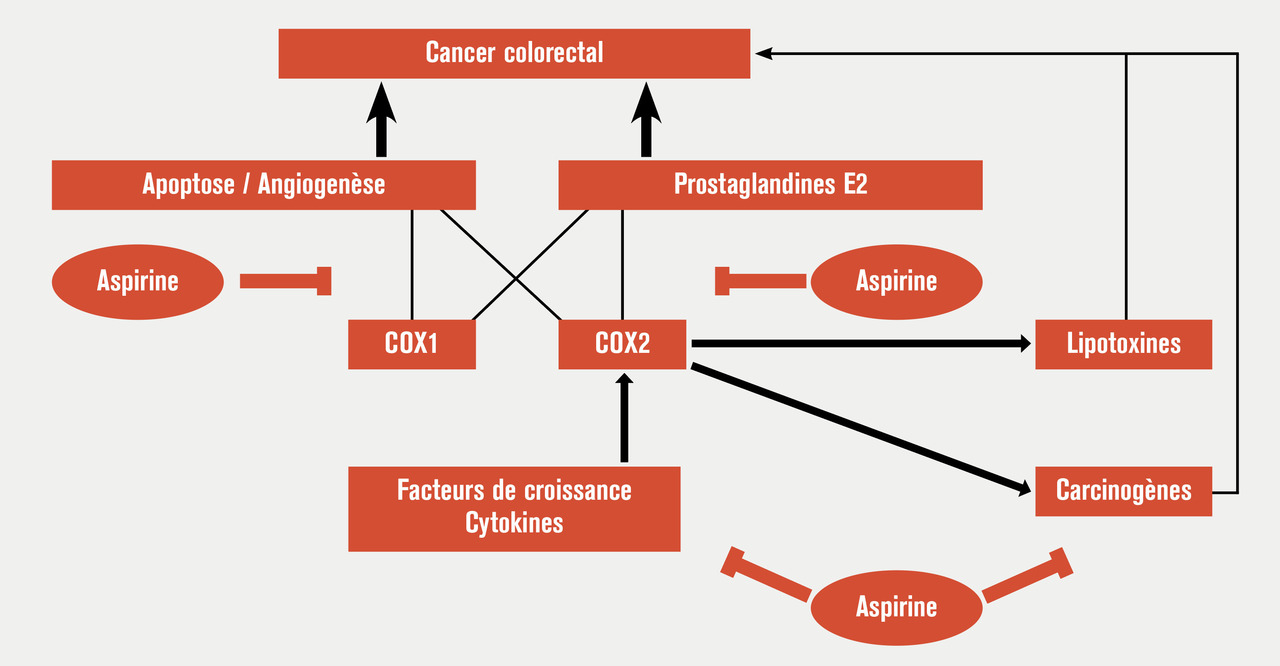
La chimioprévention du cancer colorectal est un enjeu majeur de santé publique pour les années à venir. Parmi les substances actuellement testées, l’aspirine est la substance qui a été la plus étudiée et qui a donné les meilleurs résultats, sans que son usage systématique puisse encore être préconisé.
La chimioprévention du cancer consiste à utiliser des agents chimiques pour prévenir ou inhiber le développement du processus de carci- nogenèse, et cette intervention peut être envisagée à tous ses stades. La chimioprévention peut aussi être utilisée pour tenter de diminuer l’apparition de la récidive tumorale. Parmi les très nombreux agents candidats en cours d’évaluation, nous ne traiterons que de ceux déjà bien évalués chez l’homme.
Chimioprévention : concepts et méthodes
Les composés administrés au long cours doivent être efficaces tout en ayant une toxicité minime et un coût acceptable pour pouvoir être largement utilisés. Le choix de la population cible est important. Le traitement à long terme d’une population à risque standard expose de très nombreux patients aux éventuels effets indésirables du produit pour un bénéfice limité (faible nombre de cancers attendus) tout en entraînant un coût important. Le traitement d’une population à risque élevé est plus légitime. Le dévelop- pement de ces agents repose sur des bases classiques : phase I appréciant la toxicité et la pharmacodynamie ; phase II avec études randomisées en double aveugle évaluant l’efficacité sur des marqueurs intermédiaires corrélés à l’apparition des tumeurs ; puis phase III avec des études randomisées en double aveugle évaluant l’efficacité réelle du produit sur l’apparition ou la récidive des tumeurs. L’approche la plus généralement retenue consiste à évaluer l’effet de l’agent testé chez des patients ayant des adénomes coliques réséqués et à haut risque de récidive ou chez des patients opérés d’un cancer colorectal de bon pronostic. Une fois prouvée l’efficacité d’un agent, il reste à en apprécier l’intérêt réel. En effet, le bénéfice « vrai » doit être apprécié en fonction de l’efficacité du produit et de ses éventuels effets indésirables mais aussi en tenant compte de l’effet protecteur lié à la nécessaire surveillance endoscopique.
Polypose adénomateuse familiale
Le sulindac (Arthrocine) administré par voie orale à la dose de 100 à 400 mg par jour entraîne une diminution du nombre et de la taille des polypes coliques chez les patients atteints de polypose adénomateuse familiale. Son effet n’est que suspensif et après l’arrêt du traitement les polypes coliques réapparaissent en quelques mois. Toutefois, ces derniers régres- sent à nouveau si le traitement est repris. Quelques cas de cancer du rectum ont été observés chez des patients colectomisés traités par sulindac malgré une surveillance optimale. Ces observations incitent à la prudence. Par ailleurs, le sulindac n’est pas efficace sur l’apparition des premiers polypes coliques chez les jeunes patients ayant une atteinte génotypique caractérisée avant l’apparition des premières manifestations phénotypiques.1 L’efficacité du sulindac sur le développement des adénomes duodénaux, bien que suggérée par quelques observations, n’est pas démontrée.
Le célécoxib (Celebrex) administré par voie orale à la dose de 800 mg par jour entraîne une diminution du nombre et de la surface totale des poly- pes au niveau du duodénum ou de la muqueuse rectale résiduelle après colectomie chez l’adulte. Cet effet est aussi observé chez l’enfant à la dose de 16 mg/kg. L’utilisation d’une association D,L-alpha-difluorométhylornithine (DFM0, v. infra) et célécoxib ne semble pas plus efficace que le célécoxib seul.2 Le rofécoxib par voie orale à la dose de 25 mg par jour entraîne une diminution du nombre de polypes au niveau du réservoir rectal restant après chirurgie chez l’adulte. Quelques cas de patients ayant une polypose atténuée, refusant la colectomie, traités par sulindac ou par coxib et régulièrement surveillés par endoscopie avec polypectomies itératives ont été rapportés.
L’aspirine, administrée à la dose de 600 mg par jour, diminue la taille des polypes du rectum et du sigmoïde, mais ne modifie pas significativement leur nombre chez des patients surveillés avant colectomie.3
L’acide icosapentaénoïque (EPA), un acide gras poly-insaturé faisant partie de la famille des oméga 3, administré à la dose de 2 g par jour, diminuerait le nombre de polypes.4 Il existe un produit disponible à la pharmacopée contenant environ 500 mg d’EPA par gélule. L’effet de la supplémentation par EPA (2 g/j) n’a pas été confirmé chez des patients ayant des adénomes hors polypose.5 Une nouvelle forme d’EPA (TP-252), plus stable, semble prometteuse, mais n’est à ce jour qu’au stade de l’évaluation préclinique.6 Enfin, un effet favorable de l’association curcumine-quercétine (480 mg et 20 mg) administrée par voie orale 3 fois par jour a été rapporté dans une courte série ouverte.7
Le célécoxib (Celebrex) administré par voie orale à la dose de 800 mg par jour entraîne une diminution du nombre et de la surface totale des poly- pes au niveau du duodénum ou de la muqueuse rectale résiduelle après colectomie chez l’adulte. Cet effet est aussi observé chez l’enfant à la dose de 16 mg/kg. L’utilisation d’une association D,L-alpha-difluorométhylornithine (DFM0, v. infra) et célécoxib ne semble pas plus efficace que le célécoxib seul.2 Le rofécoxib par voie orale à la dose de 25 mg par jour entraîne une diminution du nombre de polypes au niveau du réservoir rectal restant après chirurgie chez l’adulte. Quelques cas de patients ayant une polypose atténuée, refusant la colectomie, traités par sulindac ou par coxib et régulièrement surveillés par endoscopie avec polypectomies itératives ont été rapportés.
L’aspirine, administrée à la dose de 600 mg par jour, diminue la taille des polypes du rectum et du sigmoïde, mais ne modifie pas significativement leur nombre chez des patients surveillés avant colectomie.3
L’acide icosapentaénoïque (EPA), un acide gras poly-insaturé faisant partie de la famille des oméga 3, administré à la dose de 2 g par jour, diminuerait le nombre de polypes.4 Il existe un produit disponible à la pharmacopée contenant environ 500 mg d’EPA par gélule. L’effet de la supplémentation par EPA (2 g/j) n’a pas été confirmé chez des patients ayant des adénomes hors polypose.5 Une nouvelle forme d’EPA (TP-252), plus stable, semble prometteuse, mais n’est à ce jour qu’au stade de l’évaluation préclinique.6 Enfin, un effet favorable de l’association curcumine-quercétine (480 mg et 20 mg) administrée par voie orale 3 fois par jour a été rapporté dans une courte série ouverte.7
Syndrome de Lynch
Peu d’études interventionnelles ont été réalisées chez les patients ayant un syndrome de Lynch. Dans le travail du consortium CAPP 2, l’aspirine administrée à la dose de 600 mg par jour ne modifiait pas significativement le nombre d’adénomes et/ ou de cancer après 27 mois de traitement. Une diminution significative du nombre de cas de cancer colorectal était cependant observée lorsque le suivi allait au-delà de la 4e année dans le groupe initialement traité par aspirine.8 Un essai multicen- trique anglais (CAPP 3) comparant l’effet de 3 doses (600, 300 et 100 mg) d’aspirine et un essai multicentrique français évaluant 2 doses (100 et 300 mg) d’aspirine versus placebo (AAS-Lynch) devraient préciser davantage l’intérêt de cette approche.
Polypes et cancers sporadiques
AINS et aspirine
De nombreuses études cas-témoin ou de cohorte ont évalué le lien entre prise d’aspirine ou d’anti-inflam- matoires non stéroïdiens (AINS) et survenue d’un cancer colorectal. Ces travaux montrent que la consommation régulière d’aspirine et/ou d’AINS est associée à une diminution du risque de cancer et de polypes colorectaux de l’ordre de 30 %.9 Cet effet (v. figure) est observé aussi bien pour le côlon que pour le rectum, tant chez les hommes que chez les femmes, et qu’il existe ou non des antécédents familiaux. Les études de cohorte suggèrent que cet effet ne serait observé qu’au-delà d’une exposition supérieure à 10 ans. La consommation d’aspirine et/ou d’AINS même régulière et de longue durée mais interrompue depuis plus d’un an ne semble pas associée à une protection. Cette observation suggère que l’effet de l’aspirine et des AINS ne serait que suspensif. Les résultats des essais prospectifs évaluant l’intérêt de l’aspirine en prévention primaire sont divergents.
Un premier essai contrôlé disponible évaluant l’effet de l’aspirine à la dose de 325 mg prise un jour sur deux a été mené chez 22 071 médecins américains volontaires enrôlés dans un essai de prévention des maladies cardiovasculaires. L’incidence des cancers ou des polypes colorectaux n’était pas modifiée après 5 ans de traitement. Un essai évaluant l’effet de l’aspirine à la dose de 100 mg prise un jour sur deux mené chez 38 876 femmes américaines âgées de plus de 45 ans n’a pas mis en évidence d’effet protecteur après 10 ans. Un essai randomisé portant sur 15 460 patients diabétiques suivis pendant 7 ans et randomisés aspirine versus placebo n’a pas montré de différence significative en termes d’incidence sur la survenue de cancers digestifs.10
Au contraire, l’analyse groupée des données de quatre essais de pré- vention primaire à visée vasculaire suggère que la mortalité spécifique par cancer colorectal serait signi- ficativement diminuée, y compris dès la faible dose de 75 mg par jour.11
Les résultats concernant la prévention secondaire sont plus homogènes. L’étude APACC, qui a porté sur 291 patients ayant un antécédent d’adénome recevant quotidiennement 160 ou 300 mg d’acétylsalicylate de lysine ou du placebo pendant 4 ans, a mis en évidence une protection après une année de traitement qui s’estompait cependant au moment du dernier suivi.12 Cet effet protecteur a aussi été observé dans des populations ayant des antécédents personnels d’adénome dans un essai nord-américain et un essai anglais ainsi que chez des patients ayant un antécédent de cancer colorectal opéré et à faible risque de rechute. Une méta-analyse de ces quatre essais ainsi qu’une analyse critique des données disponibles menées selon la méthodologie Cochrane ont confirmé l’effet protecteur de l’aspirine à faible dose. Cependant, deux essais récemment publiés n’ont pas mis en évidence cet effet protecteur.5, 13 L’effet opposé a même été observé dans une étude menée chez des patients américains âgés de plus de 70 ans avec une surmortalité liée aux cancers, incluant les cancers digestifs.14 Ce résultat surprenant peut s’expliquer, selon certains auteurs, par un effet de l’aspirine différent selon le moment de l’exposition (carcinome in situ) ou selon l’âge et les différents facteurs de risque associés.15 Il reste encore à déterminer les groupes de patients susceptibles de bénéficier réellement de cette chimioprévention.
Des essais cliniques prospectifs multicentriques menés chez des sujets ayant eu des adénomes coliques sporadiques réséqués ont été menés à la fois avec le célécoxib (essai PreSAP) et le rofécoxib (essai APPROVE). Ces médicaments sont associés à un moindre risque de récidive des adénomes. Les effets vasculaires délétères associés à la prise du rofécoxib au long cours ont mené à l’arrêt de sa commercialisation, disqualifiant ainsi cette classe de produits dans cette indication.7 L’efficacité du sulindac sur les polypes sporadiques apparaît probable, mais la survenue d’accidents hémorragiques potentiellement sévères ne permet pas d’envisager de stratégies prophylactiques avec ce produit.7 Les traitements par dérivés salicylés comme la salazopyrine ou la mésalazine sont associés à un moindre risque de cancer colique chez les patients atteints de colite inflammatoire ancienne étendue, mais leur effet n’a pas été évalué dans d’autres populations.7
Un premier essai contrôlé disponible évaluant l’effet de l’aspirine à la dose de 325 mg prise un jour sur deux a été mené chez 22 071 médecins américains volontaires enrôlés dans un essai de prévention des maladies cardiovasculaires. L’incidence des cancers ou des polypes colorectaux n’était pas modifiée après 5 ans de traitement. Un essai évaluant l’effet de l’aspirine à la dose de 100 mg prise un jour sur deux mené chez 38 876 femmes américaines âgées de plus de 45 ans n’a pas mis en évidence d’effet protecteur après 10 ans. Un essai randomisé portant sur 15 460 patients diabétiques suivis pendant 7 ans et randomisés aspirine versus placebo n’a pas montré de différence significative en termes d’incidence sur la survenue de cancers digestifs.10
Au contraire, l’analyse groupée des données de quatre essais de pré- vention primaire à visée vasculaire suggère que la mortalité spécifique par cancer colorectal serait signi- ficativement diminuée, y compris dès la faible dose de 75 mg par jour.11
Les résultats concernant la prévention secondaire sont plus homogènes. L’étude APACC, qui a porté sur 291 patients ayant un antécédent d’adénome recevant quotidiennement 160 ou 300 mg d’acétylsalicylate de lysine ou du placebo pendant 4 ans, a mis en évidence une protection après une année de traitement qui s’estompait cependant au moment du dernier suivi.12 Cet effet protecteur a aussi été observé dans des populations ayant des antécédents personnels d’adénome dans un essai nord-américain et un essai anglais ainsi que chez des patients ayant un antécédent de cancer colorectal opéré et à faible risque de rechute. Une méta-analyse de ces quatre essais ainsi qu’une analyse critique des données disponibles menées selon la méthodologie Cochrane ont confirmé l’effet protecteur de l’aspirine à faible dose. Cependant, deux essais récemment publiés n’ont pas mis en évidence cet effet protecteur.5, 13 L’effet opposé a même été observé dans une étude menée chez des patients américains âgés de plus de 70 ans avec une surmortalité liée aux cancers, incluant les cancers digestifs.14 Ce résultat surprenant peut s’expliquer, selon certains auteurs, par un effet de l’aspirine différent selon le moment de l’exposition (carcinome in situ) ou selon l’âge et les différents facteurs de risque associés.15 Il reste encore à déterminer les groupes de patients susceptibles de bénéficier réellement de cette chimioprévention.
Des essais cliniques prospectifs multicentriques menés chez des sujets ayant eu des adénomes coliques sporadiques réséqués ont été menés à la fois avec le célécoxib (essai PreSAP) et le rofécoxib (essai APPROVE). Ces médicaments sont associés à un moindre risque de récidive des adénomes. Les effets vasculaires délétères associés à la prise du rofécoxib au long cours ont mené à l’arrêt de sa commercialisation, disqualifiant ainsi cette classe de produits dans cette indication.7 L’efficacité du sulindac sur les polypes sporadiques apparaît probable, mais la survenue d’accidents hémorragiques potentiellement sévères ne permet pas d’envisager de stratégies prophylactiques avec ce produit.7 Les traitements par dérivés salicylés comme la salazopyrine ou la mésalazine sont associés à un moindre risque de cancer colique chez les patients atteints de colite inflammatoire ancienne étendue, mais leur effet n’a pas été évalué dans d’autres populations.7
Calcium
Une consommation élevée de calcium et/ou de vitamine D semble associée à un moindre risque de cancer et d’adénomes. Plusieurs études portant sur le rôle protecteur éventuel de différents sels de calcium ont été réalisées ou sont en cours chez l’homme. Un effet protecteur d’une supplémentation quotidienne par 3 g de carbonate de calcium (6 comprimés de Calperos) pendant 4 ans sur le risque de récurrence des adénomes est démontré (risque ajusté de 0,81 avec intervalle de confiance de 0,67 à 0,99). Une revue Cochrane récente confirme un effet protecteur de faible ampleur, et l’analyse complémentaire de l’essai nord- américain suggérant une efficacité préférentielle sur la récurrence des adénomes avancés justifie une réévaluation de cette position. Le caractère limité de cet effet, les résultats négatifs d’un travail européen similaire et la possible toxicité urologique, voire vasculaire, de ce type de supplémentation menée au long cours ne permettent pas d’envisager une supplémentation à l’échelle de la population générale. L’usage d’une supplémentation chez les sujets à risque particulier ayant un faible apport alimentaire de calcium peut cependant être discuté.16
Folates
Le rôle protecteur d’une alimentation riche en fruits et légumes frais est bien établi. Une alimentation riche en folates est associée à un moindre risque de cancer et d’adénomes coliques dans les études observationnelles. L’acide folique diminue le nombre de tumeurs chimio-induites chez le rat ainsi que des tumeurs de la souris Min. Chez l’homme, une méta-analyse récente de trois essais n’a révélé aucune différence significative sur la récurrence d’adénomes, voire un risque augmenté.17
Vitamines
Plusieurs études concernant le rôle du β-carotène, des vitamines C et E ont été réalisées. La supplémentation par l’association de 25 mg de β-carotène, 1 g de vitamine C et 400 mg de vitamine E, celle par l’association β-carotène 15 mg, vitamine C 150 mg, vitamine E 75 mg, sélénium 100 μg, et carbonate de calcium 1,6 g ainsi que celle par l’association α-tocophérol 50 mg et β-carotène 20 mg n’ont pas montré d’effet protecteur.7
DFMO
Le DFMO inhibe spécifiquement l’activité de l’ornithine décarboxylase, l’enzyme clé de la synthèse des polyamines qui sont un des éléments essentiels de la régulation de la prolifération cellulaire. Un traitement par DFMO est associé à une moindre récidive des adénomes coliques.7 Ce produit n’est pas commercialisé.
Traitement hormonal substitutif de la ménopause
L’effet protecteur du traitement hormonal substitutif de la ménopause (THS) sur la survenue des cancers coliques et la mortalité liée à ces cancers est suggéré par différentes études cas-témoin comparant l’incidence des cancers colorectaux dans une population de femmes bénéficiant d’un THS avec celle d’une population appariée ne prenant pas ce type de traitement. Des données d’études de cohorte sont aussi disponibles. Certaines de ces études, en particulier les plus récentes, tiennent compte de facteurs confondants potentiels comme l’indice de masse corporelle, l’apport énergéti- que, la consommation d’aspirine ou l’activité physique. La majorité de ces travaux suggère une diminution du risque de cancer colique avec une amplitude de protection variant de 10 à 60 %. Certains de ces travaux suggèrent une augmentation de la protection avec la durée de trai- tement hormonal substitutif.
Acide ursodésoxycholique
La supplémentation en acide urso- désoxycholique serait associée à un taux moindre de cancer colique chez les patients traités au long cours comme les patients atteints de cirrhose biliaire primitive ou de cholangite sclérosante. Cette supplémentation n’a pas d’effet protecteur sur la récidive des adénomes sporadiques.
Autres
De nombreuses autres substances ayant présenté des effets in vitro ou in vivo chez l’animal sont en cours d’évaluation dans des études préliminaires.
Un intérêt réel encore débattu
Cette nouvelle approche nécessite pour son développement des moyens importants. Elle représente un enjeu majeur de santé publique pour les années à venir, récemment identifié comme tel par un groupe de réflexion stratégique. Parmi les substances actuellement testées, l’aspirine est la substance qui a été la plus étudiée et qui a donné les meilleurs résultats, sans que son usage systématique puisse encore être préconisé. V
Références
1. Lynch PM. Pharmacotherapy for inherited colorectal cancer. Expert Opin Pharmacother 2010;11:1101-8.
2. Lynch PM, Burke CA, Phillips R, et al. An international randomised trial of celecoxib versus celecoxib plus difluoromethylornithine in patients with familial adenomatous polyposis. Gut 2016;65:286-95.
3. Burn J, Bishop DT, Chapman PD, et al. A randomized placebo-controlled prevention trial of aspirin and/or resistant starch in young people with familial adenomatous polyposis. Cancer Prev Res 2011;4:655-65.
4. West NJ, Clark SK, Phillips RK, et al. Eicosapentaenoic acid reduces rectal polyp number and size in familial adenomatous polyposis. Gut 2010;59:918-25.
5. Hull MA, Sprange K, Hepburn T, et al. Eicosapentaenoic acid and aspirin, alone and in combination, for the prevention of colorectal adenomas (seAFOod Polyp Prevention trial): a multicentre, randomised, double-blind, placebo-controlled, 2 × 2 factorial trial. Lancet 2018;392:2583-94.
6. Nakanishi M, Hanley MP, Zha R, et al. A novel bioactive derivative of eicosapentaenoic acid (EPA) suppresses intestinal tumor development in ApcΔ14/+ mice. Carcinogenesis 2018;39:429-38.
7. Half E, Arber N. Colon cancer: preventive agents and the present status of chemoprevention. Expert Opin Pharmacother 2009;10:211-9.
8. Burn J, Gerdes AM, Macrae F, et al. Long-term effect of aspirin on cancer risk in carriers of hereditary colorectal cancer: an analysis from the CAPP2 randomised controlled trial. Lancet 2011;378:2081-87.
9. Benamouzig R, Uzzan B. Aspirin to prevent colorectal cancer: time to act? Lancet 2010;376:1713-4.
10. The ASCEND study collaborative group. Effects of aspirin for primary prevention in persons with diabetes mellitus. N Engl J Med 2018;379:1529-39.
11. Cole BF, Logan RF, Halabi S, et al. Aspirin for the chemoprevention of colorectal adenomas: meta-analysis of the randomized trials. J Natl Cancer Inst 2009;101:256-66.
12. Benamouzig R, Uzzan B, Deyra J, et al. Prevention by daily soluble aspirin of colorectal adenoma recurrence: 4-year results of the APACC randomised trial. Gut 2012;61:255-61.
13. Pommergaard HC, Burcharth J, Rosenberg J, Raskov H. Aspirin, calcitriol, and calcium do not prevent adenoma recurrence in a randomized controlled trial. Gastroenterology 2016;150:114-22.
14. McNeil JJ, Nelson MR, Woods RL, et al. Effect of aspirin on all-cause mortality in the healthy elderly. N Engl J Med 2018;379:1519-28.
15. Chan AT, McNeil J. Aspirin and cancer prevention in the elderly: where do we go from here? Gastroenterology 2018. doi:10.1053/j.gastro.2018.11.063
16. Benamouzig R, Chaussade S. Calcium supplementation for preventing colorectal cancer: where do we stand? Lancet 2004;364:1197-9.
17. Fife J, Raniga S, Hider PN, Frizelle FA. Folic acid supplementation and colorectal cancer risk: a meta-analysis: Folic acid supplementation and colorectal cancer risk. Colorectal Disease 2011;13:132-7.
2. Lynch PM, Burke CA, Phillips R, et al. An international randomised trial of celecoxib versus celecoxib plus difluoromethylornithine in patients with familial adenomatous polyposis. Gut 2016;65:286-95.
3. Burn J, Bishop DT, Chapman PD, et al. A randomized placebo-controlled prevention trial of aspirin and/or resistant starch in young people with familial adenomatous polyposis. Cancer Prev Res 2011;4:655-65.
4. West NJ, Clark SK, Phillips RK, et al. Eicosapentaenoic acid reduces rectal polyp number and size in familial adenomatous polyposis. Gut 2010;59:918-25.
5. Hull MA, Sprange K, Hepburn T, et al. Eicosapentaenoic acid and aspirin, alone and in combination, for the prevention of colorectal adenomas (seAFOod Polyp Prevention trial): a multicentre, randomised, double-blind, placebo-controlled, 2 × 2 factorial trial. Lancet 2018;392:2583-94.
6. Nakanishi M, Hanley MP, Zha R, et al. A novel bioactive derivative of eicosapentaenoic acid (EPA) suppresses intestinal tumor development in ApcΔ14/+ mice. Carcinogenesis 2018;39:429-38.
7. Half E, Arber N. Colon cancer: preventive agents and the present status of chemoprevention. Expert Opin Pharmacother 2009;10:211-9.
8. Burn J, Gerdes AM, Macrae F, et al. Long-term effect of aspirin on cancer risk in carriers of hereditary colorectal cancer: an analysis from the CAPP2 randomised controlled trial. Lancet 2011;378:2081-87.
9. Benamouzig R, Uzzan B. Aspirin to prevent colorectal cancer: time to act? Lancet 2010;376:1713-4.
10. The ASCEND study collaborative group. Effects of aspirin for primary prevention in persons with diabetes mellitus. N Engl J Med 2018;379:1529-39.
11. Cole BF, Logan RF, Halabi S, et al. Aspirin for the chemoprevention of colorectal adenomas: meta-analysis of the randomized trials. J Natl Cancer Inst 2009;101:256-66.
12. Benamouzig R, Uzzan B, Deyra J, et al. Prevention by daily soluble aspirin of colorectal adenoma recurrence: 4-year results of the APACC randomised trial. Gut 2012;61:255-61.
13. Pommergaard HC, Burcharth J, Rosenberg J, Raskov H. Aspirin, calcitriol, and calcium do not prevent adenoma recurrence in a randomized controlled trial. Gastroenterology 2016;150:114-22.
14. McNeil JJ, Nelson MR, Woods RL, et al. Effect of aspirin on all-cause mortality in the healthy elderly. N Engl J Med 2018;379:1519-28.
15. Chan AT, McNeil J. Aspirin and cancer prevention in the elderly: where do we go from here? Gastroenterology 2018. doi:10.1053/j.gastro.2018.11.063
16. Benamouzig R, Chaussade S. Calcium supplementation for preventing colorectal cancer: where do we stand? Lancet 2004;364:1197-9.
17. Fife J, Raniga S, Hider PN, Frizelle FA. Folic acid supplementation and colorectal cancer risk: a meta-analysis: Folic acid supplementation and colorectal cancer risk. Colorectal Disease 2011;13:132-7.