C’est une des options thérapeutiques de l’obésité sévère ou morbide. Intégrée à une prise en charge globale, ses résultats sont excellents, mais leur maintien à long terme nécessite un suivi à vie et un changement du mode de vie du patient.
DOSSIER
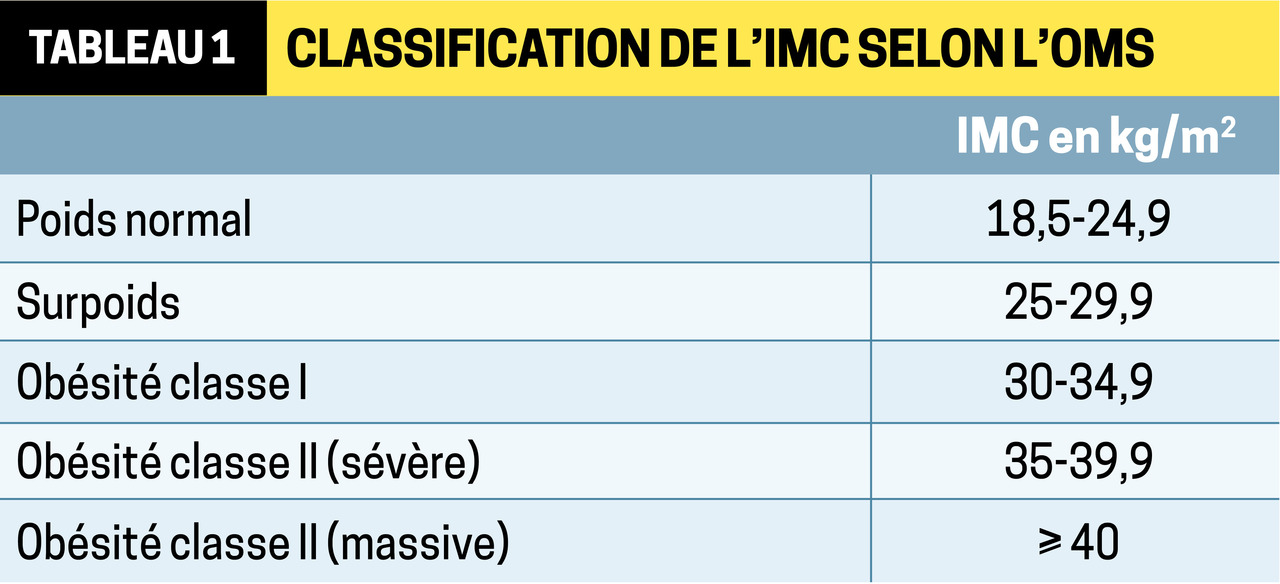
L’obésité, reconnue comme maladie par l’OMS depuis 1998, est définie comme un excès de masse grasse ayant un effet délétère sur la santé. L’indice de masse corporelle (IMC) est un outil anthropométrique simple pour caractériser l’excès pondéral (
Surpoids (IMC > 25 kg/m²) et obésité (IMC > 30 kg/m²) sont en constante augmentation (doublement de la prévalence en Europe entre 2010 et 2030). Ainsi 30 % de la population française devrait être concernée en 2030.
L’obésité est responsable de nombreuses comorbi- dités (notamment le diabète de type 2 [DT2]) et d’une mortalité précoce, directement corrélée à l’IMC.1
Avec la maîtrise des risques médico-chirurgicaux, la chirurgie bariatrique – au sein d’une prise en charge globale – est devenue le traitement de référence des formes sévères (IMC ≥ 35 kg/m²) et morbides (IMC ≥ 40 kg/m²) : actuellement, 500 000 patients ont été opérés en France, soit quasiment 1 % de la population.2
Son expansion au cours de ces 3 dernières décennies3 est liée à plusieurs facteurs :
– les résultats au long cours ont montré sa supério- rité, toutes interventions confondues, versus une prise en charge médicale exclusive dans l’obésité compliquée ou non de DT2 ;3
– la standardisation des procédures, réalisées sous cœlioscopie dans des centres experts, a fait baisser de façon significative la morbi-mortalité postopératoire et homogénéisé les critères d’efficacité.
Parcours clinique d’un candidat
La première consultation doit être assurée par un chirurgien ou un médecin expérimenté. Le délai entre celle-ci et l’acte chirurgical ne peut être inférieur à 6 mois. L’obésité étant une maladie complexe, la préparation à l’intervention requiert une équipe multidisciplinaire experte : chirurgien, praticien spécialiste de cette affection, diététicien(ne), psychiatre ou psychologue et anesthésiste-réanimateur, toujours en lien avec le médecin traitant.
Le patient peut se référer à un praticien coordinateur. De multiples consultations sont programmées afin d’appréhender toutes les facettes de sa pathologie. Celles d’endocrinologie-nutrition visent à dépister des étiologies organiques ou génétiques (qui peuvent contre-indiquer la procédure) et traiter les éventuelles comorbidités.
La prise en charge par un(e) psychologue et un(une) diététicien(ne) a pour objet d’éliminer des troubles sévères du comportement alimentaire et de travailler sur l’estime de soi et l’image du corps.
Plusieurs explorations sont pratiquées :
–biologie : bilan nutritionnel et vitaminique complet, lipidique, hépatique, d’hémostase, glycémie, NFS, test de grossesse ;
– fibroscopie œsogastroduodénale : pour identifier une lésion gastrique, des signes d’hypertension portale, une hernie hiatale, une œsophagite peptique ou un endobrachyœsophage ; on pratique systématiquement des biopsies antrales, angulaires et fundiques pour exclure une infection à Helicobacter pylori (à éradiquer en préopératoire) ;
– échographie abdominale : à la recherche d’une lithiase vésiculaire, d’une hépatomégalie ou d’une tumeur hépatique ;
– polysomnographie et EFR : pour détecter et appareiller un syndrome d’apnées-hypopnées obstructives du sommeil (SAHOS) et dépister un trouble ventilatoire lié à l’obésité.
Au terme de l’évaluation globale, la décision finale est prise en réunion de concertation pluridisciplinaire. Son rôle est de garantir que toutes les conditions médicales préalables à l’intervention sont bien réunies4 et notamment que le patient a compris les enjeux et les risques.
L’information du malade à chaque étape est primordiale, pour qu’il soit acteur de son parcours (détails sur les interventions, adoption des règles hygiénodiététiques à maintenir en postopératoire ; risque de reprise pondérale à moyen et long terme). Enfin, il est capital que le patient ait intégré la nécessité d’un suivi à vie, pour limiter les complications médico-chirurgicales et maintenir dans le temps la perte pondérale et les autres bénéfices (réduction des comorbidités).
Pour quels patients ?
Les indications sont définies par la HAS4 (encadré 1). L’IMC retenu lors de la décision en RCP peut être l’indice actuel ou sa valeur maximale à condition qu’elle soit documentée. Si l’IMC devient inférieur au seuil requis pour envisager la chirurgie (35 kg/m²) grâce à une prise en charge médicale multidisciplinaire, la chirurgie n’est pas contre-indiquée ; cela est même un facteur prédictif de succès. Chez les patients d’origine asiatique, les seuils d’IMC sont réduits de 2,5 points. Il n’y a pas de limite d’âge, mais les bénéfices et les risques chez les plus de 60 ans doivent être discutés et l’indication opératoire posée au cas par cas en fonction du niveau d’activité physique et des antécédents. Les indications pédiatriques, très limitées, ne sont pas abordées ici.
Quatre options
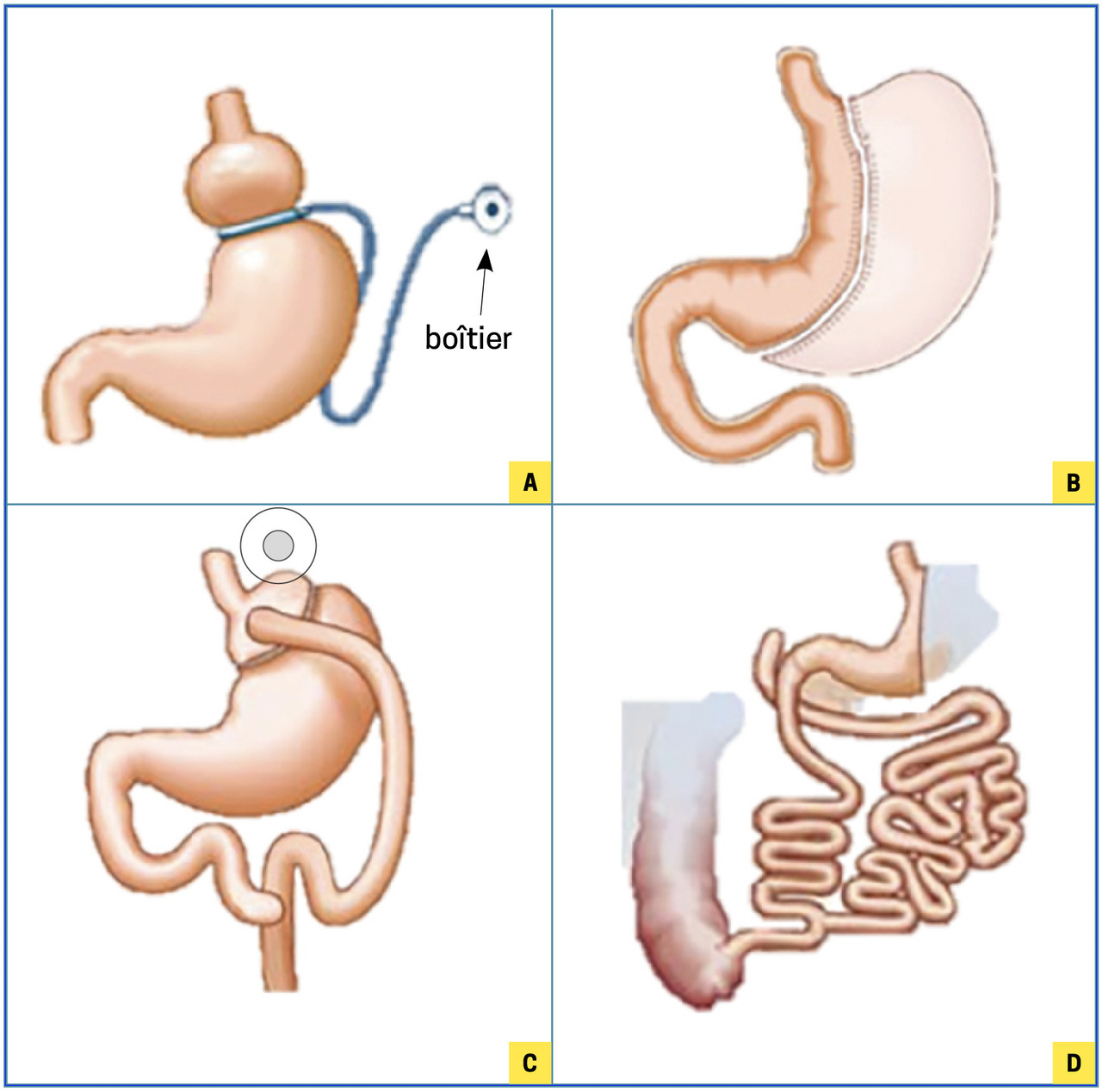
Restrictif, l’anneau gastrique ajustable (AGA) consiste à créer un petit compartiment gastrique (15-20 cc) par la mise en place d’un anneau gonflable autour de la partie proximale de l’estomac (figure). La pression exercée, et donc la taille de la lumière gastrique, est ajustée en fonction de la tolérance alimentaire via un boîtier placé sous la peau et relié à l’anneau par une tubulure. L’objectif est de ralentir le passage des aliments dans l’estomac et d’entraîner une satiété plus rapide. Les indications ont diminué en raison de résultats inconstants à long terme et d’effets indésirables (blocage, régurgitations, vomissements, RGO, épigastralgies). Principal avantage : peu morbide et facilement réversible. L’ablation de l’AGA est réalisée en cas d’insuffisance de perte pondérale, de mauvaise tolérance et/ou de complications (cf. infra).
La gastrectomie longitudinale (GL), technique la plus fréquente (plus de deux tiers des cas), consiste à transformer la poche gastrique en manchon (sleeve). L’estomac est sectionné verticalement à l’aide d’une agrafeuse automatique. Les deux tiers sont ainsi réséqués laissant un tube de 150 cc. Cette intervention est assez simple (par rapport au bypass) et n’entraîne pas de malabsorption, mais elle est irréversible. Efficace à 5 ans, les résultats sur le long terme sont à confirmer.
Le bypass (RYGB) associe restriction, assurée par la confection d’une poche gastrique de 25 à 30 cc, et malabsorption obtenue par un court-circuit gastro- intestinal (anse Roux-en-Y, reliant la poche à la partie moyenne de l’intestin grêle). L’intervention est complexe mais réversible. C’est la technique pour laquelle nous avons le plus de recul.
La dérivation biliopancréatique avec switch duodénal (DBP) est composée d’une GL (restriction) et d’un shunt digestif post-pylorique long responsable d’une malabsorption importante. Cette intervention, qui requiert une équipe médicochirurgicale experte, est très efficace mais elle a des complications nutritionnelles et un fort retentissement fonctionnel (selles quotidiennes nombreuses, importantes, molles, flatulences) limitant sa pratique en routine.
Bypass en oméga (mini-bypass) et Single Anasto- mosis Duodeno-Ileal bypass (SADI) sont en cours d’étude. Enfin, aucun traitement endoscopique n’est recommandé actuellement, y compris la pose d’un ballon intragastrique, dont les résultats sont comparables à ceux de la prise en charge médicale classique (
Quels résultats ?
Selon les travaux du registre suédois,5 à 20 ans, par rapport à une prise en charge médicale exclusive, la chirurgie – tous gestes confondus – entraîne une perte de poids plus importante et durable chez la majorité des patients.
Elle prévient l’apparition du DT2 chez les sujets indemnes de cette maladie, et les complications micro- et macrovasculaires chez les diabétiques. Par ailleurs, elle diminue le risque cardiovasculaire et l’incidence des cancers chez les femmes.
L’ensemble de ces bénéfices concourt à une baisse significative de la mortalité après chirurgie (- 30 % à 16 ans), indépendamment de l’IMC initial.
Efficacité pondérale et métabolique
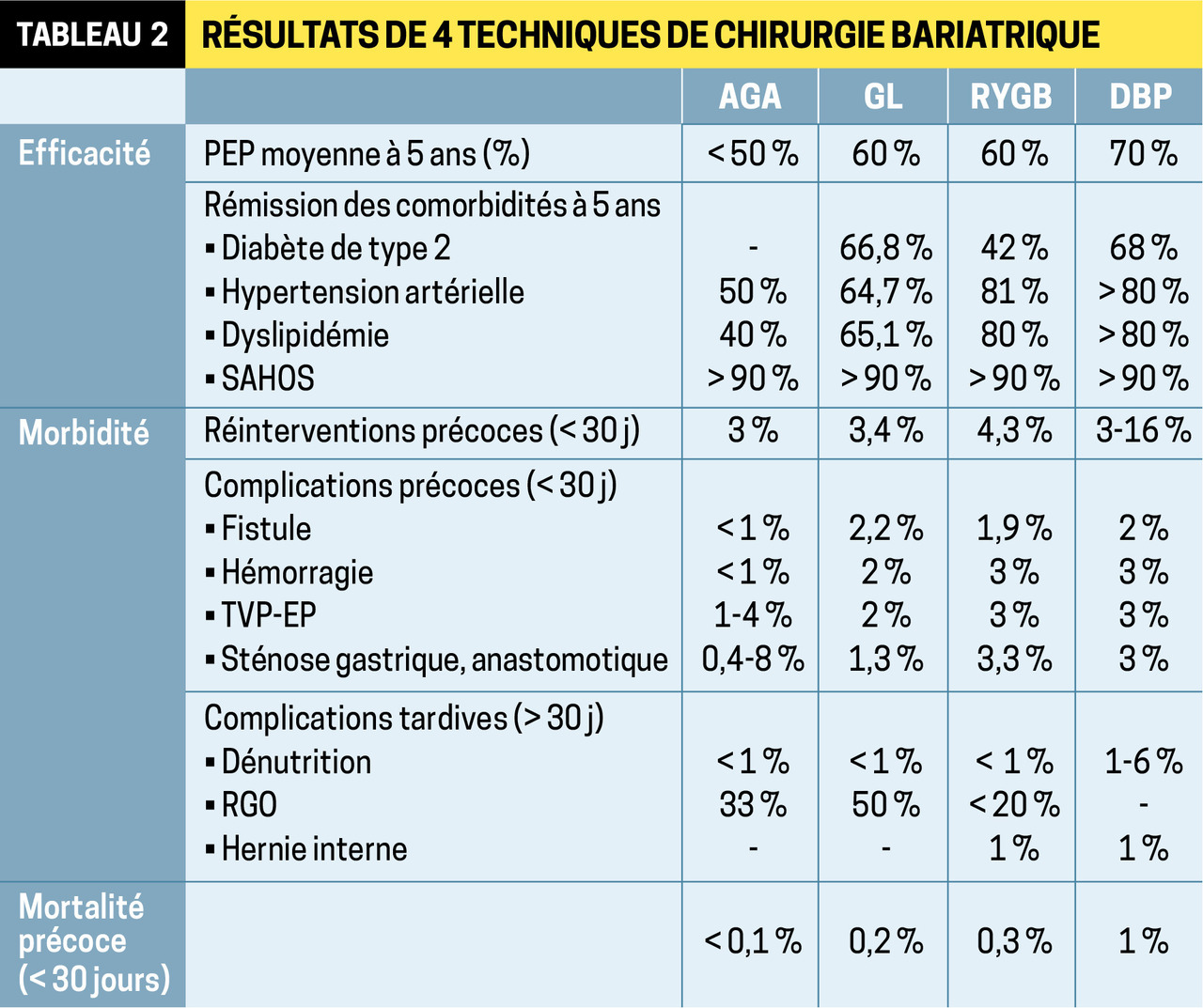
GL et RYGB représentaient, en 2018, 90 % des interventions réalisées, en raison d’une balance bénéfice-risque favorable. L’AGA est la moins invasive mais également la moins efficace, alors que la DBP est la plus performante mais aussi la plus morbide (
Cependant, avec moins d’une vingtaine d’études randomisées comparant au minimum 2 interventions, on ne peut pas conclure, avec un niveau de preuve suffisant, à la supériorité d’une technique par rapport à une autre.6
Le choix dépend de l’expérience de l’équipe, des antécédents médico-chirurgicaux et du souhait du patient.
Indépendamment du type de chirurgie, les bénéfices les plus importants sont observés chez les patients ayant un suivi médico-chirurgical et diététique assidu et pratiquant une activité physique même modérée.
Pour la GL, intervention la plus récente, la majorité des études rapportent une perte d’excès de poids (PEP) > 50 % au-delà de 5 ans, qui se maintiendrait (mais peu de données au-delà de 10 ans). Le RYGB permet d’obtenir une PEP > 50 %, homogène et durable au-delà de 10 ans et un contrôle des différentes comorbidités.
GL et RYGB seraient équivalents tant sur le plan pondéral que métabolique, avec des taux de rémission du DT2 comparables (léger bénéfice du RYGB concernant le contrôle de l’HTA).7, 8
Cependant, dans une étude rétrospective de patients ayant bénéficié 10 ans auparavant d’une GL, le taux de conversion en RYGB était de 33 %, la raison n’étant pas précisée (complication ou inefficacité).
Les résultats de l’AGA au-delà de 5-10 ans sont variables et inférieurs à ceux des 2 techniques précédentes (réinterventions dans plus de 1 cas sur 2 après 5 ans). Cependant, chez les sujets respectant un suivi régulier, les bénéfices sur la perte de poids à 15 ans sont proches de ceux du bypass.
La DBP donne les meilleurs résultats pondéraux avec une PEP > 60 % à long terme et une reprise du poids limitée par rapport aux autres procédures ; la rémission des comorbidités est rapportée dans plus de 65 % des cas.
Toutes les techniques exposent à une reprise pondérale observée généralement après 36 mois. La qualité de la préparation à la chirurgie et du suivi global postopératoire (activité physique, hygiène alimentaire) sont des facteurs prédictifs du maintien des bénéfices à long terme.
Morbidité et mortalité
Après AGA, les complications sont essentiellement mécaniques et liées au matériel : migrations intragastriques de l’anneau (1 %/an), bascule de ce dernier (12,5 %), problèmes de boîtier (8 %). Leur survenue aboutit fréquemment à une ablation à moyen ou long terme (60 % à 5 ans).
Parmi les problèmes chirurgicaux précoces, la fistule après GL ou RYGB est de moins en moins fréquente (2 %) [tableau 2] et sa prise en charge mieux standardisée.
Cependant, elle impose hospitalisation et suivi prolongés, et peut justifier une réintervention (le patient doit en être informé au préalable). Le risque hémorragique est compris entre 1 et 4 % après ces 2 procédures et n’impose une nouvelle chirurgie que si la tolérance clinique n’est pas maintenue.
En cas d’hématome intrapéritonéal de moyenne à grande abondance, un lavage-drainage de la cavité péritonéale est nécessaire pour limiter les douleurs postopératoires et permettre la reprise de l’anticoagulation (cf. infra), l’hémorragie (1-4 %) étant un facteur de risque indépendant d’embolie pulmonaire et la première cause de décès postopératoire précoce.
À plus long terme – 10 ans après GL– un reflux gastroœsophagien est présent chez 57 % des patients. Chez 14 % d’entre eux, un endobrachyœsophage était identifié. Seulement 15-20 % des patients ont un reflux symptomatique postopératoire après RYGB. Ces données renforcent celles suggérées par la récente étude comparant GL et RYGB à 5 ans :8 aggravation du reflux chez 32 % après GL versus 6,3 % après RYGB ; disparition des symptômes dans respectivement 25 et 60 % des cas.
La prévalence du RGO chez les patients obèses est estimée à 35 %. Un tiers des sujets ayant bénéficié d’une GL font un RGO de novo.
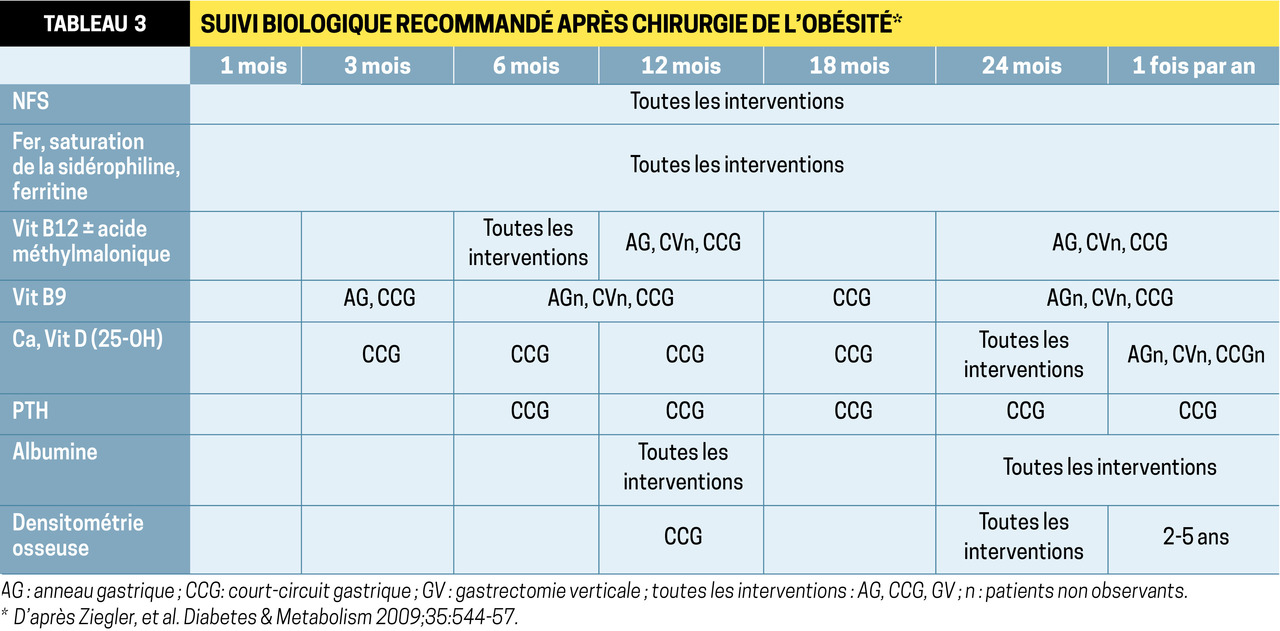
Durant la période de perte pondérale (12-18 mois), tous les patients opérés sont exposés au risque de carences, justifiant une supplémentation, indépendamment de la procédure. Elle doit être prolongée au long cours après bypass et DBP (techniques mal- absorptives). En effet, après DBP, 30 à 50 % des patients sous supplémentation et surveillés ont au minimum une carence en macro-/micronutriments. Des signes fonctionnels digestifs sont fréquents (v. p. 240), impactant la qualité de vie. Une surveillance biologique régulière est donc nécessaire.
La mortalité a considérablement diminué au cours des dernières décennies : elle est évaluée à 0,1 % après GL ou bypass. La première cause est l’embolie pulmonaire, ce qui justifie une anticoagulation prophylactique postopératoire durant 3 semaines.
De multiples carences
Indépendamment de la chirurgie, l’obésité s’accompagne de déficits en micronutriments. Selon les données de la NHANES III (3 831 individus), leur prévalence est accrue chez les sujets dont l’IMC est > 30 kg/m² comparativement aux contrôles en normo-poids (vitamines B9, B12, A, E et D3, sélénium).9 Les carences sont également liées aux usages alimentaires et culinaires des populations étudiées.10
Ainsi, la HAS recommande de doser albumine, hémo- globine, ferritine, coefficient de saturation en fer, transferrine, calcémie, vitamines D, B1, B9 et B12, et de corriger les éventuels déficits avant la chirurgie (
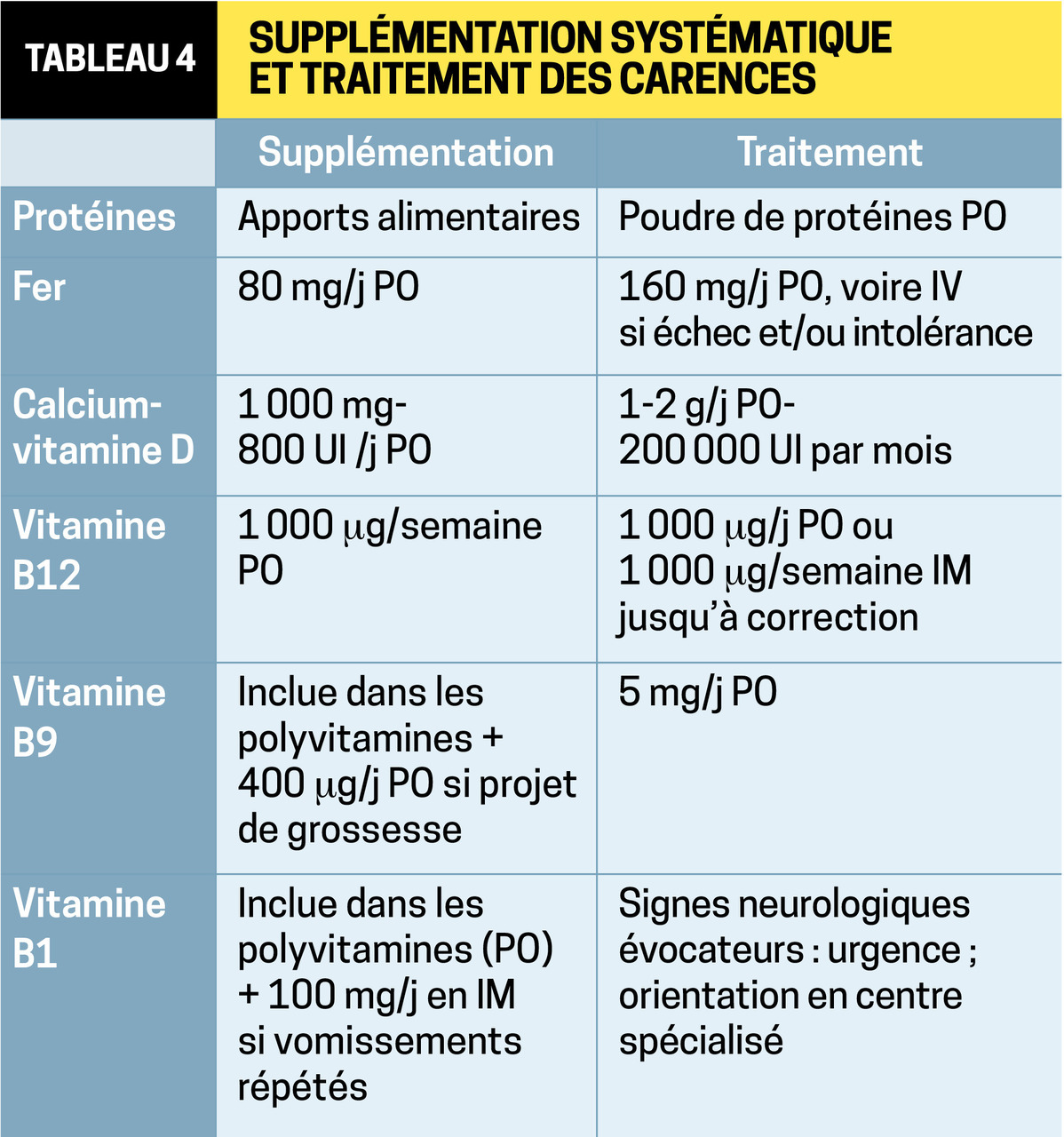
Après l’intervention, la dénutrition protéique est rare et surtout liée aux procédures malabsorptives (5 % en cas de court-circuit gastrique). Il faut toutefois rester vigilant car certains patients développent une aversion aux protéines ou une intolérance. Il est recommandé de consommer 60 à 80 g de protéines par jour et jusqu’à 120 g en cas de DBP.
À cause de la réduction des sécrétions acides et de l’absorption du fer (liée à l’exclusion du duodénum et du jéjunum proximal), la carence martiale est fréquente, surtout en cas de court-circuit gastrique (15 à 50 %) mais aussi après chirurgie restrictive, imposant une substitution systématique. Les patients devenant intolérants à la viande et les femmes non ménopausées sont les plus à risque.
Le déficit en vitamine B12 est d’apparition plus tardive et impose une supplémentation systématique.
Le déficit en B9 est en principe rare car son absorption peut se faire le long de l’intestin grêle et pas seulement au niveau de la portion proximale. Une grande restriction alimentaire peut néanmoins le favoriser. Sa prévalence peut atteindre 38 % après bypass. Dosage et substitution sont nécessaires chez les femmes en âge de procréer. À noter que cette carence peut être le témoin de la non-prise régulière des compléments multivitaminés.
La malabsorption du calcium et de la vitamine D est liée à l’exclusion du duodénum ou à une perte pondérale importante, aggravée par la prise d’anti- acides. Selon les études (pour la plupart rétrospectives), cette carence concerne environ la moitié des patients, en moyenne 2 ans après interventions mal- absorptives, malgré une supplémentation systématique.11 Dans un travail prospectif (176 sujets opérés d’une gastrectomie longitudinale et suivis 5 ans), le déficit en vitamine D persistait malgré une substitution mensuelle. D’où l’importance du suivi et de la titration vitaminique. Préférer le citrate de calcium, mieux assimilé.
L’absorption de la vitamine B1 a lieu au niveau du jéjunum proximal, et ses réserves sont rapidement épuisées au bout de 20 jours en cas de diminution d’apports ou de vomissements. Quelle que soit la procédure chirurgicale, de nombreux cas de béribéri ont été décrits, aussi bien dans sa forme dite humide (ou cardiaque) que dans la forme sèche ou neuropathique avec à l’extrême une encéphalopathie de Gayet-Wernicke. Si la carence est avérée, le complément multivitaminique ne suffit plus, on lui associe la vitamine-élément, Bevitine 250 mg, 1 à 2 cp/j à avaler sans croquer avec un peu d’eau
Pour les vitamines liposolubles A, E, K (absorption liée à celle des graisses), le déficit est plutôt l’apanage des chirurgies purement malabsorptives : dans la DBP, l’incidence est respectivement de 69 %, 4 % et 68 %. En cas de bypass, la carence est rare, et les compléments multivitaminiques suffisent pour l’éviter.
Le zinc et le sélénium étant absorbés au niveau duodéno-jéjunal, et le cuivre au niveau de l’estomac et du duodénum proximal, il est logique de s’attendre à leur carence au décours de toute chirurgie, surtout malabsorptive.12 Pour certains auteurs, la prise de compléments multivitaminés-minéraux pourrait suffire la première année (pas au delà) nécessitant une surveillance biologique régulière et l’adaptation des apports sur le plan alimentaire ou en compléments.
Suivi : à vie !
Idéalement, les patients devraient être suivis tous les 3 mois pendant les 2 premières années, puis annuellement jusqu’à la 5e année postopératoire par l’équipe qui les a pris en charge (incluant le médecin traitant). But : surveiller la cinétique de la perte de poids, prévenir les carences et les traiter, adapter la posologie des traitements en cours, et éviter la reprise pondérale.
Si les contacts avec le chirurgien ou l’endocrinologue-nutritionniste se raréfient au-delà de la première année, les rapports avec le médecin traitant demeurent les plus solides : c’est le principal enseignement d’une étude française sur le suivi à long terme.13 Elle révèle en outre qu’au bout de 5 ans la majorité des patients opérés ne prennent plus les compléments alimentaires. Ainsi, l’implication du médecin traitant s’avère cruciale.
1. Qui sont les candidats à la chirurgie bariatrique ? (réf.4)
Indications :
Après échec du traitement conventionnel de l’obésité (perte de poids insuffisante ou perte d’excès de poids non maintenue) combinant plusieurs approches thérapeutiques bien conduites au cours des 6-12 derniers mois
– IMC ≥ 35 kg/m² avec au moins une pathologie liée à l’obésité : HTA, dyslipidémie, diabète de type 2, atteinte ostéo-articulaire invalidante, antécédent de dépression guérie, SAHOS, troubles respiratoires sévères liés à l’obésité, stéatohépatite non alcoolique (NASH)
– IMC ≥ 40 kg/m² avec ou sans pathologie associée
Contre-indications :
– Âge < 18 ans ou > 60 ans (relative)
– Prise en charge hygiénodiététique de durée < 6 mois
– Absence de prise en charge médicale préalable
– Troubles sévères du comportement alimentaire non stabilisés : boulimie, anorexie, binge eating disorder, sweet eating disorder
– Troubles cognitifs et mentaux sévères non stabilisés sauf avis contraire d’un psychiatre expert en obésité : troubles de l’humeur caractérisés (épisode dépressif majeur, maladie bipolaire) ; schizophrénie ; déficit intellectuel
– Incapacité à se conformer à un suivi médical prolongé
– Absence de soutien familial, garant d’un suivi médical à long terme
– Dépendance à l’alcool et/ou à une substance psychoactive
– Maladie engageant le pronostic vital à court ou moyen terme (cancer)
– Pathologie endocrinienne sous-jacente : hypothyroïdie, Cushing
– MICI
– Contre-indication à l’anesthésie
2. Chirurgie bariatrique chez la femme enceinte
La grossesse est déconseillée la première année post-chirurgie. Dans l’idéal, il faudrait attendre plus de 18 mois afin d’éviter l’écueil des carences vitaminiques et en éléments-traces.
Chez les femmes ayant un anneau gastrique ajustable, il est souhaitable de le desserrer. Les carences les plus fréquentes concernent le fer, l’acide folique, la vitamine B12, le calcium et les vitamines liposolubles, qu’il est recommandé de contrôler avant la conception, puis chaque trimestre, et pendant la lactation.
Supplémentation vitaminique après bypass*
• Polyvitamines enrichies en iode et acide folique : 1 par jour
• Polyvitamines standard : 1 par jour
• Fer oral 80 mg : 2 par jour
• Acide folique 5 mg : 1 par jour (1er trimestre)
• Calcium vitamine D 500 mg/440 UI : 2 par jour
• Vitamine B12 1 000 mg : 1 ampoule tous les 7 à 15 jours
* Recommandations en cours d’actualisation.
Troubles digestifs après chirurgie bariatrique
Leur étude est complexe car ils sont associés à l’obésité morbide, en l’absence de chirurgie digestive. Selon un travail suédois (1 001 sujets, 51 % de femmes, 16 % de patients obèses), l’obésité était associée à un RGO (OR : 2,05), une douleur épigastrique (1,63), des symptômes d’intestin irritable (1,58), une diarrhée (2,2) et à une sensation d’évacuation rectale incomplète (1,64). Une colonisation bactérienne chronique du grêle, retrouvée chez 15 % des obèses morbides,2 pourrait être favorisée par une hypochlorhydrie gastrique liée notamment à la prise d’IPP.Des troubles moteurs de l’œsophage ou de l’estomac sont recherchés en préopératoire, car ils peuvent influencer le choix du type de chirurgie (certains majorant les symptômes). Complications de la chirurgie En préopératoire, le bilan fonctionnel (manométrie œsophagienne, pH-métrie des 24 h) quantifie le reflux acide chez ces patients, qui semblent avoir des symptômes moins importants que les non-obèses. En effet, dans une série française, seuls 25 % se plaignaient de pyrosis et signes supradigestifs, alors que 44 % avaient un RGO pathologique selon la pH-métrie (7 % de dyskinésie en manométrie).3Ce bilan de référence est utile en cas d’apparition après chirurgie d’un tableau de pseudo-achalasie (dysphagie, régurgitations) ou d’aggravation du reflux, avec parfois une exposition acide importante (pourcentage du temps à pH < 4 allant jusqu’à 30 %), notamment après mise en place d’un anneau gastrique.3 Ainsi, ce dernier paraît contre-indiqué en cas de hernie hiatale volumineuse (> 4 cm), de troubles moteurs œsophagiens ou de reflux acide sévère préexistant. La GL induirait également une augmentation significative du reflux : 71 % versus 41 % des patients avant chirurgie (étude française chez 34 patients).À l’inverse, le RYGB serait associé à une amélioration du reflux préexistant et à aucun RGO de novo. Un dumping syndrome – tachycardie, sueurs, hypotension, flush et parfois perte de connaissance ou diarrhée après ingestion de sucres ou de graisses – est courant après bypass (40-45 % des patients) et GL (notamment chez les diabétiques de type 2). Le plus souvent transitoire, il survient surtout la première année suivant la chirurgie. Précoce, il est dû à une inondation hyperosmolaire de l’intestin grêle, tandis qu’une apparition plus tardive suggère des modifications hormonales (glucagon, incrétines). Il faut alors baisser les apports en glucides, augmenter les fibres et fractionner les repas. Des analogues de la somatostatine ont été proposés (50 microgrammes SC 30 min avant chaque repas). Le bypass est associé à un risque accru de syndrome de l’anse borgne, avec pullulation microbienne (cf. infra), diarrhée, flatulences (2 à 20 % des patients). Cependant, la persistance d’une diarrhée est inhabituelle et doit être explorée. Après DBP, le nombre de selles serait plus important et leur consistance plus liquide versus RYGBP.
Références encadré :1. Aro P, et al. Body mass index and chronic unexplained gastrointestinal symptoms: an adult endoscopic population based study. Gut 2005;54:1377-83.
2. Sabate JM, et al. Consequences of Small Intestinal Bacterial Overgrowth in Obese Patients Before and After Bariatric Surgery. Obes Surg 2017;27: 599-605.
3. Merrouche M, et al. Gastro-esophageal reflux and esophageal motility disorders in morbidly obese patients before and after bariatric surgery. Obes Surg 2007;17:894-900.
Pullulation bactérienne du grêle : quelles conséquences ?
La clairance des bactéries dans l’intestin grêle est en partie assurée par les complexes moteurs migrants qui propulsent le bol alimentaire entre les repas. La pullulation serait due à des troubles de la motricité induits par la chirurgie ou à la création d’une anse borgne. Elle peut donner des symptômes digestifs (diarrhée, douleurs abdominales, ballonnements, flatulences) mais aussi une malabsorption des graisses, des carences en vitamines (B12), voire une malnutrition.
Elle pourrait aussi impacter la perte de poids. Une pullulation était retrouvée chez 10 % des patients après anneau gastrique (même ordre qu’en préopératoire : 15,4 %) contre 40 % après RYGB ; 65 % avaient au moins un symptôme digestif ; 15,4 % une diarrhée, 9,5 % une constipation, 17,3 % des douleurs abdominales, 5,8 % des borborygmes, 34,6 % un dumping syndrome, et 7,7 % des vomissements ou régurgitations.
En raison d’une supplémentation vitaminique systématique, le pourcentage de carences n’était pas différent avec ou sans pullulation.2 Malgré des apports caloriques légèrement inférieurs en cas de pullulation, la perte de poids et d’excès de poids étaient moindres, probablement en rapport avec une capacité d’extraction calorique accrue et peut être une modification du microbiote.2
Dans une autre étude rétrospective, une pullulation était retrouvée chez 35 % des patients après RYGB, et la correction des carences en thiamine nécessitait dans certains cas – outre la supplémentation – un antibiotique. Les probiotiques (Lactobacillus) seraient bénéfiques, avec à 3 mois de meilleurs résultats pondéraux (non maintenus à 6 mois).
Référence : Woodard GA, Encarnacion B, Downey JR, et al. Probiotics improve outcomes after Roux-en-Y gastric bypass surgery: a prospective randomized trial. J Gastrointest Surg 2009;13:1198-204.
1. Global BMI Mortality Collaboration; Di Angelantonio E, Bhupathiraju ShN, Wormser D, et al. Body-mass index and all-cause mortality: individual-participant-data meta-analysis of 239 prospective studies in four continents. Lancet 2016;388:776-86.
2. IGAS. Situation de la chirurgie de l’obésité. Janvier 2018
https://bit.ly/2UoAu8A
3. Rubino F, Nathan DM, Eckel RH, et al. Metabolic Surgery in the Treatment Algorithm for Type 2 Diabetes: A Joint Statement by International Diabetes Organizations. Diabetes Care 2016;39:861-77.
4. HAS. Obésité : prise en charge chirurgicale chez l’adulte. Recommandations. Janvier 2009.
5. Sjöström L. Review of the key results from the Swedish Obese Subjects (SOS) trial - a prospective controlled intervention study of bariatric surgery. J Intern Med 2013;273:219-34.
6. Colquitt JL, Pickett K, Loveman E, Frampton GK. Surgery for weight loss in adults. Cochrane Database Syst Rev 2014;8:CD003641.
7. Salminen P, Helmiö M, Ovaska J, et al. Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss at 5 Years Among Patients With Morbid Obesity: The SLEEVEPASS Randomized Clinical Trial. JAMA 2018;319:241-54.
8. Peterli R, Wölnerhanssen BK, Peters T, et al. Effect of Laparoscopic Sleeve Gastrectomy vs Laparoscopic Roux-en-Y Gastric Bypass on Weight Loss in Patients With Morbid Obesity: The SM-BOSS Randomized Clinical Trial. JAMA 2018;319:255-65.
9. Kimmons JE, Blanck HM, Tohill BC, et al. Associations between body mass index and the prevalence of low micronutrient levels among US adults. MedGenMed 2006;8:59.
10. Ernst B, Thurnheer M, Schmid SM, Schultes B. Evidence for the necessity to systematically assess micronutrient status prior to bariatric surgery. Obes Surg 2009;19:66-73.
11. Bloomberg RD, Fleishman A, Nalle JE, Herron DM, Kini S. Nutritional deficiencies following bariatric surgery: what have we learned? Obes Surg 2005;15:145-54.
12. Papamargaritis D, Aasheim ET, Sampson B, le Roux CW. Copper, selenium and zinc levels after bariatric surgery in patients recommended to take multivitamin-mineral supplementation. J Trace Elem Med Biol 2015;31:167-72.
13. Thereaux J, Lesuffleur T, Païta M, et al. Long-term follow-up after bariatric surgery in a national cohort. Br J Surg 2017;104:1362-71.

 Encadrés
Encadrés