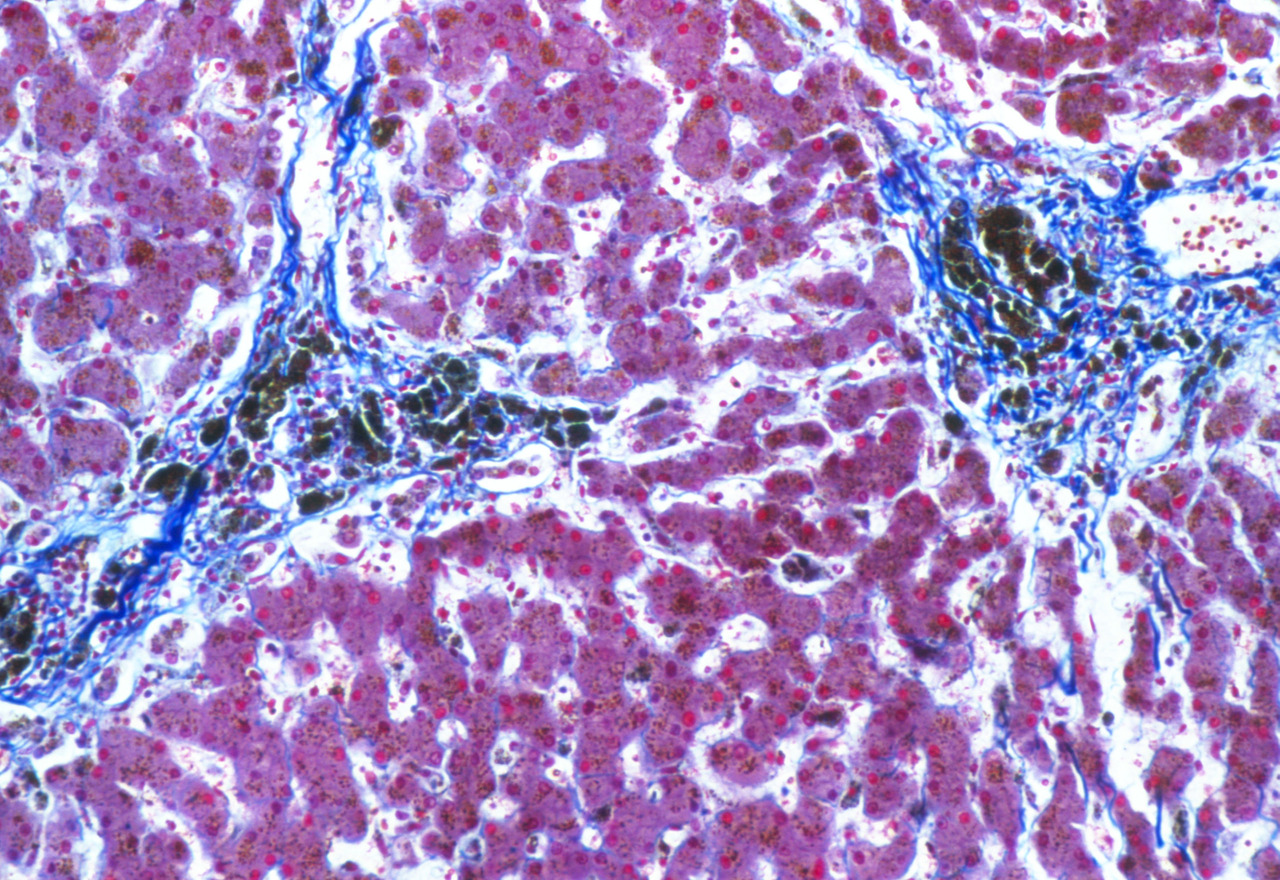
Sans surprise, la 3e place est occupée par la stéato- hépatite non alcoolique (NASH), pathologie émergente liée à « l’épidémie » d’obésité (15 % des Français sont obèses et 30 % en surpoids). De plus en plus courante, elle concernait dans l’Hexagone en 2016 un total de 2,3 millions de patients dont 217 000 avec une fibrose avancée, dans une cohorte de consultants en centre de santé. 1
Évoquer le diagnostic
Est susceptible de développer une cirrhose toute personne ayant un ou plusieurs facteurs de risque :
• un mésusage de l’alcool peut être dépisté rapidement et simplement en consultation, par le questionnaire AUDIT-C (
• des comportements à risque (toxicomanie, partenaires sexuels multiples, tatouage) doivent être recherchés et conduire à un dépistage sérologique des infections virales C et B ;
• un syndrome métabolique, défini par une obésité abdominale (tour de taille > 94 cm chez les hommes et 80 cm chez les femmes) associée à au moins 2 critères parmi : une hypertriglycéridémie (> 1,70 g/L) ; un faible taux d’HDL-cholestérol (< 0,4 g/L chez les hommes et 0,5 g/L chez les femmes) ; une hypertension artérielle ; une hyperglycémie à jeun (> 1 g/L) ou un diabète.
L’obésité abdominale peut être présente chez des personnes ayant un IMC proche de la norme. Sa fréquence augmente avec le surpoids, a fortiori l’obésité : elle est systématique lorsque l’IMC est > 35. Ces patients sont à risque de NAFLD (Non Alcoholic Fatty Liver Disease), définie par une stéatose hépatique en l’absence d’autre cause (alcoolique, médicamenteuse, génétique, bypass…). Elle risque d’évoluer vers une NASH, dont les lésions hépatiques inflammatoires peuvent elles-mêmes entraîner une fibrose, puis une cirrhose.
Lorsque la cirrhose est avancée, le diagnostic devient évident. Le véritable enjeu est le dépistage au stade précoce, lorsqu’elle est bien compensée et asymptomatique, afin d’en prévenir les complications et d’en améliorer le pronostic.
Les symptômes et signes cliniques sont ceux de l’insuffisance hépatocellulaire (encéphalopathie hépatique, ictère, angiomes stellaires) et de l’hypertension portale (œdèmes, ascite, hémorragie digestive, circulation collatérale).
La biologie objective des perturbations du bilan hépatique aspécifiques (cholestase, cytolyse, hyperbilirubinémie), une possible insuffisance rénale (en cas de syndrome hépatorénal), une thrombopénie liée à l’hypersplénisme. La baisse du taux de prothrombine (TP) associée à celle du facteur V signe une insuffisance hépatique sévère.
L’échographie abdominale ou le scanner abdomino- pelvien apportent des arguments non spécifiques en faveur du diagnostic : foie dysmorphique, hétérogène, circulation collatérale, splénomégalie.
Tests non invasifs et dépistage
Des tests non invasifs de fibrose ont été développés pour un dépistage précoce. Ils sont proposés aux populations cibles dont le bilan hépatique est perturbé, pour adresser les patients les plus « suspects » en milieu spécialisé et confirmer le diagnostic. Ces tests comprennent des tests sériques et l’élastométrie (FibroScan) [
Le score APRI, le NAFLD fibrosis score et le FIB-4 sont faciles à évaluer en consultation grâce aux outils électroniques disponibles sur internet (nafldscore.com, www.cregg.org, www.mdcalc.com). Les autres, plus performants, nécessitent une simple prescription sur ordonnance, mais la formule est complexe et oblige à un calcul en laboratoire (rendu très rapidement).
L’élastométrie hépatique (FibroScan) et l’élastométrie couplée à l’échographie utilisent les ultrasons pour mesurer l’élasticité du tissu hépatique, sa dureté et son atténuation ultrasonore, par un appareil dédié. La seconde technique permet en outre de mesurer le CAP (Controlled Attenuation Parameter), marqueur de quantification de la stéatose.
Le résultat des tests est habituellement exprimé par un score allant de F0 (pas de fibrose) à F4 (cirrhose). Lorsqu’il est supérieur à F2, il doit inciter à prendre un avis auprès d’un hépatologue. Ces contrôles peuvent être répétés tous les 1 à 3 ans pour le dépistage et le suivi de la fibrose. L’interprétation de leur résultat tient compte de l’étiologie de la cirrhose, car elle influence leurs paramètres diagnostiques.
Mesurés sur des indicateurs sériques ou clinico- biologiques, ils excluent une cirrhose, avec une valeur prédictive négative de fibrose > 95 % chez les patients alcooliques et > 90 % en cas de NASH. Les plus performants (FibroTest et FibroMètre) sont aussi les plus coûteux et ne sont pas remboursés par l’Assurance maladie dans ces 2 indications. Leur capacité diagnostique est meilleure que ce soit pour exclure ou pour affirmer une cirrhose liée à une hépatite virale B ou C.
L’élastométrie par FibroScan semble être la méthode la plus fiable pour écarter l’hypothèse d’une cirrhose secondaire au virus de l’hépatite C (VHC). Le cut-off (seuil à partir duquel on considère une atteinte cirrhotique) est de 12,5 kPa (infections actives) ou de 9,5 kPa (guéries). Dans la maladie alcoolique, sa performance diagnostique est très bonne chez les patients sevrés. Néanmoins, la consommation excessive d’alcool et l’élévation des transaminases augmentent l’élasticité. Il est donc important d’interpréter le chiffre d’élastométrie à la lumière du bilan biologique et d’une intoxication éthylique sevrée ou non.
Explorations et suivi
– les sérologies virales (VHB, VHC) ; Ag HBs, Ac anti- HBc avec ADN VHB en PCR si positive, Ac anti-VHC et ARN VHC en PCR si positif ;
– la sérologie VIH si VHB ou VHC positive, en raison de la fréquence des comorbidités;
– la sérologie VHD si le patient est porteur de l’antigène HBs ;
– glycémie, cholestérol total, triglycérides, HDL et LDL-cholestérol ;
– ferritinémie (à distance d’un sevrage en alcool) et coefficient de saturation de la transferrine.
En seconde intention, on recherche une origine auto-immune : anticorps antinucléaires, anti-muscles lisses, anti-LKM1, anti-LC1, antimitochondrie, électrophorèse des protéines sériques et dosage pondéral des immunoglobulines. Chez les patients jeunes, un déficit en alpha-1-antitrypsine et une surcharge en cuivre sont également à considérer.
La biologie initiale et de suivi (tous les 6 mois au minimum pour les formes compensées) comprend :
– hémogramme ;
– ionogramme sanguin et créatinine ;
– bilan hépatique (bilirubine totale, ASAT, ALAT, GGT, PAL) ;
– taux de prothombine (TP), international normalized ratio (INR), albumine.
Les examens de routine permettent le calcul du score de Child-Pugh, simple et très utile pour le suivi pronostique de la cirrhose (
L’échographie abdominale avec doppler veineux portal (à mentionner sur l’ordonnance) est à répéter tous les 6 mois pour tous les patients. L’objectif est le dépistage du CHC et la recherche de thrombose porte. Un retard d’un mois dans le diagnostic impacte significativement le pronostic.
En cas de nodule suspect ou de doute sur une thrombose porte, une imagerie injectée (TDM ou IRM) au temps précoce artériel et au temps tardif portal confirme le diagnostic.
La fibroscopie œso-gastro-duodénale (FOGD) dépiste des varices œsophagiennes ou gastriques, permettant de prévenir l’hémorragie digestive par rupture variqueuse. Selon les recommandations Baveno VI sur la prise en charge de l’hypertension portale, il est possible de l’éviter si les 3 critères suivants sont réunis :
– cirrhose compensée ;
– plaquettes > 150 000/mm3 ;
– FibroScan < 20 kPa.
Dans ce cas, la numération plaquettaire et le Fibro- Scan doivent être répétés tous les ans.
Dans le cas contraire, la FOGD est renouvelée tous les 1 à 3 ans pour les cirrhoses Child A, tous les ans pour les Child B ou C (
Un traitement étiologique
Hépatites chroniques virales B et C. L’hépatite C peut aujourd’hui être traitée, avec plus de 90-95 % de chance de succès grâce aux antiviraux directs dont la tolérance est excellente. Ces médicaments sont initiés par l’hépatologue en raison du risque de décompensation en cours de traitement. Des études récentes suggèrent qu’une régression de la fibrose peu avancée est possible chez les patients traités pour le VHC. Toutefois, la cirrhose constituée n’est pas réversible. Le contrôle de la réplication virale B sous analogues nucléosidiques est possible, avec peu de complications.
Diabète et dyslipidémie. L’ensemble des facteurs favorisant la NAFLD et la NASH relève d’une prise en charge spécifique.
Prévenir les complications
– hépatite A (en l’absence d’immunité) ;
– hépatite B (en cas de négativité de l’antigène HBs et des anticorps anti-HBc) ;
– antigrippale annuelle ;
– antipneumococcique (chez l’adulte non vacciné, Prevenar 13 suivi, 2 mois plus tard au moins, de Pneumovax 23).
Hémorragie digestive
La prophylaxie secondaire associe les bêtabloquants à la ligature (ou l’injection de colle) endoscopique des varices.
Ascite
Le traitement des grades 2 ou 3 repose d’abord sur les diurétiques, particulièrement la spironolactone. Le mécanisme de l’ascite fait en effet intervenir une hyperactivation du système rénine-angiotensine- aldostérone. Sa posologie initiale est de 100 mg/j, pouvant être augmentée jusqu’à 400 mg/j par palier de 100 mg en l’absence de réponse thérapeutique (perte de poids inférieur à 2 kg par semaine). En second choix (hyperkaliémie), on recourt au furosémide, introduit à la posologie de 40 mg/j et augmenté par palier de 40 mg s’il est inefficace. La posologie maximale est de 160 mg/j. La perte de poids liée aux diurétiques ne doit pas excéder 0,5 kg/j chez les patients sans œdèmes et 1 kg/j chez les patients avec. Une surveillance ionique et rénale hebdomadaire, puis mensuelle, est requise.
Une fois l’ascite résolue, les diurétiques sont réduits jusqu’à la dose minimale efficace. Enfin, ils sont arrêtés dans les situations suivantes :
– hyponatrémie < 125 mmol/L ;
– hypokaliémie < 3 mmol/L ;
– hyperkaliémie > 6 mmol/L ;
– insuffisance rénale aiguë ;
– crampes sévères.
Le traitement du grade 3 (distension abdominale marquée) associe, en plus du diurétique, une ponction de grand volume.
L’ascite est dite réfractaire en cas d’échec ou d’impossibilité d’utiliser le traitement diurétique (encadré page 740).
Infection de liquide d’ascite (ILA)
Après un premier épisode, une antibioprophylaxie secondaire est nécessaire. Le déremboursement récent de la norfloxacine a conduit à de nouvelles recommandations en faveur de la ciprofloxacine 500 mg/j, du cotrimoxazole ou de la rifaximine, lorsque le patient a un antécédent d’encéphalopathie hépatique.
Une prophylaxie primaire de l’ILA est également justifiée chez les patients ayant une cirrhose avec Child C et liquide d’ascite pauvre en protides (< 15 g/L). elle est stoppée dès que l’ascite disparaît.
Insuffisance rénale
Les premières mesures à prendre sont la suspension des traitements néphrotoxiques (diurétique, bêtabloquants, AINS) et le remplissage par cristalloïdes ou albumine 20 % (en l’absence de cause évidente) afin de restaurer la volémie.
Dans tous les cas, une IRA requiert une prise en charge hospitalière. Lorsqu’elle survient chez un patient décompensé au pronostic péjoratif, elle fait évoquer un syndrome hépatorénal (SHR), qui est une insuffisance rénale fonctionnelle compliquant une cirrhose décompensée. Le SHR est secondaire à une vasodilatation splanchnique liée à l’hypertension portale.
Carcinome hépatocellulaire
Encéphalopathie hépatique
Le lactulose peut être utilisé en traitement curatif ou en prévention secondaire. En cas d’échec, la rifaximine, antibiotique non absorbable, est prescrite.
Quels médicaments éviter ?
Les anti-inflammatoires non stéroïdiens (AINS) augmentent le risque d’insuffisance rénale et d’hyponatrémie, surtout en cas d’ascite et de paracentèse.
Les inhibiteurs de l’enzyme de conversion (IEC), les antagonistes de récepteurs de l’angiotensine 2 (ARA2) et les bloqueurs des récepteurs alpha-1-adrénergiques sont à éviter chez les patients avec ascite en raison de la majoration de la menace d’insuffisance rénale aiguë.
Le traitement par inhibiteurs de la pompe à protons (IPP) au long cours élève le risque d’infection de liquide d’ascite.2 Les indications doivent donc être mesurées, et le bien-fondé de ces médicaments réévalué régulièrement.
L’injection de produit de contraste iodé n’est pas contre-indiquée chez le patient avec fonction rénale préservée, mais doit être utilisée avec prudence, en respectant les mesures préventives.
Des patients dénutris
Les besoins nutritionnels du patient cirrhotique sont de 30 à 35 kcal/kg/j d’apport énergétique, dont 1,2 à 1,5 g/kg/j de protéines (en utilisant le poids sec sans ascite comme référence). Pour y parvenir, il faut s’appuyer sur la prescription de compléments nutritionnels oraux. Il est préférable de fractionner les prises alimentaires et de prévoir systématiquement une collation en fin de soirée pour réduire le jeûne nocturne. En effet, une situation de jeûne « accéléré » avec activation du catabolisme des acides aminés musculaires survient la nuit chez le cirrhotique, les stocks de glycogène étant réduits du fait de la cirrhose et de l’insulinorésistance. Si ces mesures sont insuffisantes, une nutrition entérale est discutée.
Une supplémentation systématique en calcium (1 g/j) et vitamine D (800 UI/j) est recommandée au long cours pour la prévention de l’ostéoporose, dont le risque augmente en cas de cirrhose. Un dépistage par ostéodensitométrie est également préconisé. Une complémentation systématique en vitamine B1, oligo- éléments et polyvitamines est nécessaire si l’intoxication alcoolique est pérenne. Cette dernière ne doit pas être poursuivie au long cours, du fait du risque de surcharge, notamment en vitamine A (hépatotoxicité potentielle).
Le régime sans sel risque de majorer l’anorexie et la dénutrition et il est associé à une mauvaise observance. Par ailleurs, l’efficacité de sa version « stricte » est comparable à celle plus large sur le contrôle de l’ascite. Pour cette raison, une restriction modérée (5 g NaCl/j) est préconisée. Elle est proche des apports recommandés chez le sujet sain par le Programme national nutrition santé (6 g NaCl/j). Au vu du caractère anorexigène de la restriction sodée, il ne faut en aucun cas la prescrire à un patient déjà anorexique. Un régime pauvre en protéines n’est pas indiqué, même en cas d’encéphalopathie, en raison de son caractère cachectisant.
1. Cirrhose : principaux tests non invasifs
Score biologique APRI, développé pour la pathologie alcoolique, calculé par la formule (ASAT x 100/normale de l’ASAT)/plaquettes.
FibroTest, test biologique faisant intervenir le dosage sanguin de 6 marqueurs (alpha-2-globuline, haptoglobine, apolipoprotéine A1, bilirubine totale, GGT, ALAT).
FibroMètre, test clinico-biologique prenant en compte plusieurs paramètres (poids, plaquettes, ASAT, ALAT, ferritine, glycémie, acide hyaluronique, TP).
Le NAFLD fibrosis score est calculé à partir de l’hémogramme, de l’âge, de l’IMC, d’un(e) hyperglycémie/diabète, des ASAT/ALAT, plaquettes et albumine.
Le FIB-4, généré pour la NASH, est évalué à partir de l’hémogramme, de l’âge, des ASAT/ALAT et plaquettes.
2. Check-list de consultation de suivi du patient cirrhotique
Traitement de la cause de la cirrhose
Échographie avec doppler portal (à préciser sur l’ordonnance) tous les 6 mois
Surveillance biologique (hémogramme, bilan hépatique, TP, INR, ionogramme, créatinine), calcul du score de Child-Pugh et MELD tous les 6 mois
Mise à jour des vaccinations (hépatite, grippe, pneumocoques)
Fibroscopie de dépistage de l’hypertension portale et bêtabloquants en prophylaxie primaire si indiqués
Prévenir la dénutrition et les carences avec une collation dans la soirée et une supplémentation systématique en vitamine D et calcium. Éviter les régimes restrictifs
Interdire les anti-inflammatoires non stéroïdiens et évaluer la balance bénéfice-risque des autres médicaments
Se poser la question de la transplantation hépatique en cas de Child-Pugh C ou MELD > 15
L’ascite réfractaire, une complication rare
Laure Elkrief Service d’h&eacx. l.elkrief@chu-tours.fr
L’ascite est le plus souvent contrôlable par le traitement médical. Elle est considérée comme « réfractaire » quand elle persiste ou récidive précocement en dépit d’un régime pauvre en sodium et d’un traitement diurétique maximal, situation rencontrée chez environ 10 % des patients. Dans la majorité des cas, c’est parce qu’elle ne peut être traitée par les diurétiques, en raison des complications induites par ces médicaments. Son diagnostic est clinique et ne peut être posé que chez un malade stable, après 4 semaines d’observation au minimum.
L’ascite réfractaire témoigne d’une maladie hépatique avancée, et ce malgré des paramètres de fonction hépatique (taux de prothrombine et bilirubine plasmatique) souvent peu altérés. Le patient doit donc rapidement être adressé au spécialiste, d’autant que la mortalité de ces malades est élevée à court terme.
Outre le traitement de la cause de la cirrhose et la prévention des autres complications de l’hypertension portale, les paracentèses évacuatrices répétées constituent le traitement de première intention. Elles doivent être associées à un remplissage vasculaire par des perfusions d’albumine intraveineuse (8 g d’albumine à 20 % par litre d’ascite retiré), afin de prévenir les complications post-paracentèse, en particulier l’hyponatrémie et la mortalité.
Le shunt intrahépatique portosystémique transjugulaire (TIPS) permet le plus souvent un contrôle de l’ascite, mais au prix d’un risque accru d’insuffisance hépatocellulaire et d’encéphalopathie hépatique. Le bénéfice du TIPS sur la survie n’est pas établi. Les résultats de cette intervention dépendent largement de l’expertise des centres, tant pour le geste technique que pour la sélection des malades. En effet, une importante proportion d’entre eux présente des contre-indications à cette technique.
La transplantation hépatique demeure ainsi le meilleur traitement, avec une survie > 50 % à 5 ans. Ses principales limitations sont l’accès restreint et la pénurie de greffons.
2. Min YW, Kim KS, Min Bh, et al. Proton pump inhibitor use significantly increases the risk of spontaneous bacterial peritonitis in 1965 patients with cirrhosis and ascites: a propensity score matched cohort study. Aliment Pharmacol Ther 2014;40:695-704.
– Angeli P, Bernardi M, Villanueva C, et al. EASL Clinical Practice Guidelines for the Management of Patients with Decompensated Cirrhosis. J Hepatol 2018;69:406-60.
– Castera L, Friedrich-Rust M, Loomba R. Noninvasive Assessment of Liver Disease in Patients With Nonalcoholic Fatty Liver Disease. Gastroenterology 2019;156:1264-1281.e4.
– Merli M, Berzigotti A, Zelber-Sagi S, et al. EASL Clinical Practice Guidelines on Nutrition in Chronic Liver Disease. J Hepatol 2019;70:172-93.
– Thursz M, Gual A, Lackner C et al. EASL Clinical Practice Guidelines: Management of Alcohol-Related Liver Disease. J Hepatol 2018;69:154-81.
– EASL-ALEH Clinical Practice Guidelines: Non-Invasive Tests for Evaluation of Liver Disease Severity and Prognosis. J Hepatol 2015;63:237-64.
– Lim JK, Flamm SL, Singh S, et al. American Gastroenterological Association Institute Guideline on the Role of Elastography in the Evaluation of Liver Fibrosis. Gastroenterology 2017;152:1536-43.
– De Franchis R. Expanding Consensus in Portal Hypertension. J Hepatol 2015;63:743-52.
– EASL-EASD-EASO Clinical Practice Guidelines for the Management of Non-Alcoholic Fatty Liver Disease. Journal of Hepatol 2016;64:1388-402.
– HAS. Critères diagnostiques et bilan initial de la cirrhose non compliquée. Mai 2019. https://bit.ly/3mogC39
– Club francophone pour l’hypertension portale. Recommandations. https://bit.ly/3ecYNBn

 Encadrés
Encadrés