L’émergence, en 2005, d’un clone spécifique responsable d’épidémies sévères a marqué l’évolution des infections à Clostridioides difficile, bactérie impliquée dans 15 à 25 % des diarrhées associées à l’antibiothérapie. Suite à des avancées majeures, la Société européenne de microbiologie clinique et des maladies infectieuses (ESCMID) a actualisé ses recommandations concernant les traitements et les mesures de prévention.
Découvert en 1935, Clostridioides difficile (anciennement Clostridium difficile) a été incriminé dans les colites et les diarrhées post-antibiotiques à la fin des années 1970. Cette bactérie anaérobie sporulée s’est rapidement imposée comme la principale cause infectieuse de diarrhées associées aux soins. L’intérêt porté à ce micro-organisme a connu un tournant à partir de 2005, avec la description, d’abord en Amérique du Nord puis en Europe, d’épidémies de formes sévères d’infections, caractérisées par une mortalité élevée et une moins bonne réponse au traitement par métronidazole.1, 2
Une présentation clinique très variable
Le tableau clinique des infections à Clostridioides difficile (ICD) peut varier de la diarrhée banale, sans retentissement sur l’état général du patient, jusqu’à la colite pseudomembraneuse (CPM) pouvant se compliquer d’un mégacôlon toxique, d’une perforation digestive ou d’un choc septique. Les formes compliquées sont rares (5 % des cas) mais associées à une mortalité pouvant atteindre 30 % malgré une prise en charge réanimatoire ou chirurgicale. Les récidives représentent une autre complication, moins sévère mais plus fréquente : 20 à 25 % des patients dans les deux mois sui-vant l’épisode initial ; à la suite d’une première récidive, un patient a davantage de risque de faire d’au-tres épisodes, dont la prise en char-ge médicale constitue un véritable défi thérapeutique.
Des facteurs de risque élargis
Les principaux facteurs de risque d’ICD sont au nombre de quatre :
– l’utilisation récente d’antibiotiques (augmentation du risque d’un facteur 10) ; les antibiotiques les plus à risque sont les céphalosporines, l’association amoxicilline-acide clavulanique, la clindamycine et les nouvelles fluoroquinolones ;
– l’âge supérieur à 65 ans des patients ; selon les données du Programme de médicalisation des systèmes d’information (PMSI), près de deux tiers des patients hospitalisés avec une ICD ont plus de 65 ans ;
– la présence de maladies chroniques sous-jacentes telles que l’insuffisance rénale, les cancers ou les hémopathies malignes, l’immunodépression, etc. ;
– l’hospitalisation récente ou prolongée ainsi que les séjours en établissement d’hébergement pour personnes âgées dépendantes (EHPAD).
Ces dernières années ont été marquées par une meilleure reconnaissance des infections communautaires, chez des patients jeunes n’ayant aucun facteur de risque classique. Une étude prospective recherchant systématiquement C. difficile chez 2 541 patients ayant consulté leur médecin généraliste pour troubles digestifs a montré qu’il s’agissait de la deuxième cause bactérienne de diarrhée (3,27 %) après les Campylobacter (3,64 %).3 Parmi les patients infectés, 20 % avaient moins de 65 ans et aucun antécédent d’hospitalisation ni d’antibiothérapie. Compte tenu de la variabilité des patients à risque, la possibilité d’une ICD doit être systématiquement envisagée chez tout patient présentant une diarrhée aiguë inexpliquée.
L’incidence des ICD est plus importante chez les patients atteints de maladies inflammatoires chroniques de l’intestin (MICI) que dans la population générale. En revanche, aucune donnée de la littérature ne montre que la diverticulose colique serait facilitante.
Durée d’hospitalisation et mortalité accrues
La survenue d’une diarrhée à C. difficile chez un patient hospitalisé augmente sa durée de séjour d’environ sept jours (médiane) comparé à des témoins non infectés appariés sur l’âge et la sévérité de la maladie sous-jacente.4
La mortalité dépend de la présentation clinique (inférieure à 1 % pour les formes bénignes mais jusqu’à 30 % en cas de forme compliquée). Une étude récente suggère que l’ICD augmente le risque de décès de 58 % comparé à des témoins appariés sur l’âge et la maladie sous-jacente.5
Par ailleurs, du fait de la prolongation de l’hospitalisation, de leurs traitements spécifiques ainsi que des nécessaires mesures de contrôle, l’impact économique des ICD est élevé : il a été estimé pour l’Union européenne (UE) à environ 3 milliards d’euros par an. En France, ce surcoût a été estimé à 9 024 euros par épisode.6
Une physiopathologie bien décrite
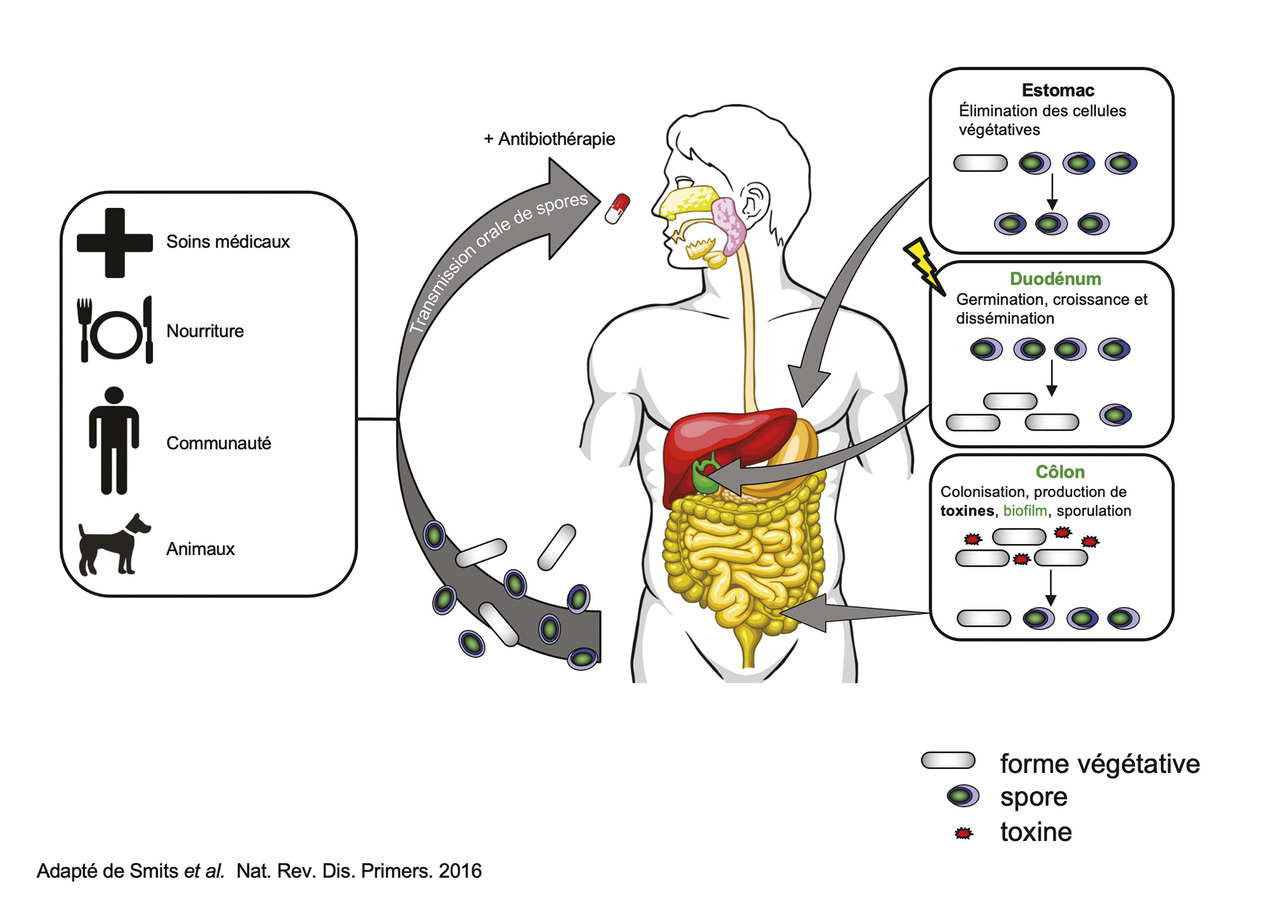
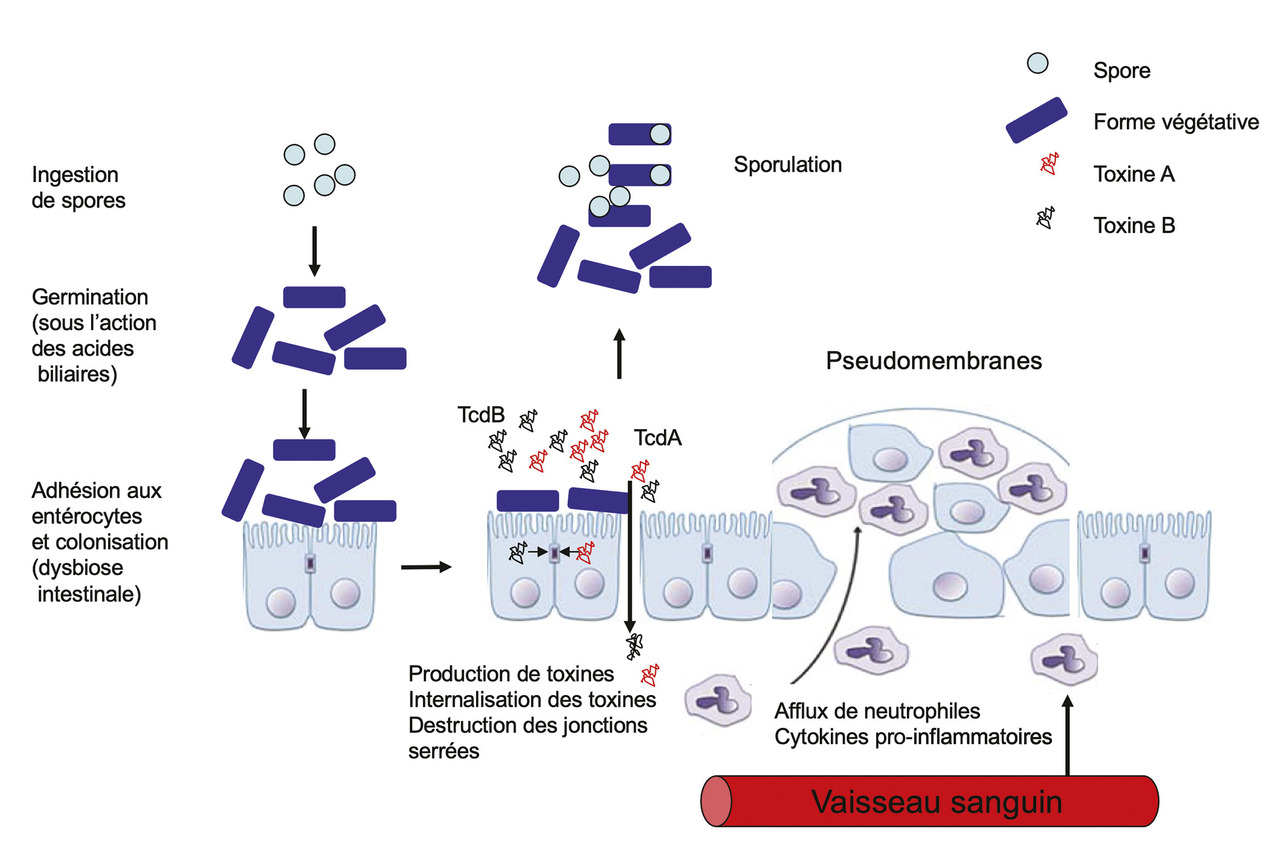
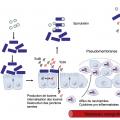
La contamination se fait par ingestion de spores de C. difficile. Après avoir résisté à l’acidité gastrique, leur germination se produit dans le duodénum sous l’action des sels biliaires (
La réceptivité de l’hôte, en particulier son immunité humorale, intervient également dans la physiopathologie des ICD. Il a ainsi été montré qu’après colonisation par C. difficile, les patients qui développent une infection ont un taux d’anticorps sérique anti-toxine A significativement plus faible que les patients restant porteurs asymptomatiques. Par ailleurs, une élévation du titre d’anticorps dirigés contre la toxine A lors d’un premier épisode d’ICD est associée à une meilleure protection contre les récidives.
Épidémiologie : un tournant à partir de 2005
L’évolution des ICD a été marquée par l’émergence et la dissémination mondiale, à partir de 2005, d’un clone spécifique de C. difficile, appelé 027/NAP1/BI, responsable d’épidémies de formes sévères d’ICD. En 2015, ce clone représentait 15 % des souches de C. difficile isolées en Europe, avec de grandes variations selon les pays (plus de 30 % en Allemagne et moins de 5 % en France). La plus grande virulence de ce clone serait liée à une production accrue de toxines A et B et à la sécrétion d’une troisième toxine, la toxine binaire. Sa diffusion a probablement été facilitée par sa résistance aux fluoroquinolones, qui lui a conféré un avantage sélectif.
En France, selon les données du PMSI, l’incidence des ICD a augmenté de 2010 à 2015, puis s’est stabilisée à partir de 2015, avec environ 20 000 séjours hospitaliers mentionnant une ICD en diagnostic principal ou associé (soit une incidence de 3,6 cas pour 10 000 journées d’hospitalisation [JH]).8 Les données du réseau BMR-Raisin, qui regroupe 207 établissements hospitaliers, sont concordantes, estimant l’incidence des ICD à 3,1/10 000 JH en 2017.
Optimiser la démarche diagnostique
La mise en évidence de pseudomembranes au cours de l’examen endoscopique est pathognomonique de l’ICD ; mais il s’agit d’un examen long, invasif et peu sensible, car les pseudomembranes ne sont pas présentes au début de la maladie ni en cas de diarrhée simple associée aux antibiotiques.
Tests de détection des souches toxinogènes et des toxines
Le diagnostic bactériologique des ICD repose sur la mise en évidence, dans les selles, soit des toxines libres (par des tests immuno-enzymatiques ou par le test de cytotoxicité des selles), soit d’une souche toxinogène (par culture ou par biologie moléculaire).9-10
La révision de la nomenclature des actes de biologie médicale (décision du 23 mai 2019 de l’Union nationale des caisses d’assurance maladie) précise que la recherche de C. difficile doit être systématique en cas de diarrhées associées aux soins et peut être réalisée à l’initiative du biologiste médical.
Schématiquement, les tests détectant la présence d’une souche toxinogène sont très sensibles mais peu spécifiques de l’infection car certains patients sont porteurs asymptomatiques de C. difficile toxinogène. À l’inverse, les tests visant à dépister les toxines dans les selles sont très spécifiques mais peu sensibles.11 Des études ont montré que la présence de toxines libres dans les selles serait mieux corrélée à la sévérité de l’infection (mortalité et taux de leucocytes significativement plus élevés).12
Un algorithme diagnostique en deux étapes
Les recommandations européennes10 et françaises (Référentiel en microbiologie médicale : REMIC 2018) proposent d’utiliser un algorithme de diagnostic en deux étapes avec un test rapide de screening (par exemple, un test dépistant un antigène spécifique de C. difficile, la glutamate déshydrogénase [GDH], mais non spécifique des souches toxinogènes) puis un test de détection des toxines libres (test immuno-enzymatique). Cet algorithme est un compromis qui allie rapidité, sensibilité, spécificité et moindre coût.
Certains fabricants proposent un test rapide immuno-chromatographique combinant le test de screening (détection de la GDH) et le test de confirmation (recherche des toxines) sur la même cassette.
Prise en charge : l’antibiothérapie spécifique en deuxième intention
La restauration rapide du microbiote intestinal et de son effet barrière est un élément clé de la guérison des patients.
La réhydratation du patient et l’arrêt de l’antibiothérapie en cause ou son remplacement par un antibiotique à moindre risque sont les premières mesures à mettre en place ; simples, elles suffisent à obtenir une amélioration clinique dans 25 % des cas.
Si l’antibiotique responsable ne peut être arrêté ou remplacé, ou si les symptômes persistent, un traitement spécifique doit être initié.
De nouveaux antibiotiques plus efficaces et mieux tolérés
Trois molécules sont actuellement disponibles pour traiter les infections à C. difficile : le métronidazole, la vancomycine ou la fidaxomicine.
Le métronidazole est un antibiotique à large spectre, responsable d’une importante dysbiose intestinale. Il est rapidement absorbé et peut être à l’origine d’effets indésirables (effet antabuse, neuropathies périphériques).
La vancomycine et la fidaxomicine sont des molécules à spectre plus étroit qui entraînent moins de dysbiose intestinale. Elles sont administrées par voie orale et ne sont pas absorbées, de sorte que les concentrations fécales sont environ 1 000 fois supérieures aux concentrations minimales inhibitrices (CMI) vis-à-vis de C. difficile. Ces deux molécules sont à dispensation hospitalière et inscrites sur la liste des médicaments en rétrocession. En 2022, le prix d’un traitement par fidaxomicine est de l’ordre de 1 300 € (soit environ 25 fois plus coûteux que la vancomycine).
Des études ont montré que la vancomycine est plus efficace que le métronidazole, en particulier sur les formes sévères d’ICD.13 Par ailleurs, le métronidazole est associé à davantage de récidives et à une mortalité plus élevée que la vancomycine.14
La fidaxomicine, commercialisée en 2012, s’est avérée non inférieure à la vancomycine en matière de guérison clinique après dix jours de traitement et permet de réduire de 39 à 52 % le taux de récidives.15
Deux options en prévention des récidives
Le bezlotoxumab (anticorps monoclonal dirigé contre la toxine B), commercialisé en 2017, a permis de réduire le taux de récidives de l’ordre de 37 % lorsqu’il est administré en association à un traitement standard.16
La transplantation de microbiote fécal (TMF), considérée comme un médicament en France, s’est avérée efficace dans plus de 90 % des cas pour le traitement des récidives multiples d’ICD. Elle consiste à administrer au patient une suspension filtrée de selles d’un donneur sain, afin de reconstituer un microbiote plus riche et diversifié. La préparation des selles et leur administration ne sont pas encore standardisées : l’origine du donneur (anonyme ou un membre de la famille), le volume de selles, la fréquence d’administration, la voie d’administration (nasogastrique, nasoduodénale ou endoscopique) varient d’une étude à l’autre.
Des recommandations stratifiées selon la sévérité, le risque et le nombre de récidives
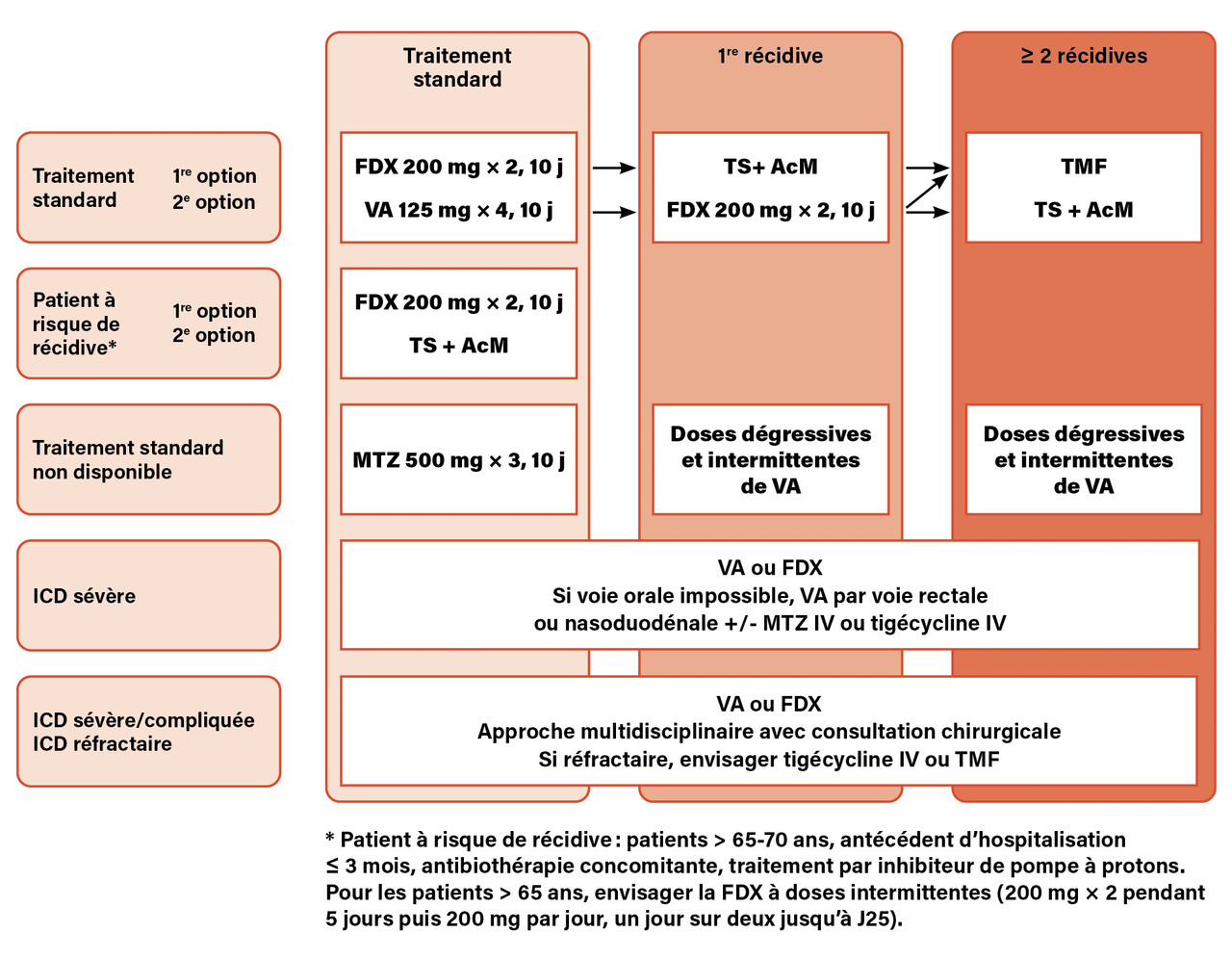
Les recommandations pour le traitement des ICD ont récemment été réactualisées par la Société européenne de microbiologie clinique et des maladies infectieuses (ESCMID).17 Elles sont ainsi stratifiées selon la forme clinique (bénigne, sévère, compliquée), le risque et le nombre de récidives (
La définition de la sévérité n’est pas à ce jour consensuelle, mais de nombreuses études utilisent la définition nord-américaine de l’Infectious Diseases Society of America (IDSA) qui tient compte de la créatinémie (supérieure à 1,5 fois la valeur de base) ou de l’hyperleucocytose (supérieure à 15 000/mm3).
Un patient est considéré « à risque de récidives » s’il présente un des facteurs de risque suivants : âge supérieur à 65 ans, antécédent d’hospitalisation de trois mois ou plus, antibiothérapie concomitante, traitement par inhibiteur de la pompe à protons.
Les principales modifications par rapport aux recommandations de 2014 sont les suivantes :
– le métronidazole n’est plus recommandé pour le traitement des ICD, sauf si c’est la seule molécule disponible (par exemple en ville) ou si le patient ne peut pas prendre de médication par voie orale (le métronidazole par voie intra-veineuse peut alors être proposé) ;
– la fidaxomicine est privilégiée pour le traitement initial d’une ICD ou d’une première récidive ;
– la TMF ou le bezlotoxumab est priorisé en association à un traitement standard pour le traitement d’une deuxième récidive et au-delà ;
– le bezlotoxumab est recommandé pour la première récidive lorsque la fidaxomicine a été utilisée en première intention.
Seule l’amélioration des signes cliniques rend compte de l’efficacité du traitement. Le contrôle microbiologique après traitement est inutile car C. difficile ou ses toxines restent détectables chez environ 30 % des patients à l’issue d’un traitement cliniquement efficace.
La prévention passe en premier lieu par le bon usage des antibiotiques
Les mesures de prévention des ICD ont également été réactualisées en 2018, sous l’égide de l’ESCMID.18 Elles reposent tout d’abord sur le bon usage des antibiotiques : la diminution de la consommation de certaines classes particulièrement à risque (céphalosporines, clindamycine, amoxicilline + acide clavulanique, nouvelles fluoroquinolones) a été corrélée à une diminution d’incidence des ICD dans plusieurs études.
Les mesures essentielles pour prévenir la transmission croisée (précautions contact) comprennent l’isolement du patient infecté en chambre seule avec des toilettes privatives, l’augmentation de l’observance de l’hygiène des mains, le port de gants dès l’entrée dans la chambre et la désinfection (quotidienne et à la sortie du patient) de l’environnement à l’aide de produits sporicides (eau de Javel à 0,5 % ou équivalent). Ces mesures sont à maintenir tant que le patient est diarrhéique.
Des vaccins sont à l’étude
Il n’y a pas de vaccin disponible contre les ICD à ce jour. Néanmoins, des efforts considérables ont été déployés ces dernières années pour son développement. Le vaccin de Sanofi (toxoïde) a été arrêté à la suite d’un essai de phase III interrompu pour cause de futilité. Le vaccin de Pfizer (à toxines recombinantes) est le plus avancé : un communiqué de presse, paru au début de l’année 2022 après la clôture de l’essai de phase III, indiquait une efficacité de 31 % associée à une diminution des formes sévères et à une réduction de la durée des symptômes liés à l’ICD.
Des recommandations actualisées à la faveur de l’évolution des connaissances
Les ICD ont connu un regain d’intérêt au début des années 2000, stimulant recherches clinique et fondamentale autour de cette bactérie. Des progrès considérables ont été réalisés tant épidémiologiques (meilleure reconnaissance des formes communautaires), diagnostiques (tests moléculaires) que thérapeutiques (nouvelles molécules, transplantation de microbiote fécal, vaccins…). Ces avancées ont conduit les sociétés savantes (notamment l’ESCMID) à régulièrement réactualiser leurs recommandations sur le diagnostic, la prise en charge et la prévention des ICD.
en chiffres…
- C. difficile est responsable de plus de 95 % des colites pseudomembraneuses.
- Il est impliqué dans 15 à 25 % des diarrhées associées à l’antibiothérapie.
- Il est responsable de 10 % des diarrhées associées aux soins.
- Environ 20 à 25 % des patients récidivent après un premier épisode d’infection liée à C. difficile (ICD).
- Environ 10 % des récidives nécessitent une réhospitalisation.
- Tous les ans en France, environ 20 000 patients hospitalisés en court séjour ont un diagnostic d’ICD.
- Le coût d’un épisode d’ICD est de 9 024 €.
1. Loo VG, Poirier L, Miller MA, Oughton M, Libman MD, Michaud S, et al. A predominantly clonal multi-institutional outbreak of Clostridium difficile-associated diarrhea with high morbidity and mortality. N Engl J Med 2005;353:2442-9.
2. McDonald LC, Killgore GE, Thompson A, Owens RC Jr, Kazakova SV, Sambol SP, et al. An epidemic, toxin gene-variant strain of Clostridium difficile. N Engl J Med 2005;353:2433-41.
3. Barbut F, Day N, Bouée S, Youssouf A, Grandvoinnet L, Lalande V, et al. Toxigenic Clostridium difficile carriage in general practice: results of a laboratory-based cohort study. Clin Microbiol Infect 2019;25(5):588-94.
4. Gabriel L, Beriot-Mathiot A. Hospitalization stay and costs attributable to Clostridium difficile infection: a critical review. J Hosp Infect 2014;88(1):12-21.
5. Barbut F, Bouée S, Longepierre L, Goldberg M, Bensoussan C, Levy-Bachelot L. Excess mortality between 2007 and 2014 among patients with Clostridium difficile infection: a French health insurance database analysis. J Hosp Infect 2018;98(1):21-8.
6. Le Monnier A, Duburq A, Zahar JR, Corvec S, Guillard T, Cattoir V, et al. Hospital cost of Clostridium difficile infection including the contribution of recurrences in French acute-care hospitals. J Hosp Infect 2015;91(2):117-22.
7. Rupnik M, Wilcox MH, Gerding DN. Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol 2009;7(7):526-36.
8. Colomb-Cotinat M, Assouvie L, Durand J, Daniau C, Leon L, Maugat S, et al. Epidemiology of Clostridioides difficile infections, France, 2010 to 2017. Euro Surveill 2019;24(35):1800638.
9. Cohen SH, Gerding DN, Johnson S, Kelly CP, Loo VG, McDonald LC, et al. Clinical practice guidelines for Clostridium difficile infection in adults: 2010 update by the Society for Healthcare epidemiology of America (SHEA) and the Infectious Diseases Society of America (IDSA). Infect Control Hosp Epidemiol 2010;31(5):431-55.
10. Crobach MJT, Planche T, Eckert C, Barbut F, Terveer EM, Dekkers OM, et al. European Society of Clinical Microbiology and Infectious Diseases: update of the diagnostic guidance document for Clostridium difficile infection Clin Microbiol Infect 2016;22 Suppl 4:S63-81.
11. Eckert C, Jones G, Barbut F. Diagnosis of Clostridium difficile infection: the molecular approach. Future Microbiol 2013;8:1587-98.
12. Planche TD, Davies KA, Coen PG, Finney JM, Monahan IM, Morris KA, et al. Differences in outcome according to Clostridium difficile testing method: a prospective multicentre diagnostic validation study of C difficile infection. Lancet Infect Dis 2013;13(11):936-45.
13. Johnson S, Louie TJ, Gerding DN, Cornely OA, Chasan-Taber S, Fitts D, et al. Vancomycin, metronidazole, or tolevamer for Clostridium difficile infection: results from two multinational, randomized, controlled trials. Clin Infect Dis 2014;59(3):345-54.
14. Stevens VW, Nelson RE, Schwab-Daugherty EM, Khader K, Jones MM, Brown KA, et al. Comparative effectiveness of vancomycin and metronidazole for the prevention of recurrence and death in patients with Clostridium difficile infection. JAMA Intern Med 2017;177(4):546-53.
15. Crook DW, Walker AS, Kean Y, Weiss K, Cornely OA, Miller MA, et al. Fidaxomicin versus vancomycin for Clostridium difficile infection: meta-analysis of pivotal randomized controlled trials. Clin Infect Dis 2012;55 Suppl 2:S93-103.
16. Wilcox MH, Gerding DN, Poxton IR, Kelly C, Nathan R, Birch T, et al. Bezlotoxumab for prevention of recurrent Clostridium difficile infection. N Engl J Med 2017;376(4):305-17.
17. van Prehn J, Reigadas E, Vogelzang EH, Bouza E, Hristea A, Guery B, et al. European Society of Clinical Microbiology and Infectious Diseases: 2021 update on the treatment guidance document for Clostridioides difficile infection in adults. Clin Microbiol Infect 2021;27 Suppl 2:S1-S21.
18. Tschudin-Sutter S, Kuijper EJ, Durovic A, Vehreschild MJGT, Barbut F, Eckert C, et al. Guidance document for prevention of Clostridium difficile infection in acute healthcare settings. Clin Microbiol Infect 2018;24(10):1051-154.
Dans cet article
- Une présentation clinique très variable
- Des facteurs de risque élargis
- Durée d’hospitalisation et mortalité accrues
- Une physiopathologie bien décrite
- Épidémiologie : un tournant à partir de 2005
- Optimiser la démarche diagnostique
- Prise en charge : l’antibiothérapie spécifique en deuxième intention
- La prévention passe en premier lieu par le bon usage des antibiotiques
- Des vaccins sont à l’étude
- Des recommandations actualisées à la faveur de l’évolution des connaissances

 Encadrés
Encadrés