Avant d’aborder le sujet de l’initiation d’un traitement par buprénorphine en cabinet de ville, il convient de revenir sur la pathologie chronique à l’origine de son indication : l’addiction, ou les troubles liés à l’usage (TLU) d’opiacés.
Le mot « addiction » tire sa racine du latin : ad-dicere qui désignait, dans l’Antiquité, un individu qui avait souscrit une dette non remboursable. Afin de la rembourser, il devenait esclave de son créancier et perdait ainsi sa liberté. Étymologiquement, un patient pour lequel un diagnostic d’addiction a été posé a donc perdu la liberté de s’abstenir.
Troubles liés à l’usage d’opiacés : de quoi parle-t-on ?
Les TLU désignent une pathologie chronique, donc complexe et tridimensionnelle. C’est également une maladie biopsychosociale1 qui touche un individu aux prises avec des consommations répétées et non contrôlables de substances, qu’elles soient légales ou illégales, sur prescription ou obtenues clandestinement.
Les TLU incluent également les addictions comportementales, dites « sans produit », telles que l’excès de sport, de jeux d’argent, d’écrans, de jeux vidéo, de consommation de contenu à caractère pornographique et les troubles du comportement alimentaire.
Le terme « biopsychosocial » se réfère à une problématique globale dont l’approche se doit d’être holistique. Il faut ainsi prendre en compte les trois dimensions de la dépendance – physique, psychologique et comportementale – sans négliger les trois catégories de complications – somatiques, psychiques et sociales.
Le Manuel diagnostique et statistique des troubles mentaux 5 (DSM- 5) recense onze critères permettant de poser le diagnostic d’addiction (tableau).
Sur le plan neurobiologique, le patient souffre d’une atteinte du circuit de la récompense.2 Cette fonction cérébrale complexe permet à chaque individu de remplir des besoins fondamentaux pour la survie et la perduration de l’espèce. Remplir l’un de ces besoins fondamentaux (boire, manger, dormir, avoir des interactions sociales et des rapports sexuels) permet la libération dans le cerveau d’une petite quantité de dopamine – hormone du plaisir.
Seulement, chez le patient qui consomme une substance, ce circuit de la récompense est modifié (« shunté ») et la prise de la substance entraîne une libération de dopamine, sans remplir de besoin fondamental. La quantité de dopamine libérée est alors bien supérieure aux libérations physiologiques,3 et ce finalement « sans effort ». On comprend aisément qu’un patient dans une période de fragilité se tourne naturellement vers le produit qui lui apporte aussi bien un soulagement sur le plan thymique qu’une sensation de bien-être : c’est la recherche d’hédonisme.4
Opioïdes : la dépendance s’installe rapidement
Les opioïdes correspondent à de nombreux produits :5
- les morphiniques (antalgiques de palier 3), qu’ils soient de synthèse ou non ;
- les antalgiques dits « de palier 2 » (tramadol, codéine, poudre d’opium) et l’héroïne. Certains sirops antitussifs en contiennent également ;
- les traitements de substitution classés en deux catégories : la méthadone (sirop ou gélule) et la buprénorphine haute dose (Subutex, Suboxone, Orobupré, Buvidal, génériques…).
Les opioïdes sont principalement utilisés dans trois indications :
- antalgie contre des douleurs modérées à intenses ;
- antitussif ;
- substitution en cas de pharmaco-dépendance aux opiacés.
Les opioïdes ont un inconvénient non négligeable : la dépendance pharmacologique s’instaure rapidement.6 Par exemple, un traitement « banal » par tramadol à visée antalgique peut s’avérer difficile à arrêter brutalement après deux à trois semaines de prise, et nécessiter un sevrage progressif encadré par un médecin.
Par ailleurs, la dépendance psychologique présente dans certains cas ne doit pas non plus être négligée. Un patient dont l’histoire de vie est difficile (traumatisme physique, psychologique, sexuel ou accident de la vie) ou ayant des prédispositions peut trouver un soulagement de son mal-être après une consommation d’opioïdes. Plusieurs mois après l’épisode douloureux, le patient s’automédique car il ne se sent pas bien, sans pour autant ressentir de douleur ; le souvenir de cette euphorie active une envie de reprendre un antalgique opioïde, même sans douleur ressentie : c’est le mécanisme d’entrée dans les TLU. À court de traitement, le patient consulte à nouveau son médecin, demande le même traitement « au cas où », parfois en simulant ou en exagérant une douleur (critère du DSM- 5).
Il est donc aisé de comprendre que l’initialisation d’un traitement de substitution aux opiacés (TSO) abordant principalement la dimension physique de la dépendance ne prend pas en compte les deux autres dimensions que sont la dépendance psychique et la dépendance comportementale.
Causes menant aux TLU
L’addiction est la maladie en tant que telle ; la prise de produit est à voir comme l’expression symptomatique de la pathologie. Qu’il s’agisse de cannabis, d’alcool, d’opioïdes, de tabac, de cocaïne, de sport à l’excès, tous visent l’objectif de procurer du plaisir et d’apaiser, voire d’apporter de l’euphorie à celui qui y a recours. Ils entraînent une libération de dopamine.3
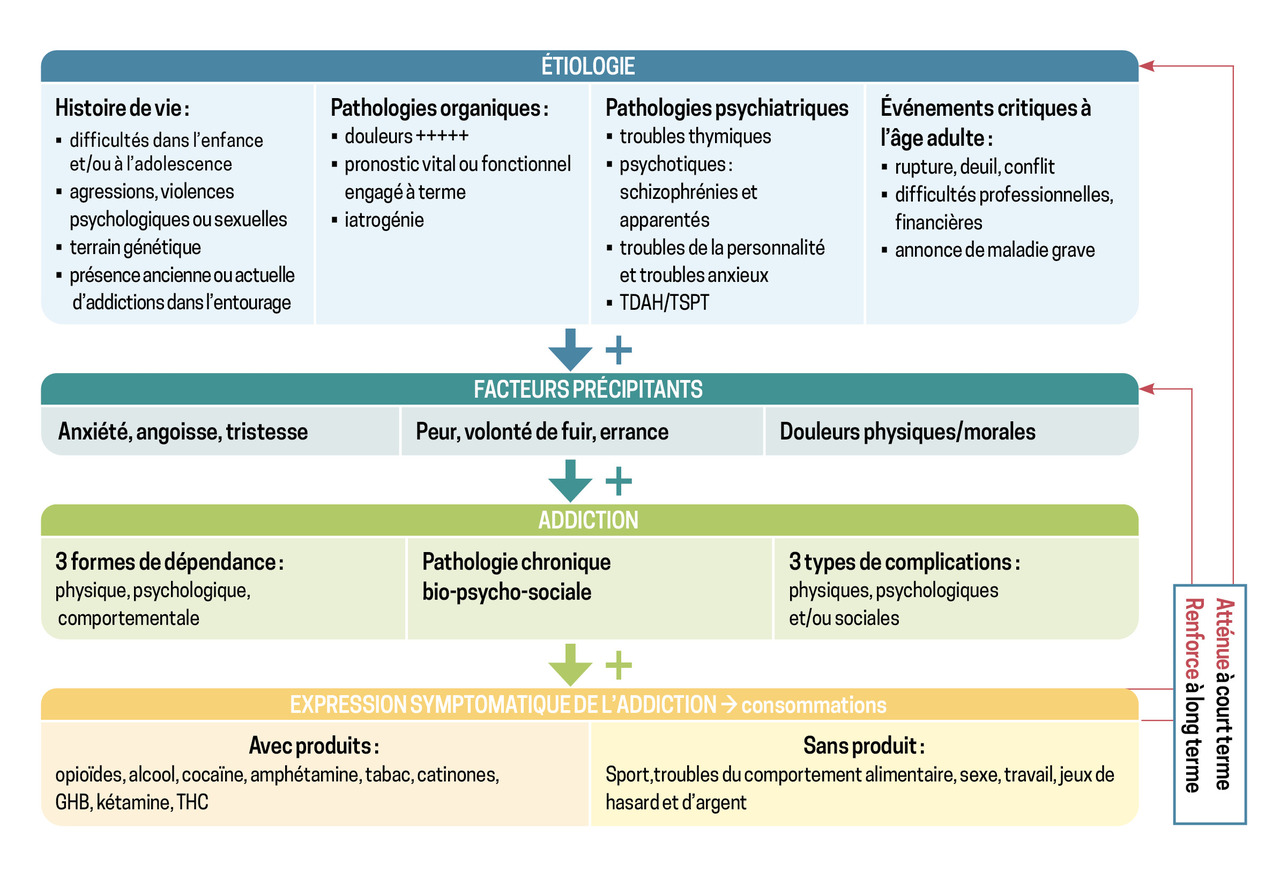
Il existe trois grandes catégories de causes à l’origine de l’addiction :7, 8
- l’histoire de vie doit être explorée. Sont ainsi recherchées : des difficultés dans l’enfance, l’adolescence, une parentification (inversion des rôles parent-enfant), une antipathie parentale ; des agressions subies, des violences psychologiques ou sexuelles ; un terrain génétique ; la présence d’addiction dans l’entourage ;
- la survenue d’événements critiques à l’âge adulte s’inscrit également dans l’enquête étiologique : rupture, deuil, conflit ; difficultés professionnelles, familiales, financières, scolaires ;
- l’existence de pathologies organiques ou psychiatriques doit, enfin, être envisagée : douleurs physiques (très fréquentes) ; pronostic vital ou fonctionnel engagé à terme ; iatrogénie ; troubles thymiques ; troubles psychotiques ; troubles de personnalité ; troubles anxieux ; trouble déficitaire de l’attention avec ou sans hyperactivité (TDAH) et trouble de stress post-traumatique (TSPT).
La prise en charge holistique de l’addiction aux opiacés, au-delà de la mise en route d’un TSO, nécessite à terme une prise en charge globale, notamment psychologique et éventuellement sociale, afin d’identifier les causes et de limiter le risque d’entretien de l’addiction. En effet, la suppression d’un symptôme sans en considérer la cause entraîne un déplacement de produit, laissant place à de nouveaux symptômes (arrêt de l’héroïne et passage à l’alcool, par exemple).
En outre, en addictologie, le sevrage n’est pas un aboutissement, il doit plutôt être considéré comme une étape non obligatoire du soin.
Quelle prise en charge ?
Le patient tient la place centrale !
Les objectifs dans une prise en charge addictologique sont toujours fixés en concertation entre le médecin et le patient, mais le patient a le dernier mot. Ainsi, s’il n’est pas prêt à accepter une abstinence totale, choisir cet objectif pour lui est contre-productif.
Pour rappel, étymologiquement, le patient dépendant a perdu la liberté de s’abstenir. Adopter un réflexe correcteur9 et penser à sa place ne fait que le priver davantage de son autonomie décisionnelle. La réaction naturelle du patient est alors de s’opposer au soignant afin de préserver sa liberté de décider, comportement parfois à l’origine de l’échec de la prise en charge.
Prérequis à une initialisation ambulatoire du sevrage
Comment aborder une prise en charge en médecine générale d’un patient qui fait part de sa pharmacodépendance aux opiacés et qui souhaite bénéficier d’une aide ?
Une évaluation clinique du patient est nécessaire, en recherchant les éléments suivants :
- antériorité des consommations, mode de consommation, produits consommés ;
- coconsommations et leur antériorité ;
- situation sociale et professionnelle ;
- antécédents médicochirurgicaux, notamment psychiatriques ;
- traitements actuels, prescrits ou non ;
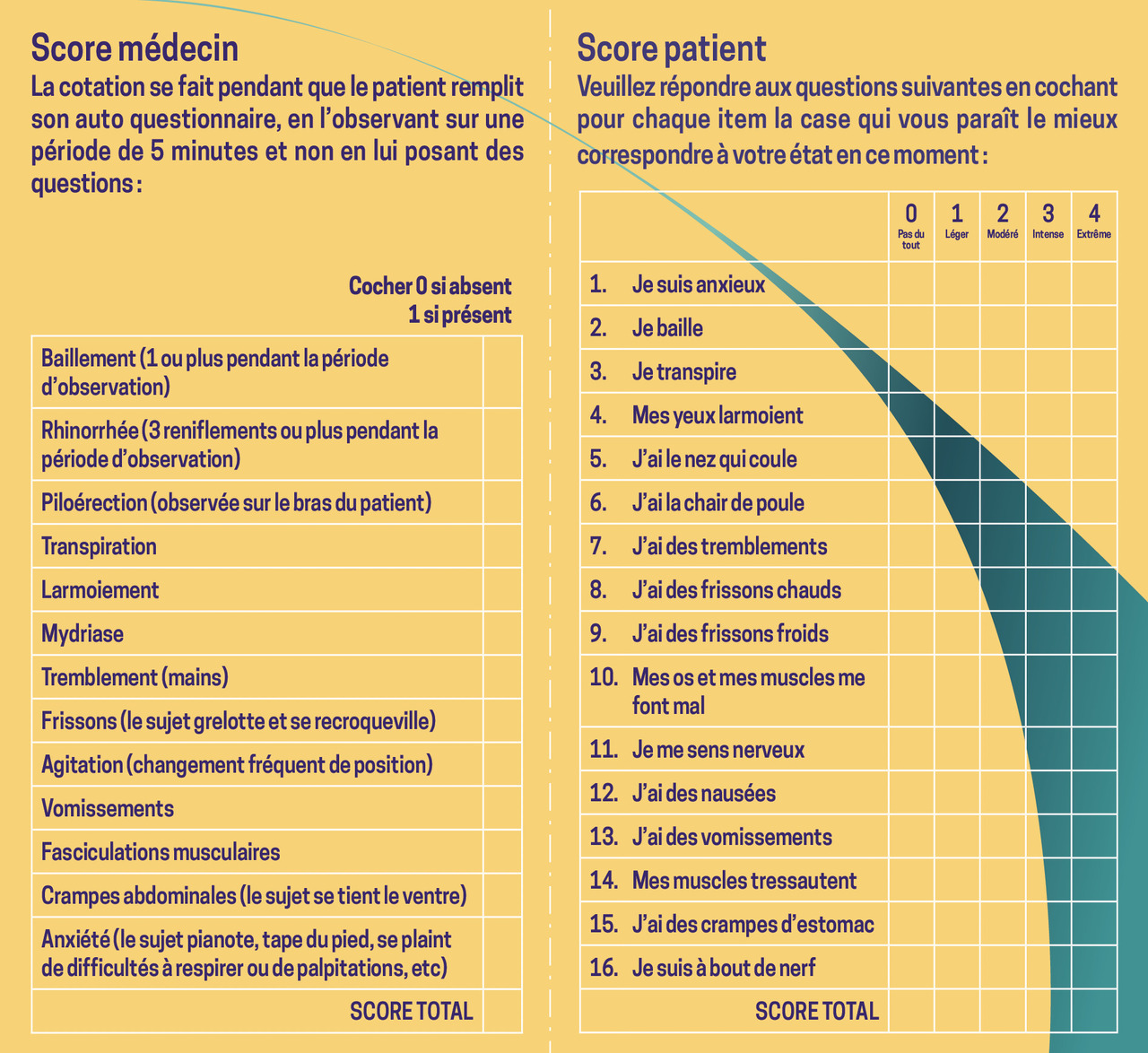
- signes physiques de manque (aux opiacés) précoces : bâillements, mydriase, rhinorrhées, sueurs, larmoiements ;
- signes physiques de manque tardifs : polypnée, tachycardie, hypertension artérielle, agitation, insomnie, tremblements, piloérection, douleurs musculaires et articulaires (sans organicité sous-jacente), frissons, nausées, vomissements, diarrhées ;
- signes de surdosage (aux opiacés) : myosis en tête d’épingle ;
- bradypnée, bradycardie, hypotension artérielle ;
- somnolence, dépression respiratoire.
À l’extrême peuvent s’observer apnées et coma calme, voire un arrêt respiratoire.
Le score de Handelsman (fig. 1) peut aider à réaliser l’évaluation. Il a l’avantage de proposer une partie objective et une partie subjective.
Il existe des tests urinaires de détection rapide des différentes drogues. Ils sont disponibles auprès des distributeurs de matériel médical. On peut ainsi rechercher les substances suivantes : morphine, amphétamine, cocaïne, benzodiazépines, buprénorphine, méthadone, tétra-hydrocannabinol (THC), etc. Toutefois, ces tests n’ont pas de caractère obligatoire dans une initialisation par buprénorphine haute dose (HD).
Si l’évaluation conclut à un TLU aux opiacés, une mise sous buprénorphine HD (la méthadone ne peut être primo-prescrite qu’en centre addictologique) est indiquée.
Initialisation : buprénorphine Haute Dose par voie sublinguale
Les dernières recommandations de la Haute Autorité de santé (HAS) de 2022 posent les indications et le cadre précis de la prescription de ces molécules.10
La buprénorphine HD est un médicament à la fois agoniste et antagoniste. Elle interagit donc avec tous les autres médicaments à base d’opioïdes (palier 3, palier 2, nalméfène, naltrexone). Elle est aussi contre-indiquée en cas d’antécédent de delirium tremens. Il ne faut donc pas hésiter à se référer au résumé des caractéristiques du produit.
Intérêts de la titration
En cas d’objectif de sevrage de la consommation d’opioïdes, la titration permet d’obtenir :
- l’abstinence aux opioïdes (hors médicaments de substitution aux opiacés [MSO]) ;
- l’absence de signes de sevrage ;
- la diminution progressive du craving, défini comme un désir intense et irrépressible de consommer la substance ;
- des effets indésirables acceptables.
La posologie est à adapter à la clinique, aux interactions médicamenteuses (benzodiazépines, hypnotiques, antidépresseurs tricycliques), à une éventuelle consommation d’alcool du patient.
Phase d’initialisation et éducation thérapeutique
La phase d’initialisation est assez simple et courte : le patient doit interrompre sa consommation du produit opioïde auquel il est dépendant vingt-quatre heures avant de débuter le traitement. Idéalement, on propose de débuter le traitement un lundi et de revoir le patient deux ou trois fois durant la semaine.
La dose initiale recommandée est de 8 mg/j. L’ajout d’une boîte de 2 mg sur l’ordonnance permet au patient de faire une titration si les symptômes de manque tardif apparaissent au cours de la journée. En revanche, il est conseillé de ne plus rien prendre après minuit.
Conseils de bon usage
Le passage sanguin de la buprénorphine HD s’effectue uniquement au niveau de la muqueuse buccale, rendant cette thérapeutique singulière.11 Tout ce qui est avalé est donc perdu (sauf pour l’enfant chez qui des cas de surdose par ingestion ont été rapportés).
Il est important de bien éduquer le patient, avec les conseils suivants :
- trente minutes avant la prise, éviter la consommation de café, thé, tabac, alcool, menthe, dentifrice ; en effet, la vasoconstriction qu’ils induisent risque de perturber la bonne biodisponibilité ;
- humidifier la muqueuse buccale avec de l’eau à température ambiante, afin de favoriser les échanges. Une fois le comprimé dans la bouche, le placer sous la langue jusqu’à dissolution ;
- conserver la salive dans la bouche jusqu’à dix minutes après introduction du comprimé sans parler, boire, manger, avaler ni fumer.
La disponibilité de prise dans des conditions optimales est de 30 %.
Évaluation à J2 et poursuite du traitement
À J2, l’interrogatoire du médecin permet de savoir :
- comment le traitement a été pris ;
- à quel moment de la journée les symptômes précoces/tardifs sont apparus ;
- si la prise de comprimés à 2 mg a été nécessaire.
Augmentation progressive du dosage pour titrer
À J2, la posologie préconisée est celle de J1 additionnée de celle des interdoses. Ce schéma est répété jusqu’à la fin de la semaine. Le patient atteint alors son dosage de titration, et le praticien peut effectuer une prescription d’une à quatre semaines, selon les circonstances, pour poursuivre le traitement. On dit que le patient a été initialisé.
Traitement au long cours
Le traitement introduit est chronique.12 Le temps entre l’initialisation et la stabilisation peut être long car le système nerveux doit s’habituer à l’absence d’opiacés autre que le TSO au quotidien.
La diminution du traitement ne doit jamais être précipitée. Il a été établi qu’une proportion non négligeable des patients doit conserver un traitement substitutif au long cours,13 d’autant plus si la cause ayant mené à la dépendance n’est pas prise en charge. L’arrêt d’un TSO peut être un objectif pour le patient, mais constitue une étape non obligatoire du soin. Le but doit être d’aider le patient à tendre vers un mieux-être physique, psychologique et/ou social.14
Que dire à vos patients ?
- L’addiction est une pathologie à part entière, le patient n’est pas responsable de son état.
- La mise en route d’un traitement de substitution soulage les symptômes du manque, mais l’amélioration globale du patient requiert une prise en charge holistique.
- L’éducation thérapeutique des prises du traitement et la bonne observance sont deux prérequis à une bonne efficacité.
- On ne peut prédire de la durée totale de maintien sous traitement de substitution, mais il ne faut pas faire de son arrêt un objectif final, plutôt une étape potentielle dans le processus de rétablissement.
2. Tassin JP. Neurobiologie de l’addiction : proposition d’un nouveau concept. L’information psychiatrique 2007;2(83):91-7.
3. Dervaux A. Neurobiologie des addictions. In: Laqueille X, Chassagnoux A (coord.). Pratiques cliniques en addictologie. Paris: Lavoisier; 2017, pp. 8-15.
4. Pin-Scarna H. Processus addictif : psychopathologie et neurobiologie. Psychologie. Université Bourgogne Franche-Comté, 2017. Français. ffNNT : 2017UBFCC015ff.
5. ANSM. État des lieux de la consommation des antalgiques opioïdes et leurs usages problématiques. Février 2019.
6. Tourmente C. Quatre questions sur l’addiction au tramadol. Allo Docteurs, l’info santé en vidéo [en ligne, publié le 06/06/22, mis à jour le 07/08/23]. http://tinyurl.com/2s3k7cpv
7. Institut national de la santé et de la recherche médicale (Inserm). Addictions – Du plaisir à la dépendance [internet, publié le 29/05/2017, mis à jour le 11/09/2020]. http://tinyurl.com/3bwzv66v
8. Mission interministérielle de lutte contre les drogues et les conduites addictives (Midelca). Qu’est-ce qu’une addiction ? [internet, 2015]. http://tinyurl.com/22tx66x6
9. Rollnick S, Miller WR, Butler CC. Pratique de l’entretien motivationnel. Communiquer avec le patient en consultation. Paris: Interéditions, 2018.
10. HAS. Recommandation de bonnes pratiques. Traitement du trouble de l’usage d’opioïdes. 10 mars 2022. http://tinyurl.com/yk7yzfcw
11. Le J. Absorption des médicaments. Le manuel MSD (version pour les professionnels de santé) [internet, juin 2022]. Disponible sur l’URL http://tinyurl.com/2fxjxbrx
12. Brisacier AC. Tableau de bord « Traitement de substitution aux opioïdes ». OFDT, septembre 2020.
13. HAS. Recommandation de bonnes pratiques. Bon usage des médicaments opioïdes : antalgie, prévention et prise en charge du trouble de l’usage et des surdoses. 10 mars 2022. http://tinyurl.com/4hwy8x82
14. Sees KL, Delucchi KL, Masson C, et al. Methadone maintenance vs 180-day psychosocially enriched detoxification for treatment of opiod dependance: A randomized controlled trial. JAMA 2000;283(10):1303-10.

 Encadrés
Encadrés