On ne peut prendre en charge une maladie que si on l’a diagnostiquée. Cela paraît une évidence, mais la dénutrition reste sous-diagnostiquée. Un médecin généraliste réalisant un dépistage et un diagnostic exhaustifs de la dénutrition dans sa patientèle aura, en moyenne, 6 % de patients dénutris à prendre en charge. Cela nécessite donc une approche systématique.
Préciser le phénotype et la cause de la dénutrition
Les articles précédents ont précisé les critères retenus par la Haute Autorité de santé et la Fédération française de nutrition en 2019 et 2021 pour diagnostiquer la dénutrition à tous les âges.
Le critère phénotypique permet de définir la sévérité de la dénutrition dont dépend en partie la prise en charge.
La dénutrition est souvent diagnostiquée chez un patient dont la maladie chronique est connue. Parfois, le critère étiologique oriente le bilan, si la dénutrition est le premier symptôme conduisant à la consultation (par exemple en cas de cancer ou de maladie d’Alzheimer). Pour autant, même en présence d’une affection chronique ou aiguë, la réduction des ingesta est habituelle, et, seule, elle ne permet pas d’orienter le diagnostic.
Évaluer les besoins et ingesta du patient pour optimiser la prise en charge
Il n’y a pas moyen, en médecine de ville, de mesurer la dépense énergétique totale. L’accès à la calorimétrie indirecte (qui permet la mesure de la dépense énergétique de repos) étant difficile et les équations complexes, on peut estimer les besoins chez l’adulte et la personne âgée à 30 kcal/kg/j et 1,2 g de protéines/kg/j.1 La pathologie du patient peut conduire à modifier ces besoins, mais il ne sera jamais faux de les couvrir, à l’exception des patients en insuffisance rénale terminale avant dialyse, chez lesquels l’apport protéique doit être limité à 0,6 g/kg/j.
L’évaluation des ingesta est nécessaire, d’une part pour objectiver la carence d’apports, d’autre part pour favoriser les apports oraux spontanés et donc prescrire les ajouts de nutrition médicale (compléments nutritionnels oraux [CNO], nutrition entérale [NE], nutrition parentérale [NP]) en fonction de ce que mange le patient.
La technique de référence pour mesurer les ingesta est l’enquête alimentaire (idéalement prospective sur trois jours) réalisée par une diététicienne. Pour autant, les difficultés d’accès aux consultations de diététique en ville peuvent amener à s’aider de la mesure semi-quantitative des ingesta grâce à une échelle visuelle analogique (Score d’Evaluation Facile des Ingesta : SEFI) [voir l’article « Dépistage et diagnostic de la dénutrition chez l’adulte en pratique quotidienne »,
Agir graduellement
Contrairement à certaines pathologies, en particulier auto-immunes, pour lesquelles on admet l’intérêt d’une prise en charge maximaliste précoce, la dénutrition doit faire appel à une prise en charge graduelle en matière de facilité de mise en place, d’accessibilité, de rapport risques/bénéfices et de coût : conseils diététiques, compléments nutritionnels oraux, nutrition entérale puis nutrition parentérale.
On a trop souvent entendu que le traitement de la maladie causale conduirait à la résolution de la dénutrition. Cette allégation est fausse, et le cancer en donne un parfait exemple : la dénutrition en compromet le traitement et donc le pronostic dans de nombreuses situations.3
Des moyens à mettre en œuvre par étapes
Conseils diététiques adaptés
Il s’agit là de la première étape pour tous les patients, à l’exception bien sûr de ceux susceptibles d’inhalation par fausse route (sténose des voies aérodigestives supérieures, troubles neurologiques de la déglutition en cas de maladie de Parkinson, accident vasculaire cérébral, sclérose latérale amyotrophique…). Elle comprend l’arrêt de régimes devenus inutiles et dangereux (exemple du régime hypocholestérolémiant prescrit vingt ans plus tôt) mais aussi l’augmentation de la densité énergétique et protéique des aliments (plats en sauce, fromage râpé sur les aliments…) et, en miroir, la diminution d’aliments à faible densité protéino-énergétique (fruits et légumes), même si leur densité nutritionnelle est supérieure.
Compléments nutritionnels oraux
Les compléments nutritionnels oraux (CNO) peuvent être prescrits par tout médecin chez tout patient dénutri ou à risque de dénutrition (
Nutrition entérale (NE) initiale prescrite en établissement de santé
Il s’agit de l’administration directe de produits complets (macronutriments, électrolytes, micronutriments couvrant les recommandations nutritionnelles pour la population dès lors qu’on administre plus de 1 500 kcal/j) dans le tube digestif par l’intermédiaire d’une sonde. Ces produits ont, comme les CNO, le statut de denrées alimentaires destinées à des fins médicales spéciales (DADFMS). Leur administration s’effectue indépendamment de la faim et de la satiété du patient et permet d’amener jusqu’à 10 fois plus de calories qu’un CNO. Leur première prescription n’est pas réalisable en ville, seuls les renouvellements trimestriels, à six et à neuf mois, le sont. Les autres prescriptions doivent être rédigées par un médecin exerçant en établissement de santé.
S’il est fortement recommandé de débuter la NE en établissement de santé, ce n’est pas une obligation. La coordination du suivi du patient est confiée à un prestataire de soins – distributeur de matériel – qui doit informer, outre le médecin prescripteur, le médecin traitant et les différents intervenants à domicile.1
Nutrition parentérale débutée en établissement de santé
Il s’agit de l’administration intraveineuse de produits complets (macronutriments, souvent électrolytes et micronutriments, qu’il convient d’ajouter aux poches avec autorisation de mise sur le marché) par l’intermédiaire d’un cathéter central, en règle de moyenne à longue durée (cathéter tunnelisé, chambre implantable, Picc line). Ces produits ont le statut de médicament et sont disponibles en pharmacie d’officine (des façonniers fabriquent une partie des poches pour des besoins spécifiques). Leur administration se fait indépendamment de la faim et de la satiété du patient et permet d’amener jusqu’à 10 fois plus de calories qu’un CNO. Leur prescription et leur renouvellement sont réservés à des médecins exerçant en établissement de santé. Il est obligatoire de débuter une nutrition parentérale (NP) en établissement de santé. La coordination du suivi du patient est confiée à un prestataire de soins – distributeur de matériel – qui doit informer, outre le médecin prescripteur, le médecin traitant et les différents intervenants à domicile.1
Toute NP à domicile durant plus de douze semaines chez l’adulte doit être confiée à un centre labellisé de NP à domicile (www.sfncm.org/images/stories/Centre-Expert/centres_NPAD.pdf). Ces centres sont spécialisés dans l’insuffisance intestinale, qui est l’indication d’une NP en première intention.
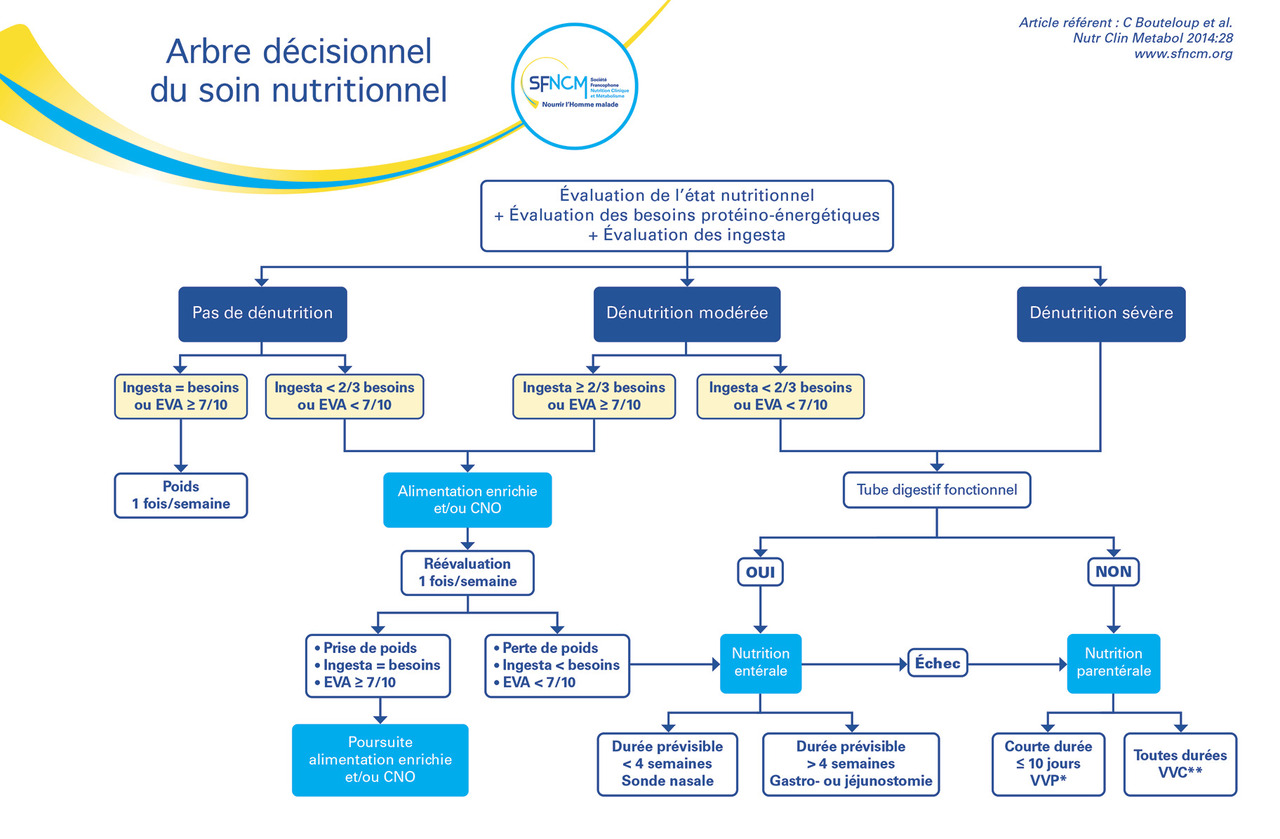
La prise en charge est modulée selon la gravité de la dénutrition
La Société francophone de nutrition clinique et métabolisme a défini un arbre décisionnel du soin nutritionnel (
– en cas de dénutrition modérée avec des ingesta conservés, il faut essayer d’augmenter ces derniers ;
– en cas de dénutrition sévère, quels que soient les ingesta, il faut recourir à la nutrition artificielle (entérale ou parentérale) ; en effet, la correction de la dénutrition par l’augmentation des ingesta demande du temps et continuerait à exposer le patient aux risques liés à la dénutrition.
Quelle que soit la pathologie du patient, il n’est pas recommandé de débuter une nutrition artificielle chez un patient au stade terminal, avec une espérance de vie estimée inférieure à trois mois, et soit un score de Karnofsky inférieur ou égal à 50, soit un performance status supérieur ou égal à 3.5
Réévaluer régulièrement pour adapter la prise en charge
La réévaluation régulière des patients s’impose afin d’adapter la prise en charge en cas d’échec. Dans une étude multicentrique suisse qui a mis en évidence l’intérêt d’une prise en charge individualisée de la dénutrition sur la morbidité et la mortalité de malades hospitalisés, Schuetz et al. ont évalué après vingt-quatre à quarante-huit heures la couverture des besoins nutritionnels.6 Si la prise en charge orale ne permettait pas de couvrir au moins 75 % des besoins en protéines et énergie, la NE était débutée. Puis, si l’ensemble (alimentation orale associée à une NE) ne permettait pas de couvrir au moins 75 % des besoins en protéines et énergie, la NP était débutée. Indépendamment de la stratégie d’utilisation, NE et NP présentent des contre-indications, somme toute assez rares (
Une surveillance à deux niveaux
Il est nécessaire de surveiller tant l’efficacité que la tolérance de la prise en charge nutritionnelle.
Gain pondéral : indicateur d’efficacité
L’efficacité est évaluée sur le poids mesuré dans les mêmes conditions. On peut attendre un gain de 500 g par semaine sans œdème. L’albuminémie, qui n’est plus un critère diagnostique de dénutrition, peut être suivie, mais il ne faut pas la doser plus d’une fois par mois.8
Veiller à la tolérance et à l’absence de complications
Le risque d’une renutrition trop rapide chez un patient chroniquement et sévèrement dénutri est celui d’un syndrome de renutrition inappropriée, très protéiforme dans sa présentation.9 Il justifie une augmentation progressive des apports et un dosage régulier des ions intracellulaires (potassium, phosphore, magnésium), avec supplémentation le cas échéant.
D’autres complications peuvent se produire à domicile.1 Pour la NE, différents événements peuvent ainsi survenir : arrachage de sonde, sonde bouchée, complications ORL, diarrhée, constipation, pneumopathie d’inhalation… Pour la NP, on peut observer une infection liée au cathéter veineux central, une désadaptation du cathéter, une surcharge vasculaire, une hyperglycémie, des anomalies biologiques hépatiques… Si ces complications motivent en règle le contact du centre prescripteur par le prestataire de soins, le médecin traitant est également impliqué dans leur prise en charge.
Sur qui le médecin traitant peut-il s’appuyer ?
D’abord le patient
Convaincre le patient est crucial et souvent difficile, car il peut opposer de nombreux arguments auxquels il faut savoir répondre :
– la perte de poids est une bonne chose car il est obèse ou en surpoids : la perte de poids en cas de maladie concerne la masse maigre (on peut être obèse et dénutri, a minima obèse et sarcopénique) ;10
– il n’aime pas les CNO : il existe une variété très importante de saveurs et textures ;
– il faut manger cinq fruits et légumes par jour et limiter la viande : ces recommandations s’adressent à une population générale en bonne santé, pas à des gens malades ;
– il n’aura pas le droit de manger en plus de la nutrition artificielle : sauf contre-indication, les apports oraux sont encouragés ;
– la sonde va l’empêcher de manger : les sondes sont aujourd’hui celles qu’on utilise pour les enfants, plus petites et donc moins gênantes.
La diététicienne pour des conseils personnalisés
Son rôle est majeur pour l’évaluation des ingesta et les conseils diététiques. L’absence de prise en charge par la Sécurité sociale (mais certaines assurances complémentaires le prévoient) est le principal facteur limitant à son recours.
Le médecin nutritionniste
Titulaire du diplôme d’études spécialisées complémentaires de nutrition ou maintenant du diplôme d’études spécialisées d’endocrinologie-diabétologie-nutrition, c’est le spécialiste de cette pathologie à qui on confie les patients atteints de dénutrition sévère ainsi que les patients en échec de la prise en charge initiale.
Le médecin hospitalier en cas de nutrition artificielle
Idéalement médecin nutritionniste, il prend en charge le patient nécessitant une nutrition artificielle, la débute en milieu hospitalier et prescrit la nutrition artificielle à domicile.
Des preuves d’efficacité peu nombreuses
S’il n’est plus à démontrer que la dénutrition aggrave tant la morbidité que la mortalité de la pathologie qu’elle accompagne, les preuves de l’efficacité de sa prise en charge sont moins nombreuses. Une revue systématique selon la méthodologie Cochrane publiée en 2017 a principalement mis en évidence l’intérêt médico-économique de la prise en charge nutritionnelle chez des malades hospitalisés.7 L’étude suisse mentionnée plus haut a, elle, mis en évidence que, chez 2 088 patients dénutris présentant diverses pathologies, une prise en charge nutritionnelle individualisée permettait de réduire les complications mais aussi la mortalité.6 Il est notable que ces résultats étaient obtenus dans 91 % des cas par des conseils diététiques et l’administration de CNO.
1. Bouteloup C, Fayemendy P, Schneider S, Comité de nutrition artificielle à domicile de la SFNCM. Guide de bonnes pratiques de nutrition artificielle à domicile. Édition 2022. Paris: SFNCM; 2022.
2. Thibault R, Goujon N, Le Gallic E, Clairand R, Sebille V, Vibert J, et al. Use of 10-point analogue scales to estimate dietary intake: a prospective study in patients nutritionally at-risk. Clin Nutr 2009;28:134-40.
3. Muscaritoli M, Arends J, Bachmann P, Baracos V, Barthelemy N, Bertz H, et al. ESPEN practical guideline: Clinical Nutrition in cancer. Clin Nutr 2021;40:2898-913.
4. Bouteloup C, Thibault R. Arbre décisionnel du soin nutritionnel. Nutr Clin Metabol 2013;28:52-6.
5. French Speaking Society of Clinical N, Metabolism. Clinical nutrition guidelines of the French Speaking Society of Clinical Nutrition and Metabolism (SFNEP): Summary of recommendations for adults undergoing non-surgical anticancer treatment. Dig Liver Dis 2014;46:667-74.
6. Schuetz P, Fehr R, Baechli V, Geiser M, Deiss M, Gomes F, et al. Individualised nutritional support in medical inpatients at nutritional risk: A randomised clinical trial. Lancet 2019;393:2312-21.
7. Muscaritoli M, Krznaric Z, Singer P, Barazzoni R, Cederholm T, Golay A, et al. Effectiveness and efficacy of nutritional therapy: A systematic review following Cochrane methodology. Clin Nutr 2017;36:939-57.
8. Crenn P, Vasson MP, Bouteloup C, Barnoud D, Hasselmann M, Hennequin V, et al. Suivi biologique du patient en nutrition artificielle. Nutr Clin Metabol 2009;23:149-59.
9. Mouillot T, Brindisi MC, Chambrier C, Audia S, Brondel L. Syndrome de renutrition inappropriee. Rev Med Interne 2021;42:346-54.
10. Donini LM, Busetto L, Bischoff SC, Cederholm T, Ballesteros-Pomar MD, Batsis JA, et al. Definition and diagnostic criteria for sarcopenic obesity: ESPEN and EASO consensus statement. Clin Nutr 2022;41:990-1000.